Method Article
アデノウイルス産生のための効率的な方法
要約
ここでは、pAdEasyシステムを用いたアデノウイルス産生プロトコルを紹介する。この技術には、pAdTrackおよびpAdEasy-1プラスミドの組換え、アデノウイルスの包装および増幅、細胞リセートおよび培養培地からのアデノウイルス粒子の精製、ウイルス滴定、およびアデノウイルスの機能試験が含まれる。
要約
アデノウイルス伝達は、対象遺伝子の発現を幅広い種類の細胞タイプおよび器官に強く一過性誘導するという利点を有する。しかし、組換えアデノウイルス技術は、手間がかかり、時間がかかり、高価です。ここでは、pAdEasyシステムを用いて、強力な緑色蛍光タンパク質(GFP)発現を誘導できる精製されたアデノウイルス粒子を、トランスデューセ細胞に誘導する改良されたプロトコルを提示する。この改良された方法の利点は、Bert Vogelsteinが開発した元の方法と比較して、より速い準備と生産コストの減少です。アデノウイルス技術の主なステップは次のとおりです: (1) BJ5183細菌のpAdEasy-1プラスミドとpAdTrack-GFPの再結合;(2)アデノウイルス粒子の包装;(3) AD293細胞におけるアデノウイルスの増幅;(4)細胞ライセートおよび培養培地からのアデノウイルス粒子の精製;(5)アデノウイルスのウイルス滴定および機能試験。元の方法の改良は、(i)細菌の化学変換によるBJ5183含有pAdEasy-1の組換えで構成されています。(ii) 組換えクローンの選択を「陰性」および「陽性」PCR(iii) アデノウイルスパッケージング用のK2トランスフェクションシステムを用いたAD293細胞のトランスフェクション;(iv)細胞培養培地中のAD293細胞によって放出されるウイルス粒子の硫酸アンモニウムによる沈殿;(v)一段階の塩化セシウムによるウイルスの浄化不連続勾配超遠心分離。目的の遺伝子の強い発現(この場合、GFP)は、様々な供給源(ヒト、ウシ、マウス)から異なるタイプのトランスデューセ細胞(例えば肝細胞、内皮細胞)で得られた。アデノウイルス媒介遺伝子導入は、現代の遺伝子治療を開発するための主要なツールの1つです。
概要
アデノウイルスは、ヌクレオキャプシドと二本鎖直鎖DNAゲノム1、2、3を含む非エンベロープウイルスである。アデノウイルスは広範囲の細胞タイプに感染し、感染は活性宿主細胞分裂に依存しない。感染後、アデノウイルスはゲノムDNAを宿主細胞核に導入し、エピクロモソームのままで宿主の遺伝子と共に転写される。したがって、挿入突然変異誘発または癌遺伝子調節のための最小限の潜在的リスクは、4、5、6を達成する。このアデノウイルスゲノムは宿主ゲノムと共に複製されず、従って、アデノウイルス遺伝子は分裂細胞集団中で希釈される。アデノウイルス伝達の利点の中には、(i)高レベルの遺伝子導入発現があります。(ii) ウイルスDNAの宿主ゲノムへの統合に関連するリスクが減少し、エピソーム発現によるもの。(iii)多種多様な分割細胞タイプおよび非分裂細胞型の伝達。生物医学研究で使用されるほとんどのアデノウイルスは非複製性であり、E1領域7、8、9を欠いている。それらの生産のために、E1配列を供給する細胞株(HEK293など)が必要である。また、ウイルスのライフサイクル(E3)のための非必須領域は、ウイルスゲノムにトランスジーンの挿入を可能にするために削除されました。他の領域(E2およびE4)は、いくつかのアデノウイルスでさらに削除されたが、これらの場合、アデノウイルス産生の収率低下およびトランスジーンの低発現が報告された7。
ここでは、AdEasyシステムを使用してアデノウイルスを構築、パッケージ化、および精製するための改良されたプロトコルを紹介します。これらの改善は、次の利点のためにBert Vogelstein2,10によって開発された元の方法と比較して、より速く、より経済的な方法でアデノウイルスのパッキングを可能にしました: (i) 細菌の化学変換によるBJ5183含有pAdEasy-1の再結合;(ii) PCRによる組換えクローンの選択;(iii) アデノウイルスパッケージング用のK2トランスフェクションシステムを用いたAD293細胞のトランスフェクション;(iv) ウイルスの包装および増幅後の培地からのアデノウイルス粒子の沈殿;(v)一段階塩化セシウム(CsCl)勾配超遠心化を用いたアデノウイルス精製。
AdEasy システムを使用したアデノウイルスの生産プロトコル (図 1) は、次の手順で構成されています。
(1) BJ5183細菌におけるpAdTrack-GFPとpAdEasy-1の再結合
(2)アデノウイルス粒子の包装
(3) アデノウイルスの増幅
(4) 細胞リセートおよび培養培地からのアデノウイルス粒子の精製
(5) アデノウイルス滴定。
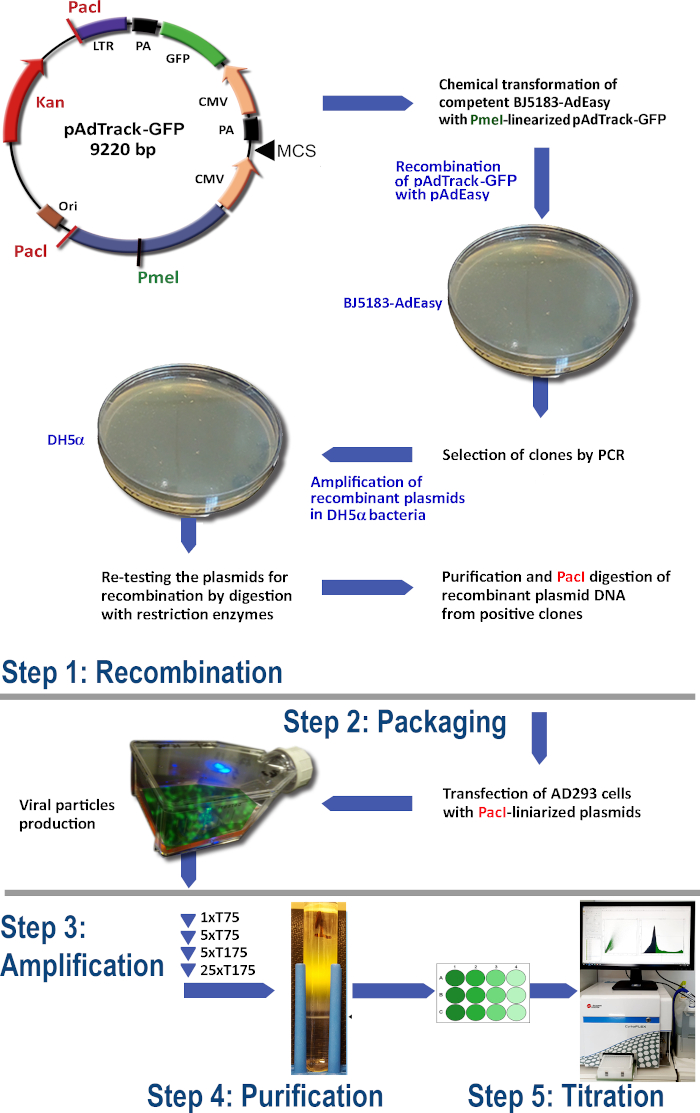
図1:アデノウイルス産生技術アデノウイルス技術の主なステップは次のとおりです: (1) BJ5183細菌のpAdEasy-1プラスミドとpAdTrack-GFPの組み換え。選択された再結合プラスミドはDH5α細菌で増幅され、次いで精製される。(2)AD293細胞におけるアデノウイルス粒子の包材、すなわちアデノ-E1タンパク質を産生している。(3) AD293細胞におけるアデノウイルスの増幅;(4)細胞リセートからのアデノウイルス粒子の精製と、CsCl密度勾配上の超遠心分離による培養液。(5) アデノウイルスの滴定と機能検査。 この図の大きなバージョンを表示するには、ここをクリックしてください。
本プロトコルでは、宿主細胞におけるGFPの発現を誘導できるアデノウイルスの産生技術を例示した。GFPは、pAdTrack-CMVシャトルベクター(Addgene #16405)の骨格に既に挿入されており、第2CMVプロモーターの下で、レポーター遺伝子として使用されている(図1)。このため、ここでは pAdTrack-CMV ベクターを pAdTrack-GFP として指定し、デモンストレーション目的で GFP の発現を評価しました。GFP発現に加えて、このシステムは、pAdTrack-CMVの複数のクローニング部位でクローン化され得る、目的の遺伝子を過剰発現するために使用することができる。pAdTrack-CMVでクローン化された遺伝子またはミニジーンは、通常、cDNA11と比較して発現誘導の効率が高い。データは、様々な供給源(ヒト、ウシ、マウス)からトランスデューセ細胞(例えば肝細胞、内皮細胞)における強いGFP発現を示した。アデノウイルス媒介遺伝子導入は、現代の遺伝子治療を開発するための主要なツールの1つです。
プロトコル
安全に関する注意事項: 一般に、アデノウイルスはバイオセーフティレベル2の生物に分類されるため、バイオハザード保護具(手袋、バイオエアロゾル用フェイスマスク、ラボコートなど)を着用して、訓練を受けた人がクラスIIバイオセーフティキャビネットですべての操作を行う必要があります。アデノウイルスに汚染されたすべての固体材料は、30分間10%の漂白剤溶液で消毒し、121°Cおよび1バールで30分間オートクレーブする必要があります。挿入された遺伝子に応じて、作成されたアデノウイルスは危険な可能性を有し、他のバイオセーフティレベルで分類される可能性がある。
1. 実験準備
- アデノウイルス操作には別個の細胞培養フードを使用し、アデノウイルスタイプごとに別個のインキュベーターを使用する。ウイルスの包装と増幅のためのフィルターキャップとTフラスコを使用してください。通気されたペトリプレートでの可能な限り多くのトランスダクション実験を避けてください。
- 使用後に細胞培養フードを空にし、15分間UVに曝します。
- オートクレーブは定期的にピペットの援助、ピペット、および他の道具を。可能であれば、別の細胞培養ラボ/フード内で、アデノウイルス包装用細胞(AD293細胞)および細胞をトランスダクション実験に用いる。同じ期間に増幅された異なるアデノウイルスのバッチは、PCRによる交差汚染をチェックする必要があります。
- 次のソリューションを準備します。
- SOB(超最適ブロス)培地を調製:トリプトン20g、酵母エキス5g、NaCl(10mM最終濃度)の0.5g、1MKCl(2.5mM最終濃度)の2.5mL、アムドH2O〜1L。121°Cでオートクレーブした後、次の無菌溶液を追加します:5 mLの1 M MgCl2と5 mLの1 M MgSO4.
- SOC(カタボライト抑制による超最適なスープ)培地を準備する:1 L滅菌SOBでは、1Mグルコースの20mL、1M MgCl2の5mL、 および1M MgSO4の5 mLの無菌溶液を追加する。
- 沈殿液を調製する:酢酸カリウム29.5gをH2Oの60mLに溶解し、酢酸11.5mL、及びH2Oを100mLに加える。
- 再懸濁液バッファーを準備する:95 mLの20%グルコース、5 mLの1 MトリスCl pH 8、0.5 M EDTA pH 8の4 mL、およびH2Oを200 mLに加える。
- 溶解液を調製:8.3 M NaOHの4.8 mL、20%SDSの10 mL、およびH2O〜200 mL。
2. BJ5183細菌におけるpAdEasy-1プラスミドとpAdTrack-GFPウイルスベクターの再結合
- pAdTrack-GFPの線形化と線形化されたプラスミドの精製。
- 氷の上に次の消化ミックスを準備します。
10 μgの pAdTrack-GFP
5 μL の 10x 無色バッファー
2 μL の Pme I
H2Oを50μLの最終体積にする。 - 37°Cで3時間、水浴でインキュベートします。
- 65°Cで20分間不活性化します。
- pme Iを用いたpAdTrack-GFPの消化の効率を確認してください:0.8%アガロースゲル上の未消化プラスミドの1μgと並行して消化プラスミドの1μgを実行します。
- 氷の上に次の消化ミックスを準備します。
- DNAの分離と精製
注:ステップ1-6はヒュームフードで行う必要があります。- 消化混合物の上にフェノール/クロロホルム/イソアミルアルコール(25:24:1)の等量を追加し、混合物が均一になるまでチューブを反転させます。
- 遠心分離機は16,200 x gで3分間、次いで、上部水相を回収管に移します。
- 低い有機相と渦の上に等量のフェノール/クロロホルム/イソアミルアルコール(25:24:1)を加えます。
- 遠心分離機を16,200 x gで3分間、上相を同じ回収管に移します。
- コレクションチューブと渦に収穫された水相の上に等量のクロロホルムを加えます。
- 遠心分離機は16,200 x gで3分間、次いで上水相を新しい回収管に移します。
- 1/10の酢酸ナトリウムを1/10に加え、2巻の冷たい100%エタノールと渦を加えます。
- -70°Cで1時間、または-20°Cで一晩インキュベートする。
- 氷の上でサンプルを解凍し、16,200 x g および4 °Cで10分間遠心分離します。
- 上清を取り除き、750 μLのエタノールを加えます。
- 遠心分離機は16,200 x g と4°Cで3分間、上清を取り除く。
- チューブを簡単に回転させて上清をすべて取り除き、フード内のペレットを乾燥させます。DNAペレットは溶解するのが難しいため、長期間乾燥しないでください。
- ペレットをH2Oの15μLに溶解します。
- 分光光度計(例えば、ナノドロップ)を用いてDNA濃度を測定する。
- pAdTrack-GFP を使用したアドナやす-1 細菌の変換
注: このステップでは、pAdEasy-1 プラスミドとの pAdTrack-GFP の再結合が行われます。- メーカーの指示に従って、市販の変換キットを使用して、Adeasy-1(BJ5183含有pAdEasy-1、addgene #16399)化学コンピテント細菌を準備します。100μLのコンピテント菌のアリコートを-80°Cに保ちます。
- 氷の上に有能なAd容易-1細菌のアリコートを解凍し、精製されたPme I -消化pAdTrack-GFPの1 μgを追加します。チューブをフリックして軽く混ぜます(混合物をピペットしないでください)。氷の上で10分間インキュベートします。
- 900 μLのSOC培地を加え、37°Cで1時間、振盪してインキュベートします。
- マイクロフュージは600×gで5分間。
- 上清の900μLを取り出し、ペレットと上清を混ぜ、変形させた細菌をLB寒天プレートにカナマイシンで種付けします。
- 37°Cで〜16時間インキュベート(18時間を超えないでください)。
- PCRによる可能性のある陽性クローンの選択
- つまようじを2つの半分に分け、オートクレーブで半爪楊枝を殺菌する。
- 滅菌半爪楊枝を使用して小さくて半透明のコロニーを拾います。
- 簡単に言えば、半爪楊枝を10μLの水(PCRチューブ)で細菌で回し、半爪楊枝をカナマイシンと100 μL SOC培地を含む1.5 mLのエペンドルフチューブに入れます。37°Cで4〜6時間インキュベートし、クローンを「陰性」および「陽性」PCRでテストします。
- 10 μLの水を含むPCRチューブを95°Cで5分間細菌とインキュベートし、細菌サンプルを得て「陰性」と「陽性」PCRを並行して実行します。
- 「ネガティブ」PCR - pAdTrack-GFPの完全性をテストする: 氷上の負のPCRのために次のPCRミックスを準備します。
細菌サンプルの5 μL
プライマーフォワードの0.1 μL (4631 F: 5'-CAGTAGTCGGTGTGcCGTCCAG)
プライマーリバースの0.1 μL (5616 R: 5'TATGGGGTGTTGtGTGTCTC)
0.1 μL の dNTP 10 mM
3 μL の 5x バッファ
MgCl2 25mM の 1.5 μL
ゴタクポリメラーゼ 0.1 μL
H2O を最終体積 15 μL に
注: DNA テンプレートが pAdTrack-GFP ベクターである正のコントロールを含める必要があります。 - 「陽性」PCR-目的の遺伝子の存在を試験する。挿入した遺伝子に特異的なプライマーを使用し、前のステップと同様に混合を調製する。GFP に使用されるプライマーは次のとおりです。
F: 5'-CAAGGACGGGCAACTACA
R: 5'-アッググクトクトクトグッガガ - 「負」と「正の」PCRを並列に実行します。PCRプログラムは:5分、95 °C;次のステップの40サイクル:30秒、95 °C;30秒、68°C;1分、72°C。最終伸び:10分、72 °C
注:関心のある遺伝子を増幅するためにアニーリング温度を調整してください。 - PCR産物を1%アガロースゲルで評価し、クローンを選択します。
- 「陽性 PCR」の後に「負の PCR」および特定の PCR 産物に PCR 産物を与えならないクローンをさらに処理することを検討してください。
- 選択した組換えクローンの細菌培養物を育てる
- 推定陽性クローンの培養物(ステップ2.4.3.)を4mLのSOC培地でカナマイシンで希釈し、37°Cで一晩揺れでインキュベートする。
- Adの容易-1細菌からのプラスミドDNAの分離(アルカリ性のリシスを用いたミニプレップ)
- 1.5mLの細菌培養物をマイクロ遠心チューブに移し、遠心分離機を16,200xgで1分間移動し、上清を除去します。
- 同じチューブ内の別の1.5 mL細菌培養物を移し、遠心分離を繰り返し、上清を除去する。
- 200 μL のリサスペンション バッファー (50 mM グルコース、10 mM EDTA、25 mM Tris-HCl pH 8) を加えます。
- 溶解液(0.2 N NaOH、1%SDS)を200μL加え、チューブを反転して軽く混ぜます。
- 沈殿液200μL(酢酸カリウム60mL、氷酢酸11.5mL、100mLまでH2Oを加える)を加え、チューブを反転して軽く混ぜます。
- 16,200 x gで3分間の遠心分離機。
- 上清を新しいマイクロ遠心チューブに移し、500 μLイソプロパノールを加え、氷の上で20分間混合してインキュベートします。
- 遠心分離機は16,200 x g で15分間、500 μLの75%エタノールを加えます。
- 16,200 x g で10分間遠心分離機を出し、上清を取り除く。
- 遠心分離機は16,200 x gで3分間、上清を取り除き、15 μLのH2Oを加えます。
- 再結合されたプラスミドの増幅、分離、再テスト
- アドナメ−1細胞から単離されたDNAを用いてDH5α細菌の形質転換を行った。
- メーカーの指示に従って、市販の変換キットを使用してDH5αの有能な細菌を準備します。
- 氷上のDH5αのコンピテント菌の100 μLを解凍し、組換えDNAを加え、氷の上に10分間インキュベートします。その後、カナマイシンでLB寒天プレートに細菌を播種します。
- 一晩で37°Cでインキュベートする。
- いくつかのコロニーをピックアップし、カナマイシンとLB培地の2mLでそれぞれ成長し、37°Cで、一晩、振盪する。
- DNAを分離し(アルカリ性のリシスを用いたMiniprep)、得られたDNAを25μLH2Oで再中断する。
- 酵素消化により陽性クローンを確認します。
- 氷の上に次のミックスを準備します。
組換えDNA 5 μL
10x無色バッファの1.5 μL
0.5 μL の ヒンド III または Pst I
H2O を最終体積 15 μL に - 37°Cで30分間インキュベートします。
注:コントロールとして、ダイジェストもpAdTrack-GFPとpAdEasy-1プラスミド。 - 各サンプルでは、RNase Aを使用してSx6ローディングバッファを3μL追加します(RNase Aがminiprepバッファに存在しない場合)。
- 消化したDNA断片を1%アガロースゲル電気泳動で実行します。
注:陽性クローンの消化パターンには、pAdTrackベクターとのpAdEasy再結合を明らかにし、消化されたpAdEasyプラスミドの断片の大部分が含まれています。対象遺伝子はクローニングに使用される制限酵素による消化によって証明されるべきである。
- 氷の上に次のミックスを準備します。
- アデノウイルスの包装のためのプラスミドDNA(トランスフェクショングレード)の調製。
- プラスミドDNAを単離するために陽性クローンから細菌の200mL培養を成長させます。
- プラスミドDNAミディプレップ(例えば、Qiagenプラスミドミディキット)の市販キットを使用してプラスミドDNAを分離します。
- アドナメ−1細胞から単離されたDNAを用いてDH5α細菌の形質転換を行った。
3. アデノウイルス粒子の包装
- 1日目。AD293細胞のシード
- AD293細胞をPBSで洗浄し、37°Cで2〜5分間0.125%トリプシンでインキュベートします。
- 血清と冷媒で細胞を収集します。
- 4°Cで400×gで5分間の遠心分離機。
- 血清で培地中の細胞を再懸濁し、〜2 x 106/T25フラスコの密度で細胞を播種する。好ましくは、フィルター付きフラスコを使用する。
- 1日目。Pac I で組み換えDNAを消化する
- 次のミックスを準備します。
組換えDNA 6 μL(1 μg/μL)
2 μL の Pac I
2.5 μL の 10x 無色バッファ
H2O から最終容積 25 μL まで - 37°Cで3時間(または一晩)インキュベートし、65°Cで酵素を20分間不活性化する。
- エタノールでのDNA沈殿:2.5 μL(1/10 v/v)3 M酢酸ナトリウムと100%エタノールの2〜3容量を加えます。-70°Cで30分間、または-20°Cで一晩インキュベーションする。
- 遠心分離機は4°Cで30分間16,200xgで、滅菌水中でペレットを再懸濁します。
- 次のミックスを準備します。
- 2日目:K2試薬を用いたAD293細胞のトランスフェクション
- 細胞の上にK2乗数40μLを加え、トランスフェクションの2時間前に添加します。
- A および B ソリューションを準備します。
解決策A:オプティ-MEMの260 μLにPac l線形化DNAを6μg加えます。
ソリューションB:21.6 μLのK2試薬を248.4 μLのOpti-MEMに添加します。 - 溶液Aオーバー溶液Bを加え、ピペットで軽く混ぜます。
- 室温で20分間、混合物をインキュベートします。セルにドロップワイズAとBミックスを追加します。
- 3-11日目:蛍光顕微鏡によるGFP発現のモニタリング
注:細胞は蛍光顕微鏡で緑色に見える必要があり、徐々に取り外す必要があります。 - 11日目:F1アデノウイルス粒子を収穫する
- 50 mLチューブに取り外した細胞と培地を集め、接着細胞を掻き取り、同じチューブに加えます。
- 400 x gで5分間遠心分離機を、新しいチューブに上清を集め、PBSの0.5 mLで細胞ペレットを再懸濁します。
- 細胞破壊
- マイクロ遠心チューブに細胞懸濁液を移す。
- 3回の凍結/解凍サイクルを実行します(液体窒素で凍結するか、37 °Cで-80 °C /融解して最大7分)
- 壊れた細胞を23Gの注射針を通して3回渡す。
- 9,600 x g で12分間遠心分離して細胞の破片を取り除きます。
- 集めた培地と共に上清を50mLチューブに移します。
4. アデノウイルスの増幅
注:AD293細胞が必要な合流に達しなかった場合、感染に使用されるアデノウイルスストック(ウイルス産生細胞から得られたリセート)のアリコートは-80°Cで保存され得る。
- F2アデノウイルス粒子を調製する。
- AD293細胞をT75フラスコ(5 x 106 細胞/フラスコ)に播種します。
- F1アデノウイルス粒子を用いて〜90%コンフルエントAD293細胞に感染する:T75フラスコで増殖した細胞の上にT25フラスコから細胞ホモジネートおよび培地を加える。
- 蛍光顕微鏡でGFP発現をモニターします。
- トランスデューセAD293の90%が剥離した場合にウイルス産生細胞を収穫する(転写後5日目 )。細胞培養培地を4°Cに保つ。
- 細胞を1 mL PBSで(F1の細胞と同様に)破壊する。
- F3アデノウイルス粒子を調製する。
- F2アデノウイルス粒子とF2アデノウイルス粒子と細胞培養培地を用いてT175フラスコに播種したコンフルエントAD293細胞を90%感染させる。
- 細胞を収穫する(約5日後)。
- 2 mLのPBSで細胞を(F1の場合と同様に)破壊する。
- F4アデノウイルス粒子を調製する。
- F3アデノウイルス粒子および細胞培養培地を用いて〜90%コンフルエントAD293細胞を含む5 T175フラスコに感染する。
- 細胞を収穫する(約5日後)。
- 3 mLのPBSで細胞を(F1の細胞と同様に)破壊する。
- F5アデノウイルス粒子を調製する。
- F4アデノウイルスストックおよび細胞培養培地を用いて〜90%コンフルエントAD293細胞を含む25 T175フラスコに感染する。
5. 細胞のライセートおよび培養培地からのアデノウイルスの精製
- ウイルス産生細胞及び培養培地を収穫する。
- 5日後に、F5のAD293細胞を収穫した。
- アデノウイルス粒子の沈殿のために滅菌ボトルに培地を保存します。
メモ:アデノウイルスを浄化するまで、冷蔵庫に媒体を保管してください。 - 400 x g で細胞を遠心分離し、5 分間、4 o C で 行います。
- 最終ペレットを10 mMトリスHClの5 mL、2 mM MgCl2でpH 8に再懸濁します。
- 1.5 mLチューブでサスペンションをアリコート。
- 細胞を破壊する(F1の細胞と同様に):凍結/解凍の3サイクル。
メモ:超遠心分離をすぐに行うことができない場合は、サンプルを-80°Cに保ちます。 - 23G注射針を通して細胞懸濁液を3回通過する。
- ホモジェン酸を9 600xgで遠心分離し、12分間用いた。
- CsClの勾配超遠心化によるアデノウイルス精製のための上清を保存する。
- 培養培地中に放出されたアデノウイルスの沈殿。
- 保存した細胞培養液を室温でボトルに持参します。
- 細胞培養培地の500mLごとに121gの硫酸アンモニウムを加える(溶液の飽和度は40〜42%)。
- 硫酸アンモニウムが完全に溶解するまで慎重に混合する。
- 室温で最低2.5時間インキュベートします。
- 遠心分離機1600xg、15分間 、22oCでペレットを保存します。
- 2mM MgCl2で 10mM トリス HCl pH 8 の 4 mL でペレットを再懸濁します。この懸濁液は、CsClの勾配超遠心分離によって直ちに精製されるべきである。
注:精製ステップを後で行うことができない場合、透析は10mMトリスHClに対して再懸濁されたペレットを、2mM MgCl2でpH 8。
- 超遠心分離によるアデノウイルス精製。
- SW41Tiローター用ポリプロピレンチューブで不連続なCsCl勾配を準備します。チューブの下部に765 mg/mL CsCl(高密度:1.4 g/L)の3 mLを加えます。最初の CsCl 層の上に 288.5 mg/mL CsCl (低密度: 1.2 g/L) の 3 mL をゆっくりと加えます。
- 細胞から放出されたアデノウイルス粒子懸濁液の3〜4mLを、または細胞培養培地から沈殿した(前述の通り)勾配の上に静かに重ね合わせる。
- ミネラルオイルでチューブを充填し、冷たいSW41Tiバケットにチューブを入れます。
- チューブを平衡にします。充填されたポリプロピレンチューブがローターに対称的にロードされていることを確認してください。ローターを超遠心分離機に入れます。
- 210,000 x g および4°Cで遠心分離機、18時間、ブレーキなし。
- バンドを得るために後ろに黒い紙でスタンドに超遠心チューブを置きます。
- 透明な上相、細胞の破片、および漂白液を用いた廃容器内の上部バンドを廃棄する。
- 完全なアデノウイルス(〜700 μL~1 mL)を含む最も低いバンドを無菌1.5mLチューブに収穫し、氷の上に保管してください。
- 透析バッファー内の透析カセットを予め濡らします (10 mM Tris-Cl バッファー pH 8, 2 mM MgCl2)。
- 精製したアデノウイルスを2mLの注射器を使用して透析カセットに注入します。
- 透析は10 mM Tris-ClバッファーpH 8、2 mM MgCl2 に対して一晩(透析バッファーを3〜4回変更する)
- 10-100 μLのアリコートで透析カセットからアデノウイルスストックを収穫します。
- ウイルスアリコートに4%の最終濃度にスクロースを加える(凍結保護用)。
- アリコートは-80°Cで保管してください。
6. アデノウイルス滴定
- 1日目:細胞をめっきする
- AD293細胞を、図2に示すように、1mL完全増殖培地に1mLで(12ウェル培養プレートで)1ウェルあたり2.5×10個の細胞の密度で播種する。正確な気性の決定のために、細胞が各ウェルに均等に広がっていることを確認してください。
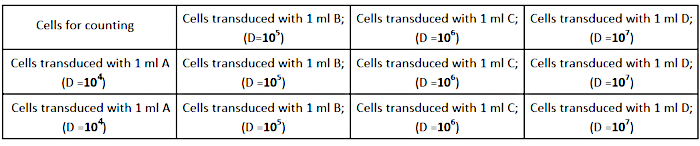
図2:滴定板設計この図の大きなバージョンを表示するには、ここをクリックしてください。
- 2日目:細胞の細胞の導入
- トリプシンで1つの井戸から細胞を取り外し、それらを数えます。この数値は、ウイルス価の計算に使用されるため注意してください。
- 完全な成長培地の1 mLでウイルスストックの連続希釈を行う (1/104;1/105;1/106;1/107)以下のように:
- 1/103: ウイルスストックの希釈 - 完全な培地の1998 μLに2μLのウイルスストックを加える。
- 1/104: 120 μLを完全培地(A)の1080 μLに希釈して1/103 の1:10希釈を行います。
- 1/105: 完全培地(B)の120μLを1080μLに希釈して、Bを1:10希釈します。
- 1/106: 完全培地(C)の120 μLを1080 μLに希釈してCを1:10希釈します。
- 1/107: 完全培地(D)の120 μLを1080 μLに希釈してDを1:10希釈します。
注:各希釈液(A、B、C、D)の3つのチューブを準備して、三重で実験を行います。 - ウェルから細胞培養培地を取り出し、ウイルスの調製された希釈液を追加します( 図2を参照)。
- 3日目:GFP表現のモニタリング
- 蛍光顕微鏡を用いて、緑色細胞の存在を調べてください。
- 4日目:GFP陽性細胞のフローサイトメトリー解析
- 12個の1.5mLチューブを準備し、ラベルを付けます。
- 1.5 mLのチューブに細胞培養培地(脱離した細胞と一緒に)を集め、氷の上に保管します。
- 各ウェルに200μLのトリプシンを加えます。
- CO2インキュベーターで37°Cでプレートを2〜3 分間インキュベートします。
- 細胞培養培地と同じエペンドルフチューブ内の細胞を収穫する。チューブを氷の上に置いておきなさい。
- 細胞を400xgでペレット、5分間、4°Cで。
- 上清を取り除く。チューブを氷の上に置いておく。
- PBS + 2% FBS の 250 μL でペレットを再懸濁します。チューブを氷の上に置いておく。
- フローサイトメトリーチューブまたはプレートで細胞懸濁液を移動します。
- GFP発現細胞の蛍光を記録するフローサイトメーター上でサンプルを実行します。
Titer 計算: 親集団から 5 - 20% GFP 陽性セルを持つサンプルは、次の式を使用してウイルスの活用量の計算に考慮する必要があります。
タイター(TU/mL) = D x F/100 x C/V
D = 希釈係数
F = 陽性細胞のパーセント / 100
C = セルの数 / ウェル
V = ウイルス性接種量
7. 標的細胞のアデノウイルス伝達と誘導タンパク質発現の試験
- 1 日目: セルのシード処理
- ターゲット細胞をシードし、ウェルに均等に広がっていることを確認します。
- 2日目:細胞の導入
- ターゲット セルを 1 つのウェルから切り離し、カウントします。
- 細胞当たりの感染性粒子の所望の数で細胞をトランスデュースするために必要なアデノウイルス懸濁液の適切な容積を計算する。
- 標的細胞に対応する量のウイルス懸濁液を加える。
- 3日目:ウイルス懸濁液の除去とGFP発現の確認
- アデノウイルス粒子を含む細胞培養培地を新鮮な培地で交換する。
- 蛍光顕微鏡でGFPの発現を確認してください。
結果
より速く、より効率的なアデノウイルスの生産を達成するために、元のフォーゲルシュタインのプロトコルを変更し、改善しました。まず、組換え組換えの選択を容易にするために方法論を改訂した。再結合後、BJ5183細菌クローンは、再結合の欠如の指標としてpAdTrack-GFPの完全性を評価するために「陰性PCR」によって試験された(図3A)、または「陽性PCR」によって、対象遺伝子を同定し、我々の場合GFPに同化した(図3B)。「ネガティブ」と「ポジティブ」の両方のPDRにおいて、pAdTrack-GFPを制御テンプレートとして使用し、pAdTrackの完全性に対して986 bpのバンドを与えました(図3A、レーン1)、GFPのバンド264 bp(図3B、レーン3)を使用しました。「負のPCR」に使用されるプライマーは、pAdTrack-GFPにPmeI部位を含む986bpの断片を増幅するように設計された。このDNA断片は、組み換え後に大幅に拡大され、正の組換えクローンでは増幅されない。pAdTrack-GFPがそのまま残った組換え用の陰性クローンは、図3A、レーン3、4、および6に示されています。このプライマーは、組換え部位に隣接するDNA配列上でアニールする。図3B、レーン1、および2に示すように、潜在的陽性組換えクローン(図3A、レーン2および5)がGFPを発現する。これらのクローンからプラスミドDNAを単離し、DH5α変換に用い、より多くのDNAを得た。これらの事前選択された組換えプラスミドをDH5αで増幅し、酵素消化により試験した。図3においてC-Eは、ヒンドIII、PstI、BamHI制限酵素(図3C、D、Eレーン2)で消化された1つの組換え陽性クローンの酵素消化の結果を示す。組換えクローンのHindIIIおよびPstI消化パターンは、それぞれpAdEasy-1プラスミドを24回および25回切断した後、pAdEasy-1のために得られたものと類似していた(図3CおよびD、レーン3)。HindIIIは1回カットし、PstIはpAdTrack-GFPベクトルの4倍をカットした(図3CおよびD、レーン1)。bamHIは、pAdEasy-1ベクター(図3C、レーン3)を2回切断し、1回pAdTrack-GFP(図3C、レーン1)を切断した。
PacIは、組換えプラスミド(図3F、レーン2)から4.5kbの断片を切り取り、pAdTrack-GFPから2863bpの断片(図3F、レーン1)を切り取り、pAdEasy-1ベクター(図3F、レーン3)を直線化した。DNAラダーは 、図3C-Fで、レーン4で表される。組換えプラスミドを、AD293トランスフェクションに対して更に使用するためにPac Iで消化した。
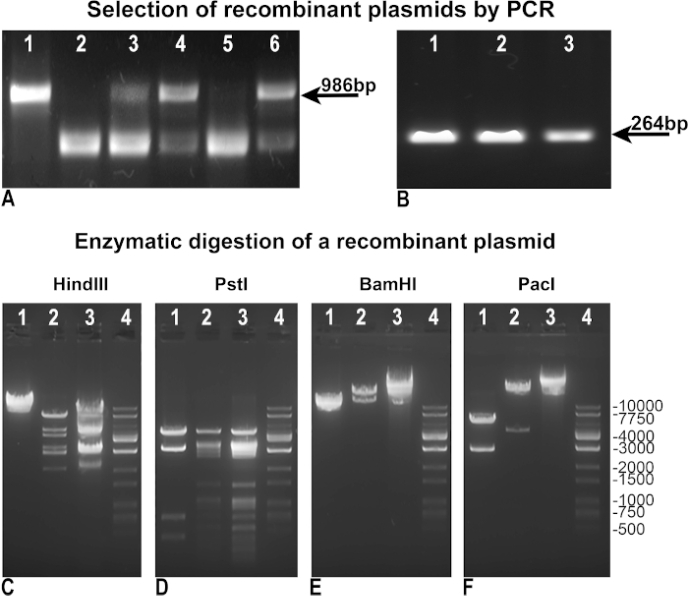
図3:pAdEasy-1プラスミドとのpAdTrack-GFPの組み換え。pAdTrack-GFPとpAdEasy-1の再結合後に得られたプラスミドを、pAdTrack-GFP完全性(A)に対する「陰性」PCRによって試験した。非組換えクローンは、pAdTrack-GFPプラスミド(A、レーン3、4、および6)から増幅された配列に対応する986bpバンドの存在によって証明された。再結合に対して潜在的に陽性のクローン(A、レーン2および5)も得られた。pAdTrack-GFP ベクターをテンプレートとして使用した場合、pAdTrack-GFP (A, レーン 1) に対して 986 bp のバンドが得られた。潜在的に陽性の組換えクローンを「陽性」PCR(B)によってGFP発現について試験した。264 bp のバンドは、潜在的に再結合されたクローン (B、レーン 1、2) と pAdTrack-GFP プラスミドの両方に対して現れます。1つの潜在的な組換えクローンからのDNAを、HindIII、PstI、BamHI、およびPacI制限酵素(C-F、レーン2)で試験した。コントロールでは、pAdEasy-1ベクター(C-F、レーン3)およびpAdTrack-GFPプラスミド(C-F、レーン1)を同じ酵素で消化した。DNAラダーはC-Fレーン4で表される。 この図の大きなバージョンを表示するには、ここをクリックしてください。
このアデノウイルスの包装および増幅は、AD293細胞で行った。このアデノウイルス粒子(AdV-GFP)をAD293細胞リセートと細胞培養培地から精製し、感染細胞によって放出された。細胞培地に見られるアデノウイルスを濃縮するために、粒子を硫酸アンモニウムで沈殿させ、次いで2 mMMgCl2で10 mM Tris HCl pH 8に再懸濁し、細胞リシスに使用したのと同じバッファーを含む。続いて、細胞ライセートおよび培養培地からのアデノウイルス粒子を、超遠心分離のCsCl不連続勾配で精製した。超遠心分離後、 図4に示すように、精製されたAdV-GFPの強力なバンドが得られた。

図4:不連続なCsCl勾配上の超遠心分離によるアデノウイルス精製。培地から沈殿した細胞ホモジネートおよびアデノウイルスは、低密度および高密度のCsCl溶液によって形成された不連続勾配上で超遠心分離を行った。GFP-アデノウイルスの強いバンドは、両方のケースで証明された。 この図の大きなバージョンを表示するには、ここをクリックしてください。
1 mL当たりのトランスデューシングユニット(TU/mL)で発現するウイルス価を決定するために、AD293細胞にAdV-GFPの連続希釈液を感染させた。48時間後、感染細胞はGFPを発現し、ウイルス懸濁液の希釈因子との逆相関を有する。これを観察した蛍光顕微鏡とGFP陽性細胞の割合は、フローサイトメトリー(図5)によって決定した。力価を算出するために、GFP陽性細胞の5~20%を誘導したウイルス希釈が考慮された(図5C)。通常、GFP-アデノウイルスに対して、〜1010(TU/mL) のウイルス用タイターを取得します。
以下に、300000細胞(C)を1 mLアデノウイルス溶液(V)で導入した特定のアデノウイルスバッチに対するアデノウイルス価数計算の例を示し、希釈係数106(D) で、6%GFP陽性細胞(F)が得られた。
タイター (TU/mL) = D x F/100 x C/V = 106 x 6/100 x 300000/1 = 1.8 x10 10 TU/mL
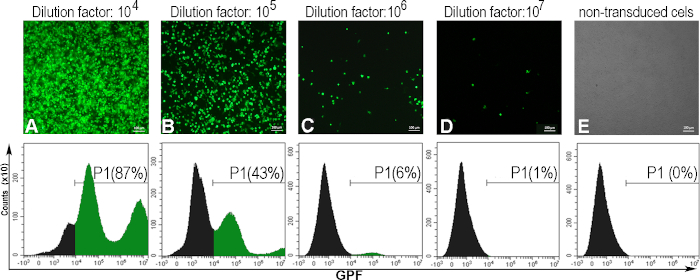
図5:アデノウイルス用の評価AD293細胞は、各種のアデノウイルス希釈液に感染した。48時間後、蛍光顕微鏡で細胞を観察し、フローサイトメトリーで分析し、異なる腺ウイルス希釈によって誘導されたGFP陽性細胞の割合(A-D)を決定した。フローサイトメトリーのゲートを確立するために、非導入細胞も解析した(E)。希釈因子106について算出した価価率は、細胞の6%がGFP陽性であった場合、1.8 x10 10 TU/mLであった。パネルA-Eの場合、バー:100μm。 この図のより大きなバージョンを表示するには、ここをクリックしてください。
調製されたアデノウイルスの伝達電位を試験するために、ヒト内皮細胞(EA.hy926)、ウシの大動脈内皮細胞(BAEC)、マウス肝細胞(Hepa 1-6)、マウス中葉間質細胞(MSC)の4つの細胞株を使用した。内皮細胞(EA.hy926およびBAEC)を25TU/細胞で導入し、肝細胞を5TU/細胞で導入し、MSCを250 TU/細胞で導入した。
ここでは、3 x 106 細胞を25 TU/細胞で感染させるために必要なアデノウイルス懸濁液の体積を、1.8 x 1010 TU/mLでアデノウイルス懸濁液を用いて、どのように計算したかの例を示す。
1 セルの場合.25 TU
3 x 106 細胞 .x TU  x=75 x 106 TU
x=75 x 106 TU
ウイルスストックに含まれている場合
1.8 x 1010 TU .1 mL
75 x 106 TU .y mL  y= 4.2 x 10-3 mL = 4.2μL のウイルスストック
y= 4.2 x 10-3 mL = 4.2μL のウイルスストック
導入から48時間後、細胞を蛍光顕微鏡で解析した。図6に示すように、ヒトまたはウシ内皮細胞を良好な効率で導入した(〜50%)25 TU/セル(図6 EA.hy926およびBAEC)用。マウス肝細胞(Hepa 1-6)は、アデノウイルス粒子(5TU/細胞)の低い量で効率よくアデノウイルスによってトランスタイズされたが、死細胞(PI陽性細胞)の割合が高いためアデノウイルスにも感受性である(〜16%)他のセルの種類と比較して。間葉間質細胞は、特定のアデノウイルス受容体(未発表データ)がないため、トランスデュースが最も困難であった(図6)。
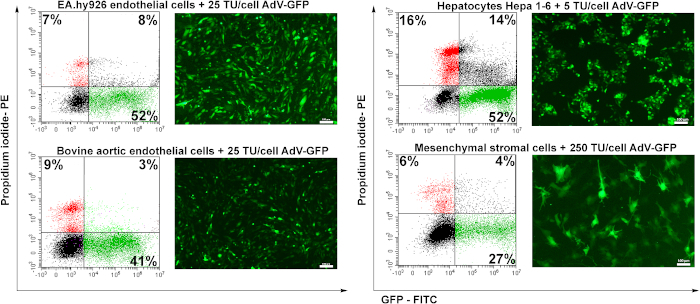
図6:トランスデューセ細胞におけるアデノウイルスの感染性とGFP発現の誘導。ヒト内皮細胞(EA.hy926)、ウシ大動脈内皮細胞(BAEC)、マウス肝細胞(Hepa 1-6)、及びマウス間葉間質細胞(MSC)を、アデノウイルスの所示量でトランスミタイズした。GFPは蛍光顕微鏡で検出し、GFP陽性細胞の割合をフローサイトメトリーで分析した。フローサイトメトリーによって決定されるPI陽性細胞は、ウイルス伝達によって決定される細胞死亡率を示す。EA.hy926細胞、ウシ大動脈内皮細胞、およびヘパ1-6細胞をアデノウイルスによって高度にトランステーションし、41〜52%の範囲のトランスダクションの収率を示した。MSCの場合、より多くのウイルス(250 TU/細胞)が、トランスデューセド細胞のGFP陽性の27%しか誘導しなかなかった。バー:100μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
組換えアデノウイルスは、遺伝子の送達および発現12、13、14のための汎用性の高いツールです。アデノウイルス伝達によって強力なタンパク質発現を誘導するために、対象となる遺伝子のコード配列がアデノウイルスのゲノムに挿入される。バート・フォーゲルシュタインの研究室で開発されたAdEasyアデノウイルスシステムは、野生型アデノウイルス血清型5ゲノムの大部分を含む骨格プラスミド(pAdEasy-1)と、遺伝子クローニング2、10用に設計されたシャトルベクター(pAdTrack)を含む。アデノウイルス遺伝子E1(感染性ウイルス粒子の集合を担う)およびE3(宿主免疫の回避に関与するタンパク質をコードする)の欠失は、6.5〜7.5kbの目的遺伝子を挿入することができるアデノウイルスゲノムに空間を作り出した。このサイズは、特に短いイントロン15、16、17を持つもののために、多くの遺伝子のために十分です。また、トランスジーン18、19、20のcDNAを運ぶアデノウイルスの産生を報告する研究者もあります。しかし、cDNAを運ぶアデノウイルスに対するトランスジーン発現の収率は、遺伝子やミニ遺伝子を運ぶ相手よりも低い(データは示されていない)。
前の方法2、10、14、18、21を改善し、適応させる、アデノウイルス生産のための技術は、より短い時間、より低コスト、およびより少ない労力を必要とする。全長アデノウイルスDNAは、相同組換えが起こりやすい大腸菌株BJ5183におけるシャトルベクターとpAdEasy-1プラスミドとの間の再結合によって得られる。このプロトコルは、Adeasy-1細胞(pAdEasy-1を含むBJ5183バクテリア)の化学変換を意味します。この技術は、いくつかの実験室では利用できない可能性のあるエレクトロポレーターを必要とせず、非常に単純であり、再結合収率を増加させ、そして有能な細胞を得るために必要な時間を短縮し、変換を行うために必要な時間を短縮する。PCRによって行われる組換えクローンの事前選択は、さらに時間を短縮し、全体の手順を容易にします。Zhaoと同僚22でも同様の手順を使用したが、プロトコルではプライマーの配列を最適化した。
GFP-アデノウイルスの包装および増幅のために、HEK293誘導細胞株、すなわちAD293細胞を使用し、これはより培養プレートに付着している。アデノウイルス産生に一般的に使用される他の細胞株は、以下である:911、293FT、pTG6559(A549誘導体)、PER。C6(HER誘導体)、GH329(HeLa誘導体)、N52。E6、およびHeLa-E1 23、24、25、26。我々の手では、911細胞を使用した場合、アデノウイルス産生の改善は得られなかった(データは示されていない)。K2試薬を用いた組換えプラスミドを用いたAD293細胞のトランスフェクションは、ウイルス包装工程の効率を高めた。アデノウイルス産生後、アデノウイルスの70%までは細胞内に残り、3回の凍結および解凍サイクルによって放出される。サイクル数を増やすことは、アデノウイルスを破壊するので適していません。
ルーチンのアデノウイルス産生プロセスを通して、多数のウイルス粒子が細胞培養培地中に放出される。感染したAD293細胞の収穫中にこの細胞培地を廃棄することは、重要なウイルス損失をもたらすであろう。我々は、Schagenと同僚が記述したプロトコルを最適化し、硫酸アンモニウム27で沈殿することにより、細胞培養培地からアデノウイルス粒子を精製する。この方法は、ポリエチレングリコール28を用いた方法に比べて、細胞培養培地からのアデノウイルス回収において高い効率を有する。沈殿したアデノウイルスは、超遠心分離によって直ちに精製するか、または数日間冷蔵庫に保管する必要がありますが、透析後にのみ、塩過剰を除去する必要があります。透析なしで数時間よりも長く沈殿物を維持することは、ウイルスに有害です。
1段階で行われる超遠心分離によるアデノウイルス粒子の精製は、アデノウイルスストックの操作を減少させ、連続する超遠心分離ステップ14、29を用いたプロトコルと比較して手順を容易にする。精製されたアデノウイルスの透析は、さらにトランスダクションに影響を与える可能性のある塩化セシウムを除去する必要がある。プロトコルでは、凍結のための防腐剤として必要とされる膨大で不当な量のスクロースが必要なため、透析にはMgCl2を含むトリスバッファーを使用しましたが、透析にはスクロースは使用しませんでした。したがって、後で、凍結のために準備されたアデノウイルス株に直接スクロースを加えた。精製されたアデノウイルスの頻繁な凍結および解凍を避けるために、アデノウイルスストックをアリクォートし、−80°Cで貯蔵することが推奨される。 アデノウイルス力価は、GFPレポーター遺伝子と特異的なウイルス希釈に対するトランスデューセ細胞の割合を考慮したフローサイトメトリーによって評価した。この方法は、古典的な「プラークアッセイ」と比較して速く、アデノウイルス粒子の感染能力を明らかにしていない(ELISAやフローサイトメトリーなどの様々な方法による)カプシドタンパク質の評価と比較して信頼できます。しかしながら、市販キットを用いたELISAベースの定量法、Q-PCR、またはプラークアッセイは代替方法であり、特に蛍光トレーサを含まないアデノウイルスの滴定に有用である。
pAdTrackアデノウイルスは、コクサッキーウイルスおよびアデノウイルス受容体(CAR)によって認識されるヒトアデノウイルス血清型5に由来することを考慮して、ヒト起源の細胞(内皮細胞)をトランスデュースするGFP-アデノウイルスの能力を実証したが、他の起源の細胞であるウシ(内皮細胞)およびマウス(mesenalals)およびマウス(mesenalals)細胞も実証した。このデータは、GFP-アデノウイルスが高レベルのトランスジーンの発現を誘導できることを示した。
結論として、我々は時間、コスト、およびアデノウイルス粒子を得るために必要な労力を削減するために、この骨の多い技術を最適化しました。調製されたアデノウイルスは、様々な細胞型に感染し、目的の遺伝子の発現を誘導することができる。アデノウイルス媒介遺伝子導入は、現代の遺伝子治療を開発するための主要なツールの1つを表すので、このプロトコルは、様々な実験で使用することができる。
略語: AdV-GFP, アデノウイルス粒子;BAEC, ウシ大動脈内皮細胞;CsCl、塩化セシウム;GFP, 緑色蛍光タンパク質;MSC, 間葉間質細胞;TU、トランスデューシングユニット。
開示事項
著者らは開示するものは何もない。
謝辞
この作業は、欧州地域開発基金から競争力運用プログラム2014-2020(POC-A.1-A.1.1.4-E-2015)を通じて共同出資されたプロジェクトによって支援されました。 ID: P_37_668; 頭字語 DIABETER, 頭字語, 研究イノベーションのルーマニア省PCCDI - UEFISCDI, プロジェクト番号PN-III-P1-1.2-PCCDI-PCCDI-2017-0697内 PNCD III 内およびルーマニアアカデミーによって.著者らは、キリアコス・キプレオス(ギリシャのパトラス大学)に対する寛大で関連性の高いアドバイス、オビディウ・クロワトル(ルーマニアのブカレスト美術大学)の撮影、映画編集、グラフィカルデザイン、技術支援のためのミハエラ・ブラトゥに感謝する。
資料
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
参考文献
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved