Method Article
Эффективный метод производства аденовируса
В этой статье
Резюме
Здесь мы представляем протокол по производству аденовируса с использованием системы pAdEasy. Технология включает рекомбинацию плазмидов pAdTrack и pAdEasy-1, аденовирусную упаковку и усиление, очистку аденовирусных частиц от лизоля клетки и среды культуры, вирусное титрование и функциональное тестирование аденовируса.
Аннотация
Аденовирусная трансдукция имеет преимущество сильной и преходящей индукции экспрессии гена интереса в широкий спектр типов клеток и органов. Тем не менее, рекомбинантные аденовирусные технологии являются трудоемкими, трудоемкими и дорогостоящими. Здесь мы представляем улучшенный протокол с использованием системы pAdEasy для получения очищенных аденовирусных частиц, которые могут вызвать сильное зеленое флуоресцентное выражение белка (GFP) в трансдуцированных клетках. Преимущества этого усовершенствованного метода являются более быстрая подготовка и снижение себестоимости производства по сравнению с оригинальным методом, разработанным Бертом Фогельштейном. Основными шагами аденовирусной технологии являются: (1) рекомбинация pAdTrack-GFP с плазмидой pAdEasy-1 в бактериях BJ5183; (2) упаковка аденовирусных частиц; (3) усиление аденовируса в клетках AD293; (4) очищение аденовирусных частиц от лисата клетки и среды культуры; и (5) вирусное титровать и функциональное тестирование аденовируса. Улучшения к первоначально методу состоят из i) рекомбинации в BJ5183-содержа pAdEasy-1 химической трансформацией бактерий; ii) выбор рекомбинантных клонов с помощью "негативного" и "позитивного" ПЦР; iii) трансфекция клеток AD293 с использованием системы трансфекции К2 для аденовирусной упаковки; iv) осадки с сульфатом аммония вирусных частиц, высвобождаемых клетками AD293 в среде клеточной культуры; и v) очищение вируса одношагом цезия хлорида прерывистый градиент ультрацентрифугации. Сильное выражение гена интереса (в данном случае GFP) было получено в различных типах трансинированных клеток (таких как гепатоциты, эндотелиальные клетки) из различных источников (человек, бык, мурин). Аденовирусная передача генов является одним из основных инструментов разработки современных генной терапии.
Введение
Аденовирусы являются неувелицированные вирусы, содержащие нуклеокапсид и двухтысяногийлинейный геном ДНК 1,2,3. Аденовирусы могут инфицировать широкий спектр типов клеток, и инфекция не зависит от активного деления клеток-хозяина. После заражения аденовирус вводит свою геномную ДНК в ядро клетки-хозяина, где он остается эпихромосомным и транскрибируется вместе с генами хозяина. Таким образом, минимальный потенциальный риск для вставки мутагенеза или онкогеноврегуляции достигается 4,5,6. Аденовирал геном не реплицируется вместе с геномом хозяина и, таким образом, аденовирусные гены разбавляются в делеющейся популяции клеток. Среди преимуществ аденовирусной трансдукции, есть: i) высокий уровень трансгенного выражения; ii) снижение рисков, связанных с интеграцией вирусной ДНК в геном хозяина, в связи с эписомальным выражением; iii) трансдукция широкого спектра разделительных и неразмещенных типов клеток. Большинство аденовирусов, используемых в биомедицинских исследованиях, не реплицируются, неимеют региона Е1 7,8,9. Для их производства требуется сотовая линия, поставляющей последовательность E1 (например, HEK293). Кроме того, несущественные области для вирусного жизненного цикла (E3) был удален, чтобы позволить вставки трансгена в вирусный геном; другие регионы (E2 и E4) были дополнительно удалены в некоторых аденовирусов, но в этих случаях, снижение урожайности аденовирусного производства и низкое выражение трансгена былизарегистрированы 7.
Здесь мы представляем улучшенный протокол для построения, упаковки и очистки аденовирусов с помощью системы AdEasy. Эти улучшения позволили упаковки аденовируса в более быстрым и экономичным способом по сравнению с оригинальнымметодом,разработанным Бертом Vogelstein2,10, из-за следующих преимуществ: (i) рекомбинации в BJ5183-содержащих pAdEasy-1 химической трансформации бактерий; ii) выбор рекомбинантных клонов ПЦР; iii) трансфекция клеток AD293 с использованием системы трансфекции К2 для аденовирусной упаковки; iv) выпадение аденовирусных частиц из среды культуры после вирусной упаковки и усиления; v) аденовирусная очистка с использованием одношагового хлорида цезия (CsCl) градиентного ультрацентрифугации.
Протокол производства аденовируса с использованием системы AdEasy(рисунок 1)включает следующие шаги:
(1) Рекомбинация pAdTrack-GFP с pAdEasy-1 в bj5183 бактерий
(2) Упаковка аденовирусных частиц
(3) Усиление аденовируса
(4) Очистка аденовирусных частиц из лисата клеток и среды культуры
(5) Аденовирусная титровая.
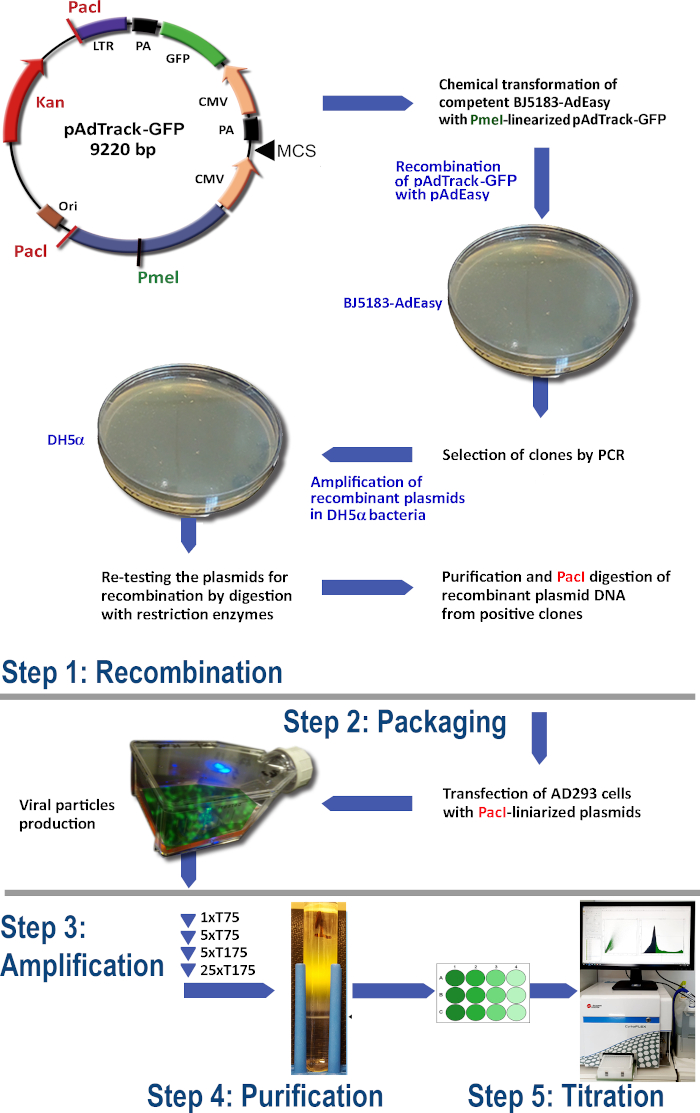
Рисунок 1: Технология производства аденовируса. Основными шагами аденовирусной технологии являются: (1) Рекомбинация pAdTrack-GFP с плазмидой pAdEasy-1 в бактериях BJ5183. Выбранные рекомбинированные плазмиды усиливаются в dh5'бактериями, а затем очищаются; (2) Упаковка аденовирусных частиц в клетках AD293, которые производят белки адено-Е1; (3) Усиление аденовируса в клетках AD293; (4) Очистка аденовирусных частиц из лисата клетки и среды культуры путем ультрацентрифугации на градиенте плотности CsCl; (5) Титровая аденовируса и функциональное тестирование. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
В этом протоколе мы привели в пример технологию производства аденовируса, которая может вызвать экспрессию GFP в клетках-хозяинах. GFP уже вставлен в основу вектора шаттла pAdTrack-CMV (Addgene #16405), под вторым промоутером CMV и используется в качестве гена репортера(рисунок 1). По этой причине мы обозначили вектор pAdTrack-CMV как pAdTrack-GFP и оценили выражение GFP для демонстрационных целей. Помимо выражения GFP, система может быть использована для переэкспрессирования гена, представляющий интерес, который может быть клонирован в нескольких местах клонирования pAdTrack-CMV. Ген или миниген, клонированный в pAdTrack-CMV, как правило, более эффективен для индукции экспрессии по сравнению с cDNA11. Данные показали сильное выражение GFP в трансинированных клетках (таких как гепатоциты, эндотелиальные клетки) из различных источников (человек, бык, мурин). Аденовирусная передача генов является одним из основных инструментов разработки современных генной терапии.
протокол
Примечание по безопасности: Как правило, аденовирусы классифицируются как организмы уровня биобезопасности 2, и, таким образом, все манипуляции должны быть сделаны в кабинете биобезопасности класса II квалифицированным человеком, нося биоопасным защитным оборудованием (включая перчатки, маску для биологических аэрозолей, лабораторное пальто и т.д.). Все твердые материалы, загрязненные аденовирусом, должны быть дезинфицированы 10% раствором отбеливателя в течение 30 мин и автоматически затвердевать в течение 30 мин при 121 кк и 1 бар. В зависимости от вставленного гена, созданный аденовирус может иметь опасный потенциал и может быть классифицирован в других уровнях биобезопасности.
1. Экспериментальная подготовка
- Используйте отдельный капюшон культуры клеток для аденовирусных манипуляций и отдельный инкубатор для каждого типа аденовируса. Используйте T колбы с крышками фильтра для вирусной упаковки и усиления; избегать как можно больше экспериментов по трансдукции в вентилируемых пластин Петри.
- Освободите капюшон культуры клеток после каждого использования и подвергните его УФ в течение 15 минут.
- Автоклав периодически пипетки помощи, пипетки, и другая посуда. Если это возможно, культура в отдельной лаборатории культуры клеток / капюшон клеток для аденовирусной упаковки (AD293 клеток) и клетки, которые будут использоваться в экспериментах трансдукции. Пакеты различных аденовирусов, усиленных в тот же период, должны быть проверены на перекрестное загрязнение ПЦР.
- Подготовь следующие решения.
- Подготовка SOB (Super Optimal Broth) среды: 20 г триптона, 5 г дрожжевого экстракта, 0,5 г NaCl (10 мМ конечной концентрации), 2,5 мл 1 МКл (2,5 мм окончательной концентрации), amd H2O до 1 л. После автоклавирования при 121 градусе цельсия добавьте следующие стерильные растворы: 5 мл 1 M MgCl2 и 5 мл 1 M MgSO4.
- Подготовка SOC (Супер Оптимальный бульон с катаболитом репрессии) среды: в 1 л стерильных SOB добавить следующие стерильные растворы: 20 мл 1 М глюкозы, 5 мл 1 M MgCl2, и 5 мл 1 M MgSO4.
- Приготовить раствор осадков: растворить 29,5 г ацетата калия в 60 мл H2O, добавить 11,5 мл уксусной кислоты и H2O до 100 мл.
- Подготовка буфера повторного незаменимия: 95 мл 20% глюкозы, 5 мл 1 M Tris-Cl pH 8, 4 мл 0,5 М EDTA pH 8, и добавить H2O до 200 мл.
- Подготовье лиза раствора: 4,8 мл 8,3 М НаОХ, 10 мл 20%SDS и H2O до 200 мл.
2. Рекомбинация вирусного вектора pAdTrack-GFP с плазмидой pAdEasy-1 в бактериях BJ5183
- Линейность pAdTrack-GFP и очистка линейной плазмиды.
- Приготовьте следующую смесь пищеварения на льду:
10 мкг pAdTrack-GFP
5 МКЛ 10x бесцветный буфер
2 МКЛ Пме I
H2O до конечного объема 50 МКЛ. - Инкубировать при 37 градусов по Цельсию в течение 3 часов на водяной бане.
- Инактивировать при 65 градусов по Цельсию в течение 20 мин.
- Проверьте эффективность пищеварения pAdTrack-GFP с Pme I: запустить 1 мкг переваренной плазмиды параллельно с 1 мкг непереваренной плазмиды на 0,8% агарозного геля.
- Приготовьте следующую смесь пищеварения на льду:
- Изоляция и очищение ДНК
ПРИМЕЧАНИЕ: Шаги 1-6 должны быть выполнены в дым капот.- Добавьте равный объем фенола/хлороформа/изоамилового спирта (25:24:1) над смесью пищеварения и инвертировать трубку до тех пор, пока смесь не станет однородной.
- Центрифуга в течение 3 мин при 16200 х г,а затем перенести верхнюю часть в трубку сбора.
- Добавьте равный объем фенола/хлороформа/изоамилового спирта (25:24:1) над нижней органической фазой и вихрем.
- Центрифуга в течение 3 мин при 16200 х г,а затем перенести верхнюю фазу в ту же трубку сбора.
- Добавьте равный объем хлороформа над аквозной фазой, собранной в трубке сбора и вихре.
- Центрифуга в течение 3 мин при 16200 х г,а затем перенести верхнюю часть в новую трубку сбора.
- Добавьте 1/10 тома 3 М ацетата натрия и 2 тома холодного 100% этанола и вихря.
- Инкубация в течение 1 часа при -70 градусов по Цельсию или на ночь при -20 градусов по Цельсию.
- Оттепель образца на льду и центрифуге его в течение 10 мин при 16200 х г и 4 градусов по Цельсию.
- Удалите супернатант и добавьте 750 л 75% этанола.
- Центрифуга в течение 3 мин при 16200 х г и 4 градусов по Цельсию и удалить супернатант.
- Кратко спина трубки, чтобы удалить все супернатанты и высушить гранулы в капюшоне. Не сушите гранулы ДНК в течение длительного времени, потому что это сложно растворить.
- Растворите гранулы в 15 МКЛ H2O.
- Измерьте концентрацию ДНК с помощью спектрофотометра (например, нанодрроп).
- Трансформация бактерий AdEasier-1 с pAdTrack-GFP
ПРИМЕЧАНИЕ: На этом этапе происходит рекомбинация pAdTrack-GFP с плазмидой pAdEasy-1.- Подготовка AdEasier-1 (BJ5183-содержащий pAdEasy-1, Addgene #16399) химических компетентных бактерий, используя коммерческий комплект преобразования, следуя инструкциям производителей. Держите aliquots 100 QL компетентных бактерий при -80 градусов по Цельсию.
- Оттепель aliquot компетентных бактерий AdEasier-1 на льду и добавить 1 мкг очищенных Pme I-переваривается pAdTrack-GFP. Смешайте осторожно, щелкивая трубку (не пипетки смеси). Инкубировать в течение 10 минут на льду.
- Добавьте 900 МКЛ среды SOC и инкубировать в течение 1 часа при 37 градусах по Цельсию со встряхивания.
- Микрофуг в течение 5 мин при 600 x g.
- Удалите 900 л супернатанта, смешайте гранулы и супернатант, и посеять преобразованные бактерии на пластинах LB-агара с канамицином.
- Инкубация в течение 16 часов при 37 градусах по Цельсию (не превышает 18 часов).
- Выбор возможных положительных клонов ПЦР
- Разделите зубочистки на две половинки и стерилизовать половинчатые зубочистки путем автоклавирования.
- Возьмите небольшие и полупрозрачные колонии с помощью стерильных полузубных подборок.
- Кратко поверните половину зубочистки с бактериями в 10 йл воды (в трубке ПЦР), а затем положить половину зубочистки в 1,5 мл Эппендорф трубки, содержащей 100 МКЛ SOC среды с канамицином. Инкубировать в течение 4-6 часов при 37 градусов по Цельсию, в то время как вы проверить клонов на "негативный" и "положительный" ПЦР.
- Инкубировать ПЦР трубки, содержащие 10 йл воды с бактериями в течение 5 мин при 95 градусов по Цельсию, чтобы получить бактериальный образец и запустить параллельно "отрицательный" и "положительный" ПЦР.
- "Отрицательный" ПЦР - для проверки целостности pAdTrack-GFP: Подготовь следующую смесь ПЦР для отрицательного ПЦР на льду.
5 МКЛ бактериального образца
0,1 МЛ грунтовки вперед (4631 F: 5'-CAGTAGTCGGTGCTCGTCCAG)
0,1 МКЛ грунтовки Обратный (5616 R: 5'-TATGGGGGCTGTAATGTTGTCTC)
0,1 МЛ dNTP 10 мМ
3 МКЛ 5x буфера
1,5 л MgCl2 25mM
0,1 МКЛ ГоТак Полимераза
H2O до конечного объема 15 МКЛ
ПРИМЕЧАНИЕ: Позитивный контроль, в котором шаблон ДНК является вектором pAdTrack-GFP, должен быть включен. - "Позитивный" ПЦР - проверить наличие гена интереса. Используйте конкретные грунтовки для вставленного гена и подготовить смесь, как на предыдущем этапе. Праймеры, используемые для GFP, были следующими:
F: 5'-CAAGGACGACGGCAACTACA
R: 5'-ATGGGGTGCTCTGCTGGTA - Запуск параллельно "отрицательный" и "положительный" ПЦР. Программа ПЦР: 5 мин, 95 градусов по Цельсию; 40 циклов следующих шагов: 30 сек, 95 градусов по Цельсию; 30 сек, 68 градусов по Цельсию; 1 мин., 72 кк; окончательное удлинение: 10 мин, 72 градусов по Цельсию.
ПРИМЕЧАНИЕ: Адаптировать температуру аннеляля для усиления гена интереса. - Оцените продукты ПЦР на 1% агарозный гель и сделать выбор клонов.
- Рассмотрим для дальнейшей обработки клонов, которые не дают ПЦР продуктов для "негативного ПЦР" и конкретного продукта ПЦР после "положительного ПЦР".
- Выращиваем бактериальные культуры отдельных рекомбинантных клонов
- Разбавить культуры предполагаемых положительных клонов (в результате шаг 2.4.3.) в 4 мл среды SOC с канамицином, и инкубировать их на ночь при 37 градусов по Цельсию с тряской.
- Изоляция плазмидной ДНК от бактерий AdEasier-1 (Miniprep с использованием щелочного лиза)
- Передача 1,5 мл бактериальной культуры в микроцентрифуг трубки, центрифуга в течение 1 мин при 16200 хг , и удалить супернатант.
- Перенесите еще 1,5 мл бактериальной культуры в ту же трубку, повторите центрифугу и удалите супернатант.
- Добавьте 200 МКЛ буфера повторного незаменимия (50 мм глюкозы, 10 мМ EDTA, 25 мм Tris-HCl pH 8).
- Добавьте 200 МКЛ раствора лиза (0,2 N NaOH, 1% SDS), аккуратно перемешайте трубку.
- Добавьте 200 мл раствора осадков (60 мл ацетата калия 5 М, 11,5 мл ледниковой уксусной кислоты, добавьте H2O до 100 мл) и аккуратно перемешайте трубку.
- Центрифуга в течение 3 мин при 16200 х г.
- Перенесите супернатант в новую микроцентрифугную трубку, добавьте 500 мкл изопропанола, смешайте и инкубировать в течение 20 мин на льду.
- Центрифуга в течение 15 мин при 16200 х г и добавить 500 л 75% этанола.
- Центрифуга в течение 10 мин при 16200 х г и удалить супернатант.
- Центрифуга в течение 3 мин при 16200 х г,удалить супернатант и добавить 15 МКЛ H2O.
- Усиление, изоляция и повторное тестирование рекомбинированных плазмидов
- Преобразование бактерий DH5 с ДНК, изолированных от клеток AdEasier-1.
- Подготовьте компетентные бактерии DH5, используя комплект коммерческих преобразований, следуя инструкциям производителей.
- Оттепель 100 йл DH5 "компетентных бактерий на льду, добавить рекомбинантной ДНК, и инкубировать 10 минут на льду. Затем семена бактерий на пластины LB-агара с канамицином.
- Инкубационный при 37 градусов по Цельсию на ночь.
- Пикап несколько колоний и расти каждый в 2 мл LB среды с канамицином, при 37 градусов по Цельсию, на ночь, с тряской.
- Изолировать ДНК (Miniprep с помощью щелочного лиза) и повторно использовать полученную ДНК в 25 йл H2O.
- Подтвердите положительные клоны с помощью энзиматической пищеварения.
- Приготовьте следующую смесь на льду:
5 МКЛ рекомбинантной ДНК
1,5 МКЛ 10x бесцветный буфер
0,5 МКЛ Хинд III или Pst I
H2O до конечного объема 15 МКЛ - Инкубационный при 37 градусов по Цельсию в течение 30 мин.
ПРИМЕЧАНИЕ: В качестве контроля, дайджест также pAdTrack-GFP и pAdEasy-1 плазмиды. - В каждом образце добавьте 3 МКЛ буфера загрузки Sx6 с RNase A (если RNase A не присутствует в буферах miniprep).
- Вы запустите переваренные фрагменты ДНК на 1% агарозы гель электрофорез.
ПРИМЕЧАНИЕ: Пищеварение модели положительного клона включает в себя большинство фрагментов переваренной плазмидной pAdEasy, выявление pAdEasy рекомбинации с вектором pAdTrack. О гене, представляющим интерес, следует свидетельствует пищеварение с ферментами ограничения, используемыми для клонирования.
- Приготовьте следующую смесь на льду:
- Подготовка плазмидной ДНК (трансфект-класса) для аденовирусной упаковки.
- Вырастить 200 мл культуры бактерий из положительного клона, чтобы изолировать плазмидной ДНК.
- Изолировать плазмидную ДНК с помощью коммерческого комплекта для плазмидной ДНК Midiprep (например, Зияген Плазмид Миди Kit) в соответствии с инструкциями производителя.
- Преобразование бактерий DH5 с ДНК, изолированных от клеток AdEasier-1.
3. Упаковка аденовирусных частиц
- День 1. Семя клеток AD293
- Вымойте клетки AD293 с ПОМОЩЬю PBS и инкубировать их с 0,125% трипсина в течение 2-5 мин при 37 градусов по Цельсию.
- Соберите клетки в холодной среде с сывороткой.
- Центрифуга в течение 5 мин при 400 x g при 4 градусах Цельсия.
- Повторное течение клеток в среде с сывороткой и семян клеток при плотности 2 х 106/T25 колбу. Предпочтительно использовать колбу с фильтром.
- День 1. Дайджест рекомбинантной ДНК с Pac I
- Подготовьте следующую смесь:
6 МКЛ рекомбинантной ДНК (1 мкг/ЛЬ)
2 йл Пак i
2,5 МКЛ 10x бесцветный буфер
H2O до конечного объема 25 МКЛ - Инкубировать в течение 3 ч (или на ночь) при 37 градусов по Цельсию, а затем инактивировать фермент при 65 градусов по Цельсию в течение 20 минут.
- Осадки ДНК с этанолом: добавьте 2,5 л (1/10 в/в) 3 М ацетата натрия и 2-3 тома 100% этанола. Инкубация в течение 30 мин при -70 градусов по Цельсию или на ночь при -20 градусов по Цельсию.
- Центрифуга при 16200 х г в течение 30 мин при 4 градусов по Цельсию и повторно гранулы в стерильной воде.
- Подготовьте следующую смесь:
- День 2: Трансфекция клеток AD293 с использованием реагента K2
- Добавьте 40 МКЛ множитель K2 над клетками, за два часа до трансфекции.
- Подготовь решения A и B:
Решение A: Добавьте 6 мкг Pac l-линейной ДНК в 260 МКЛ Opti-MEM.
Решение B: Добавьте 21,6 МКЛ реагента К2 в 248,4 МКЛ Opti-MEM. - Добавить раствор A над раствором B и аккуратно перемешать с помощью пипетки.
- Инкубировать смесь в течение 20 мин при комнатной температуре. Добавить dropwise A и B смесь в клетки.
- День 3-11: Мониторинг экспрессии GFP с помощью микроскопии флуоресценции
ПРИМЕЧАНИЕ: Клетки должны появляться зелеными при микроскопии флуоресценции и должны постепенно отделяться. - День 11: Урожай аденовирусных частиц F1
- Соберите отдельные клетки и среду в 50 мл трубки, соскребать клетки-адепты, и добавить их в той же трубке.
- Центрифуга в течение 5 мин при 400 x g, собирать супернатант в новую трубку и повторно помесят клеточные гранулы в 0,5 мл PBS.
- Нарушение работы ячейки
- Перенесите подвеску клетки в трубку микроцентрифуга.
- Выполните три цикла замораживания/оттепели (заморозка в жидком азоте или при -80 градусов по Цельсию /оттепель при 37 градусов по Цельсию максимум 7 мин).
- Перейдите сломанные клетки через 23 G шприц иглы три раза.
- Удалите клеточный мусор путем центрифугации на 9600 х г в течение 12 мин.
- Перенесите супернатант на трубку 50 мл с собранной средой.
4. Усиление аденовируса
ПРИМЕЧАНИЕ: Если клетки AD293 не достигли необходимого слияния, алициты аденовирусных запасов (лисат, полученный из вирусодобывающих клеток), которые будут использоваться для инфекции, могут храниться при -80 градусов по Цельсию.
- Подготовь аденовирусные частицы F2.
- Семя клеток AD293 в колбе T75 (5 x 106 ячеек/колбу).
- Заразить 90% стеченных клеток AD293 с помощью аденовираловых частиц F1: добавить гомогенат клетки и среды из колбы T25 над клетками, выращенными в колбе T75.
- Мониторинг экспрессии GFP с помощью микроскопии флуоресценции.
- Урожай вирусодобывающих клеток, когда 90% трансдуцированных AD293 отсоединяются (-5-й день после трансдукции). Держите клеточной культуры среды на 4 градусов по Цельсию.
- Нарушить клетки (так же, как для F1) в 1 мл PBS.
- Подготовь аденовирусные частицы F3.
- Заразить 90% стеченных клеток AD293, посеянных в колбе T175 с аденовиральными частицами F2 и средой клеточной культуры от аденовирусных частиц F2.
- Урожай клеток (через 5 дней после трансдукции).
- Нарушить клетки (так же, как для F1) в 2 мл PBS.
- Подготовь аденовиральные частицы F4.
- Заразите 5 колб T175, содержащих 90% стеченных клеток AD293 с аденовирусными частицами F3 и средой клеточной культуры.
- Урожай клеток (через 5 дней после трансдукции).
- Нарушить клетки (так же с теми, для F1) в 3 мл PBS.
- Подготовь аденовирусные частицы F5.
- Заразите 25 колб T175, содержащих 90% стеченных клеток AD293 с аденовиральным запасом F4 и средой клеточной культуры.
5. Очистка аденовируса от ликата клеток и среды культуры
- Сбор вирусодобывающих клеток и среды культуры.
- Урожай AD293 клеток F5 после 5 дней после трансдукции.
- Сохранить среду в стерильной бутылке для осадков аденовирусных частиц.
ПРИМЕЧАНИЕ: Держите среду в холодильнике до очистки аденовируса. - Центрифуга клеток при 400 x g, в течение 5 мин, при 4 oC.
- Повторное производство финальной гранулы в 5 мл 10 мМ Tris HCl, рН 8 с 2 мМ MgCl2.
- Aliquot подвески в 1,5 мл труб.
- Нарушить клетки (так же, как для F1): три цикла замораживания / оттаивания.
ПРИМЕЧАНИЕ: Если ультрацентрифугация не может быть выполнена немедленно, держите образцы на -80 градусов по Цельсию. - Пройдите подвеску клетки через иглу шприца 23G в течение трех раз.
- Центрифуга гомогената при 9 600 х г, в течение 12 мин.
- Сохранить супернатант для очистки аденовируса csCl градиент ультрацентрифугации.
- Осадки аденовируса высвобождаются в культурной среде.
- Принесите бутылку с сохраненной средой культуры клетки при комнатной температуре.
- Добавьте 121 г сульфата аммония к каждому 500 мл клеточной культуры среды (насыщенность раствора должна быть между 40 - 42%).
- Тщательно смешайте, пока сульфат аммония полностью не растворит.
- Инкубация в течение как минимум 2,5 часов при комнатной температуре.
- Центрифуга при 1600 x g, в течение 15 мин, при 22 oC и сохранить гранулы.
- Повторное производство гранул в 4 мл 10mM Tris HCl pH 8 с 2mM MgCl2; эта подвеска должна быть немедленно очищена csCl градиентом ультрацентрифугации.
ПРИМЕЧАНИЕ: Если шаг очистки не может быть впоследствии выполнен, диасиза ночь перерасход гранулы против 10mM Tris HCl, рН 8 с 2mM MgCl2.
- Очистка аденовируса с помощью ультрацентрифугации.
- Подготовка прерывистого градиента CsCl в полипропилевых трубах для ротора SW41Ti. Добавьте 3 мл 765 мг/мл CsCl (высокая плотность: 1,4 г/л) в нижней части трубки. Медленно добавьте 3 мл 288,5 мг/мл CsCl (низкая плотность: 1,2 г/л) поверх первого слоя CsCl.
- Аккуратно наложить 3 - 4 мл аденовирусной суспензии частиц, высвобождаемой из клеток или высасывной из среды клеточной культуры (как описано ранее) поверх градиента.
- Заполните трубки с минеральным маслом, и положить трубки в холодных ведрах SW41Ti.
- Равновесить трубки. Убедитесь, что заполненные полипропиленые трубки загружаются симметрично в ротор. Положите ротор в ультрацентрифуг.
- Центрифуга при 210 000 х г и 4 градусов по Цельсию, в течение 18 часов, без тормоза.
- Поместите ультрацентрифуг трубки на стенде с черной бумагой позади, чтобы получить полосы.
- Отбросьте четкую верхнюю фазу, клеточный мусор и верхнюю полосу в контейнере для отходов с отбеливающим раствором.
- Урожай низшей полосы, которая содержит полный аденовирус (700 йл - 1 мл) в стерильной трубке 1,5 мл и держать его на льду.
- Предварительно влажная диализная кассета в буфере диализа (10 мМ Трис-Кл буфер рН 8, 2 мММгКл 2).
- Ввините очищенный аденовирус в кассету диализа с помощью шприца 2 мл.
- Диализ ночь против 10 мМ Трис-Cl буфер рН 8, 2 мМ MgCl2 (изменить буфер диализа 3 - 4 раза).
- Урожай аденовирал запасов из кассеты диализа в aliquots 10 - 100 йл.
- Добавьте сахарозу до 4% окончательной концентрации вирусных алицитов (для криопротекторной).
- Храните aliquots при -80 градусов по Цельсию.
6. Аденовирусная титровая
- День 1: Покрытие клеток
- Семя AD293 клеток при плотности 2,5 × 105 клеток на колодец (в 12-хорошо пластины культуры) в 1 мл полной среды роста, как показано на рисунке 2. Убедитесь, что клетки равномерно распределены в каждом хорошо для точного определения titer.
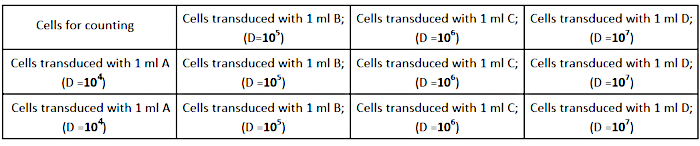
Рисунок 2: Дизайн титровая пластины. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- День 2: Трансдукция клеток
- Отсоедините клетки от одного хорошо с трипсином и посчитать их. Обратите внимание на это число, потому что он будет использоваться для расчета вирусного titer.
- Выполните серийные разбавления (1/104; 1/105; 1/106; 1/107) вирусного запаса в 1 мл полной среды роста следующим образом:
- 1/103: разбавление вирусного запаса - добавьте 2 МКЛ вирусного запаса к 1998 году к полной среде.
- 1/104: Сделайте 1:10 разбавления 1/103 путем разбавления 120 йл до 1080 йл полной среды (A).
- 1/105: Сделайте 1:10 разбавления B путем разбавления 120 МЛ от А до 1080 МЛ полной среды (B).
- 1/106: Сделайте 1:10 разбавления C путем разбавления 120 МЛ B до 1080 йл полной среды (C).
- 1/107: Сделайте 1:10 разбавления D путем разбавления 120 МКЛ от C до 1080 йл полной среды (D).
ПРИМЕЧАНИЕ: Подготовьте 3 трубки каждого разбавления (A, B, C, D) для выполнения эксперимента в трибалитах. - Удалите среду клеточной культуры из колодцев и добавьте подготовленные разбавления вируса, как показано на рисунке 2.
- День 3: Мониторинг выражения GFP
- Проверьте колодцы на наличие зеленых клеток с помощью флуоресцентный микроскоп.
- День 4: Анализ цитометрии потока GFP-положительных клеток
- Подготовка и маркировка двенадцати трубок 1,5 мл.
- Соберите клеточной культуры среды (вместе с отдельными клетками) в 1,5 мл труб и держать их на льду.
- Добавьте 200 мкл трипсина в каждую хорошо.
- Инкубировать пластину в течение 2 - 3 мин при 37 градусов по Цельсию в инкубаторе CO2.
- Урожай клеток в тех же трубах Эппендорфа со средой клеточной культуры. Держите трубки на льду.
- Пеллет клетки при 400 х г, в течение 5 мин, при 4 градусов по Цельсию.
- Удалите супернатант; держать трубки на льду.
- Повторное распределение гранул в 250 йл PBS и 2% FBS; держать трубки на льду.
- Передача клеточной подвески в потоке цитометрии труб или пластины.
- Вы запустите образцы на цитометре потока, записывающем флуоресценцию экспрессии клеток GFP.
Расчет Titer: Образцы с 5 - 20% GFP положительные клетки из родительской популяции должны быть приняты во внимание при расчете вирусного циттера с использованием следующей формулы:
Титер (TU/mL) - D x F/100 x C/V
D - фактор разбавления
F процент положительных клеток / 100
C и количество ячеек / хорошо
V - объем вирусного инокулума
7. Аденовирусная трансдукция целевых клеток и тестирование экспрессии индуцированного белка
- День 1: Посев клеток
- Семя целевых клеток, гарантируя, что они равномерно распределены в колодцах.
- День 2: Трансдукция клеток
- Отсоедините клетки-мишени от одного хорошо и посчитайте их.
- Рассчитайте соответствующий объем аденовираловой суспензии, необходимой для трансдукций клеток с желаемым количеством инфекционных частиц на клетку.
- Добавьте соответствующее количество вирусной суспензии в клетки-мишени.
- День 3: Удаление вирусной подвески и проверка на выражение GFP
- Замените среду клеточной культуры, содержащую аденовирусные частицы, на свежую среду.
- Проверьте выражение GFP на флуоресцентный микроскоп.
Результаты
Мы модифицировали и усовершенствовали оригинальный протокол Фогельштейна, чтобы достичь более быстрого и эффективного производства аденовирусов. Во-первых, мы пересмотрели методологию, чтобы добиться более простого выбора рекомбинантов. После рекомбинации, BJ5183 бактериальных клонов были протестированы "отрицательный ПЦР", чтобы оценить целостность pAdTrack-GFP как показатель отсутствия рекомбинации (рисунок 3A), или "положительный ПЦР", чтобы определить ген интереса, ассимилированных в нашем случае GFP (Рисунок 3B). Как в "негативных", так и в "положительных" ПЦР мы использовали pAdTrack-GFP в качестве шаблона управления, который дал полосу 986 bp для целостности pAdTrack(рисунок 3A, переулок 1), и полосу 264 bp для GFP(рисунок 3B, переулок 3). Праймеры, используемые для "негативного ПЦР", были разработаны для усиления фрагмента 986 bp, содержащего сайт PmeI в pAdTrack-GFP. Этот фрагмент ДНК резко увеличивается после рекомбинации и не усиливается в положительных рекомбинантных клонах. Отрицательные клоны для рекомбинации, в которых pAdTrack-GFP остались нетронутыми, представлены на рисунке 3A, полосы 3, 4 и 6. Праймеры аннеал на последовательностях ДНК, прилегающих к месту рекомбинации. Потенциальные положительные рекомбинантные клоны(рисунок 3A, полосы 2 и 5) выразили GFP, как показано на рисунке 3B, переулок 1 и 2. Плазмидная ДНК этих клонов была изолирована и использована для преобразования DH5, чтобы получить большее количество ДНК. Эти предварительно выбранные рекомбинантные плазмиды, усиленные в DH5, были затем протестированы при энзиматическом пищеварении. На рисунке 3C-E иллюстрируются результаты ферментного пищеварения одного рекомбинантно-положительного клона, переваренного с помощью ферментов ограничения Hind III, PstI, BamHI(рисунок 3C, D, E lane 2). Модели пищеварения HindIII и PstI рекомбинантного клона были похожи на те, которые были получены для pAdEasy-1, так как HindIII и PstI вырезали плазмиду pAdEasy-1 24 и 25 раз, соответственно ,Рисунок 3C и D, переулок 3); HindIII вырезать один раз и PstI сократить в четыре раза pAdTrack-GFP вектор(рисунок 3C и D, переулок 1). Бамхи вырезал два раза pAdEasy-1 вектор(рисунок 3C, переулок 3), и один раз pAdTrack-GFP(рисунок 3C, переулок 1).
PacI вырезал фрагмент 4,5 кб от рекомбинантной плазмиды(рисунок 3F,полоса 2), фрагмент 2863 bp от pAdTrack-GFP(рисунок 3F, переулок 1), и линейно pAdEasy-1 вектор(рисунок 3F, переулок 3). Лестница ДНК представлена на рисунке 3C-F,в полосах движения 4. Рекомбинантная плазмида была переварена с Pac I для дальнейшего использования для AD293 трансфекции.
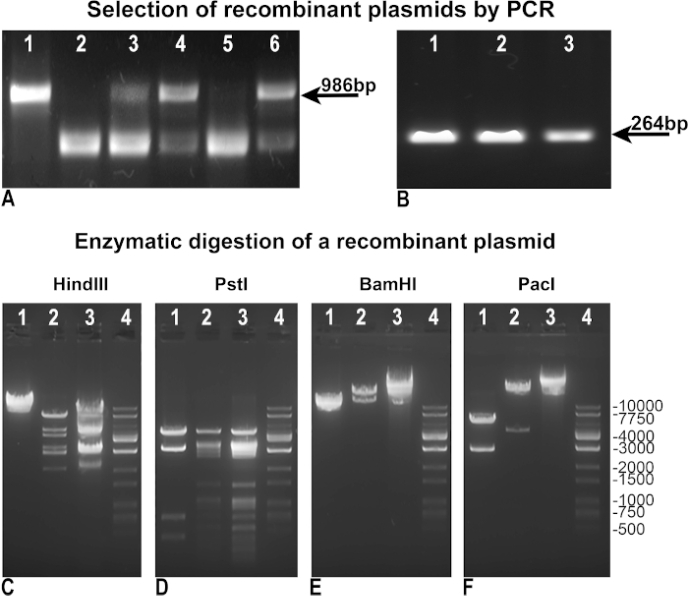
Рисунок 3: Рекомбинация pAdTrack-GFP с плазмидой pAdEasy-1. Плазмиды, полученные после рекомбинации pAdTrack-GFP и pAdEasy-1, были протестированы «отрицательным» ПЦР на целостность pAdTrack-GFP (A). О не рекомбинантных клонах свидетельствует наличие полосы 986 bp, соответствующей последовательности, усиленной плазмидной pAdTrack-GFP (A, полосы 3, 4 и 6). Были также получены клоны, потенциально положительные для рекомбинации (A, полосы 2 и 5). Когда вектор pAdTrack-GFP был использован в качестве шаблона, была получена полоса 986 bp для pAdTrack-GFP (A, полоса 1). Потенциально положительные рекомбинантные клоны были протестированы на выражение GFP на "положительном" ПЦР (B); полоса 264 bp появляется как для потенциально рекомбинированных клонов (B, полоса 1 и 2), так и для плазмиды pAdTrack-GFP. ДНК одного потенциального рекомбинантного клона была протестирована с помощью фермента ограничения HindIII, PstI, BamHI и PacI (C-F, полосы 2). В элементе управления плазмид pAdEasy-1 (C-F, полосы 3) и плазмида pAdTrack-GFP (C-F, полосы движения 1) переваривались с теми же ферментами. Лестница ДНК представлена в полосе C-F 4. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Аденовиальная упаковка и усиление были выполнены в клетках AD293. Аденовирал частицы (AdV-GFP) были очищены от лисата клетки AD293, а также из среды клеточной культуры, где они были освобождены инфицированными клетками. Чтобы сконцентрировать аденовирус, найденный в среде клеточной культуры, частицы были осаждены сульфатом аммония, а затем повторно использованы в 10 мМ Трис HCl pH 8 с 2 мМ MgCl2, тот же буфер, что и для клеточного лиза. Впоследствии аденовирусные частицы из лисата клетки и из среды культуры были очищены csCl разрывным градиентом ультрацентрифугации. После ультрацентрифугации была получена сильная полоса очищенного AdV-GFP, как показано на рисунке 4.

Рисунок 4: Аденовирал очистки ультрацентрифугации на прерывистый градиент CsCl. Однородный клеток и аденовирус, высасываемый из среды, подвергались ультрацентрифугации на прерывистом градиенте, образованном растворами CsCl низкой и высокой плотности. В обоих случаях были зарегистрированы сильные полосы аденовируса GFP-. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Для определения вирусного titer, выраженного в единицах трансдуцирования на один мл (TU/mL), клетки AD293 были заражены серийными разбавлениями AdV-GFP. После 48 часов, инфицированные клетки выразили GFP, в обратной корреляции с фактором разбавления вирусной суспензии. Это наблюдалось с помощью флуоресцентной микроскопии, и процент GFP-положительных клеток определялся цитометрией потока(рисунок 5). Для расчета titer, вирусное разбавление, которое индуцированных 5 - 20% GFP-положительных клеток было рассмотрено (Рисунок 5C). Как правило, мы получаем вирусный titer в 10фунтов стерлингов (TU/mL) для GFP-аденовируса.
Ниже приводится пример аденовирал-титерного расчета для конкретной аденовирской партии, в которой 300000 клеток (C) были трансуцированы с 1 мл аденовирусного раствора (V), при факторе разбавления 106 (D), для которого было получено 6% GFP-положительных клеток (F)
Титер (TU/mL) - D x F/100 x C/V - 106 x 6/100 x 300000/1 - 1,8 х 1010 TU/mL
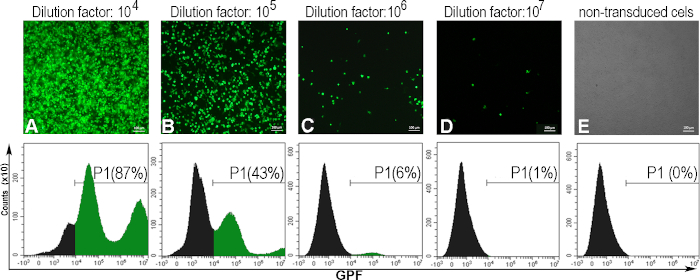
Рисунок 5: Оценка аденовирусного тьтера. Клетки AD293 были заражены различными аденовирусные разбавления. Сорок восемь часов спустя, клетки наблюдались с помощью флуоресценции микроскопии и проанализированы поток цитометрии, чтобы определить процент GFP положительных клеток, вызванных различными аденовирусными разбавлениями (A-D). Для установления ворот для цитометрии потока были также проанализированы непервированные клетки (Е). Татер, рассчитанный для фактора разбавления 106, когда 6% клеток были положительными GFP, был 1.8 x 1010 TU/mL. Для панелей A-E, бары: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Для проверки трансдукционного потенциала подготовленного аденовируса были использованы четыре клеточные линии: эндотелиальные клетки человека (EA.hy926), аортальные эндотелиальные клетки крупного рогатого скота (BAEC), гепатоциты мурина (Hepa 1-6) и мурин мезенхимальные стромальные клетки (MSC). Эндотелиальные клетки (EA.hy926 и BAEC) были трансуцированы с 25 TU/cell, гепатоциты были трансуцированы с 5 TU/cell и MSC были трансуцированы с 250 TU/cell.
Вот пример того, как был рассчитан объем аденовирусной подвески, необходимой для заражения 3 х10 6 ячеек с 25 ТУ/клеткой, с использованием аденовирусной подвески с 1,8 х10 10 ТУ/мл.
Для 1 ячейки .............. 25 ТУ
3 х 106 ячеек .............. x ТУ  x-75 x 106 TU
x-75 x 106 TU
Если вирусный запас содержит
1.8 x 1010 TU .............. 1 мл
75 х 106 ТУ .............. y mL  y' 4.2 x 10-3 мл и 4,2 мл вирусного запаса
y' 4.2 x 10-3 мл и 4,2 мл вирусного запаса
Через 48 часов после трансдукции клетки были проанализированы с помощью микроскопии флуоресценции. Как показано на рисунке 6, человеческие или бычьи эндотелиальные клетки были трансуцированы с хорошей эффективностью (50%) для 25 TU/cell(рисунок 6 EA.hy926 и BAEC). Гепатоциты Мурина (Hepa 1-6) были эффективно трансокцинированы аденовирусом при низком количестве аденовирусных частиц (5 ТУ/клетки), но они также чувствительны к аденовирусу, так как был зарегистрирован более высокий процент мертвых клеток (PI-положительные клетки) (16%) по сравнению с другими типами клеток. Мезенхимальные стромальные клетки были наиболее трудно трансдуцированных(рисунок 6), из-за отсутствия конкретных аденовирусных рецепторов (неопубликованные данные).
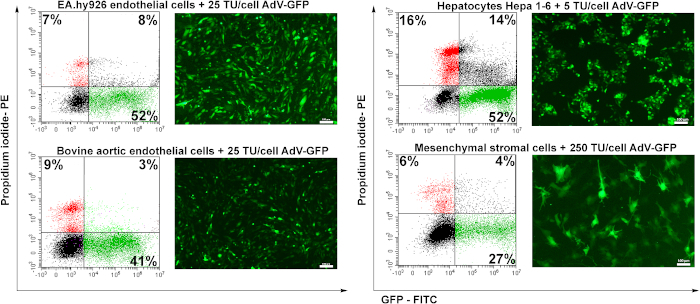
Рисунок 6: Инфекционность аденовируса и индукция экспрессии GFP в трансдуцированных клетках. Эндотелиальные клетки человека (EA.hy926), аортальные эндотелиальные клетки крупного рогатого скота (BAEC), гепатоциты мурина (Hepa 1-6) и мурин мезенхимальные стромальные клетки (MSC) были трансдированы с указанным количеством аденовируса. GFP был обнаружен с помощью флуоресцентной микроскопии и процент положительных клеток GFP был проанализирован цитометрией потока. PI-положительные клетки, определяемые цитометрией потока, показывают смертность клеток, определяемую вирусной трансдукции. Клетки EA.hy926, аортальные эндотелиальные клетки крупного рогатого скота и клетки Hepa 1-6 были сильно трансдуцированы аденовирусом, выход трансдукции колеблется от 41 до 52%. Для MSC, более высокое количество вируса (250 TU/cells) индуцированных только 27% GFP положительный из транс индуцированных клеток. Бары: 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Рекомбинантные аденовирусы являются универсальным инструментом для доставкигенов и экспрессии 12,13,14. Чтобы вызвать сильное выражение белка путем аденовирусной трансдукции, в геном аденовируса вставляется последовательность кодирования гена, представляющий интерес. Аденовиралная система AdEasy, разработанная в лаборатории Берта Фогельштейна, включает в себя основную плазмиду (pAdEasy-1), содержащую большую часть генома аденовируса дикого типа 5, и вектор шаттла (pAdTrack), предназначенный дляклонирования генов 2,10. Удаление аденовирусных генов Е1 (ответственных за сборку частиц инфекционного вируса) и Е3 (кодирующих белки, участвующие в уклонении от иммунитета хозяина) создало пространство в аденовирусном геноме, в которое может быть вставлен ген, представляющий интерес 6,5-7,5 кб2,3. Этот размер достаточен для многих генов, особенно для тех, у когокороче интроны 15,16,17. Есть также исследователи, сообщая о производстве аденовирусов, несущих кДНАтрансгена 18,19,20. Тем не менее, мы получили более низкий выход трансгенной экспрессии для аденовирусов, несущих кДНА, чем для их аналогов, несущих ген или мини-ген (данные не показаны).
Улучшение и адаптация предыдущихметодов 2,10,14,18,21, технология для аденовирусного производства требует более короткого времени, более низкой стоимости и меньше усилий. Полноформатная аденовирусная ДНК получена путем рекомбинации между вектором шаттла и плазмидой pAdEasy-1 в гомологовой рекомбинации, подверженной штамму кишечной палочки, BJ5183. Протокол подразумевает химическую трансформацию клеток AdEasier-1 (бактерии BJ5183, содержащие pAdEasy-1). Этот метод не требует электропоратора, который может быть недоступен в некоторых лабораториях, очень прост, повышает выход рекомбинации, и сокращает время, необходимое для получения компетентных клеток и для выполнения преобразования. Предварительный отбор рекомбинантных клонов, выполняемых ПЦР, еще больше сокращает время и облегчает всю процедуру. Аналогичная процедура была использована Чжао иколлегами 22, однако, в протоколе, мы оптимизировали последовательности грунтовки.
Для упаковки и усиления GFP-аденовируса использовалась производная клеточная линия HEK293, а именно клетки AD293, которые больше придерживаются культурной пластины. Другие клеточные линии, обычно используемые для аденовирал производства являются следующими: 911, 293FT, pTG6559 (A549 производные), PER. C6 (производная HER), GH329 (производная HeLa), N52. E6, и HeLa-E123,24,25,26. В наших руках, никакого улучшения в аденовирусной продукции было получено, когда 911 клеток были использованы (данные не показаны). Трансфекция клеток AD293 рекомбинантной плазмидой с использованием реагента K2 значительно увеличила эффективность шага вирусной упаковки. После производства аденовируса, до 70% аденовируса все еще находится внутри клеток и высвобождается тремя циклами замораживания и оттаивания. Увеличение количества циклов не подходит, поскольку он разрушает аденовирус.
На протяжении всего обычного аденовирусного производственного процесса, многочисленные вирусные частицы высвобождаются в среде клеточной культуры. Отказ от этой клеточной культуры среды во время сбора инфицированных клеток AD293 приведет к важной вирусной потере. Мы оптимизировали протокол, описанный Schagen и коллегами, чтобы очистить аденовирусные частицы от среды клеточной культуры осадками с сульфатомаммония 27. Этот метод имеет более высокую эффективность в восстановлении аденовируса из среды клеточной культуры по сравнению с методом использования полиэтиленгликоль28. Осажденный аденовирус следует немедленно очистить путем ультрацентрифугации или хранить в холодильнике в течение нескольких дней, но только после диализа, чтобы удалить избыток соли. Сохранение осадков дольше, чем несколько часов без диализа вредно для вируса.
Очистка аденовирусных частиц путем ультрацентрифугации, выполняемой в один шаг, уменьшает манипуляции аденовирусным запасом и облегчает процедуру по сравнению с протоколами с использованием последовательных ультрацентрифугациишагов 14,29. Диализ очищенного аденовируса необходим для удаления хлорида цезия, который может еще больше повлиять на трансдукцию. В протоколе мы использовали буфер Tris, содержащий MgCl2, но не сахарозу для диализа, так как он требует огромного, неоправданного количества сахарозы, которая необходима в противном случае в качестве консерванта для замораживания. Таким образом, мы добавили сахарозу позже, непосредственно в аденовирусные запасы, подготовленные к замораживанию. Чтобы избежать частого замораживания и оттаивания очищенного аденовируса, рекомендуется алицитировать аденовирусные запасы и хранить их при -80 градусов по Цельсию. Аденовирал-титер был оценен по цитометрии потока с учетом гена репортера GFP и процент трансинндуцированных клеток для специфического вирусного разбавления. Этот метод быстрее по сравнению с классическим "анализом бляшек" и более доверчив по сравнению с оценкой капсидных белков (различными методами, такими как ELISA или цитометрия потока), которая не показывает способность инфекции аденовираловых частиц. Тем не менее, ELISA основе количественной оценки, З-ПЦР, или налет анализ с использованием коммерчески доступных комплектов являются альтернативными методами, особенно полезно для титрованию аденовирусов, которые не содержат флуоресцентный трассировщик.
Учитывая, что аденовирусы pAdTrack получены из серотипа аденовирусов человека 5, который распознается Коксакивирусом и аденовирусными рецепторами (CAR), мы продемонстрировали способность GFP-аденовируса к трансдуцированию клеток человеческого происхождения (эндотелиальных клеток), а также клеток другого происхождения: крупного рогатого скота (эндотелиальных клеток) и мурина ( Данные показали, что GFP-аденовирус может вызвать высокий уровень экспрессии трансгена.
В заключение, мы оптимизировали эту трудоемкую технологию, чтобы сократить время, затраты и усилия, необходимые для получения аденовирусных частиц. Подготовленный аденовирус способен инфицировать различные типы клеток и вызывать экспрессию гена интереса. Этот протокол может быть использован в различных экспериментах, так как аденовирусная передача генов является одним из основных инструментов для разработки современных генной терапии.
АББРЕВИАТУРЫ: AdV-GFP, аденовирусные частицы; BAEC, аортальные эндотелиальные клетки крупного рогатого скота; CsCl, хлорид цезия; GFP, зеленый флуоресцентный белок; MSC, мезенхимальные стромальные клетки; ТУ, трансдуцирование единиц.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Эта работа была поддержана проектом, финансируемым совместно Европейским фондом регионального развития в рамках Оперативной программы по обеспечению конкурентоспособности на 2014-2020 годы (POC-A.1-A.1.1.4-E-2015, ID: P_37_668; аббревиатура DIABETER), грант румынского министерства исследований и инноваций PCCDI- UEFISCDI, номер проекта PN-III-P1-1.2-PCCDI-2017-0697 в рамках PNCD III и Румынской академии. Авторы благодарят Кириакоса Кипрооса (Университет Патраса, Греция) за его щедрые и соответствующие советы, Овидиу Кройтору (Университет изобразительных искусств, Бухарест, Румыния) за съемки, редактирование фильмов и графический дизайн, а Михаэлу Брату за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
Ссылки
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены