Method Article
腺病毒生产的有效方法
摘要
在这里,我们提出了使用pAdEasy系统进行腺病毒生产的协议。该技术包括重新组合pAdTrack和pAdEasy-1质粒,腺病毒包装和放大,从细胞赖酸和培养基净化腺病毒颗粒,病毒滴定,和腺病毒的功能测试。
摘要
腺体转导具有强而瞬时诱导利益基因表达到各种细胞类型和器官的优点。然而,重组腺苷技术是费力的,耗时的,昂贵的。在这里,我们提出了一个改进的协议,使用pAdEasy系统获得纯化腺苷颗粒,可以诱导一个强大的绿色荧光蛋白(GFP)表达在转导细胞。与伯特·沃格尔斯坦开发的原始方法相比,这种改进方法的优点是准备更快,生产成本更降低。腺素技术的主要步骤是:(1) 将 pAdTrack-GFP 与 BJ5183 细菌中的 pAdEasy-1 质粒重组:(二)腺苷颗粒的包装:(3) AD293细胞中腺病毒的扩增:(四)从细胞化解水合物、培养介质中净化腺苷颗粒的:(5) 腺病毒的病毒滴定和功能测试。对原始方法的改进包括:(一) 通过细菌的化学转化,对含有BJ5183的pAdEasy-1进行重组:((二) 选择"负"和"正"PCR的重组克隆:(三) 使用K2转染系统进行腺体包装的AD293细胞的传输:(四) AD293细胞在细胞培养介质中释放的病毒颗粒硫酸铵的沉淀:(五)通过一步氯化钠不连续梯度超集中净化病毒。在不同类型的转导细胞(如肝细胞、内皮细胞)中,从各种来源(人类、牛、穆林)中获得了兴趣基因的强烈表达(在此例中为GFP)。腺活体介质基因转移是开发现代基因疗法的主要工具之一。
引言
腺病毒是含有核胶囊和双链线性DNA基因组1,2,3的非病毒。腺病毒可以感染广泛的细胞类型和感染不依赖于活性宿主细胞分裂。感染后,腺病毒将其基因组DNA引入宿主细胞核,在那里它保持史诗色素,并与宿主的基因一起转录。因此,插入突变或异基因调节的潜在风险最小达到4,5,6。腺病毒基因组不与宿主基因组一起复制,因此,腺病毒基因在分裂的细胞群中被稀释。在腺素转化的优点中,有:(一) 高水平的转基因表达:(二) 由于表皮表达,减少与病毒DNA整合到宿主基因组相关的风险:(三) 各种分割和非分裂细胞类型的转导。生物医学研究中使用的大多数腺病毒都是非复制性的,缺乏E1区域7、8、9。对于它们的生产,需要提供 E1 序列(如 HEK293)的单元线。此外,删除了病毒生命周期 (E3) 的非必要区域,以便在病毒基因组中插入转基因:其他地区(E2和E4)在一些腺病毒中进一步被删除,但在这些情况下,腺病毒产量下降和转基因表达低的报告7。
在这里,我们提出了一个改进的协议,用于使用 AdEasy 系统构建、包装和净化腺病毒。这些改进使腺病毒的包装速度更快,更经济,比伯特·沃格尔斯坦2,10开发的原始方法,由于以下优点:(一) 通过细菌的化学转化,在BJ5183含pAdEasy-1中重新组合:(二) 选择PCR的重组克隆:(三) 使用K2转染系统进行腺体包装的AD293细胞的传输:(四) 病毒包装和放大后培养介质中腺病毒颗粒的沉淀:(五) 使用一步氯化钠 (CsCl) 梯度超中心化进行腺素净化。
使用 AdEasy 系统(图 1)进行腺病毒生产的协议包括以下步骤:
(1) 在 BJ5183 细菌中用 pAdTrack-GFP 与 pAdEasy-1 进行重组
(2) 腺体颗粒的包装
(3) 扩增腺病毒
(4) 从细胞水合物和培养基中净化腺苷酸颗粒
(5) 腺病毒滴定。
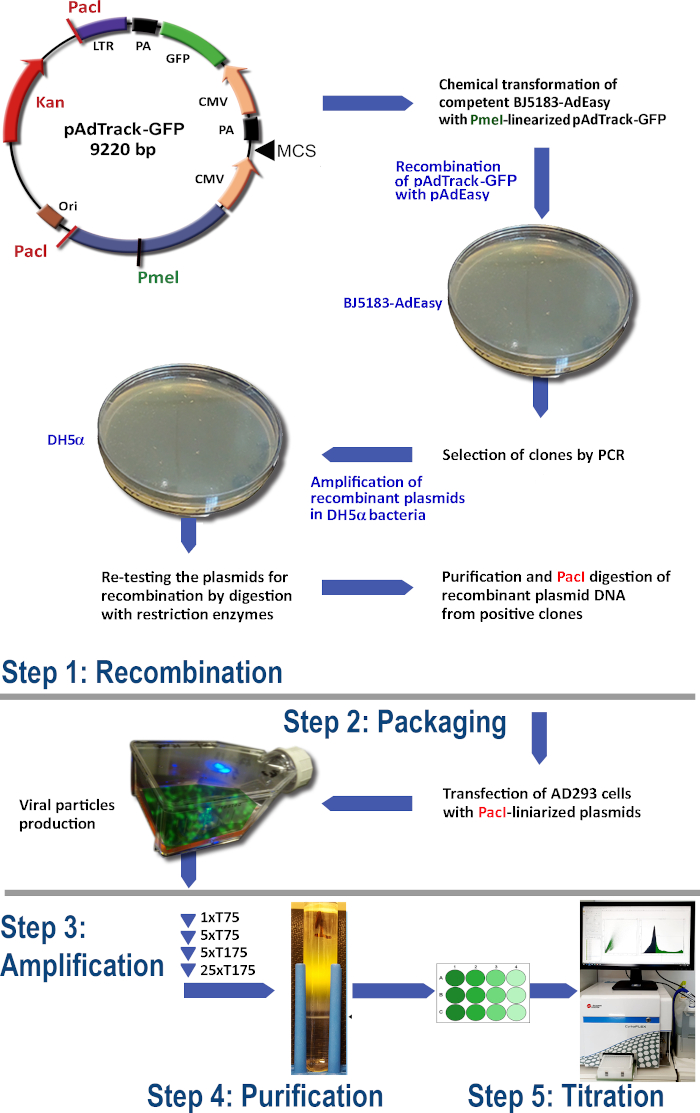
图1:腺病毒生产技术。腺素技术的主要步骤是:(1) pAdTrack-GFP 与 BJ5183 细菌中的 pAdEasy-1 质粒的重组。选定的重组质粒在DH5+细菌中放大,然后纯化:(2) AD293细胞中产生腺-E1蛋白的腺苷颗粒的包装:(3) AD293细胞中腺病毒的扩增:(四)通过对CSCl密度梯度进行超集中,净化细胞裂解物和培养基中的腺苷颗粒:(5) 腺病毒的滴定和功能测试。 请单击此处查看此图的较大版本。
在此协议中,我们体现了腺病毒的生产技术,该技术可诱导宿主细胞中 GFP 的表达。GFP 已插入第二个 CMV 促进器下的 pAdTrack-CMV 穿梭载体(添加基因#16405)的骨干,并用作报告基因(图 1)。因此,我们在此指定 pAdTrack-CMV 矢量为 pAdTrack-GFP,并评估了 GFP 的表达以示示范目的。除了GFP表达之外,该系统还可用于过度表达感兴趣的基因,该基因可能在pAdTrack-CMV的多个克隆站点克隆。与cDNA11相比,在pAdTrack-CMV中克隆的基因或微型基因通常更有效地进行表达感应。数据显示,来自不同来源(人类、牛、穆林)的转基因细胞(如肝细胞、内皮细胞)中具有很强的GFP表达。腺活体介质基因转移是开发现代基因疗法的主要工具之一。
研究方案
安全说明: 一般来说,腺病毒被归类为生物安全级别 2 生物,因此,所有操作都必须由训练有素的人在 II 类生物安全柜中进行,佩戴生物危害防护设备(包括手套、生物气溶胶面罩、实验室外套等)。所有被腺病毒污染的固体材料必须用10%漂白剂溶液消毒30分钟,并在121 °C和1酒吧自动清除30分钟。根据插入的基因,所创建的腺病毒可能具有危险潜力,并可能被归入其他生物安全级别。
1. 实验准备
- 使用单独的细胞培养罩进行腺病毒操作,并为每个腺病毒类型使用单独的孵化器。使用带有过滤帽的 T 烧瓶进行病毒包装和放大;尽可能避免在通风的培养皿板中进行转导实验。
- 每次使用后将细胞培养罩清空,并将其暴露在紫外线下 15 分钟。
- 定期自动编织移液器辅助器、移液器和其他器具。如果可能,在单独的细胞培养实验室培养腺苷脂包装(AD293细胞)的细胞和用于转导实验的细胞。应检查在同一时期放大的不同腺病毒批次是否由 PCR 进行交叉污染。
- 准备以下解决方案。
- 准备 SOB (超级最佳肉汤) 介质: 20 克 tryptone, 5 克酵母提取物, 0.5 克 NaCl (10 mM 最终浓度), 2.5 mL 1 M KCl (2.5 mM 最终浓度), amd H2O 至 1 L.在 121 °C 自动切割后,添加以下无菌解决方案:5 mL 的 1 M mgCl2 和 5 mL 的 1 M MgSO4。
- 准备 SOC (超级最佳肉汤与卡塔博利特抑制) 介质: 在 1 L 无菌 SOB 添加以下无菌解决方案: 20 毫升 1 M 葡萄糖, 5 mL 1 MgCl2, 和 5 毫升 1 MgSO4.
- 准备降水溶液:在60毫升H 2 O中溶解29.5克醋酸钾,加入11.5毫升醋酸,H2O至100毫升。
- 准备悬念缓冲:95毫升20%葡萄糖,5毫升1M特里斯-Cl pH 8,4毫升0.5 M EDTA pH 8,并添加H2O到200毫升。
- 准备裂解解决方案:4.8 mL 的 8.3 M NaOH,10 mL 的 20% SDS,H2O 到 200 mL。
2. 在 BJ5183 细菌中用 pAdEasy-1 质粒重组 pAdTrack-GFP 病毒载体
- pAdTrack-GFP 的线性化和线性质粒的纯化。
- 在冰上准备以下消化混合物:
10 微克的帕德特克 - 格夫普
5 μL 的 10 倍无色缓冲区
2μL的下午I
H2O 到最终卷 50 μL。 - 在37°C的灌木,在水浴中浸泡3小时。
- 在 65 °C 下停用 20 分钟。
- 使用 Pme I 检查 pAdTrack-GFP 的消化效率:在 0.8% 的蔗糖凝胶上与 1 μg 未消化的质粒并行运行 1 μg 的消化质粒。
- 在冰上准备以下消化混合物:
- DNA的隔离和净化
注意:步骤 1-6 需要在烟罩中执行。- 在消化混合物上加入等量的酚/氯仿/异酰酒精(25:24:1),倒置管子,直到混合物均匀。
- 离心机在16,200 x g下3分钟,然后将上水相转移到收集管中。
- 在较低的有机相和涡流中加入等量的酚/氯仿/异酰醇(25:24:1)。
- 离心机在16,200 x g下3分钟,然后将上一阶段转移到同一个收集管。
- 在收集管和涡流中收获的水相上加入等量的氯仿。
- 离心机在16,200 x g下3分钟,然后将上水相转移到新的收集管。
- 加入1/10卷3M醋酸钠,以及2卷100%乙醇和涡流的冷。
- 在-70°C或-20°C过夜孵育1小时。
- 在冰上解冻样品,在16,200 x g 和4°C下离心10分钟。
- 去除超自然,加入750微升的75%乙醇。
- 离心机在 16,200 x g 和 4 °C 下 3 分钟,并去除超自然。
- 短暂旋转管子以去除所有超自然剂并干燥发动机罩中的颗粒。不要长时间干燥DNA颗粒,因为它很难溶解。
- 在 H2O 的 15μL 中溶解颗粒。
- 使用光谱仪(如纳米滴)测量DNA浓度。
- 与帕德跟踪 -GFP 的阿迪西尔 - 1 细菌的转化
注意:在此步骤中,将 pAdTrack-GFP 与 pAdEasy-1 质粒进行重组。- 按照制造商的指示,使用商用转化套件准备 AdEasier-1 (BJ5183 含 pAdEasy-1,添加基因#16399) 化学合格细菌。将 100μL 合格细菌的引用量保持在 -80 °C。
- 在冰上解冻一种称职的AdEasier-1细菌,并加入1μg的纯化Pme I-消化的pAdTrack-GFP。轻拂管子轻轻混合(不要将混合物移液)。在冰上孵化10分钟。
- 加入 900 μL 的 SOC 介质,在 37 °C 下孵育 1 小时,并具有震动。
- 微浮在 600 x g下 5 分钟。
- 去除超物质的 900 μL,混合颗粒和超纳特,并将转化后的细菌与卡纳霉素一起播种在 LB-agar 板上。
- 在37°C(不超过18小时)孵化约16小时。
- 选择 PCR 可能的正克隆
- 将牙签分成两半,然后通过自切灭菌对半牙签进行消毒。
- 使用无菌半牙签拾取小而半透明的菌落。
- 简言之,在 10 μL 水中(在 PCR 管中)中用细菌旋转半牙签,然后将半牙签放入含有 100 μL SOC 中含有卡那霉素的 1.5 mL Eppendorf 管中。在 37 °C 下孵化 4-6 小时,同时通过"阴性"和"阳性"PCR 测试克隆。
- 在 95 °C 时将含有 10μL 水的 PCR 管与细菌一起孵化 5 分钟,以获取细菌样本,并并行运行"阴性"和"阳性"PCR。
- "负"PCR - 测试 pAdTrack-GFP 完整性:为冰上的负 PCR 准备以下 PCR 组合。
细菌样本的 5μL
0.1μL 的引物转发 (4631 F: 5'- 卡格塔格特克特卡格)
0.1μL 引言反向 (5616 R: 5'-塔格塔特格特格特克)
0.1 μL 的 dNTP 10 mM
5倍缓冲区3μL
1.5 微升 MgCl2 25mM
0.1 微升戈塔克聚合酶
H2O 至最终卷 15 μL
注:必须包括DNA模板为pAdTrack-GFP载体的正控制。 - "正"PCR - 以测试感兴趣的基因的存在。使用特定的引物插入基因,并准备组合,如上一步。用于 GFP 的引言如下:
F: 5'-卡加加卡卡
R:5'-阿格格塔 - 并行运行"负"和"正"PCR。PCR 程序为:5 分钟,95 °C;以下步骤的 40 个周期: 30 秒, 95 °C;30秒,68°C:1分钟,72°C;最后拉长:10分钟,72°C。
注意:调整退化温度以放大兴趣基因。 - 在 1% 的蔗糖凝胶上评估 PCR 产品,并选择克隆。
- 考虑在"正 PCR"之后,对"负 PCR"和特定 PCR 产品不提供 PCR 产品的克隆进行进一步处理。
- 培养选定的重组克隆的细菌培养
- 用卡那霉素稀释 SOC 介质 4 mL 中假定的阳性克隆(导致步骤 2.4.3.)的文化,并在 37°C 的温度下通过摇晃在一夜之间孵育它们。
- 从AdEasier-1细菌中分离质粒DNA(使用碱性裂解的迷你素)
- 在微中螺管中转移1.5毫升细菌培养物,在16,200 x g下将离心机转移1分钟,并去除超自然物。
- 在同一管中再转移1.5mL细菌培养,重复离心,并去除超自然。
- 添加 200 μL 的悬念缓冲器(50 mM 葡萄糖、10 mM EDTA、25m 三重-HCl pH 8)。
- 加入200μL的裂解溶液(0.2 N NaOH,1%SDS),通过倒置管子轻轻混合。
- 加入200微升降水溶液(60毫升5M醋酸钾,11.5毫升冰川醋酸,加入H2O至100毫升),并通过倒管轻轻混合。
- 离心机3分钟,16,200 x 克。
- 将超自然体转移到新的微中福管中,加入500μL异丙酚,在冰上混合孵育20分钟。
- 离心机在16,200 x g 下15分钟,加入500μL的75%乙醇。
- 离心机在 16,200 x g 下 10 分钟,并去除超自然。
- 离心机在16,200 x g下3分钟,去除超自然,并添加15μL的H2O。
- 放大、隔离和重新测试重组的质粒
- DH5®细菌的转化,DNA从AdEasier-1细胞中分离出。
- 按照制造商的指示,使用商业转化套件准备 DH5® 合格细菌。
- 在冰上解冻100μL的DH5°合格细菌,加入重组DNA,并在冰上孵育10分钟。然后用卡那霉素将细菌播种到LB-agar板上。
- 在37°C的夜间孵化。
- 拿起几个殖民地,并在2毫升的LB介质与卡纳霉素生长,在37°C,过夜,与震动。
- 分离DNA(使用碱性裂解的迷你准备),并在25μL H2O中恢复获得的DNA。
- 通过酶消化确认阳性克隆。
- 在冰上准备以下混合:
重组DNA的5μL
1.5 μL 的 10 倍无色缓冲区
0.5 μL 的欣德我或 Pst I
H2O 至最终卷 15 μL - 在37°C孵育30分钟。
注意:作为控制,还要消化pAdTrack-GFP和pAdEasy-1质粒。 - 在每个示例中添加 3 μL 的 Sx6 加载缓冲区,并加入 RNase A(如果 RNase A 不存在于迷你预取缓冲器中)。
- 在1%的糖凝胶电泳上运行消化的DNA片段。
注:正克隆的消化模式包括消化的pAdEasy质粒的大部分片段,揭示了pAdTrack向量的pAdEasy重组。兴趣基因应该用用于克隆的限制酶的消化来证明。
- 在冰上准备以下混合:
- 为腺病毒包装准备质粒DNA(转染级)。
- 从正克隆中培养出200mL的细菌培养,以分离质粒DNA。
- 按照制造商的指示,使用质粒DNA中尖端脱氧核糖核酸(如奇根质粒米迪套件)的商业套件分离。
- DH5®细菌的转化,DNA从AdEasier-1细胞中分离出。
3. 包装腺苷颗粒
- 第1天。播种AD293细胞
- 用 PBS 清洗 AD293 细胞,并在 37 °C 下用 0.125% 的 Trypsin 孵育它们 2-5 分钟。
- 用血清在冷介质中收集细胞。
- 离心机5分钟,400 x 克 ,4°C。
- 用血清将细胞重新用介质补充,并以 ±2 x 106/T25烧瓶的密度播种细胞。最好使用带过滤器的烧瓶。
- 第1天。用 Pac I 消化重组的 Dna
- 准备以下组合:
重组DNA的6μL(1微克/微升)
2 μL 的 Pac I
2.5 μL 的 10 倍无色缓冲区
H2O 至 25μL 的最终音量 - 在37°C下孵育3小时(或过夜),然后在65°C下灭活酶20分钟。
- 含有乙醇的DNA沉淀:加入2.5微升(1/10 v/v)3M醋酸钠和2-3卷100%乙醇。在 -70 °C 或 -20 °C 的夜间孵化 30 分钟。
- 离心机在16,200 x g 30分钟在4°C,并恢复颗粒在无菌水中。
- 准备以下组合:
- 第2天:使用K2试剂传输AD293细胞
- 在细胞上加入 40 μL 的 K2 乘数,在传输前两小时。
- 准备 A 和 B 解决方案:
解决方案 A: 在 Opti-MEM 的 260 μL 中添加 6 μg 的 Pac l 线性脱氧核糖核酸。
解决方案 B:在 Opti-MEM 的 248.4 μL 中加入 21.6 μL 的 K2 试剂。 - 添加解决方案 A 过溶液 B,并通过管道轻轻混合。
- 在室温下将混合物孵育20分钟。在细胞中加入滴答和 B 混合。
- 第3-11天:通过荧光显微镜监测GFP表达
注意:细胞在荧光显微镜中应呈绿色,应逐渐分离。 - 第11天:收获F1腺苷颗粒
- 将分离的细胞和介质收集在 50 mL 管中,刮掉粘附细胞,并将其添加到同一管中。
- 离心机在 400 x g 下 5 分钟,在新管中收集超母细胞,并在 0.5 mL 的 PBS 中重新注入细胞颗粒。
- 细胞中断
- 将细胞悬架转移到微中微管中。
- 执行三个冻结/解冻周期(在液氮中冻结或在 -80 °C/thaw 在 37 °C 最多 7 分钟)。
- 通过23G注射针三次通过破碎的细胞。
- 以 9,600 x g 的离心速度清除细胞碎片,12 分钟。
- 将超自然人转移到 50 mL 管与收集的介质。
4. 腺病毒的扩增
注:如果AD293细胞没有达到必要的汇合,用于感染的腺病毒储存物(从病毒生成细胞获得的芦溶胶)的脂肪库可储存在-80°C。
- 准备F2腺苷颗粒。
- 将AD293细胞播种在T75烧瓶中(5 x 106 个细胞/烧瓶)。
- 使用 F1 腺苷颗粒感染约 90% 的汇合 AD293 细胞:在 T75 烧瓶中生长的细胞上加入细胞同质化和 T25 烧瓶中的介质。
- 通过荧光显微镜监测 GFP 表达。
- 当 90% 的转导 AD293 分离时(~转导后的第 5 天),收获产生病毒的细胞。将细胞培养介质保持在 4 °C。
- 在 1 mL PBS 中破坏单元格(与 F1 的细胞类似)。
- 准备F3腺苷颗粒。
- 感染约90%的汇流AD293细胞种子在T175烧瓶与F2腺苷颗粒和细胞培养介质从F2腺苷颗粒。
- 收获细胞(转导后5天)。
- 在PBS的2毫升中破坏细胞(与F1的细胞类似)。
- 准备F4腺苷颗粒。
- 感染 5 T175 烧瓶,其中含有约 90% 的结合 AD293 细胞与 F3 腺苷酸颗粒和细胞培养介质。
- 收获细胞(转导后5天)。
- 在 3 毫升的 PBS 中破坏细胞(与 F1 的细胞类似)。
- 准备F5腺苷颗粒。
- 感染 25 T175 烧瓶,其中含有约 90% 的汇流 AD293 细胞与 F4 腺苷酸库存和细胞培养介质。
5. 从细胞利萨酸盐和文化介质中净化腺病毒
- 采集产生病毒的细胞和培养介质。
- 从转导5天后收获F5的AD293细胞。
- 将介质保存在无菌瓶中,以沉淀腺苷颗粒。
注意:将介质保存在冰箱中,直到腺病毒纯化。 - 以 400 x g 的速度将细胞离心,5 分钟,在 4 oC 下。
- 在 5 mL 的 10 mM 特里斯 HCl 中补充最终颗粒,pH 8 与 2 mM MgCl2进行恢复。
- 将悬架引用到 1.5 mL 管中。
- 破坏细胞(与F1的细胞类似):冻结/解冻三个周期。
注意:如果无法立即执行超中心化,请将样品保持在 -80 °C。 - 通过 23G 注射器针将细胞悬架传递三次。
- 在9 600 x g下将同质化离心机,12分钟。
- 通过 CsCl 梯度超中心化保存超自然药物,用于腺病毒净化。
- 文化介质中释放的腺病毒的降水。
- 在室温下将瓶子与保存的细胞培养介质一起带上。
- 每500mL细胞培养介质中加入121克硫酸铵(溶液饱和度应在40-42%之间)。
- 小心混合,直到硫酸铵完全溶解。
- 在室温下孵化至少2.5小时。
- 离心机在1600 x g,15分钟,在 22oC,并保存颗粒。
- 以 4 mL 的 10mM 特里斯 HCl pH 8 与 2mM MgCl2重新插入颗粒:这种悬架应立即通过 CsCl 梯度超中心化进行净化。
注:如果随后不能执行净化步骤,请隔夜对 10mM Tris HCl、pH 8 与 2mM MgCl2进行隔夜增补颗粒。
- 腺病毒通过超集中式净化。
- 在聚丙烯管中为 SW41Ti 转子准备不连续的 CsCl 梯度。在管子底部添加 3 毫升 765 毫克/毫升 CsCl(高密度:1.4 克/升)。在第一个 CsCl 层顶部缓慢添加 3 毫升 288.5 毫克/毫升 CsCl(低密度: 1.2 g/L)。
- 轻轻地覆盖从细胞释放或从梯度顶部的细胞培养介质(如前所述)沉淀的3-4 mL腺苷酸粒子悬浮。
- 将管子装满矿物油,并将管子放入冷 SW41Ti 桶中。
- 平衡管子。确保填充的聚丙烯管对称加载到转子中。将转子放入超中心。
- 离心机在210,000 x g 和4°C,18小时,没有刹车。
- 将超中心管放在支架上,后面放一张黑纸,以获得带子。
- 用漂白溶液将透明上相、细胞碎片和上带丢弃在废物容器中。
- 在无菌的 1.5 mL 管中收获包含完整腺病毒(~700 μL - 1 mL) 的最低带,并将其保持在冰上。
- 在透析缓冲区(10 mM 三联缓冲区 pH 8,2 mM MgCl2)中预湿透析盒。
- 使用 2 mL 注射器将纯化腺病毒注射到透析盒中。
- 隔夜透析对10米特里斯-Cl缓冲区pH 8,2米M MgCl2( 改变透析缓冲3-4次)。
- 从 10 - 100 μL 的透析盒中收获腺素库存。
- 将蔗糖添加到病毒性阿利库特(用于冷冻保护)的最终浓度为4%。
- 在 -80 °C 下存储别名报价。
6. 腺病毒滴定
- 第1天:对细胞进行电镀
- 种子AD293细胞的密度为2.5×105 细胞每井(在12井培养板)在1mL完整的生长介质,如 图2所示。确保细胞在每个井中均匀分布,以获得准确的滴定。
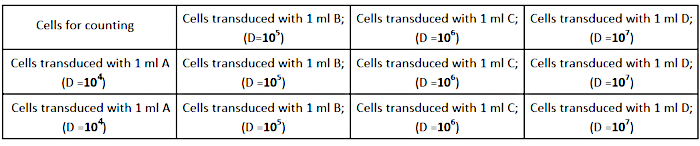
图2:滴定板设计。请单击此处查看此图的较大版本。
- 第2天:细胞的转导
- 用肌素将细胞从一口井中分离,并计数。注意这个数字,因为它将用于计算病毒滴定器。
- 在完整的生长介质的1mL中对病毒股进行串行稀释(1/104:1/105:1/106;1/107):
- 1/103: 病毒库存稀释 - 将病毒库存的 2μL 添加到 1998 μL 的完整介质中。
- 1/104: 通过稀释 120 μL 至 1080 μL 的完整介质 (A),使 1:10 稀释 1/103。
- 1/105: 通过稀释 120 μL 的 A 到 1080μL 的完整介质 (B) 来稀释 B 的 1:10 稀释。
- 1/106: 稀释 120 μL B 至 1080 μL 的完整介质 (C) 来稀释 C 的 1:10。
- 1/107: 通过稀释 120 μL 的 C 到 1080 μL 的完整介质 (D) 来稀释 D 的 1:10 稀释。
注:准备3管每个稀释(A,B,C,D)执行三元体实验。 - 从井中取出细胞培养介质,并添加病毒的预制稀释剂,如 图2所示。
- 第 3 天:监控 GFP 表达
- 使用荧光显微镜检查井中是否有绿色细胞。
- 第4天:GFP阳性细胞的流动细胞学分析
- 准备和标记12个1.5 mL管。
- 将细胞培养介质(连同分离的细胞)收集在1.5 mL管中,并将其保持在冰上。
- 在每口井中加入200微克的三氯辛。
- 在 CO 2 孵化器中的 37 °C 下孵化板 2 -3 分钟。
- 用细胞培养介质在同一埃彭多夫管中收获细胞。把管子放在冰上
- 在 400 x g 下,在 4 °C 下将细胞颗粒化 5 分钟。
- 去除超自然人;把管子放在冰上
- 以PBS+2%FBS的250μL重新喷射颗粒;把管子放在冰上
- 将细胞悬架转移到流细胞测量管或板中。
- 在记录 GFP 表达细胞荧光的流动细胞仪上运行样本。
Titer 计算:使用以下公式计算病毒滴定器时,应考虑来自母群的 5 - 20% GFP 阳性细胞的样本:
滴答声 (TU/mL) = D x F/100 x C/V
D= 稀释因子
F = 正细胞百分比 / 100
C=细胞数量/井数
V = 病毒接种量
7. 目标细胞的腺体转导和诱导蛋白表达的测试
- 第1天:播种细胞
- 播种目标细胞,确保它们均匀地分布在井中。
- 第2天:细胞的转导
- 将目标细胞从一口井中分离并计数。
- 计算用每个细胞所需的传染性颗粒数量传输细胞所需的腺病毒悬浮量。
- 将相应数量的病毒悬浮添加到目标细胞中。
- 第 3 天:去除病毒暂停并检查 GFP 表达
- 用新鲜介质替换含有腺苷酸颗粒的细胞培养介质。
- 检查荧光显微镜上的GFP表达式。
结果
我们修改和改进了原来的沃格尔斯坦协议,以实现更快、更高效的腺病毒生产。首先,我们修改了方法,以实现更易选择的重组剂。重组后,BJ5183细菌克隆通过"阴性PCR"进行测试,以评估pAdTrack-GFP的完整性,作为缺乏重组的指标(图3A),或通过"正PCR"来识别感兴趣的基因,在我们的情况下,与GFP(图3B)同化。在"负"和"正"PCR 中,我们使用 pAdTrack-GFP 作为控制模板,该模板为 pAdTrack 完整性(图 3A,车道 1)提供了 986 bp 的频段,GFP(图 3B,车道 3)的频段为 264 bp。用于"负PCR"的引座设计用于放大包含pAdTrack-GFP中的PmeI站点的986 bp的片段。这种DNA片段在重组后被大大放大,在正重组克隆中不会被放大。重组的负克隆,其中pAdTrack-GFP保持不变,表现在 图3A,车道3,4和6。与重组站点相邻的DNA序列上的引物退化。潜在的正重组克隆(图3A,车道2和5)表示GFP如 图3B,车道1和2所示。这些克隆的质粒DNA被分离并用于DH5+转化,以获得更高数量的DNA。这些预先选择的重组质粒放大在DH5®然后通过酶消化测试。图 3C-E 中展示了一个重组阳性克隆的酶消化结果,该克隆与欣德三世、PstI、BamHI限制酶(图3C、D、E 车道2)一起消化。重组克隆的印地语和 PstI 消化模式与 pAdEasy-1 获得的消化模式相似,因为印地安人和 PstI 分别切割了 pAdEasy-1 质粒 24 次和 25 次(图 3C 和 D,车道 3):印地语切割一次,PstI切四倍于pAdTrack-GFP矢量(图3C和D,车道1)。Bamhi 切割了两次 pAdEasy-1 矢量 (图 3C,车道 3), 和一次 pAdtrack - Gfp (图 3C,车道 1) 。
PacI 从重组质粒(图 3F,车道 2)中切出 4.5 kb 的片段,从 pAdTrack-GFP(图 3F,车道 1)中切出 2863 bp 的片段,并将 pAdEasy-1 矢量线性化(图 3F,车道 3)。DNA梯子在 图3C-F中表示,在4号车道上。重组质粒与 Pac I 一消化,用于 AD293 的进一步传输。
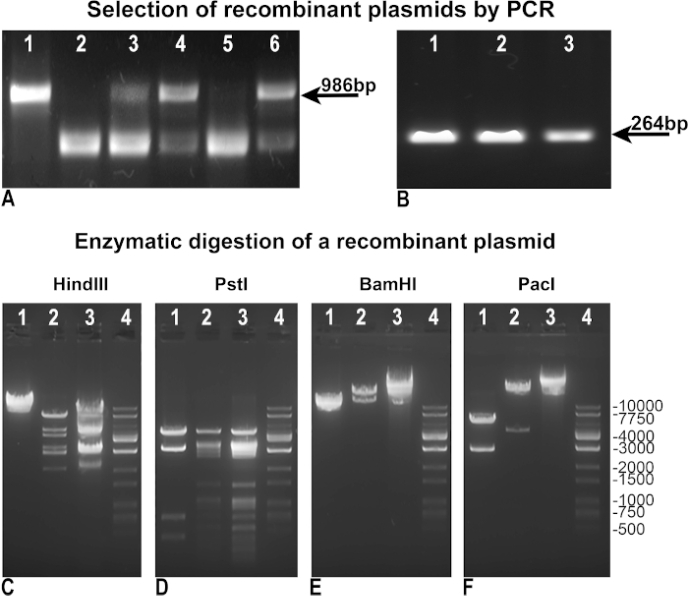
图3:pAdTrack-GFP与pAdEasy-1质粒的重组。pAdTrack-GFP 和 pAdEasy-1 重组后获得的质粒通过"阴性"PCR 测试,以检测 pAdTrack-GFP 完整性 (A)。非重组克隆的证据表明,存在一个986 bp波段,与从pAdTrack-GFP质粒(A,车道3,4和6)放大的序列相对应。克隆可能积极重组(A,车道2和5)也获得。当 pAdTrack-GFP 矢量用作模板时,获得了 pAdTrack-GFP (A,车道 1) 的 986 bp 频段。潜在的阳性重组克隆通过"阳性"PCR (B) 测试了 GFP 表达:一个264 bp的频段出现在两个潜在的重组克隆(B,车道1和2),以及为pAdTrack-GFP质粒。一个潜在的重组克隆的DNA用印地语、PstI、BamHI和PacI限制酶(C-F,通道2)进行了测试。在控制中,用相同的酶消化了 pAdEasy-1 向量 (C-F,车道 3) 和 pAdTrack-GFP 质粒 (C-F,通道 1)。DNA 梯在 C-F 车道 4 中表示。 请单击此处查看此图的较大版本。
腺苷体包装和放大在AD293细胞中进行。腺病毒颗粒(AdV-GFP)是从AD293细胞的番茄酱以及细胞培养介质中纯化的,在那里它们已被受感染的细胞释放出来。为了浓缩细胞培养介质中发现的腺病毒,这些颗粒被硫酸铵沉淀,然后以2mM MgCl2在10mM Tris HCl pH 8中再沉淀,与用于细胞裂解的缓冲器相同。随后,细胞裂解物和培养介质中的腺卵颗粒通过 CsCl 不连续梯度超中心化进行净化。超集中后,获得了一个强大的纯化ADV-GFP带,如 图4所示。

图4:通过在不连续的CSCl梯度上超集中式净化腺素。细胞同质化和从介质中沉淀的腺病毒在低密度和高密度 CsCl 溶液形成的不连续梯度上受到超集中处理。在这两种情况下都证明了GFP-腺病毒的强带。 请单击此处查看此图的较大版本。
为了确定每mL(TU/mL)的转导单元中表达的病毒滴定器,AD293细胞感染了AdV-GFP的连续稀释。48小时后,受感染的细胞表示GFP,与病毒悬浮的稀释因子成反比。荧光显微镜观察到这一点,GFP阳性细胞的百分比由流动细胞学(图5)确定。为了计算滴定器,考虑了诱导5 -20%GFP阳性细胞的病毒稀释(图5C)。通常,我们获得GFP-腺病毒的病毒滴定剂为±10 10(TU/mL)。
下面,我们提供了一个特定腺苷基滴定器计算的例子,其中 300000 个细胞 (C) 被转导为 1 mL 腺苷溶液 (V),稀释因子为 106 (D),为此获得了 6% 的 GFP 阳性细胞 (F):
蒂特 (TU/mL) = D x F/100 x C/V = 106 x 6/100 x 300000/1 = 1.8 x 1010 TU/mL
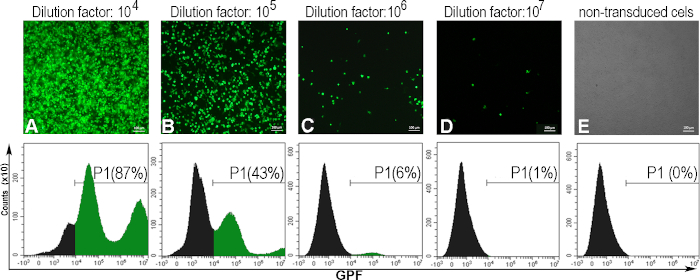
图5:腺体滴定器的评估。AD293细胞感染了各种腺病毒稀释。48小时后,荧光显微镜观察到这些细胞,并通过流动细胞学进行分析,以确定由不同腺素稀释(A-D)诱导的GFP阳性细胞的百分比。为了建立流动细胞测量的门,还分析了非转导细胞(E)。稀释因子106计算的滴定器,当6%的细胞为GFP阳性时,为1.8 x 1010 TU/mL。对于面板 A - e, 条: 100μm. 请点击这里查看此图的更大版本。
为了测试预制腺病毒的转导潜力,使用了四个细胞系:人类内皮细胞(EA.hy926)、牛主动脉内皮细胞(BAEC)、穆林肝细胞(Hepa 1-6)和穆林间皮质频闪细胞(MSC)。内皮细胞(EA.hy926和BAEC)用25个TU/细胞进行转导,用5个TU/细胞转导肝细胞,用250个TU/细胞转导MSC。
下面是一个示例,说明如何计算使用 1.8 x 10 TU/mL 的腺活性悬架感染 3 x 106细胞所需的腺活性悬浮体量。
对于1个单元格。。。25 图
3 x 106 细胞。。。x TU  x=75 x 106 TU
x=75 x 106 TU
如果病毒库存包含
1.8 x10 10 图。。。1升
75 x 106 图。。。y mL  y= 4.2 x 10-3 mL = 4.2μL 病毒库存
y= 4.2 x 10-3 mL = 4.2μL 病毒库存
转导48小时后,通过荧光显微镜对细胞进行分析。如图6所示,人类或牛内皮细胞的转化效率良好(+50%)25 个 TU/单元格(图 6 EA.hy926 和 BAEC)。Murine 肝细胞(Hepa 1-6)在低量腺病毒颗粒(5 TU/细胞)中被腺病毒有效转化,但它们对腺病毒也很敏感,因为记录了较高比例的死细胞(PI阳性细胞)(+16%)与其他细胞类型相比。由于缺乏特定的腺苷受体(未公开的数据),中度频闪细胞是最难转输的(图6)。
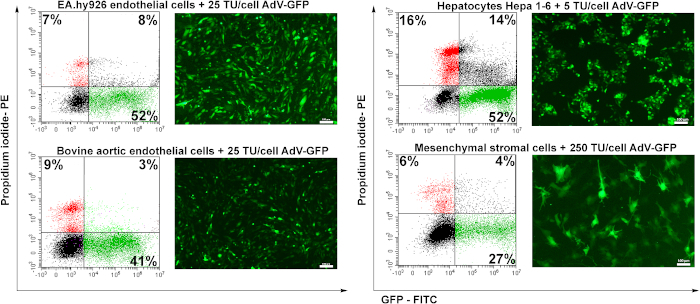
图6:腺病毒的感染和转基因细胞中GFP表达的诱导。人类内皮细胞(EA.hy926)、牛主动脉内皮细胞(BAEC)、穆林肝细胞(肝细胞1-6)和穆林间质质细胞(MSC)均随腺病毒的指示量而转化。通过荧光显微镜检测出GFP,通过流动细胞学分析GFP阳性细胞的百分比。由流动细胞学确定的PI阳性细胞显示由病毒转导决定的细胞死亡率。EA.hy926细胞、牛主动脉内皮细胞和肝1-6细胞均由腺病毒高度转化,转导的收益率在41-52%不等。对于MSC,病毒(250TU/细胞)的含量较高,只诱导27%的转基因细胞GFP阳性。条形图:100μm。 请单击此处查看此图的更大版本。
讨论
重组腺病毒是基因传递和表达的多功能工具12,13,14。为了通过腺病毒转导诱导强蛋白表达,将感兴趣的基因编码序列插入腺病毒的基因组中。在伯特·沃格尔斯坦实验室开发的AdEasy腺病毒系统包括一个骨干质粒(pAdEasy-1),其中包含大多数野生型腺病毒血清型5基因组,以及一个用于基因克隆2,10的穿梭载体(pAdTrack)。删除腺病毒基因E1(负责传染性病毒颗粒的组装)和E3(参与逃避宿主免疫的编码蛋白)在腺病毒基因组中创造了一个空间,其中可以插入6.5-7.5 kb感兴趣的基因2,3。这个大小足以满足许多基因,特别是那些具有较短的直子15,16,17。也有研究人员报告,携带cDNA的基因18,19,20的腺病毒的生产。然而,我们获得的cDNA携带腺病毒的转基因表达的产量低于携带基因或微型基因的对应体(未显示的数据)。
改进和适应以前的方法2,10,14,18,21,腺苷生产技术需要更短的时间,更低的成本,更少的努力。全长腺病毒DNA是通过航天飞机载体和padEasy-1质粒在同源重组易感大肠杆菌株BJ5183之间的重组获得的。该协议意味着AdEasier-1细胞(BJ5183细菌含有padEasy-1)的化学转化。该技术不需要在某些实验室中可能不可用的电推进器,非常简单,可提高重组产量,并缩短获得合格细胞和进行转化所需的时间。PCR 进行的重组克隆的预选进一步缩短了时间,简化了整个过程。赵和同事22也使用了类似的程序,但是,在协议中,我们优化了引物的序列。
对于GFP-腺病毒的包装和放大,使用了 HEK293 衍生细胞系,即 AD293 细胞,它们更粘附于培养板。其他通常用于腺体生产的细胞系如下: 911, 293FT, pTG6559 (A549 衍生物), PER.C6 (HER 衍生品), GH329 (HeLa 衍生品), N52.E6和赫拉-E1 23,24,25,26。在我们手中,当使用911细胞时,腺体生产没有改善(数据未显示)。使用 K2 试剂的重组质粒对 AD293 细胞的传输显著提高了病毒包装步骤的效率。腺病毒生产后,高达 70% 的腺病毒仍在细胞内,并通过三个冻结和解冻周期释放。增加周期数是不适合的,因为它会破坏腺病毒。
在整个常规腺病毒生产过程中,细胞培养介质中释放出许多病毒颗粒。在收获受感染的AD293细胞时丢弃这种细胞培养介质会导致重要的病毒损失。我们优化了沙根和同事描述的协议,通过含硫酸铵27的降水来净化细胞培养介质中的腺苷颗粒。与使用聚乙二醇28的方法相比,该方法在细胞培养介质的腺病毒恢复方面效率更高。沉淀的腺病毒应立即通过超集中式净化或在冰箱中保存几天,但只有在透析后,才能去除过量的盐分。保持沉淀时间超过几个小时而不透析对病毒有害。
通过一步超集中式净化腺卵巢颗粒可减少对腺体储存的操纵,并简化与使用连续超中心化步骤14、29的协议相比的程序。对纯化腺病毒进行透析是消除氯化铀的必要手段,这种氯化物可能会进一步影响转导。在协议中,我们使用含有 MgCl2的 Tris 缓冲器,但不用于透析蔗糖,因为它需要大量不合理的蔗糖,否则需要作为冷冻的防腐剂。因此,我们后来加入蔗糖,直接进入准备冻结的腺苷油库存。为了避免净化腺病毒的频繁冻结和解冻,建议将腺病毒库存引用并储存在-80°C。 根据GFP报告器基因和转导细胞的百分比进行特定病毒稀释,通过流动细胞学对腺病毒滴定器进行了评估。与经典的"斑块检测"相比,这种方法更快,与评估不会揭示腺病毒颗粒感染能力的辣椒蛋白(通过各种方法,如ELISA或流动细胞测量)相比,它更值得信赖。但是,基于 ELISA 的定量、Q-PCR 或使用市售工具包进行斑块检测是替代方法,尤其可用于对不含荧光示踪剂的腺病毒进行滴定。
考虑到pAdTrack腺病毒源自人类腺病毒血清型5,这是公认的考克斯卡奇病毒和腺病毒受体(CAR),我们证明了GFP-a的能力 去传播人类起源的细胞(内皮细胞),但也转导其他起源的细胞:牛(内皮细胞)和穆林(脑脊髓细胞和肝细胞)。数据显示,GFP-腺病毒可以诱导转基因的高表达。
最后,我们优化了这项费力的技术,以减少获得腺苷颗粒所需的时间、成本和努力。准备的腺病毒能够感染各种细胞类型,并诱导兴趣基因的表达。由于腺活介质基因转移是开发现代基因疗法的主要工具之一,此协议可用于各种实验。
缩写: AdV-GFP,腺苷颗粒;BAEC,牛主动脉内皮细胞:氯化铀:GFP,绿色荧光蛋白;MSC,间质质频闪细胞;TU,传输单元。
披露声明
作者没有什么可透露的。
致谢
这项工作由欧洲区域发展基金通过2014-2020年竞争力运营方案(POC-A.A.1.1.1.1.4-E-2015) 共同资助的项目提供支持, ID:P_37_668;缩写DIBETER),罗马尼亚研究和创新部的赠款PCCDI-UEFISCDI,项目编号PN-III-P1-1.2-PCCDI-2017-0697在PNCD III和罗马尼亚学院。作者感谢基里亚科斯·凯普罗斯(希腊帕特雷亚大学)的慷慨和相关建议,奥维迪乌·克罗托鲁(罗马尼亚布加勒斯特美术大学)的拍摄、电影编辑和平面设计,以及米海拉·布拉图的技术援助。
材料
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
参考文献
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。