Method Article
طريقة فعالة لإنتاج فيروس أدينو
In This Article
Summary
هنا، نقدم بروتوكول لإنتاج الفيروس الغدي باستخدام نظام pAdEasy. وتشمل هذه التكنولوجيا إعادة دمج pAdTrack وpAdEasy-1 plasmids، والتعبئة والتغليف الفيروس الغدي والتضخيم، وتنقية الجسيمات أدينوفيرالية من lysate الخلية والثقافة المتوسطة، والحلمة الفيروسية، والاختبار الوظيفي للفيروس الغدي.
Abstract
إن النقل الأدينوفيرالي له ميزة الحث القوي والعابرة للتعبير عن جين الاهتمام في مجموعة واسعة من أنواع الخلايا والأعضاء. ومع ذلك ، فإن التكنولوجيا الأدينوفيرالية المؤتلفة شاقة وتستغرق وقتا طويلا ومكلفة. هنا، نقدم بروتوكول محسن باستخدام نظام pAdEasy للحصول على جزيئات أدينوفيرالية نقية يمكن أن تحفز على تعبير بروتين فلوري أخضر قوي (GFP) في الخلايا المنقولة. مزايا هذه الطريقة المحسنة هي إعداد أسرع وانخفاض تكلفة الإنتاج مقارنة مع الطريقة الأصلية التي وضعها بيرت فوغلشتاين. الخطوات الرئيسية لتكنولوجيا أدينوفيرالي هي: (1) إعادة دمج pAdTrack-GFP مع pAdEasy-1 plasmid في البكتيريا BJ5183; (2) التعبئة والتغليف من الجسيمات أدينوفيرالية؛ (3) تضخيم الفيروس الغدي في خلايا AD293؛ (4) تنقية الجسيمات الأدينوفيرالية من lysate الخلية والثقافة المتوسطة؛ و (5) المعايرة الفيروسية والاختبار الوظيفي للفيروس الغدي. تتكون التحسينات على الطريقة الأصلية من (1) إعادة التركيب في BJ5183 التي تحتوي على pAdEasy-1 عن طريق التحول الكيميائي للبكتيريا؛ و (2) إعادة التركيب في BJ5183 التي تحتوي على pAdEasy-1 عن طريق التحول الكيميائي للبكتيريا؛ و (2) إعادة التركيب في BJ5183-1 بواسطة التحويل الكيميائي للبكتيريا. '2' اختيار المستنسخين المستنسخين المستنسخين ب "سالب" و"إيجابي" من حيث ال PCR؛ '3' نقل 293 AD الخلايا باستخدام نظام العدوى K2 للتغليف أدينوفيرالي؛ '4' هطول الأمطار باستخدام كبريتات الأمونيوم للجسيمات الفيروسية التي تطلقها خلايا AD293 في وسط زراعة الخلايا؛ و(5) تنقية الفيروس عن طريق التدرج المتقطع من كلوريد السيزيوم من خطوة واحدة. تم الحصول على تعبير قوي عن جين الاهتمام (في هذه الحالة ، GFP) في أنواع مختلفة من الخلايا المنقولة (مثل خلايا الكبد والخلايا البطانية) من مصادر مختلفة (الإنسان والأبقار والمورين). يمثل نقل الجينات بوساطة أدينوفيرالية واحدة من الأدوات الرئيسية لتطوير العلاجات الجينية الحديثة.
Introduction
الفيروسات الغدية هي فيروسات غير مجسمة تحتوي على نواة جينوم الحمض النووي الخطي المزدوج تقطعت بهم السبل1،2،3. يمكن أن تصيب الفيروسات الغدية مجموعة واسعة من أنواع الخلايا والعدوى لا تعتمد على انقسام الخلايا المضيفة النشطة. بعد العدوى ، يدخل الفيروس الغدي حمضه النووي الجينومي في نواة الخلية المضيفة ، حيث يبقى epichromosomal ويتم نسخه مع جينات المضيف. وهكذا، يتم تحقيق الحد الأدنى من المخاطر المحتملة لتولد الطفرات الإدراجية أو تنظيم oncogenes4،5،6. لا يتم تكرار الجينوم الأدينوفيرالي جنبا إلى جنب مع الجينوم المضيف ، وبالتالي ، يتم تخفيف الجينات الأدينوفيرالية في مجموعة خلايا منقسمة. ومن بين مزايا النقل الأدينوفيرالي، هناك: '1' مستويات عالية من التعبير المتحول؛ '2' المستويات العالية من التعبير المتحول؛ '2' المستويات العالية من التعبير المتحول؛ '2' المستويات العالية من التعبير المتحول؛ '2' المستويات العالية من التعبير المتحول؛ '2' المستويات العالية من التعبير الجيني '2' تقليل المخاطر المتصلة بدمج الحمض النووي الفيروسي في الجينوم المضيف، بسبب التعبير الظهاري؛ '3' نقل طائفة واسعة من أنواع الخلايا الفاصلة وغير المقسمة. معظم الفيروسات الغدية المستخدمة في البحوث الطبية الحيوية هي غير متماثلة، تفتقر إلى منطقة E17،8،9. لإنتاجها، مطلوب خط الخلية توريد تسلسل E1 (مثل HEK293). إلى جانب ذلك، تم حذف منطقة غير أساسية لدورة الحياة الفيروسية (E3) للسماح بإدخال متحول في الجينوم الفيروسي. تم حذف مناطق أخرى (E2 و E4) في بعض الفيروسات الغدية ، ولكن في هذه الحالات ، تم الإبلاغ عن انخفاض غلة إنتاج الغدية والتعبير المنخفض عن المتحول7.
هنا، نقدم بروتوكولا محسنا لبناء الفيروسات الغدية وتعبئتها وتنقية باستخدام نظام AdEasy. سمحت هذه التحسينات بتعبئة الفيروس الغدي بطريقة أسرع وأكثر اقتصادا بالمقارنة مع الطريقة الأصلية التي طورها بيرت فوغلشتاين2،10، بسبب المزايا التالية: (1) إعادة التركيب في BJ5183 التي تحتوي على pAdEasy-1 عن طريق التحول الكيميائي للبكتيريا ؛ (2) إعادة التركيب في BJ5183 التي تحتوي على pAdEasy-1 عن طريق التحول الكيميائي للبكتيريا ؛ '2' اختيار المستنسخين المؤتلفين بواسطة PCR؛ '3' نقل 293 AD الخلايا باستخدام نظام العدوى K2 للتغليف أدينوفيرالي؛ '4' هطول الجسيمات الأدينوفيرالية من وسط الاستزراع بعد التعبئة والتضخيم الفيروسيين؛ '5' تنقية الأدينوفيرالية باستخدام جهاز طرد فائق فائق التدرج من كلوريد السيزيوم من خطوة واحدة.
بروتوكول لإنتاج الفيروس الغدي باستخدام نظام AdEasy (الشكل 1) يتضمن الخطوات التالية:
(1) إعادة دمج pAdTrack-GFP مع pAdEasy-1 في بكتيريا BJ5183
(2) تغليف الجسيمات الأدينوفيرالية
(3) تضخيم الفيروس الغدي
(4) تنقية الجسيمات الأدنوفيرالية من lysate الخلية والثقافة المتوسطة
(5) المعايرة من الفيروس الغدي.
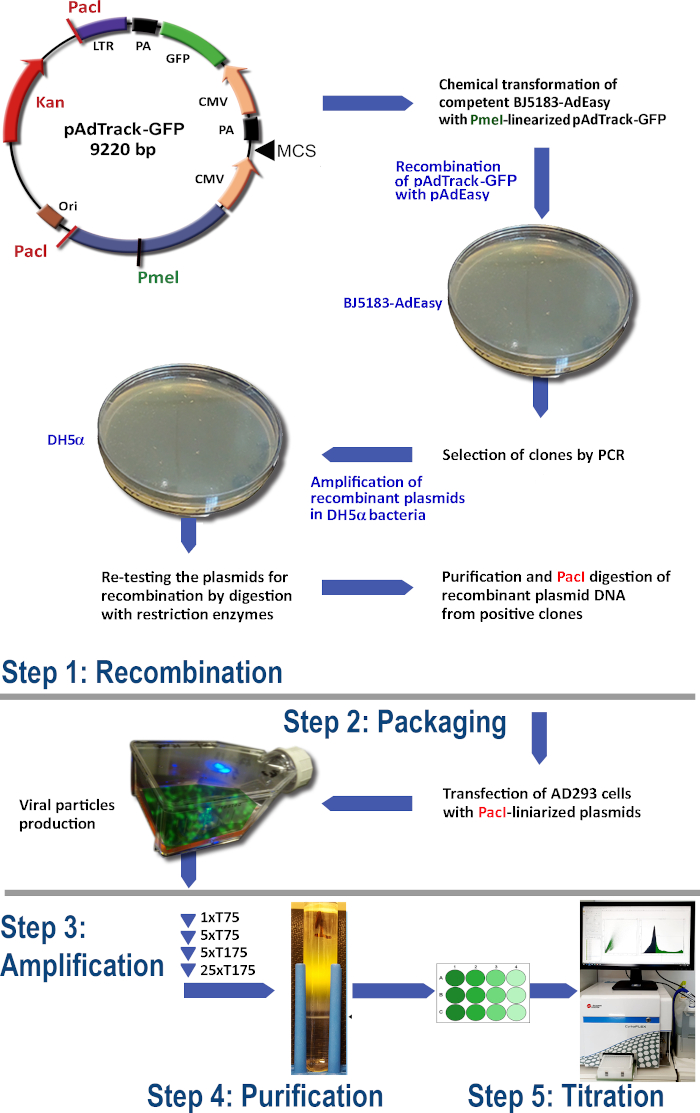
الشكل 1: تكنولوجيا إنتاج الفيروس الغدي. الخطوات الرئيسية لتكنولوجيا أدينوفيرالي هي: (1) إعادة دمج pAdTrack-GFP مع البلازميد pAdEasy-1 في بكتيريا BJ5183. يتم تضخيم البلازميدات المختارة التي أعيد تركيبها في بكتيريا DH5α ثم تنقيتها. (2) تغليف الجسيمات الأدينوفيرالية في خلايا AD293، التي تنتج بروتينات أدينو-E1؛ (3) تضخيم الفيروس الغدي في خلايا AD293؛ (4) تنقية الجسيمات الأدينوفيرالية من lysate الخلية ووسط الثقافة عن طريق الطرد المركزي الفائق على تدرج كثافة CsCl؛ (5) المعايرة من الفيروس الغدي والاختبار الوظيفي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
في هذا البروتوكول، قمنا بأمثلة على تكنولوجيا إنتاج الفيروس الغدي، والتي يمكن أن تحفز التعبير عن GFP في الخلايا المضيفة. يتم إدراج GFP بالفعل في العمود الفقري لمتجه المكوك pAdTrack-CMV (أدجين #16405) ، تحت مروج CMV الثاني ويستخدم كجين مراسل(الشكل 1). لهذا السبب، قمنا هنا بتعيين المتجه pAdTrack-CMV ك pAdTrack-GFP وقيمنا التعبير عن GFP لأغراض إثباتية. وإلى جانب التعبير عن GFP، يمكن استخدام النظام للتعبير عن جين مثير للاهتمام، والذي يمكن استنساخه في مواقع الاستنساخ المتعددة ل pAdTrack-CMV. الجين أو المستنسخة في pAdTrack-CMV عادة ما تكون أكثر كفاءة للتحريض التعبير بالمقارنة مع cDNA11. وأظهرت البيانات تعبير GFP قوية في الخلايا المنقولة (مثل خلايا الكبد والخلايا البطانية) من مصادر مختلفة (الإنسان والأبقار والمورين). يمثل نقل الجينات بوساطة أدينوفيرالية واحدة من الأدوات الرئيسية لتطوير العلاجات الجينية الحديثة.
Protocol
ملاحظة السلامة: بشكل عام ، تصنف الفيروسات الغدية ككائنات حية من المستوى 2 للسلامة البيولوجية ، وبالتالي ، يجب أن يتم جميع عمليات التلاعب في خزانة السلامة البيولوجية من الفئة الثانية من قبل شخص مدرب ، يرتدي معدات واقية من المخاطر البيولوجية (بما في ذلك القفازات ، قناع الوجه للهباء الجوي البيولوجي ، معطف المختبر ، وما إلى ذلك). يجب تطهير جميع المواد الصلبة الملوثة بفيروس الغدي بمحلول تبييض بنسبة 10٪ لمدة 30 دقيقة وتعقيمها تلقائيا لمدة 30 دقيقة عند 121 درجة مئوية وشريط واحد. اعتمادا على الجين المدرج، قد يكون للفيروس الغدي الذي تم إنشاؤه إمكانات خطيرة ويمكن تصنيفه في مستويات السلامة البيولوجية الأخرى.
1. إعداد تجريبي
- استخدام غطاء محرك السيارة ثقافة الخلية منفصلة للتلاعب أدينوفيرالية، وحاضنة منفصلة لكل نوع من أنواع الفيروس الغدي. استخدام قوارير T مع قبعات التصفية للتغليف والتضخيم الفيروسية؛ تجنب قدر الإمكان تجارب النقل في لوحات بيتري تنفيس.
- إفراغ غطاء محرك السيارة ثقافة الخلية بعد كل استخدام وتعريضه للأشعة فوق البنفسجية لمدة 15 دقيقة.
- أوتوكلاف دوريا المساعدات ماصة، ماصة، وغيرها من الأواني. إذا كان ذلك ممكنا، والثقافة في مختبر ثقافة الخلية منفصلة / غطاء محرك السيارة خلايا التعبئة والتغليف أدينوفيرالي (خلايا AD293) والخلايا لاستخدامها في تجارب النقل. وينبغي فحص دفعات من الفيروسات الغدية المختلفة التي تضخمت في نفس الفترة للتأكد من التلوث المتبادل بواسطة PCR.
- قم بإعداد الحلول التالية.
- إعداد SOB (سوبر الأمثل مرق) المتوسطة: 20 غرام من تريبتون، 5 غرام من استخراج الخميرة، 0.5 غرام من NaCl (10 mM التركيز النهائي)، 2.5 مل من 1 M KCl (2.5 mM التركيز النهائي)، amd H2O إلى 1 L. بعد الالاستعباد التلقائي عند 121 درجة مئوية، أضف الحلول العقيمة التالية: 5 مل من 1 م ملغكل2 و5 مل من 1 م مغسو4.
- إعداد SOC (سوبر مرق الأمثل مع قمع تقويض) المتوسطة: في 1 L SOB العقيمة إضافة الحلول العقيمة التالية: 20 مل من الجلوكوز 1 M, 5 مل من 1 م MgCl2, و 5 مل من 1 م MgSO4.
- إعداد محلول هطول الأمطار: حل 29.5 غرام من خلات البوتاسيوم في 60 مل من H2O، إضافة 11.5 مل من حمض الخليك، وH2O إلى 100 مل.
- إعداد احتياطي إعادة الإنفاق: 95 مل من الجلوكوز بنسبة 20٪، و 5 مل من 1 M Tris-Cl pH 8، و 4 مل من 0.5 M EDTA pH 8، وإضافة H2O إلى 200 مل.
- إعداد حل التحلل: 4.8 مل من 8.3 M NaOH، و10 مل من 20٪ SDS، وH2O إلى 200 مل.
2. إعادة تركيب pAdTrack-GFP ناقلات الفيروسية مع pAdEasy-1 البلازميد في البكتيريا BJ5183
- الخطية من pAdTrack - GFP وتنقية البلازميد الخطي.
- إعداد مزيج الهضم التالي على الجليد:
10 ميكروغرام من pAdTrack-GFP
5 ميكرولتر من 10x العازلة عديم اللون
2 ميكرولتر من Pme I
H2O إلى حجم نهائي قدره 50 ميكرولتر. - حضانة في 37 درجة مئوية لمدة 3 ساعات في حمام مائي.
- تعطيل عند 65 درجة مئوية لمدة 20 دقيقة.
- تحقق من كفاءة عملية الهضم من pAdTrack-GFP مع Pme I: تشغيل 1 ميكروغرام من البلازميد المهضوم بالتوازي مع 1 ميكروغرام من البلازميد غير المهضوم على هلام الآجروز بنسبة 0.8٪.
- إعداد مزيج الهضم التالي على الجليد:
- عزل وتنقية الحمض النووي
ملاحظة: يجب تنفيذ الخطوات 1-6 في غطاء محرك السيارة fume.- إضافة كمية متساوية من الكحول الفينول / الكلوروفورم / ايزاميل (25:24:1) على خليط الهضم وعكس الأنبوب حتى الخليط متجانسة.
- جهاز الطرد المركزي لمدة 3 دقائق في 16200 × ز، ومن ثم نقل المرحلة المائية العليا إلى أنبوب جمع.
- إضافة كمية متساوية من الكحول الفينول / الكلوروفورم / ايزاميل (25:24:1) على المرحلة العضوية السفلى ودوامة.
- جهاز الطرد المركزي لمدة 3 دقائق في 16200 x g، ثم نقل المرحلة العليا إلى نفس أنبوب التجميع.
- إضافة حجم متساو من الكلوروفورم على مدى المرحلة المائية حصادها في أنبوب جمع ودوامة.
- جهاز الطرد المركزي لمدة 3 دقائق في 16200 × ز، ومن ثم نقل المرحلة المائية العليا إلى أنبوب جمع جديد.
- إضافة حجم 1/10 من خلات الصوديوم 3 M، و 2 مجلدات من الإيثانول البارد 100٪ ودوامة.
- حضانة لمدة ساعة واحدة في -70 درجة مئوية أو بين عشية وضحاها في -20 درجة مئوية.
- إذابة العينة على الجليد والطرد المركزي لمدة 10 دقائق في 16200 × ز و 4 درجة مئوية.
- إزالة supernatant وإضافة 750 ميكرولتر من الإيثانول 75٪.
- الطرد المركزي لمدة 3 دقائق في 16200 س ز و 4 درجة مئوية وإزالة supernatant.
- تدور لفترة وجيزة أنبوب لإزالة جميع supernatant وتجفيف بيليه في غطاء محرك السيارة. لا تجف بيليه الحمض النووي لفترة طويلة لأنه من الصعب أن تذوب.
- حل بيليه في 15 ميكرولتر من H2O.
- قياس تركيز الحمض النووي باستخدام مطياف (على سبيل المثال، Nanodrop).
- تحويل بكتيريا AdEasier-1 مع pAdTrack-GFP
ملاحظة: في هذه الخطوة، يتم إعادة دمج pAdTrack-GFP مع pAdEasy-1 plasmid.- إعداد AdEasier-1 (BJ5183 التي تحتوي على pAdEasy-1، أدجين #16399) البكتيريا الكيميائية المختصة، وذلك باستخدام مجموعة التحول التجاري، وفقا لتعليمات الشركات المصنعة. الحفاظ على aliquots من البكتيريا المختصة 100 ميكرولتر في -80 درجة مئوية.
- تذوب aliquot من البكتيريا AdEasier-1 المختصة على الجليد وإضافة 1 ميكروغرام من تنقية Pme I -هضم pAdTrack-GFP. مزيج بلطف عن طريق النقر على الأنبوب (لا ماصة الخليط). احتضان لمدة 10 دقائق على الجليد.
- إضافة 900 ميكرولتر من SOC المتوسطة واحتضان لمدة 1 ساعة في 37 درجة مئوية مع اهتزاز.
- ميكروفوج لمدة 5 دقائق في 600 × ز.
- إزالة 900 ميكرولتر من supernatant، مزيج بيليه وsupernatant، والبذور البكتيريا المحولة على لوحات LB-أجار مع kanamycin.
- حضانة لمدة 16 ساعة تقريبا عند 37 درجة مئوية (لا تتجاوز 18 ساعة).
- اختيار استنساخ إيجابية ممكنة من قبل PCR
- تقسيم المسواك إلى نصفين وتعقيم نصف المسواك عن طريق الالاستعباد التلقائي.
- التقاط المستعمرات الصغيرة وشفافة باستخدام معقمة نصف المسواك.
- لفترة وجيزة، تدوير نصف مسواك مع البكتيريا في الماء 10 ميكرولتر (في أنبوب PCR) ومن ثم وضع نصف مسواك في أنبوب إيبيندورف 1.5 مل تحتوي على 100 ميكرولتر SOC المتوسطة مع kanamycin. حضانة لمدة 4-6 ساعات في 37 درجة مئوية، في حين يمكنك اختبار استنساخ بواسطة "سلبية" و "إيجابية" PCR.
- احتضان أنابيب PCR التي تحتوي على 10 ميكرولتر من الماء مع البكتيريا لمدة 5 دقائق عند 95 درجة مئوية للحصول على العينة البكتيرية وتشغيل بالتوازي مع PCR "السلبية" و "الإيجابية".
- "السلبية" PCR - لاختبار سلامة pAdTrack-GFP: إعداد مزيج PCR التالية لPCR السلبية على الجليد.
5 ميكرولتر من العينة البكتيرية
0.1 ميكرولتر من التمهيدي إلى الأمام (4631 F: 5'-CAGTAGTCGGTGCTCGTCCAG)
0.1 ميكرولتر من التمهيدي عكس (5616 R: 5'-TATGGGGGCTGTAATGTTGTCTC)
0.1 ميكرولتر من dNTP 10 mM
3 ميكرولتر من المخزن المؤقت 5x
1.5 ميكرولتر من ملغكل2 25mM
0.1 ميكرولتر من غوتاك بوليمراز
H2O إلى حجم نهائي من 15 ميكرولتر
ملاحظة: يجب تضمين عنصر التحكم الإيجابي الذي يكون فيه قالب DNA هو متجه pAdTrack-GFP. - "إيجابية" PCR - لاختبار وجود جين الفائدة. استخدم التمهيديات المحددة للجين المدرج واستعد المزيج كما في الخطوة السابقة. وكانت التهيئة المستخدمة في GFP هي التالية:
واو: 5'-كاجاكاغاكجاكتاكتاكاكا
R: 5'-أجغغجتجكتكتكتغستا - تشغيل بالتوازي مع "السلبية" و "إيجابية" PCR. برنامج PCR هو: 5 دقائق، 95 درجة مئوية؛ 40 دورة من الخطوات التالية: 30 ثانية، 95 درجة مئوية؛ 30 ثانية، 68 درجة مئوية؛ دقيقة واحدة، 72 درجة مئوية؛ الاستطالة النهائية: 10 دقيقة، 72 درجة مئوية.
ملاحظة: تكييف درجة حرارة التلين لتضخيم جين الفائدة. - تقييم منتجات PCR على هلام agarose 1٪ وجعل اختيار المستنسخين.
- النظر في مزيد من تجهيز المستنسخين التي تعطي أي منتجات PCR ل "PCR السلبية" والمنتج PCR محددة بعد "PCR إيجابية".
- زراعة الثقافات البكتيرية لاستنساخات مختارة مؤتلفة
- تمييع ثقافات المستنسخين الإيجابيين المفترضين (أدى ذلك إلى الخطوة 2.4.3.) في 4 مل من وسط SOC مع الكاناميسين ، واحتضانهم بين عشية وضحاها عند 37 درجة مئوية مع الاهتزاز.
- عزل الحمض النووي البلازميد من البكتيريا AdEasier-1 (Miniprep باستخدام تحلل قلوية)
- نقل 1.5 مل من الثقافة البكتيرية في أنابيب الطرد المركزي الدقيق، والطرد المركزي لمدة دقيقة واحدة في 16200 × ز،وإزالة supernatant.
- نقل آخر 1.5 مل الثقافة البكتيرية في نفس الأنبوب، وتكرار الطرد المركزي، وإزالة supernatant.
- إضافة 200 ميكرولتر من العازلة إعادة الإنفاق (50 mM الجلوكوز, 10 mM EDTA, 25 mM تريس-HCl درجة الحموضة 8).
- إضافة 200 ميكرولتر من محلول التحلل (0.2 N NaOH, 1٪ SDS), مزيج بلطف عن طريق عكس الأنبوب.
- إضافة 200 ميكرولتر من محلول هطول الأمطار (60 مل من خلات البوتاسيوم 5 M، 11.5 مل من حمض الخليك الجليدي، إضافة H2O حتى 100 مل)، وتخلط بلطف عن طريق عكس الأنبوب.
- جهاز طرد مركزي لمدة 3 دقائق عند 16,200 x g.
- نقل supernatant في أنبوب جديد microcentrifuge، إضافة 500 ميكرولتر isopropanol، مزيج واحتضان لمدة 20 دقيقة على الجليد.
- جهاز طرد مركزي لمدة 15 دقيقة عند 16200 x g وإضافة 500 ميكرولتر من الإيثانول بنسبة 75٪.
- الطرد المركزي لمدة 10 دقائق في 16200 x ز وإزالة supernatant.
- الطرد المركزي لمدة 3 دقائق في 16200 x g، قم بإزالة الناسخة الخارقة وأضف 15 ميكرولتر من H2O.
- تضخيم وعزل وإعادة اختبار البلازميدات الملتصقة
- تحويل بكتيريا DH5α مع الحمض النووي المعزول عن خلايا AdEasier-1.
- إعداد البكتيريا المختصة DH5α باستخدام عدة التحول التجاري، وفقا لتعليمات الشركات المصنعة.
- إذابة 100 ميكرولتر من البكتيريا المختصة DH5α على الجليد، إضافة الحمض النووي المؤتلف، واحتضان 10 دقيقة على الجليد. ثم بذور البكتيريا على لوحات LB-أجار مع كاناميسين.
- حضانة عند 37 درجة مئوية بين عشية وضحاها.
- التقاط عدة مستعمرات وتنمو كل في 2 مل من LB المتوسطة مع kanamycin، في 37 درجة مئوية، بين عشية وضحاها، مع اهتزاز.
- عزل الحمض النووي (Miniprep باستخدام تحلل قلوية) وإعادة إنفاق الحمض النووي التي تم الحصول عليها في 25 ميكرولتر H2O.
- تأكيد الحيوانات المستنسخة إيجابية عن طريق الهضم الأنزيمي.
- إعداد المزيج التالي على الجليد:
5 ميكرولتر من الحمض النووي المؤتلف
1.5 ميكرولتر من 10x المخزن المؤقت عديم اللون
0.5 ميكرولتر من هند الثالث أو Pst I
H2O إلى حجم نهائي من 15 ميكرولتر - حضانة عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: كعنصر تحكم، هضم أيضا pAdTrack-GFP وpAdEasy-1 البلازميدات. - في كل عينة إضافة 3 ميكرولتر من المخزن المؤقت تحميل Sx6 مع RNase A (إذا لم يكن موجودا RNase A في المخازن المؤقتة miniprep).
- تشغيل شظايا الحمض النووي هضمها على 1٪ agarose هلام الكهربائي.
ملاحظة: يتضمن نمط الهضم لاستنساخ إيجابي غالبية أجزاء من البلازميد pAdEasy المهضوم ، مما يكشف عن إعادة دمج pAdEasy مع ناقل pAdTrack. وينبغي أن يثبت الجين الذي يهمه الهضم بالإنزيمات القيدية المستخدمة في الاستنساخ.
- إعداد المزيج التالي على الجليد:
- إعداد الحمض النووي البلازميد (درجة العدوى) لتغليف الفيروس الغدي.
- تنمو ثقافة 200 مل من البكتيريا من استنساخ إيجابي لعزل الحمض النووي البلازميد.
- عزل الحمض النووي البلازميد باستخدام عدة تجارية لPlasmid DNA Midiprep (على سبيل المثال، Qiagen Plasmid ميدي كيت) وفقا لتعليمات الشركة المصنعة.
- تحويل بكتيريا DH5α مع الحمض النووي المعزول عن خلايا AdEasier-1.
3. التعبئة والتغليف الجسيمات أدينوفيرالي
- اليوم الأول. زرع خلايا AD293
- غسل الخلايا AD293 مع برنامج تلفزيوني واحتضانها مع 0.125٪ تريبسين لمدة 2-5 دقيقة في 37 درجة مئوية.
- جمع الخلايا في وسط بارد مع المصل.
- جهاز طرد مركزي لمدة 5 دقائق عند 400 × ز عند 4 درجات مئوية.
- Resuspend الخلايا في المتوسط مع المصل والبذور الخلايا في كثافة ~ 2 × 106/ T25 قارورة. ويفضل استخدام قارورة مع مرشح.
- اليوم الأول. هضم الحمض النووي المؤتلف مع Pac I
- إعداد المزيج التالي:
6 ميكرولتر من الحمض النووي المؤتلف (1 ميكروغرام/ميكرولتر)
2 ميكرولتر من باك I
2.5 ميكرولتر من 10x المخزن المؤقت عديم اللون
H2O إلى حجم نهائي قدره 25 ميكرولتر - حضانة لمدة 3 ساعة (أو بين عشية وضحاها) في 37 درجة مئوية، ومن ثم تعطيل الانزيم في 65 درجة مئوية لمدة 20 دقيقة.
- الحمض النووي هطول الأمطار مع الإيثانول: إضافة 2.5 ميكرولتر من (1/10 v/v) 3 M خلات الصوديوم و 2-3 أحجام الإيثانول 100٪. حضانة لمدة 30 دقيقة في -70 درجة مئوية أو بين عشية وضحاها في -20 درجة مئوية.
- جهاز الطرد المركزي في 16,200 x g لمدة 30 دقيقة عند 4 °C وإعادة إنفاق بيليه في الماء العقيم.
- إعداد المزيج التالي:
- اليوم الثاني: نقل خلايا AD293 باستخدام كاشف K2
- إضافة 40 ميكرولتر من مضاعف K2 على الخلايا، قبل ساعتين من العدوى.
- إعداد حلول A و B:
الحل A: إضافة 6 ميكروغرام من باك L-خطي الحمض النووي في 260 ميكرولتر من Opti-MEM.
الحل ب: أضف 21.6 ميكرولتر من كاشف K2 في 248.4 ميكرولتر من Opti-MEM. - إضافة الحل A على الحل B وتخلط بلطف عن طريق pipetting.
- احتضان الخليط لمدة 20 دقيقة في درجة حرارة الغرفة. إضافة مزيج إسقاط A و B إلى الخلايا.
- اليوم 3-11: مراقبة التعبير GFP عن طريق المجهر الفلوري
ملاحظة: يجب أن تظهر الخلايا الخضراء في المجهر الفلوري ويجب فصل تدريجيا. - اليوم الحادي عشر: حصاد جزيئات F1 الأدينوفيرالية
- جمع الخلايا المنفصلة والمتوسطة في أنبوب 50 مل، كشط الخلايا الملتصقة، وإضافتها في نفس الأنبوب.
- الطرد المركزي لمدة 5 دقائق في 400 × ز، وجمع supernatant في أنبوب جديد وإعادة إنفاق بيليه الخلية في 0.5 مل من برنامج تلفزيوني.
- تعطيل الخلايا
- نقل تعليق الخلية في أنبوب الطرد المركزي الدقيق.
- إجراء ثلاث دورات تجميد/ ذوبان (تجميد النيتروجين السائل أو عند -80 درجة مئوية / ذوبان الجليد عند 37 درجة مئوية لمدة أقصاها 7 دقائق).
- تمرير الخلايا المكسورة من خلال إبرة حقنة 23 G ثلاث مرات.
- إزالة حطام الخلية عن طريق الطرد المركزي في 9600 × غرام لمدة 12 دقيقة.
- نقل supernatant إلى أنبوب 50 مل مع المتوسطة التي تم جمعها.
4. تضخيم الفيروس الغدي
ملاحظة: إذا لم تصل خلايا AD293 إلى التقاء الضرورية، قد يتم تخزين المغذيات من المخزونات أدينوفيرالي (lysate التي تم الحصول عليها من الخلايا المنتجة للفيروس) لاستخدامها للعدوى في -80 درجة مئوية.
- إعداد الجسيمات الغدية F2.
- زرع خلايا AD293 في قارورة T75 (5 × 106 خلايا / قارورة).
- تصيب ~ 90 ٪ التقاء AD293 الخلايا باستخدام الجسيمات الغدية F1 : إضافة تجانس الخلية والمتوسطة من قارورة T25 على الخلايا التي تزرع في قارورة T75.
- مراقبة التعبير GFP بواسطة المجهر الفلوري.
- حصاد الخلايا المنتجة للفيروس عندما يتم فصل ~ 90 ٪ من AD293 المنقولة (~ في اليوم5 بعد النقل). حافظ على متوسط ثقافة الخلية عند 4 درجات مئوية.
- تعطيل الخلايا (وبالمثل مع تلك لF1) في برنامج تلفزيوني 1 مل.
- إعداد الجسيمات الغدية F3.
- تصيب ~ 90 ٪ التقاء AD293 الخلايا المصنفة في قارورة T175 مع الجسيمات F2 أدينوفيرالية وخلية ثقافة المتوسطة من الجسيمات أدينوفيرالي F2.
- حصاد الخلايا (~ 5 أيام بعد النقل).
- تعطيل الخلايا (وبالمثل مع تلك لF1) في 2 مل من برنامج تلفزيوني.
- إعداد الجسيمات الغدية F4.
- تصيب 5 قوارير T175 تحتوي على ~ 90٪ التقاء AD293 الخلايا مع الجسيمات الغدية F3 وخلية ثقافة المتوسطة.
- حصاد الخلايا (~ 5 أيام بعد النقل).
- تعطيل الخلايا (وبالمثل مع تلك لF1) في 3 مل من برنامج تلفزيوني.
- إعداد الجسيمات الغدية F5.
- تصيب 25 T175 قوارير تحتوي على ~ 90٪ التقاء AD293 الخلايا مع المخزون F4 أدينوفيرالية وخلية ثقافة المتوسطة.
5. تنقية الفيروس الغدي من lysate الخلية والثقافة المتوسطة
- حصاد الخلايا المنتجة للفيروسات ووسط الثقافة.
- حصاد الخلايا AD293 من F5 بعد 5 أيام من النقل.
- حفظ المتوسطة في زجاجة معقمة لهطول الأمطار من الجسيمات أدينوفيرالي.
ملاحظة: احتفظ بالوسط في الثلاجة حتى تنقية الفيروس الغدي. - الطرد المركزي الخلايا في 400 × ز، لمدة 5 دقائق، في 4 سC.
- Resuspend بيليه النهائي في 5 مل من 10 mM تريس HCl، pH 8 مع 2 م م MgCl2.
- Aliquot تعليق في أنابيب 1.5 مل.
- تعطيل الخلايا (وبالمثل مع تلك لF1): ثلاث دورات من تجميد / ذوبان الجليد.
ملاحظة: إذا تعذر إجراء الطرد المركزي الفائق فورا، احتفظ بالعينات عند -80 درجة مئوية. - تمرير تعليق الخلية من خلال إبرة حقنة 23G لمدة ثلاث مرات.
- الطرد المركزي المتجانس في 9 600 × ز، لمدة 12 دقيقة.
- حفظ supernatant لتنقية الفيروس الغدي بواسطة CsCl التدرج الطرد الفائق.
- هطول الأمطار من الفيروس الغدي صدر في وسط الثقافة.
- جلب زجاجة مع حفظ خلية الثقافة المتوسطة في درجة حرارة الغرفة.
- إضافة 121 غرام كبريتات الأمونيوم إلى كل 500 مل من الخلايا المتوسطة الثقافة (يجب أن يكون تشبع الحل بين 40-42٪).
- تخلط بعناية حتى يذوب كبريتات الأمونيوم تماما.
- حضانة لمدة لا تقل عن 2.5 ساعة في درجة حرارة الغرفة.
- الطرد المركزي في 1600 x ز، لمدة 15 دقيقة، في 22 سC وحفظ بيليه.
- Resuspend بيليه في 4 مل من 10mM تريس HCl pH 8 مع 2mM MgCl2; وينبغي تنقية هذا التعليق فورا بواسطة الطرد الفائق الانحدار CsCl.
ملاحظة: إذا كان لا يمكن تنفيذ خطوة تنقية في وقت لاحق، dialyze بين عشية وضحاها بيليه resuspended ضد 10mM تريس HCl، الرقم القياسي 8 مع 2mM MgCl2.
- تنقية الفيروس الغدي عن طريق الطرد المركزي الفائق.
- إعداد الانحدار CSCl متقطعة في أنابيب البولي بروبلين لSW41Ti الدوار. أضف 3 مل من 765 ملغم/مل CsCl (كثافة عالية: 1.4 جم/لتر) في الجزء السفلي من الأنبوب. أضف ببطء 3 مل من 288.5 ملغم/مل CsCl (منخفض الكثافة: 1.2 جم/لتر) أعلى الطبقة CsCl الأولى.
- تراكب بلطف 3 -4 مل من تعليق الجسيمات أدينوفيرالية صدر من الخلايا أو عجلت من وسط ثقافة الخلية (كما هو موضح من قبل) على رأس التدرج.
- ملء الأنابيب مع النفط المعدني، ووضع الأنابيب في دلاء SW41Ti الباردة.
- توازن الأنابيب. تأكد من تحميل أنابيب البولي بروبلين المملوءة بشكل متناظر في الدوار. ضع الدوار في جهاز الطرد المركزي الفائق.
- جهاز الطرد المركزي في 210،000 س ز و 4 درجة مئوية، لمدة 18 ساعة، لا الفرامل.
- ضع أنابيب الطرد المركزي الفائق على حامل مع ورقة سوداء خلفها للحصول على الأشرطة.
- تجاهل المرحلة العليا واضحة، والحطام الخلية، والفرقة العليا في حاوية النفايات مع محلول التبييض.
- حصاد أدنى نطاق يحتوي على الفيروس الغدي الكامل (~ 700 ميكرولتر - 1 مل) في أنبوب معقم 1.5 مل وإبقائه على الجليد.
- قبل الرطب كاسيت غسيل الكلى في عازلة غسيل الكلى (10 mM تريس-Cl العازلة pH 8, 2 م م MgCl2).
- حقن الفيروس الغدي المنقى في كاسيت غسيل الكلى باستخدام حقنة 2 مل.
- Dialyze بين عشية وضحاها ضد 10 mM تريس-Cl العازلة الرقم الحموضة 8، 2 م م MgCl2 (تغيير المخزن المؤقت غسيل الكلى 3 -4 مرات).
- حصاد مخزون أدينوفيرالي من كاسيت غسيل الكلى في aliquots من 10 - 100 ميكرولتر.
- إضافة السكروز إلى تركيز 4٪ النهائي إلى aliquots الفيروسية (ل cryoprotection).
- يخزن اليكوتس عند -80 درجة مئوية
6. المعايرة من الفيروس الغدي
- اليوم الأول: طلاء الخلايا
- بذور الخلايا AD293 في كثافة 2.5 × 105 خلايا لكل بئر (في لوحة ثقافة 12 جيدا) في 1 مل متوسط النمو الكامل، كما هو مبين في الشكل 2. تأكد من أن الخلايا تنتشر بالتساوي في كل بئر لتحديد تتر دقيقة.
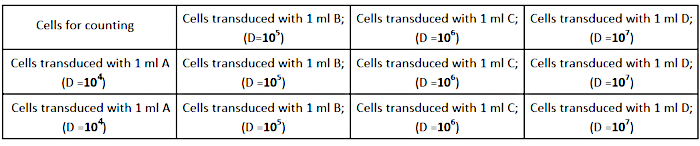
الشكل 2: تصميم لوحة المعايرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- اليوم الثاني: نقل الخلايا
- فصل الخلايا من بئر واحد مع تريبسين والعد لهم. لاحظ هذا الرقم لأنه سيتم استخدامه لحساب التيتر الفيروسي.
- تنفيذ التخفيفات التسلسلية (1/104; 1/105; 1/106; 1/107) من المخزون الفيروسي في 1 مل من متوسط النمو الكامل على النحو التالي:
- 1/103: تخفيف مخزون الفيروس - إضافة 2 ميكرولتر من المخزون الفيروسي إلى 1998 ميكرولتر من المتوسط الكامل.
- 1/104: جعل 1:10 تخفيف 1/103 عن طريق تمييع 120 ميكرولتر إلى 1080 ميكرولتر من المتوسطة كاملة (A).
- 1/105: جعل 1:10 التخفيف من B عن طريق تمييع 120 ميكرولتر من A إلى 1080 ميكرولتر من المتوسط الكامل (B).
- 1/106: جعل 1:10 التخفيف من C عن طريق تخفيف 120 ميكرولتر من B إلى 1080 ميكرولتر من المتوسط الكامل (C).
- 1/107: جعل 1:10 التخفيف من D عن طريق تخفيف 120 ميكرولتر من C إلى 1080 ميكرولتر من المتوسط الكامل (D).
ملاحظة: إعداد 3 أنابيب من كل تخفيف (A، B، C، D) لإجراء التجربة في ثلاث نسخ. - إزالة الخلايا ثقافة المتوسطة من الآبار وإضافة المخففات المعدة للفيروس، كما هو مبين في الشكل 2.
- اليوم الثالث: مراقبة تعبير GFP
- تحقق من الآبار لوجود خلايا خضراء باستخدام مجهر مضان.
- اليوم الرابع: تحليل قياس التدفق الخلوي للخلايا الإيجابية ل GFP
- إعداد وتسمية اثني عشر أنابيب 1.5 مل.
- جمع الخلايا ثقافة المتوسطة (جنبا إلى جنب مع الخلايا المنفصلة) في أنابيب 1.5 مل والاحتفاظ بها على الجليد.
- إضافة 200 ميكرولتر من التريبسين في كل بئر.
- احتضان لوحة لمدة 2 - 3 دقائق في 37 درجة مئوية في حاضنة CO2.
- حصاد الخلايا في أنابيب Eppendorf نفسه مع الخلايا ثقافة المتوسطة. أبقي الأنابيب على الثلج
- بيليه الخلايا في 400 × ز، لمدة 5 دقائق، في 4 درجة مئوية.
- إزالة supernatant; إبقاء الأنابيب على الجليد.
- Resuspend بيليه في 250 ميكرولتر من برنامج تلفزيوني + 2٪ FBS؛ إبقاء الأنابيب على الجليد.
- نقل تعليق الخلية في أنابيب قياس التدفق الخلوي أو لوحة.
- تشغيل العينات على مقياس تدفق الخلايا تسجيل مضان الخلايا التعبير عن GFP.
حساب Titer: يجب أن تؤخذ العينات ذات الخلايا الإيجابية GFP 5-20٪ من السكان الأم في الاعتبار لحساب التيتر الفيروسي باستخدام الصيغة التالية:
تيتر (TU/mL) = D x F/100 x C/V
D = عامل التخفيف
F = النسبة المئوية للخلايا الموجبة / 100
C = عدد الخلايا / جيدا
V = حجم inoculum الفيروسية
7. نقل أدينوفيرالي للخلايا المستهدفة واختبار التعبير البروتيني المستحث
- اليوم الأول: بذر الخلايا
- زرع الخلايا المستهدفة لضمان انتشارها بالتساوي في الآبار.
- اليوم الثاني: نقل الخلايا
- فصل الخلايا المستهدفة من بئر واحد والعد لهم.
- حساب الحجم المناسب للتعليق أدينوفيرالية المطلوبة لتدوين الخلايا مع العدد المطلوب من الجسيمات المعدية لكل خلية.
- إضافة كمية المقابلة من تعليق الفيروسية إلى الخلايا المستهدفة.
- اليوم الثالث: إزالة التعليق الفيروسي والتحقق من التعبير عن GFP
- استبدال وسيطة زراعة الخلية التي تحتوي على جزيئات أدينوفيرالية مع متوسطة جديدة.
- تحقق من التعبير GFP في المجهر الفلوري.
النتائج
قمنا بتعديل وتحسين بروتوكول Vogelstein الأصلي من أجل تحقيق إنتاج الفيروس الغدي بشكل أسرع وأكثر كفاءة. أولا، قمنا بمراجعة المنهجية لتحقيق اختيار أسهل للمتألفين. بعد إعادة التركيب، تم اختبار الحيوانات المستنسخة البكتيرية BJ5183 من قبل "PCR السلبية" لتقييم سلامة pAdTrack-GFP كمؤشر على عدم إعادة التركيب(الشكل 3A)،أو عن طريق "PCR إيجابية" لتحديد جين الفائدة، واستيعابها في حالتنا إلى GFP (الشكل 3B). في كل من "سلبية" و "إيجابية" PCRs، استخدمنا pAdTrack-GFP كقالب التحكم، الذي أعطى الفرقة من 986 bp لسلامة pAdTrack (الشكل 3A، حارة 1)، وعصابة من 264 نقطة أساس لGFP (الشكل 3B، حارة 3). تم تصميم البادئات المستخدمة في "PCR السلبية" لتضخيم جزء من 986 bp يحتوي على موقع PmeI في pAdTrack-GFP. يتم توسيع جزء الحمض النووي هذا بشكل كبير بعد إعادة التركيب ولا يتم تضخيمه في المستنسخين المؤتلفين الإيجابيين. يتم تمثيل المستنسخات السالبة لإعادة التركيب ، والتي ظلت فيها pAdTrack-GFP سليمة ، في الشكل 3Aوالممرات 3 و 4 و 6. التمهيديات على تسلسل الحمض النووي المجاور لموقع إعادة التركيب. وأعربت المستنسخات المؤتلفة الإيجابية المحتملة(الشكل 3 ألف،الممرات 2 و 5) عن GFP كما هو مبين في الشكل 3B، حارة 1 ، و 2. تم عزل الحمض النووي البلازميد من هذه المستنسخات واستخدامها لتحويل DH5α للحصول على كمية أعلى من الحمض النووي. ثم تم اختبار هذه البلازميدات المؤتلفة المحددة مسبقا التي تم تضخيمها في DH5α عن طريق الهضم الأنزيمي. في الشكل 3C-E ويتضح نتائج الهضم الأنزيمي لاستنساخ واحد المؤتلف إيجابية هضمها مع هند الثالث، PstI، BamHI تقييد الإنزيمات (الشكل 3C، D، E حارة 2). كانت أنماط الهضم HindIII و PstI للاستنساخ المؤتلف مماثلة لتلك التي تم الحصول عليها لpAdEasy-1 منذ HindIII و PstI قطع pAdEasy-1 plasmid 24 و 25 مرة ، على التوالي ، (الشكل 3C و D، حارة 3)؛ قطع HindIII مرة واحدة وقطع PstI أربعة أضعاف ناقلات pAdTrack-GFP (الشكل 3C و D، حارة 1). BamHI قطع مرتين pAdEasy-1 ناقلات (الشكل 3C, حارة 3), ومرة واحدة pAdTrack-GFP (الشكل 3C, حارة 1).
قطع PacI جزء من 4.5 كيلوبايت من البلازميد المؤتلف(الشكل 3F، حارة 2) ، جزء من 2863 bp من pAdTrack-GFP (الشكل 3F، حارة 1) ، وخطيا متجه pAdEasy-1 (الشكل 3F، حارة 3). يتم تمثيل سلم الحمض النووي في الشكل 3C-F، في الممرات 4. تم هضم البلازميد المؤتلف مع Pac I لمزيد من الاستخدام ل AD293 transfection.
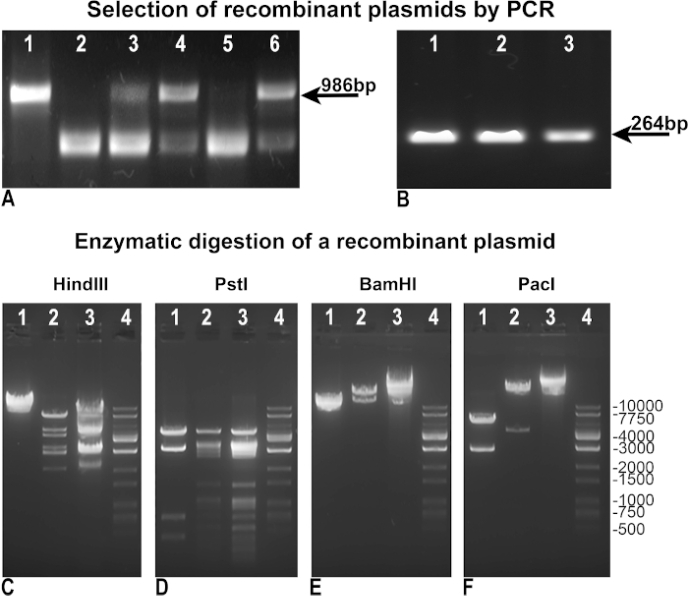
الشكل 3: إعادة تركيب pAdTrack-GFP مع pAdEasy-1 البلازميد. تم اختبار البلازميدات التي تم الحصول عليها بعد إعادة دمج pAdTrack-GFP و pAdEasy-1 بواسطة PCR "سلبي" لسلامة pAdTrack-GFP (A). وقد تجلت المستنسخات غير المؤتلفة من خلال وجود نطاق 986 نقطة أساس مطابق للتسلسل الذي تم تضخيمه من pAdTrack-GFP plasmid (A والممرات 3 و 4 و 6). كما تم الحصول على المستنسخات التي يحتمل أن تكون إيجابية لإعادة التركيب (A، الممران 2 و5). عندما تم استخدام المتجه pAdTrack-GFP كقالب، تم الحصول على نطاق من 986 bp ل pAdTrack-GFP (A، lane 1). وقد تم اختبار المستنسخين المؤتلفين الذين يحتمل أن يكونوا إيجابيين للتعبير عن GFP عن طريق PCR "الإيجابي" (B)؛ يظهر نطاق من 264 نقطة أساس لكل من المستنسخين الذين يحتمل إعادة دمجهم (B، حارة 1 و 2)، وكذلك لpAdTrack-GFP plasmid. تم اختبار الحمض النووي من استنساخ واحد المؤتلف المحتملة مع HindIII، PstI، BamHI، وانزيم تقييد PacI (C-F، الممرات 2). في عناصر التحكم، تم هضم ناقل pAdEasy-1 (C-F، الممرات 3) وبلازميد pAdTrack-GFP (C-F، الممرات 1) بنفس الإنزيمات. يتم تمثيل سلم الحمض النووي في C-F حارة 4. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم إجراء التعبئة والتغليف الأدينوفيرالي والتضخيم في خلايا AD293. تم تنقية الجسيمات الأدينوفيرالية (AdV-GFP) من lysate الخلية AD293 وكذلك من وسيط زراعة الخلية ، حيث تم إطلاقها من قبل الخلايا المصابة. لتركيز الفيروس الغدي الموجود في وسط زراعة الخلية ، تم تسريع الجسيمات مع كبريتات الأمونيوم ثم أعيد إنفاقها في 10 mM Tris HCl pH 8 مع 2 mM MgCl2، وهو نفس العازلة المستخدمة لتحلل الخلية. في وقت لاحق، تم تنقية الجسيمات الأدينوفيرالية من lysate الخلية ومن وسيط الثقافة من قبل CsCl التدرج الانقطاع الطرد الفائق. بعد الطرد الفائق، تم الحصول على نطاق قوي من AdV-GFP المنقى، كما هو موضح في الشكل 4.

الشكل 4: تنقية أدينوفيرالية بواسطة الطرد المركزي الفائق على تدرج CSCl متقطع. وقد تعرضت تجانس الخلية وفيروس الغدة الراسب من الوسط لطارد فائق التركيز على تدرج متقطع تشكله حلول CSCl منخفضة وعالية الكثافة. وجرى إثبات وجود نطاقات قوية من الفيروس الغدي GFP- في كلتا الحالتين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتحديد التيتر الفيروسي المعبر عنه في وحدات التحويل لكل مل واحد (TU/mL)، أصيبت خلايا AD293 بتمييع متسلسل ل AdV-GFP. بعد 48 ساعة ، عبرت الخلايا المصابة عن GFP ، في ارتباط عكسي مع عامل التخفيف للتعليق الفيروسي. وقد لوحظ ذلك عن طريق المجهر الفلوري، وتم تحديد النسبة المئوية للخلايا الإيجابية ل GFP من خلال قياس التدفق الخلوي(الشكل 5). لحساب التيتر ، تم النظر في التخفيف الفيروسي الذي تسبب في 5 - 20 ٪ من الخلايا الإيجابية GFP(الشكل 5C). عادة، نحصل على titer الفيروسية من ~ 1010 (TU / مل) لفيروس الغدة الحميدة GFP.
فيما يلي، نقدم مثالا على حساب التأر الغدي لدفعة أدينوفيرالية محددة تم فيها تحويل 300000 خلية (C) بمحلول أدينوفيرالي واحد مل (V)، عند عامل تمييع 106 (D)، والذي تم الحصول على 6٪ من الخلايا الإيجابية GFP (F):
تيتر (TU/mL) = D x F/100 x C/V = 106 × 6/100 × 300000/1 = 1.8 × 1010 TU/mL
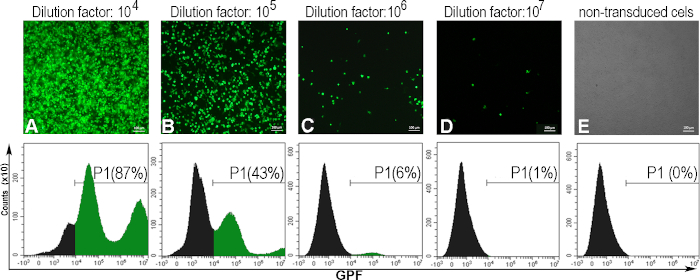
الشكل 5: تقييم التيتر الأدينوفيرالي. أصيبت خلايا AD293 بتمييعات أدينوفيرالية مختلفة. بعد 48 ساعة، لوحظت الخلايا عن طريق المجهر الفلوري وتحليلها عن طريق قياس التدفق الخلوي لتحديد النسبة المئوية للخلايا الإيجابية GFP الناجمة عن تخفيفات أدينوفيرالية مختلفة (A-D). لإنشاء بوابة لقياس التدفق الخلوي، تم تحليل الخلايا غير المنقولة أيضا (E). كان titer محسوبا لعامل التخفيف 106، عندما كانت 6٪ من الخلايا إيجابية GFP 1.8 × 1010 TU / mL. لوحات A-E، أشرطة: 100μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
لاختبار إمكانات نقل الفيروس الغدي المعد ، تم استخدام أربعة خطوط خلايا: الخلايا البطانية البشرية (EA.hy926) ، والخلايا البطانية الأبهري البقري (BAEC) ، والخلايا الكبدية المورينية (Hepa 1-6) ، والخلايا النجمية المتوسطة المورين (MSC). تم تحويل الخلايا البطانية (EA.hy926 وBAEC) مع 25 TU / الخلية ، وتم نقل خلايا الكبد مع 5 TU / الخلية وتم نقل MSC مع 250 TU / الخلية.
وفيما يلي مثال على كيفية حساب حجم التعليق الأدينوفيرالي اللازم لإصابة 3 ×10 6 خلايا ب 25 وحدة تو/خلية، باستخدام التعليق الأدينوفيرالي مع 1.8 ×10 10 TU/mL.
ل1 خلية .............. 25 تو
3 × 106 خلايا .............. x TU  x =75 × 106 TU
x =75 × 106 TU
إذا كان المخزون الفيروسي يحتوي على
1.8 × 1010 TU .............. 1 مل
75 × 106 TU .............. y mL  y = 4.2 × 10-3 مل = 4.2μL من المخزون الفيروسي
y = 4.2 × 10-3 مل = 4.2μL من المخزون الفيروسي
بعد 48 ساعة من التحويل، تم تحليل الخلايا عن طريق المجهر الفلوري. وكما هو مبين في الشكل 6،تم نقل الخلايا البطانية البشرية أو البقرية بكفاءة جيدة (~ 50٪) ل25 TU/cell (الشكل 6 EA.hy926 وBAEC). تم نقل خلايا الكبد مورين (هيبا 1-6) بكفاءة من قبل الفيروس الغدي في كمية منخفضة من جزيئات الفيروس الغدي (5 TU/cell)، لكنها حساسة أيضا للفيروس الغدي منذ أن تم تسجيل نسبة أعلى من الخلايا الميتة (الخلايا الإيجابية PI) (~ 16٪) بالمقارنة مع أنواع الخلايا الأخرى. وكانت الخلايا النجمية Mesenchymal الأكثر صعوبة في التحويل (الشكل 6) ، بسبب عدم وجود مستقبلات أدينوفيرالية محددة (بيانات غير منشورة).
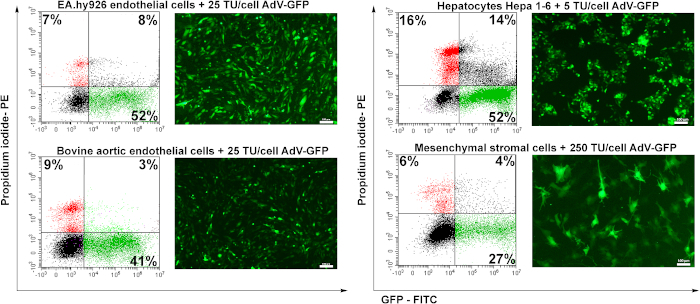
الشكل 6: عدوى الفيروس الغدي وتحريض تعبير GFP في الخلايا المنقولة. تم تحويل الخلايا البطانية البشرية (EA.hy926) والخلايا البطانية الأبهري البقرية (BAEC) والخلايا الكبدية المورينية (Hepa 1-6) والخلايا النجمية المتوسطة المرينية (MSC) مع الكمية المشار إليها من الفيروس الغدي. تم الكشف عن GFP عن طريق المجهر الفلوري وتم تحليل النسبة المئوية للخلايا الإيجابية GFP عن طريق قياس التدفق الخلوي. تظهر الخلايا الإيجابية PI التي يحددها قياس التدفق الخلوي وفيات الخلايا التي يحددها النقل الفيروسي. EA.hy926 الخلايا، والخلايا البطانية الأبهري البقري، وخلايا هيبا 1-6 تم نقلها بشكل كبير من قبل الفيروس الغدي، وعائد النقل تتراوح بين 41-52٪. بالنسبة ل MSC ، فإن كمية أعلى من الفيروس (250 TU / الخلايا) تسببت فقط في 27٪ من GFP إيجابية من الخلايا المنقولة. أشرطة: 100μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الفيروسات الغدية المؤتلفة هي أداة متعددة الاستخدامات لتسليم الجينات والتعبير12،13،14. للحث على التعبير البروتيني القوي عن طريق النقل الأدينوفيرالي ، يتم إدخال تسلسل ترميز جين الاهتمام في جينوم الفيروس الغدي. نظام AdEasy adenoviral، وضعت في مختبر بيرت فوغلشتاين، ويضم البلازميد العمود الفقري (pAdEasy-1) التي تحتوي على معظم نوع البرية الفيروس الغدي المصلي 5 الجينوم، وناقل مكوك (pAdTrack)، مصممةلاستنساخالجينات 2،10. حذف الجينات الأدينوفيرالية E1 (المسؤولة عن تجميع جزيئات الفيروس المعدية) و E3 (ترميز البروتينات المشاركة في التهرب من مناعة المضيف) خلق مساحة في الجينوم الأدينوفيرالي ، حيث يمكن إدخال جين من الفائدة من 6.5-7.5 كيلوبايت2،3. هذا الحجم يكفي لكثير من الجينات، وخاصة بالنسبة لأولئك الذين لديهم أقصر introns15،16،17. وهناك أيضا الباحثين الإبلاغ عن إنتاج الفيروسات الغدية تحمل cDNA من متحول18،19،20. ومع ذلك، حصلنا على عائد أقل من التعبير المتحول للفيروسات الغدية الحاملة لل CDNA مقارنة بنظرائهم الذين يحملون جينا أو جينا صغيرا (البيانات غير مبينة).
تحسين وتكييف الطرق السابقة2،10،14،18،21، تكنولوجيا لإنتاج أدينوفيرالي يتطلب وقتا أقصر ، وانخفاض التكلفة ، وأقل جهد. يتم الحصول على الحمض النووي الأدينوفيرالي كامل الطول عن طريق إعادة التركيب بين ناقل المكوك والبلازميد pAdEasy-1 في سلالة E. coli المعرضة للتضمين المتجانس ، BJ5183. يتضمن البروتوكول التحول الكيميائي لخلايا AdEasier-1 (بكتيريا BJ5183 التي تحتوي على pAdEasy-1). هذه التقنية لا تتطلب مطهر كهربائي قد لا تكون متاحة في بعض المختبرات، هو بسيط جدا، ويزيد من العائد إعادة التركيب، ويقلل من الوقت اللازم للحصول على الخلايا المختصة وإجراء التحول. كما أن الاختيار المسبق للمستنسخين المؤتلفين الذي يقوم به PCR يقلل من الوقت ويخفف من الإجراء بأكمله. تم استخدام إجراء مماثل من قبل تشاو وزملاء العمل22، ومع ذلك ، في البروتوكول ، قمنا بتحسين تسلسل العناوين التمهيدية.
بالنسبة لتغليف وتضخيم فيروس الغدة الحميدة GFP، تم استخدام خط خلايا مشتق HEK293، أي خلايا AD293، التي هي أكثر التزاما بلوحة الثقافة. خطوط الخلايا الأخرى المستخدمة عادة لإنتاج أدينوفيرالي هي التالية: 911، 293FT، pTG6559 (مشتق A549)، PER. C6 (مشتق لها)، GH329 (HeLa مشتق)، N52. E6، وهيلا-E123،24،25،26. في أيدينا، لم يتم الحصول على أي تحسن في إنتاج أدينوفيرالي عندما تم استخدام 911 خلية (البيانات غير مبينة). إن إصابة خلايا AD293 ببللازميد المؤتلف باستخدام كاشف K2 زادت بشكل كبير من كفاءة خطوة التعبئة والتغليف الفيروسية. بعد إنتاج الفيروس الغدي، ما يصل إلى ~ 70٪ من الفيروس الغدي لا يزال داخل الخلايا ويتم إطلاقه من قبل ثلاث دورات تجميد وذوبان الجليد. زيادة عدد الدورات ليست مناسبة لأنه يدمر الفيروس الغدي.
في جميع أنحاء عملية الإنتاج الأدينوفيرالي الروتينية ، يتم إطلاق العديد من الجسيمات الفيروسية في وسط زراعة الخلية. إن التخلص من هذه الوسيلة زراعة الخلية أثناء حصاد خلايا AD293 المصابة سيؤدي إلى فقدان الفيروسية الهامة. لقد قمنا بتحسين البروتوكول الذي وصفه Schagen وزملاء العمل لتنقية الجسيمات الأدينوفيرالية من وسيط زراعة الخلايا عن طريق هطول الأمطار مع كبريتات الأمونيوم27. هذه الطريقة لديها كفاءة أعلى في استرداد الفيروس الغدي من الخلايا المتوسطة مقارنة مع طريقة استخدام البولي ايثيلين غليكول28. وينبغي تنقية الفيروس الغدي عجلت فورا عن طريق الطرد الفائق أو الاحتفاظ بها في الثلاجة لبضعة أيام ولكن فقط بعد غسيل الكلى، لإزالة فائض الملح. الحفاظ على عجل لفترة أطول من بضع ساعات دون غسيل الكلى ضار للفيروس.
تنقية الجسيمات الأدينوفيرالية عن طريق الطرد المركزي الفائق التي أجريت في خطوة واحدة يقلل من التلاعب في المخزون أدينوفيرالي ويخفف الإجراء بالمقارنة مع البروتوكولات باستخدام خطوات الطرد الفائق المتعاقبة14،29. غسيل الكلى من الفيروس الغدي المنقى ضروري لإزالة كلوريد السيزيوم التي قد تؤثر بشكل أكبر على النقل. في البروتوكول، استخدمنا مخزن Tris المؤقت الذي يحتوي على MgCl2 ولكن ليس السكروز لغسيل الكلى، لأنه يتطلب كمية ضخمة وغير مبررة من السكروز المطلوبة بخلاف ذلك كمادة حافظة للتجميد. وهكذا، أضفنا السكروز في وقت لاحق، مباشرة إلى مخزونات أدينوفيرالية أعدت للتجميد. لتجنب التجميد المتكرر وذوبان الفيروس الغدي المنقى ، من المستحسن أن يتم تخزين المخزونات الأدينوفيرالية وتخزينها عند -80 درجة مئوية. تم تقييم التيتر الأدينوفيرالي عن طريق قياس التدفق الخلوي بالنظر إلى جين مراسل GFP والنسبة المئوية للخلايا المنقولة لتخفيف فيروسي محدد. هذه الطريقة أسرع بالمقارنة مع "فحص البلاك" الكلاسيكي وهي أكثر ثقة بالمقارنة مع تقييم البروتينات ذات الكبسولات (بطرق مختلفة مثل ELISA أو قياس التدفق الخلوي) والتي لا تكشف عن قدرة عدوى الجسيمات الأدينوفيرالية. ومع ذلك، فإن القياس الكمي القائم على ELISA، أو Q-PCR، أو فحص البلاك باستخدام مجموعات متاحة تجاريا هي طرق بديلة، مفيدة بشكل خاص لتكفير الفيروسات الغدية التي لا تحتوي على متتبع فلوري.
وبالنظر إلى أن الفيروسات الغدية pAdTrack مشتقة من الفيروسات الغدية البشرية من النمط المصلي 5 الذي يعترف به فيروس كوكساكي ومستقبلات فيروس أدينوفيروس (CAR)، أظهرنا قدرة فيروس الغدة الغددية GFP على تحويل الخلايا ذات الأصل البشري (الخلايا البطانية)، ولكن أيضا الخلايا ذات الأصول الأخرى: الأبقار (الخلايا البطانية) ومورين (الخلايا النجمية المتوسطة والخلايا الكبدية). وأظهرت البيانات أن فيروس الغدة الغامرة يمكن أن يحفز على مستوى عال من التعبير عن المتحولين جنسيا.
في الختام، قمنا بتحسين هذه التكنولوجيا الشاقة لتقليل الوقت والتكاليف والجهد اللازم للحصول على الجسيمات الأدينوفيرالية. الفيروس الغدي المعد قادر على إصابة أنواع مختلفة من الخلايا والحث على التعبير عن جين الاهتمام. ويمكن استخدام هذا البروتوكول في مجموعة متنوعة من التجارب لأن نقل الجينات بوساطة أدينوفيرالية يمثل واحدة من الأدوات الرئيسية لتطوير العلاجات الجينية الحديثة.
الاختصارات: AdV-GFP، الجسيمات أدينوفيرالية؛ BAEC, الخلايا البطانية الأبهري البقري; CSCl، كلوريد السيزيوم؛ GFP، بروتين فلوري أخضر. MSC, الخلايا النجمية mesenchymal; TU، وحدات التحويل.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد تم دعم هذا العمل من خلال مشروع ممول من صندوق التنمية الإقليمية الأوروبي من خلال البرنامج التشغيلي للقدرة التنافسية 2014-2020 (POC-A.1-A.1.1.4-E-2015، الهوية: P_37_668؛ اختصار DIABETER)، منحة من وزارة البحوث والابتكار الرومانية PCCDI- UEFISCDI، رقم المشروع PN-III-P1-1.2-PCCDI-2017-0697 داخل PNCD III والأكاديمية الرومانية. يشكر المؤلفون كيرياكوس كيبريوس (جامعة باتراس، اليونان) على نصيحته السخية والوثيقة الصلة، أوفيديو كرويتو (جامعة الفنون الجميلة، بوخارست، رومانيا) للتصوير، وتحرير الأفلام، والتصميم الرسومي، ومهايلا براتو للحصول على المساعدة التقنية.
Materials
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
References
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved