Method Article
아데노바이러스 생산을 위한 효율적인 방법
요약
여기서, 우리는 pAdEasy 시스템을 사용하여 아데노바이러스 생산을 위한 프로토콜을 제시합니다. 이 기술은 pAdTrack 및 pAdEasy-1 플라스미드의 재조합, 아데노바이러스 포장 및 증폭, 세포 용해 및 배양 배지에서 아데노바이러스 입자의 정제, 바이러스 적정, 아데노바이러스의 기능적 테스트를 포함한다.
초록
아데노바이러스 전도는 다양한 세포 유형 및 장기로 관심 있는 유전자의 발현의 강력하고 일시적인 유도의 장점이 있다. 그러나, 재조합 adenoviral 기술은 힘들고, 시간이 많이 걸리며, 비쌉합니다. 여기서, 우리는 변환된 세포에서 강한 녹색 형광 단백질(GFP) 발현을 유도할 수 있는 정제된 아데노바이러스 입자를 얻기 위해 pAdEasy 시스템을 이용한 향상된 프로토콜을 제시한다. 이 개선 된 방법의 장점은 버트 보겔슈타인에 의해 개발 된 원래 방법에 비해 빠른 준비 및 감소 생산 비용입니다. 아데노바이러스 기술의 주요 단계는 다음과 같습니다: (1) BJ5183 박테리아에서 pAdEasy-1 플라스미드와 pAdTrack-GFP의 재결합; (2) 아데노바이러스 입자의 포장; (3) AD293 세포에서 아데노바이러스의 증폭; (4) 세포 용해 및 배양 배지로부터 아데노바이러스 입자의 정제; 및 (5) 아데노바이러스의 바이러스 적정 및 기능적 테스트. 본래 의 방법에 대한 개선은 (i) 비대비5183 함유 pAdEasy-1에서 박테리아의 화학적 변형에 의한 재조합으로 구성된다. (ii) "네거티브" 및 "양수" PCR에 의한 재조합 클론의 선택; (iii) Adenoviral 포장을 위한 K2 형질전환 시스템을 이용한 AD293 세포의 배설; (iv) 세포 배양 배지에서 AD293 세포에 의해 방출된 바이러스 입자의 황산암모늄을 함유한 침전; 및 (v) 1단계 염화염화물에 의한 바이러스의 정제불방향 그라데이션 초원심분리. 관심 있는 유전자의 강한 발현(이 경우, GFP)은 다양한 소스(인간, 소, 뮤린)로부터 다른 유형의 트랜스포칭 된 세포 (간세포, 내피 세포 등)에서 수득되었다. 아데노바이러스 매개 유전자 전달은 현대 유전자 치료법 개발을 위한 주요 도구 중 하나를 나타냅니다.
서문
아데노바이러스는 뉴클레오캡시드 및 이중 가닥선형 DNA 게놈1,2,3을포함하는 비봉투 바이러스이다. 아데노바이러스는 광범위한 세포 유형을 감염시킬 수 있으며 감염은 활성 숙주 세포 분열에 의존하지 않는다. 감염 후, 아데노 바이러스는 호스트 세포 핵에 게놈 DNA를 소개합니다, 어디 그것은 서사시 roromosomal 를 유지하고 호스트의 유전자와 함께 전사된다. 따라서, 삽입 돌연변이 발생 또는 온코진 조절에 대한 최소한의 잠재적 위험은4,5,6을달성한다. 아데노바이러스 게놈은 숙주 게놈과 함께 복제되지 않으므로 아데노바이러스 유전자는 세포 집단분할에서 희석된다. 아데노바이러스 전이의 장점 중에서도( i) 높은 수준의 트랜스진 발현이 있다. (ii) 주전 게놈으로 바이러스 DNA의 통합과 관련된 위험을 감소시켰다. (iii) 다양한 분할 및 비분할 세포 유형의 변환. 생물 의학 연구에 사용되는 대부분의 아데노바이러스는 E1영역7,8,9가부족한 비복제이다. 이들의 생산을 위해서는 E1 서열(예: HEK293)을 공급하는 세포선이 필요하다. 게다가, 바이러스 성 수명 주기(E3)에 대한 비필수 영역은 바이러스 게놈내의 트랜스진의 삽입을 허용하기 위해 삭제되었다; 다른 지역(E2 및 E4)은 일부 아데노바이러스에서 추가로 삭제되었지만, 이들 경우에는 아데노바이러스 생산의 감소수율과 트랜스진의 낮은 발현이7보고되었다.
여기서는 AdEasy 시스템을 사용하여 아데노바이러스를 구성, 포장 및 정화하기 위한 향상된 프로토콜을 제시합니다. 이러한 개선은 버트 보겔슈타인에 의해 개발 된 원래 방법과 비교하여 더 빠르고 경제적 인 방법으로 아데노 바이러스의 포장을 허용2,10,다음과 같은 장점으로 인해: (i) BJ5183 함유 pAdEasy-1 박테리아의 화학 적 변형에 의해; (ii) PCR에 의한 재조합 클론의 선택; (iii) Adenoviral 포장을 위한 K2 형질전환 시스템을 이용한 AD293 세포의 배설; (iv) 바이러스 포장 및 증폭 후 배양 배지로부터 아데노바이러스 입자의 침전; (v) 1단계 염화(CsCl) 그라데이션 극심분리를 이용한 아데노바이러스 정제.
AdEasy시스템(도 1)을이용한 아데노바이러스 생산을 위한 프로토콜은 다음 단계를 포함한다.
(1) BJ5183 박테리아에서 pAdEasy-1과 pAdTrack-GFP의 재조합
(2) 아데노바이러스 입자의 포장
(3) 아데노바이러스 증폭
(4) 세포용해 및 배양 배지로부터 아데노바이러스 입자의 정화
(5) 아데노바이러스 적정.
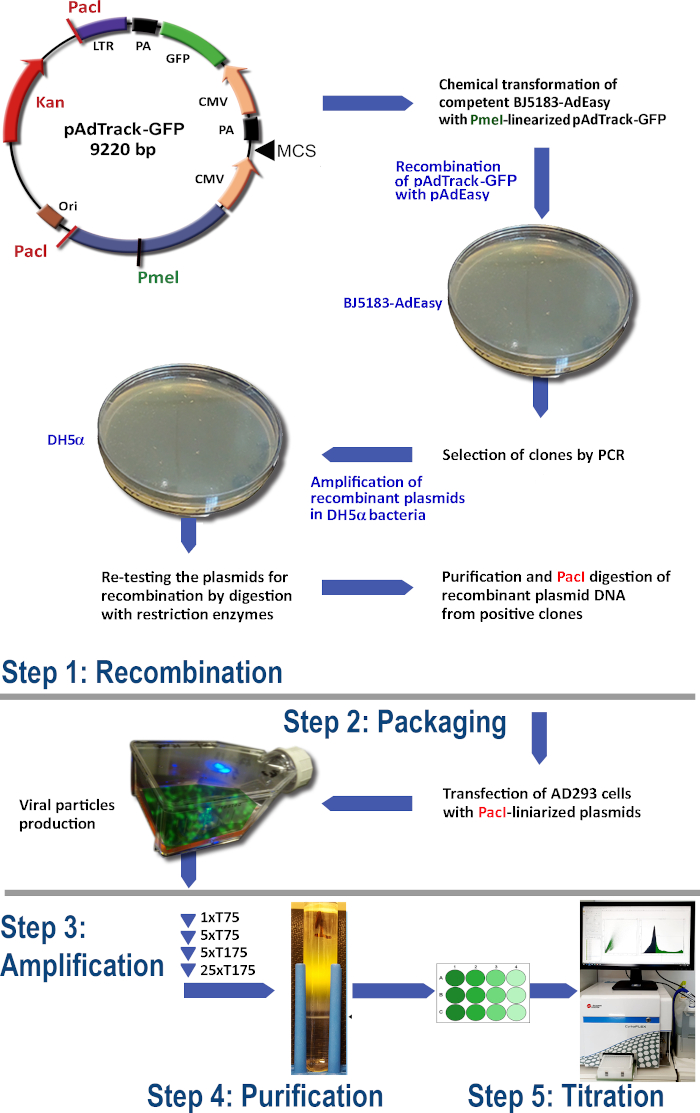
그림 1: 아데노바이러스 생산 기술. 아데노바이러스 기술의 주요 단계는 다음과 같습니다: (1) BJ5183 박테리아에서 pAdEasy-1 플라스미드와 pAdTrack-GFP의 재결합. 선택된 재결합 된 플라스미드는 DH5α 박테리아에서 증폭된 다음 정제됩니다. (2) AD293 세포에서 아데노바이러스 입자의 포장, 아데노-E1 단백질을 생산하는; (3) AD293 세포에서 아데노바이러스의 증폭; (4) CsCl 밀도 그라데이션에 대한 초원심심분리에 의한 세포 용해 및 배양 배지로부터의 아데노바이러스 입자의 정제; (5) 아데노바이러스및 기능성 테스트의 적정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 프로토콜에서, 우리는 숙주 세포에서 GFP의 발현을 유도할 수 있는 아데노바이러스의 생산을 위한 기술을 예시하였다. GFP는 이미 제2CMV 프로모터하에서 pAdTrack-CMV 셔틀 벡터(Addgene #16405)의 중추에 삽입되어 리포터유전자(도 1)로사용된다. 이러한 이유로, 여기에 우리는 pAdTrack-CMV 벡터를 pAdTrack-GFP로 지정하고 데모 목적으로 GFP의 표현을 평가했습니다. GFP 발현 외에, 시스템은 pAdTrack-CMV의 다중 복제 부위에서 복제될 수 있는 관심 유전자를 과발표현하는 데 사용될 수 있다. pAdTrack-CMV에서 복제된 유전자 또는 미니진은 cDNA11과비교하여 발현 유도를 위해 일반적으로 더 효율적입니다. 데이터는 다양한 소스 (인간, 소, 뮤린)에서 변환 된 세포 (간세포, 내피 세포와 같은)에서 강한 GFP 발현을 보였다. 아데노바이러스 매개 유전자 전달은 현대 유전자 치료법 개발을 위한 주요 도구 중 하나를 나타냅니다.
프로토콜
안전 참고 사항: 일반적으로 아데노바이러스는 생물안전 수준 2 유기체로 분류되므로, 모든 조작은 숙련된 사람이 Class II 생물안전 캐비닛에서 수행해야 하며, 생체 위험 보호 장비(장갑, 생물학적 에어로졸용 페이스 마스크, 실험실 코트 등)를 착용해야 합니다. 아데노바이러스로 오염된 모든 고체 물질은 30분 동안 10% 표백액으로 소독되어야 하며 121°C 및 1bar에서 30분 동안 자동 분해되어야 합니다. 삽입된 유전자에 따라, 생성된 아데노바이러스는 위험한 잠재력을 가질 수 있고 그밖 생물안전 수준에서 분류될 수 있습니다.
1. 실험 준비
- 아데노바이러스 조작에 대해 별도의 세포 배양 후드와 각 아데노바이러스 유형에 대해 별도의 인큐베이터를 사용한다. 바이러스 성 포장 및 증폭을 위해 필터 캡으로 T 플라스크를 사용하십시오. 벤트 페트리 플레이트에서 가능한 한 많은 변환 실험을 피하십시오.
- 각 사용 후 세포 배양 후드를 비우고 15 분 동안 UV에 노출하십시오.
- 오토클레이브는 주기적으로 파이펫 보조, 파이펫 및 기타 기구를 순환합니다. 가능하면, 별도의 세포 배양 실험실/후드에서 배양하여 아데노바이러스 포장(AD293 세포) 및 세포가 트랜스듀션 실험에 사용될 수 있다. 같은 기간에 증폭된 다른 아데노바이러스의 배치는 PCR에 의한 교차 오염을 확인해야 한다.
- 다음 솔루션을 준비합니다.
- SOB(초적최적 국물) 매체 준비: 트립톤 20g, 효모 추출물 5g, NaCl 0.5 g(최종 농도 10mM), M KCl 2.5mL(최종 농도 2.5mM), amd H2O ~ 1L. 121°C에서 오토클레이브 후, 다음멸균 용액을 추가하십시오: 1M MgCl2의 5mL 및 1 M MgSO4의5mL.
- SOC 준비 (카타 볼라이트 억압과 슈퍼 최적의 국물) 매체: 1 L 멸균 SOB에서 다음과 같은 멸균 솔루션을 추가: 20 mL 의 1 M 포도당, 5 m MgCl2의 5 mL, 그리고 5 mL 의 1 M MgSO4.
- 강수액 준비: H2O60mL에 29.5g의 칼륨 아세테이트를 녹이고, 아세트산 11.5mL, H2O ~ 100mL를 추가합니다.
- 재서스펜션 버퍼 준비: 20% 포도당 95mL, 1M Tris-Cl pH 8의 5mL, 0.5 M EDTA pH 8의 4mL, H2O ~ 200mL를 추가한다.
- 용해 준비: 8.3M NaOH의 4.8mL, 20%SDS의 10mL, H2O ~ 200mL.
2. BJ5183 박테리아에서 pAdEasy-1 플라스미드와 pAdTrack-GFP 바이러스 벡터의 재조합
- pAdTrack-GFP의 선형화 및 선형화된 플라스미드의 정제.
- 얼음에 다음과 같은 소화 믹스를 준비 :
pAdTrack-GFP 의 10 μg
10배 무색 버퍼의 5μL
Pme I의 2 μL
50 μL의 최종 부피H2O. - 수조에서 3시간 동안 37°C에서 배양합니다.
- 65°C에서 20분 동안 비활성화합니다.
- Pme I를 가진 pAdTrack-GFP의 소화의 효율을 확인하십시오: 0.8% 아가로즈 젤에 소화되지 않은 플라스미드의 1 μg와 병행하여 소화된 플라스미드의 1 μg를 실행합니다.
- 얼음에 다음과 같은 소화 믹스를 준비 :
- DNA의 격리 및 정화
참고: 1-6단계는 연기 후드로 수행해야 합니다.- 페놀/클로로폼/이소아밀 알코올(25:24:1)을 소화 혼합물에 넣고 혼합물이 균일해질 때까지 튜브를 반전시다.
- 원심분리기는 16,200 x g에서3분 동안 원심분리기를 한 다음 상부 수성 상을 수집 튜브로 옮긴다.
- 페놀/클로로폼/이소아밀 알코올(25:24:1)을 낮은 유기상과 소용돌이위에 동일한 양을 추가합니다.
- 원심분리기는 16,200 x g에서3분 동안 원심분리기를 한 다음 상층을 동일한 수집 튜브로 옮긴다.
- 수집 튜브와 소용돌이에서 수확된 수성 상 위에 동일한 양의 클로로폼을 추가합니다.
- 원심분리기는 16,200 x g에서3분 동안 원심분리기를 한 다음 상부 수성 위상을 새로운 수집 튜브로 옮긴다.
- 아세테이트 나트륨 1/10 부피, 감기 100% 에탄올 및 소용돌이 2부추가.
- -70°C에서 1시간 또는 하룻밤 -20°C에서 배양합니다.
- 얼음과 원심분리기의 샘플을 16,200 x g 및 4°C에서 10분 동안 해동합니다.
- 상체를 제거하고 75 % 에탄올의 750 μL을 추가합니다.
- 원심분리기는 16,200 x g 및 4°C에서 3분 동안 상류체를 제거하고 상류체를 제거합니다.
- 간략하게 튜브를 회전하여 모든 상체를 제거하고 후드의 펠릿을 건조시다. 녹기가 까다롭기 때문에 DNA 펠릿을 오랫동안 건조시키지 마십시오.
- 펠릿을 H2O의 15 μL로 녹입니다.
- 분광계(예를 들어, 나노드롭)를 사용하여 DNA 농도를 측정한다.
- pAdTrack-GFP를 함유한 애드시어-1 박테리아의 변신
참고 : 이 단계에서, pAdEasy-1 플라스미드와 pAdTrack-GFP의 재결합이 일어난다.- AdEasy-1 (BJ5183 함유 pAdEasy-1, Addgene #16399) 화학 유능한 박테리아를 제조 업체의 지시에 따라 상업적 변환 키트를 사용 하십시오. -80°C에서 100 μL 유능한 박테리아의 알리쿼트를 보관하십시오.
- 유능한 AdEasy-1 박테리아의 알리쿼트가 얼음 위에 녹이고 정제 된 Pme I -소화 된 pAdTrack-GFP의 1 μg를 추가하십시오. 튜브를 가볍게 섞어 부드럽게 섞습니다(혼합물을 피펫하지 마십시오). 얼음에 10 분 동안 배양.
- SOC 배지의 900 μL을 추가하고 흔들림과 함께 37 °C에서 1 시간 동안 배양하십시오.
- 600 x g에서5 분 동안 마이크로 퍼지.
- 상체의 900 μL을 제거하고 펠릿과 상체를 혼합하고 LB-천 접시에 변형 된 박테리아를 카나마이신과 시드하십시오.
- 37 °C에서 ~ 16 시간 동안 배양하십시오 (18 시간을 초과하지 마십시오).
- PCR에 의한 가능한 양성 클론 선택
- 이쑤시개를 두 개의 반으로 나누고 자동 으로 반 이쑤시개를 살균합니다.
- 멸균 반 이쑤시개를 사용하여 작고 반투명 한 식민지를 집어 들수 있습니다.
- 간략하게, 10 μL 물 (PCR 튜브)에서 박테리아로 반 이쑤시개를 회전한 다음 칸마이신을 함유한 100 μL SOC 배지를 포함하는 1.5mL Eppendorf 튜브에 반 이쑤시개를 넣습니다. 37°C에서 4-6시간 동안 배양하고 클론을 "음수" 및 "양수" PCR로 테스트합니다.
- 세균 샘플을 얻고 "네거티브"와 "양성"PCR을 병렬로 실행하기 위해 95 °C에서 5 분 동안 박테리아와 10 μL 물을 포함하는 PCR 튜브를 배양한다.
- "네거티브" PCR - pAdTrack-GFP 무결성을 테스트하려면 얼음에 있는 음수 PCR에 대해 다음 PCR 믹스를 준비합니다.
세균 시료의 5 μL
0.1 μL 프라이머 포워드 (4631 F: 5'-CAGTAGTCGGTGTTCGTCCAG)
0.1 μL 프라이머 리버스 (5616 R: 5'TATGGGCTGTAATGTTGTCTC)
0.1 μL dNTP 10 mM
5x 버퍼의 3 μL
MgCl 2 25mM의 1.5 μL
0.1 μL 의 고타크 폴리머라제
H2O ~ 15 μL의 최종 부피
참고: DNA 템플릿이 pAdTrack-GFP 벡터인 양수 제어가 포함되어야 합니다. - "긍정적 인"PCR - 관심유전자의 존재를 테스트합니다. 삽입된 유전자에 대한 특정 프라이머를 사용하고 이전 단계에서와 같이 혼합을 준비한다. GFP에 사용되는 프라이머는 다음과 같은 것입니다.
F: 5'-CAAGGACGACGGCAACTACA
R: 5'-ATGGGTTCTGCTGGTA - "음수"와 "양수" PCR을 병렬로 실행합니다. PCR 프로그램은 : 5 분, 95 ° C; 다음 단계의 40 사이클: 30초, 95°C; 30 초, 68 °C; 1 분, 72 °C; 최종 신장: 10분, 72°C.
참고: 관심 있는 유전자를 증폭하기 위해 어닐링 온도를 조정합니다. - 1% 아가로즈 젤로 PCR 제품을 평가하고 클론을 선택합니다.
- "양수 PCR" 후 "음의 PCR"및 특정 PCR 제품에 대한 PCR 제품을 제공하지 않는 클론을 추가로 처리하는 것이 좋습니다.
- 선택한 재조합 클론의 세균 배양 성장
- 추정 된 양성 클론의 배양을 희석 (단계 결과 2.4.3.) SOC 매체의 4 mL에서 카나마이신과 함께, 그리고 흔들어 37 °C에서 하룻밤 을 배양.
- AdEasy-1 박테리아에서 플라스미드 DNA의 격리 (알칼리성 용해를 사용하여 미니 준비)
- 마이크로센트심분리기 튜브에서 세균 배양 1.5mL를 옮기고, 원심분리기는 16,200 x g에서1분 동안 전달하여 상퍼를 제거한다.
- 동일한 튜브에서 또 다른 1.5 mL 세균 배양을 전송하고 원심 분리를 반복하고 상체를 제거합니다.
- 재서스펜션 버퍼 200 μL(50mM 포도당, 10m EDTA, 25mM Tris-HCl pH pH 8)을 추가합니다.
- 용액 200 μL(0.2N NaOH, 1% SDS)을 추가하여 튜브를 반전시켜 부드럽게 섞습니다.
- 침전액 200μL(아세테이트 5M 칼륨 60mL, 빙하 아세산 11.5mL, 100mL까지 H2O추가) 튜브를 반전시켜 부드럽게 섞는다.
- 원심분리기 는 16,200 x g에서3 분 동안.
- 새로운 미세원심분리기 튜브에서 상체를 옮기고 500 μL 이소프로판올을 넣고 얼음 위에 20분 동안 혼합하고 인큐베이션합니다.
- 원심분리기는 16,200 x g에서 15분 동안 원심분리기를 추가하고 75% 에탄올의 500 μL을 추가합니다.
- 원심분리기는 16,200 x g에서 10분 동안 원심분리기를 제거하고 상체를 제거합니다.
- 16,200 x g에서3 분 동안 원심 분리기는 상체를 제거하고 H2O의 15 μL을 추가합니다.
- 재결합된 플라스미드의 증폭, 격리 및 재테스트
- AdEasy-1 세포로부터 분리된 DNA를 가진 DH5α 박테리아의 변환.
- 제조업체의 지시에 따라 상용 변환 키트를 사용하여 DH5α 유능한 박테리아를 준비합니다.
- 얼음에 DH5α 유능한 박테리아의 100 μL을 해동하고, 재조합 DNA를 추가하고, 얼음에 10분 동안 배양합니다. 그런 다음 박테리아를 카나마이신으로 LB-생가 접시에 뿌린 다음 시드합니다.
- 하룻밤 사이에 37 °C에서 배양하십시오.
- 여러 식민지를 픽업하고 가나마이신과 LB 매체의 2mL에서 각각 성장, 37 °C에서, 하룻밤, 흔들림.
- DNA(알칼리성 용증을 이용한 미니프림)를 분리하고 25 μL H2O에서 얻은 DNA를 재중단한다.
- 효소 소화로 양수 클론을 확인합니다.
- 얼음에 다음 믹스를 준비 :
재조합 DNA 5 μL
10배 무색 버퍼의 1.5 μL
힌드 III 또는 Pst I의 0.5 μL
H2O ~ 15 μL의 최종 부피 - 37 °C에서 30 분 동안 배양하십시오.
참고 : 컨트롤로, 또한 pAdTrack-GFP 및 pAdEasy-1 플라스미드를 소화. - 각 샘플에서 RNase A를 사용하여 Sx6 로딩 버퍼의 3 μL을 추가합니다(RNase A가 미니준비 버퍼에 없는 경우).
- 1% 아가로즈 젤 전기포에 소화된 DNA 단편을 실행합니다.
참고: 양수 클론의 소화 패턴은 소화된 pAdEasy 플라스미드의 대부분의 조각을 포함하며, pAdTrack 벡터와의 pAdEasy 재조합을 드러냅니다. 관심의 유전자는 복제에 사용되는 제한 효소와 소화에 의해 입증되어야한다.
- 얼음에 다음 믹스를 준비 :
- 아데노바이러스 포장을 위한 플라스미드 DNA(트랜스페션 등급)의 준비.
- 플라스미드 DNA를 분리하기 위해 양성 클론에서 박테리아의 200 mL 배양을 성장시다.
- 제조업체의 지시에 따라 플라스미드 DNA 미디프(예: Qiagen Plasmid Midi Kit)용 상용 키트를 사용하여 플라스미드 DNA를 분리합니다.
- AdEasy-1 세포로부터 분리된 DNA를 가진 DH5α 박테리아의 변환.
3. 아데노바이러스 입자 포장
- 1일차. AD293 셀 시드
- PBS로 AD293 세포를 세척하고 37 °C에서 2-5 분 동안 0.125 % 트립신으로 배양하십시오.
- 혈청으로 차가운 배지에서 세포를 수집합니다.
- 4°C에서 400 x g에서 5분 동안 원심분리기.
- 혈청으로 배지에서 세포를 다시 중단하고 세포를 ~2 x 106/T25 플라스크의 밀도로 시드합니다. 바람직하게는, 필터와 플라스크를 사용한다.
- 1일차. 팩 I로 재조합 DNA를 소화
- 다음 믹스를 준비합니다.
재조합 DNA 6μL (1 μg/μL)
팩 I의 2 μL
10배 무색 버퍼의 2.5 μL
H2O ~ 25 μL의 최종 부피 - 37°C에서 3시간(또는 하룻밤)을 배양한 다음 65°C에서 효소를 20분 동안 비활성화합니다.
- 에탄올을 가진 DNA 강수량: (1/10 v/v) 3 M 나트륨 아세테이트 의 2.5 μL 및 100% 에탄올의 2-3 부피를 추가합니다. -70°C에서 30분 또는 하룻밤 -20°C의 배양.
- 원심분리기는 4°C에서 30분 동안 16,200 x g에서 살균수로 펠릿을 재차 분리합니다.
- 다음 믹스를 준비합니다.
- 2일차: K2 시약을 이용한 AD293 셀의 배설
- K2 승수의 40μL을 세포 에 추가, 2 시간 전에 형질.
- A 및 B 솔루션 준비:
솔루션 A: Opti-MEM의 260 μL에 Pac l-선형화된 DNA 6 μg를 추가합니다.
솔루션 B: Opti-MEM의 248.4 μL에 K2 시약의 21.6 μL을 추가합니다. - 솔루션 A 오버 솔루션 B를 추가하고 파이펫팅하여 부드럽게 섞습니다.
- 상온에서 20 분 동안 혼합물을 배양하십시오. 셀에 드롭와이즈 A 및 B 믹스를 추가합니다.
- 일 3-11: 형광 현미경 검사법에 의해 GFP 발현을 모니터링
참고: 세포는 형광 현미경 검사법에 녹색으로 나타나야 하며 점차적으로 분리해야 합니다. - 일 11: F1 아데노바이러스 입자 를 수확
- 50mL 튜브에서 분리 된 세포와 배지를 수집하고, 부착 세포를 긁어 내고, 동일한 튜브에 추가하십시오.
- 원심분리기는 400 x g에서 5분 동안 새로운 튜브에서 상퍼탄을 수집하고 PBS0.5 mL에서 세포 펠릿을 재연한다.
- 세포 중단
- 마이크로원심분리기 튜브에서 세포 현탁액을 전달한다.
- 세 개의 동결/해동 주기를 수행합니다(액체 질소로 동결하거나 -80°C/해동시 최대 7분 동안 37°C로 동결).
- 깨진 세포를 23 G 주사기 바늘을 세 번 통과시.
- 12 분 동안 9,600 x g에서 원심 분리에 의해 세포 파편을 제거합니다.
- 수집된 배지로 상체를 50mL 튜브로 이송한다.
4. 아데노바이러스 증폭
참고: AD293 세포가 필요한 합류에 도달하지 못하면, 감염을 위해 사용되는 아데노바이러스 주(바이러스 생성 세포로부터 얻은 lysate)의 알리쿼트(lysate)는 -80°C에 저장될 수 있다.
- F2 아데노바이러스 입자를 준비합니다.
- T75 플라스크 (5 x 106 세포 / 플라스크)에서 AD293 세포를 시드하십시오.
- F1 아데노바이러스 입자를 사용하여 ~90% 컨물물 AD293 세포를 감염: T25 플라스크에서 세포균질과 배지를 T75 플라스크에서 자란 세포 위에 첨가한다.
- 형광 현미경 검사법에 의한 GFP 발현을 모니터링합니다.
- 변환된 AD293의 ~90%가 분리될 때 바이러스 생성 세포를 수확한다(~5일 트랜스듀션 후). 세포 배양 배지를 4°C로 유지하십시오.
- 1 mL PBS에서 세포 (F1용것과 유사하게)를 방해하십시오.
- F3 아데노바이러스 입자를 준비합니다.
- F2 아데노바이러스 입자로부터 의 -90% 컨물물 AD293 세포가 F2 아데노바이러스 입자및 세포 배양 배지를 가진 T175 플라스크에 시드된다.
- 셀을 수확하십시오(변환 후 ~5일).
- PBS의 2 mL에서 세포 (F1에 대한 것과 유사하게)를 방해하십시오.
- F4 아데노바이러스 입자를 준비합니다.
- F3 아데노바이러스 입자 및 세포 배양 배지를 함유한 5T175 플라스크를 감염시킵니다.
- 셀을 수확하십시오(변환 후 ~5일).
- PBS의 3 mL에서 세포 (F1에 대 한 것과 유사 하 게) 세포를 중단.
- F5 아데노바이러스 입자를 준비합니다.
- F4 아데노바이러스 주식 및 세포 배양 배지를 함유한 25T175 플라스크를 감염시다.
5. 세포 용해 및 배양 배지에서 아데노 바이러스의 정화
- 바이러스 생성 세포 및 배양 배지를 수확한다.
- 변환후 5일 후에 F5의 AD293 세포를 수확하십시오.
- 아데노바이러스 입자의 침전을 위해 멸균 병에 배지를 저장합니다.
참고 : 아데노 바이러스의 정화 될 때까지 냉장고에 매체를 유지합니다. - 4o C에서5 분 동안 400 x g의 세포를 원심 분리합니다.
- 최종 펠릿을 10m Tris HCl5m, pH 8, 2mM MgCl2로재차 한다.
- 알리쿼트 서스펜션은 1.5mL 튜브로 되어 있습니다.
- 세포를 방해 (마찬가지로 F1에 대 한 그들과 함께): 동결/해동의 세 주기.
참고: 초원심분리가 즉시 수행될 수 없는 경우 샘플을 -80°C로 유지하십시오. - 셀 서스펜션을 23G 주사기 바늘을 3회 전달합니다.
- 원심 분리는 9 600 x g에서 12 분 동안 균모를 합니다.
- CsCl 그라데이션 극심분리에 의한 아데노바이러스 정화를 위한 상퍼를 저장한다.
- 배양 배지에서 방출되는 아데노바이러스의 침전.
- 실온에서 저장된 세포 배양 배지로 병을 가져옵니다.
- 세포 배양 배지의 매 500mL에 121 g 의 황산염을 추가하십시오 (용액의 포화는 40 - 42 % 사이여야합니다)
- 황산암모늄이 완전히 용해될 때까지 조심스럽게 섞는다.
- 실온에서 최소 2.5시간 동안 배양하십시오.
- 1600 x g의 원심분리기는 22oC에서 15분 동안 펠릿을 저장합니다.
- 2mM MgCl2로10m Tris HCl pH 8의 4mL에서 펠릿을 재차; 이 서스펜션은 CsCl 그라데이션 초원심분리에 의해 즉시 정제되어야 합니다.
참고: 정화 단계가 이후에 수행될 수 없는 경우, 10m Tris HCl, pH 8에 대해 10m Tris HCl, pH 8에 대해 하룻밤 동안 투석하여 2mM MgCl2를갖는다.
- 극심분리에 의한 아데노바이러스 정제.
- SW41Ti 로터용 폴리프로필렌 튜브의 불연속 CsCl 그라데이션을 준비한다. 튜브 하단에 765 mg /mL CsCl (고밀도 : 1.4 g / L)의 3 mL을 추가하십시오. 천천히 추가 3 mL 의 288.5 mg/mL CsCl (낮은 밀도: 1.2 g/L) 첫 번째 CsCl 층 위에.
- 세포로부터 방출되거나 세포 배양 배지로부터 침전된 아데노바이러스 입자 현탁액의 3-4 mL을 그라데이션 위에 부드럽게 오버레이한다.
- 튜브를 미네랄 오일로 채우고 차가운 SW41Ti 버킷에 튜브를 넣습니다.
- 튜브를 평형화합니다. 채워진 폴리프로필렌 튜브가 로터에 대칭으로 로드되어 있는지 확인합니다. 초원심분리기에 로터를 넣습니다.
- 원심분리기 는 210,000 x g 및 4 °C에서 18 시간 동안 브레이크가 없습니다.
- 밴드를 얻기 위해 뒤에 검은 종이와 스탠드에 초원심 분리튜브를 배치합니다.
- 표백용을 가진 폐기물 용기에 투명한 상위, 세포 파편 및 상부 밴드를 폐기하십시오.
- 멸균 1.5mL 튜브에 완전한 아데노바이러스(~700 μL - 1mL)를 포함하는 가장 낮은 대역을 수확하고 얼음 위에 보관하십시오.
- 투석 버퍼(10m Tris-Cl 버퍼 pH 8, 2 mM MgCl2)에서투석 카세트를 미리 적시한다.
- 2 mL 주사기를 사용하여 투석 카세트에 정제 된 아데노 바이러스를 주입하십시오.
- 10m Tris-Cl 버퍼 pH 8, 2 mM MgCl2에 대해 하룻밤 동안 투석 (투석 버퍼 3 - 4 회 변경).
- 10 - 100 μL의 알리쿼트에서 투석 카세트에서 아데노바이러스 육수를 수확하십시오.
- (극저온 보호용)에 4%의 최종 농도에 자당을 넣습니다.
- -80°C에 알리쿼트를 보관합니다.
6. 아데노바이러스 적정
- 1일차: 세포 도금
- AD293 세포를 도 2에도시된 바와 같이 1mL 완전 성장 배지에서 웰당 2.5 × 105세포의 밀도(12웰 배양판)를 종자한다. 정확한 티터 판정을 위해 세포가 각 우물에서 균등하게 퍼지도록 하십시오.
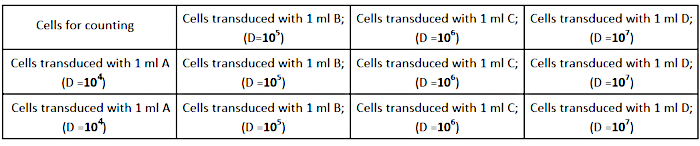
그림 2: 적정판 디자인. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 2일차: 세포 의 전도
- 트립신으로 잘 하나에서 세포를 분리하고 계산합니다. 바이러스 성 titer를 계산하는 데 사용되기 때문에이 숫자를 유의하십시오.
- 다음과 같이 완전 성장 매체의 1mL에서 바이러스 성 주식의 직렬 희석(1/104; 1/105;1/106;1/107)을수행합니다.
- 1/103: 바이러스 재고희석 - 1998 μL에 바이러스 육수 2 μL을 완전한 배지의 1998 μL을 추가합니다.
- 1/104: 120 μL에서 1080 μL까지 완전한 매체(A)를 희석하여 1/103의 희석을 합니다.
- 1/105: 완전한 매체(B)의 120 μL ~ 1080 μL을 희석하여 B의 1:10 희석을 합니다.
- 1/106: 완전한 매체(C)의 1080 μL에서 1080 μL로 희석하여 C의 1:10 희석을 합니다.
- 1/107: 완전한 매체(D)의 120 μL을 C의 120 μL에서 1080 μL로 희석하여 D의 희석을 1:10으로 만듭니다.
참고: 각 희석(A, B, C, D)의 튜브 3개를 준비하여 삼중에서 실험을 수행합니다. - 도 2에 도시된 바와 같이 우물에서 세포 배양 배지를 제거하고 바이러스의 제조된 희석을 추가한다.
- 3일차: GFP 식 모니터링
- 형광 현미경을 사용하여 녹색 세포의 존재를 위해 우물을 확인하십시오.
- 4일차: GFP 양성 세포의 유동 세포측정 분석
- 121mL 튜브를 준비하고 라벨을 부착하십시오.
- 세포 배양 배지 (분리 된 세포와 함께)를 1.5 mL 튜브에서 수집하고 얼음에 보관하십시오.
- 각 우물에 200 μL의 트립신을 추가합니다.
- CO2 인큐베이터에서 37°C에서 2 -3분 동안 플레이트를 배양합니다.
- 세포 배양 배지와 동일한 엡펜도르프 튜브에서 세포를 수확한다. 튜브를 얼음 위에 보관하십시오.
- 4°C에서 5분 동안 400 x g의 세포를 펠렛합니다.
- 상체를 제거합니다. 튜브를 얼음 위에 보관하십시오.
- PBS의 250 μL + 2 % FBS에서 펠릿을 다시 중단; 튜브를 얼음 위에 보관하십시오.
- 유동 세포측정관 또는 플레이트에서 세포 현탁액을 전달한다.
- GFP 발현 세포의 형광을 기록하는 흐름 세포계에서 샘플을 실행합니다.
Titer 계산: 부모 모집단에서 5 - 20 % GFP 양성 셀이있는 샘플은 다음 공식을 사용하여 바이러스 성 titer의 계산을 고려해야합니다.
티터 (TU / mL) = D x F / 100 x C / V
D = 희석 계수
F = 양수 세포의 퍼센트 / 100
C = 셀 수/웰
V = 바이러스 접종의 부피
7. 표적 세포의 아데노바이러스 전과 유도된 단백질 발현의 시험
- 1일차: 셀 시드
- 대상 세포를 시드하여 우물에서 균등하게 퍼지도록 합니다.
- 2일차: 세포의 전도
- 대상 셀을 하나에서 잘 분리하고 계산합니다.
- 셀당 원하는 수의 전염성 입자로 세포를 트랜스듀스하는 데 필요한 아데노바이러스 현탁액의 적절한 부피를 계산합니다.
- 대상 셀에 해당 양의 바이러스 현탁액을 추가합니다.
- 3일차: 바이러스 현탁액 제거 및 GFP 발현 확인
- 아데노바이러스 입자를 함유하는 세포 배양 배지를 신선한 배지로 대체한다.
- 형광 현미경에서 GFP 발현을 확인하십시오.
결과
우리는 더 빠르고 효율적인 아데노바이러스 생산을 달성하기 위해 원래 Vogelstein의 프로토콜을 수정하고 개선했습니다. 첫째, 재조합의 쉬운 선택을 달성하기 위해 방법론을 개정했습니다. 재조합 후, BJ5183 세균클은 "음의 PCR"에 의해 재조합의부재(도 3A)또는 "양양성 PCR"에 의해 GFP(도3B)에대한 당사의 사례에 동화되는 관심 유전자를 식별하는 지표로서 pAdTrack-GFP의 무결성을 평가하였다. "네거티브"와 "양수" PCR 모두에서, 우리는 pAdTrack 무결성(그림 3A,레인 1)에 대한 986 bp의 밴드와 GFP(그림 3B,레인 3)의 밴드를 준 제어 템플릿으로 pAdTrack-GFP를 사용했다. "음의 PCR"에 사용되는 프라이머는 pAdTrack-GFP에서 PmeI 사이트를 포함하는 986 bp의 조각을 증폭하도록 설계되었습니다. 이 DNA 단편은 재조합 후에 크게 확대되고 양성 재조합 클론에서 증폭되지 않습니다. pAdTrack-GFP가 그대로 유지되는 재결합을 위한 음의 클론은 도 3A,차선 3, 4 및 6로 표시됩니다. 재조합 부위에 인접한 DNA 서열에 대한 프라이머 막음. 잠재적 양성 재조합 클론(도3A,차선 2 및 5)은 도 3B,차선 1 및 2에 도시된 바와 같이 GFP를 발현하였다. 이러한 클론에서 플라스미드 DNA는 더 많은 양의 DNA를 얻기 위해 DH5α 변환을 위해 분리되고 사용되었다. DH5α에서 증폭된 이러한 미리 선택된 재조합 플라스미드는 효소 소화에 의해 시험되었다. 도 3C-E에서 힌드 III, PstI, BamHI 제한 효소(도3C, D, E 레인 2)로 소화된 하나의 재조합 양성 클론의 효소 소화 결과를 도시한다. 재조합 클론의 힌드III 및 PstI 소화 패턴은 힌드III와 PstI가 각각 24배와 25회 pAdEasy-1 플라스미드를 절단한 이후 pAdEasy-1을 위해 얻은 것과 유사하였다(그림3C및 D,레인 3); 힌드III는 한 번 절단하고 PstI는 pAdTrack-GFP 벡터의 4배를 잘라(그림 3C 및 D,레인 1). BamHI는 두 번 pAdEasy-1 벡터(그림 3C,레인 3) 및 한 번 pAdTrack-GFP(그림 3C,레인 1)를 잘라.
PacI는 재조합 플라스미드(도3F,레인 2)로부터 4.5kb의 조각을 잘라내고, pAdTrack-GFP(도3F,레인 1)로부터 2863bp의 단편을 잘라내고, pAdEasy-1벡터(도 3F,레인 3)를 선형화하였다. DNA 사다리는 차선 4에서 그림 3C-F로표시됩니다. 재조합 플라스미드는 AD293 트랜스페션에 대한 추가 사용을 위해 Pac I로 소화되었습니다.
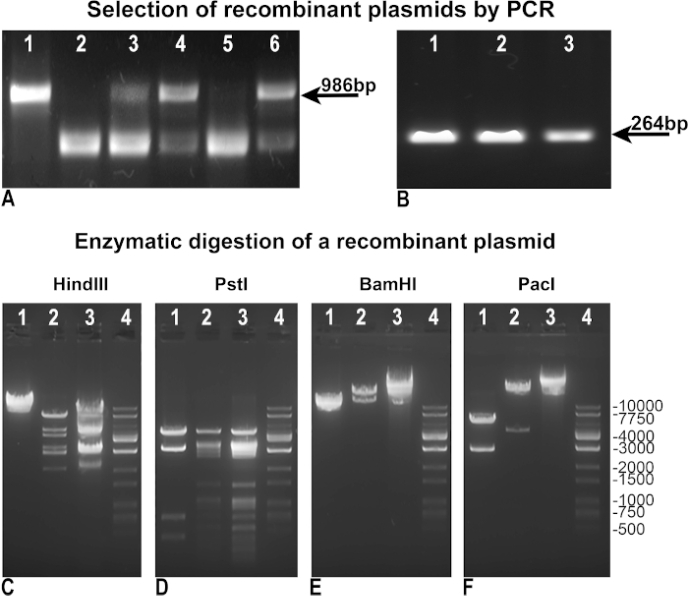
그림 3: pAdEasy-1 플라스미드와 pAdTrack-GFP의 재조합. pAdTrack-GFP 및 pAdEasy-1의 재결합 후 얻은 플라스미드는 pAdTrack-GFP 무결성(A)에 대한 "네거티브" PCR에 의해 테스트되었다. 비재조합 클론은 pAdTrack-GFP 플라스미드(A, 레인 3, 4 및 6)로부터 증폭된 서열에 대응하는 986bp 대역의 존재에 의해 입증되었다. 재조합(A, 차선 2 및 5)에 대해 잠재적으로 양성 클론도 수득하였다. pAdTrack-GFP 벡터를 템플릿으로 사용했을 때, pAdTrack-GFP(A, 레인 1)에 대해 986bp의 대역을 획득하였다. 잠재적으로 긍정적 인 재조합 클론은 "긍정적 인"PCR (B)에 의해 GFP 발현을 테스트했습니다. 264 bp의 밴드는 잠재적으로 재결합 된 클론 (B, 레인 1 및 2)뿐만 아니라 pAdTrack-GFP 플라스미드모두에 대해 나타납니다. 하나의 잠재적 재조합 클론에서 DNA는 힌드III, PstI, BamHI 및 PacI 제한 효소 (C-F, 차선 2)로 테스트되었다. 대조군에서, pAdEasy-1 벡터(C-F, 차선 3) 및 pAdTrack-GFP 플라스미드(C-F, 차선 1)는 동일한 효소로 소화되었다. DNA 사다리는 C-F 레인 4로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
아데노바이러스 포장 및 증폭은 AD293 세포에서 수행되었다. 아데노바이러스 입자(AdV-GFP)는 AD293 세포 용액뿐만 아니라 세포 배양 배지로부터 정제되었으며, 감염된 세포에 의해 방출되었다. 세포 배양 배지에서 발견되는 아데노바이러스를 농축하기 위해, 입자는 황산암모늄으로 침전된 다음 10m Tris HCl pH 8에서 2mM MgCl2로재중단되었으며, 이는 세포 용해에 사용되는 것과 동일한 완충제이다. 이어서, 세포용해및 배양배지로부터의 아데노바이러스 입자는 CsCl 불연속그라데이션 초원심분리에 의해 정제되었다. 초원심분리 후, 도 4에도시된 바와 같이 정제된 AdV-GFP의 강력한 대역을 얻었다.

도 4: 불연속 CsCl 그라데이션에 대한 초원심분리에 의한 아데노바이러스 정제. 배지로부터 침전된 세포 균질및 아데노바이러스는 저밀도 CsCl 용액에 의해 형성된 불연속그라데이션에 대한 초원심분리를 실시하였다. GFP-아데노바이러스의 강력한 밴드는 두 경우 모두 입증되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1mL(TU/mL) 당 트랜스듀싱 단위로 발현된 바이러스 성 티터를 결정하기 위해 AD293 세포는 AdV-GFP의 직렬 희석에 감염되었다. 48 시간 후에, 감염된 세포는 바이러스성 현탁액의 희석 인자와 역 상관관계에서 GFP를 발현했습니다. 이는 형광 현미경 검사법에 의해 관찰되었고 GFP 양성 세포의 백분율은 유동 세포측정법(도5)에의해 결정되었다. 티터를 계산하기 위해, GFP 양성 세포의 5-20%를 유도한 바이러스 희석을 고려하였다(도5C). 보통, 우리는 GFP-아데노바이러스에 대한~10 10 (TU/mL)의 바이러스 성 티터를 얻습니다.
아래, 우리는 300000 세포 (C)가 1mL 아데노바이러스 용액 (V)으로 변환된 특정 아데노바이러스 적혈구 계산의 예를 제공하며, 6 % GFP 양성 세포 (F)를 얻은 106 (D)의 희석 계수에서:
티터 (TU / mL) = D x F / 100 x C / V = 106 x 6/100 x 300000 /1 = 1.8 x 1010 TU / mL
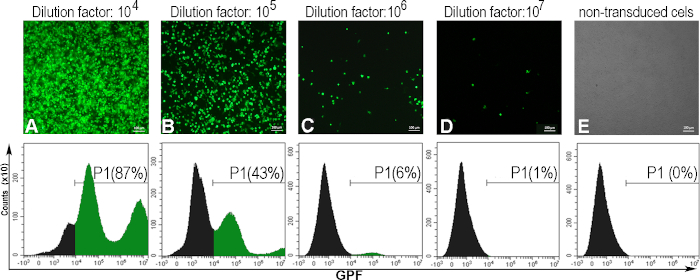
그림 5: 아데노바이러스 티터의 평가. AD293 세포는 각종 아데노바이러스 희석제에 감염되었다. 48시간 후, 세포는 형광 현미경검사에 의해 관찰되었고, 다른 아데노바이러스 희석제(A-D)에 의해 유도된 GFP 양성 세포의 비율을 결정하기 위해 혈류 세포에 의해 분석되었다. 유동 세포측정을 위한 게이트를 확립하기 위해, 비유도세포도 분석하였다(E). 희석 계수(106)를 위해계산된 티터는, 세포의 6%가 GFP 양성이었을 때 1.8 x10 10 TU/mL이었다. 패널 A-E, 바: 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
준비된 아데노바이러스의 전도 가능성을 테스트하기 위해 인간 내피 세포(EA.hy926), 소 대동맥 내피세포(BAEC), 뮤린 간세포(Hepa 1-6), 뮤린 중간기질 기질 세포(MSC)의 4개의 세포주를 사용하였다. 내피 세포 (EA.hy926 및 BAEC)는 25 TU /셀로 변환되었고, 간세포는 5 TU / 셀로 변환되었고 MSC는 250 TU /셀로 변환되었다.
여기서는 1.8 x 10 TU/mL을 이용한 아데노바이러스 현탁액을 사용하여 25TU/cell로 3 x 106 세포를 감염하는 데 필요한 아데노바이러스 현탁액의 부피가 어떻게 계산되었는지를 예로 들 수 있다.
1 셀 ........... 25 TU
3 x 106 셀 .......... x TU  x=75 x 106 TU
x=75 x 106 TU
바이러스 성 재고가 포함되어 있는 경우
1.8 x 1010 TU ........... 1 mL
75 x 106 TU .......... y mL  y = 4.2 x 10-3 mL = 바이러스 성 재고의 4.2μL
y = 4.2 x 10-3 mL = 바이러스 성 재고의 4.2μL
전염 후 48시간, 세포는 형광 현미경 검사법에 의해 분석되었다. 도 6에도시된 바와 같이, 인간 또는 소 내피 세포는 좋은 효율(~50%)으로 변형되었다. 25 TU/셀(그림6 EA.hy926 및 BAEC). 뮤린 간세포(Hepa 1-6)는 아데노바이러스 입자(5TU/cell)의 낮은 양으로 아데노바이러스에 의해 효율적으로 전이되었지만, 죽은 세포(PI 양성 세포)의 높은 비율이 기록되었기 때문에 아데노바이러스에 민감하게 반응하였다(~16%) 다른 세포 유형에 비해. 중간엽 기질 세포는 특정 아데노바이러스 수용체(미공개 데이터)의 부족으로 인해 트랜스듀스(도6)가가장 어려웠다.
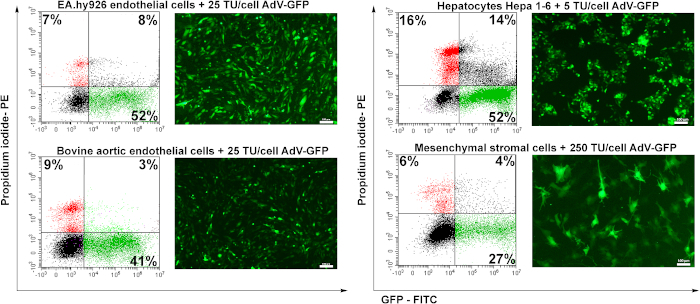
도 6: 유도된 세포에서 아데노바이러스의 감염성 및 GFP 발현의 유도. 인간 내피 세포(EA.hy926), 소 대동맥 내피 세포(BAEC), 뮤린 간세포(Hepa 1-6), 및 뮤린 중간엽 기질 세포(MSC)는 아데노바이러스의 표시량으로 전이되었다. GFP는 형광 현미경 검사법에 의해 검출되었고 GFP 양성 세포의 백분율은 혈류 세포측정에 의해 분석되었다. 유동 세포측정에 의해 결정된 PI 양성 세포는 바이러스 성 형 질과형에 의해 결정된 세포 사망률을 보여줍니다. EA.hy926 세포, 소 대동맥 내피 세포 및 Hepa 1-6 세포는 아데노바이러스에 의해 높게 변형되었고, 41내지 52%에 이르는 트랜스듀션의 수율은 높았다. MSC의 경우, 더 높은 양의 바이러스(250 TU/cells)가 유도된 세포의 27% GFP 양성만 유도하였다. 바: 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
재조합 아데노바이러스는 유전자 전달 및발현(12,13,14)을위한 다목적 도구이다. 아데노바이러스 의 전염에 의한 강력한 단백질 발현을 유도하기 위해, 관심 있는 유전자의 인코딩 서열은 아데노바이러스의 게놈에 삽입된다. 버트 보겔슈타인의 실험실에서 개발된 AdEasy 아데노바이러스 시스템은 대부분의 야생형 아데노바이러스 혈청형 5게놈을 포함하는 백본 플라스미드(pAdEasy-1)와 유전자 복제2,10을위해 설계된 셔틀 벡터(pAdTrack)를 포함한다. 아데노바이러스 유전자 E1(전염하는 바이러스 입자의 조립에 대한 책임) 및 E3(숙주 면역 회피에 관여하는 인코딩 단백질)의 삭제는 6.5-7.5 kb의 관심 유전자를삽입할수 있는 아데노바이러스 게놈의 공간을 생성하였다. 이 크기는 많은 유전자에 대 한 충분 한, 특히 짧은 introns를 가진 사람들을 위해15,16,17. 또한 연구원이 트랜스진18,19,20의cDNA를 운반하는 아데노바이러스의 생산을보고하고있다. 그러나, 우리는 유전자 또는 미니 유전자를 운반하는 그들의 대응에 대해보다는 cDNA 운반 아데노바이러스에 대한 트랜스진 발현의 낮은 수율을 얻었다 (데이터는 표시되지 않음).
이전 방법2,10,14,18,21을개선하고 적응하고, 아데노바이러스 생산을 위한 기술은 더 짧은 시간, 낮은 비용 및 적은 노력이 필요합니다. 전신 아데노바이러스 DNA는 상동성 재조합경향이 있는 대장균 균주, BJ5183에서 셔틀 벡터와 pAdEasy-1 플라스미드 사이의 재결합에 의해 얻어진다. 이 프로토콜은 AdEasy-1 세포의 화학적 변형을 암시합니다 (pAdEasy-1을 포함하는 BJ5183 박테리아). 이 기술은 일부 실험실에서 사용할 수 없는 전기포레이터를 필요로 하지 않으며, 매우 간단하며, 재조합 수율을 증가시키며, 유능한 세포를 얻고 변환을 수행하는 데 필요한 시간을 줄입니다. PCR에 의해 수행 되는 재조합 클론의 사전 선택은 더 시간을 단축 하 고 전체 절차를 완화. 비슷한 절차는 Zhao와 동료에 의해 사용되었다(22,그러나, 프로토콜에서, 우리는 프라이머의 시퀀스를 최적화.
GFP-아데노바이러스 포장 및 증폭을 위해, HEK293 유도체 세포주, 즉 배양판에 더 부착된 AD293 세포가 사용되었다. 아데노바이러스 생산에 일반적으로 사용되는 다른 세포주들은 다음과 같습니다: 911, 293FT, pTG6559 (A549 유도체), PER. C6 (그녀의 파생 상품), GH329 (헬라 유도체), N52. E6, 및 HeLa-E123,24,25,26. 우리의 손에, 아데노 바이러스 생산에 아무 개선도 911 세포가 사용 되었을 때 얻어지지 않았다 (데이터는 표시 되지 않음). K2 시약을 이용한 재조합 플라스미드를 이용한 AD293 세포의 트랜스포메이션은 바이러스 포장 단계의 효율을 크게 높였다. 아데노바이러스 생산 후, 아데노바이러스의 최대 ~70%는 여전히 세포 내부에 있으며 3개의 동결 및 해동 사이클에 의해 방출된다. 그것은 아데노 바이러스를 파괴하기 때문에 사이클의 수를 증가하는 것은 적합하지 않습니다.
일상적인 아데노바이러스 생산 공정 전반에 걸쳐, 수많은 바이러스 성 입자가 세포 배양 배지에서 방출된다. 감염된 AD293 세포의 수확 중에 이 세포 배양 배지를 폐기하면 중요한 바이러스 손실이 발생할 수 있습니다. 우리는 샤겐과 동료가 황산암모늄(27)을 침전시킴으로써 세포 배양 배지로부터 아데노바이러스 입자를정화하기 위해 기술한 프로토콜을 최적화하였다. 이러한 방법은 폴리에틸렌글리콜(28)을사용하는 방법에 비해 세포 배양 배지로부터 아데노바이러스 회수효율이 높다. 침전 된 아데노 바이러스는 초원심 분리에 의해 즉시 정제되거나 며칠 동안 냉장고에 보관해야하지만 투석 후에만 소금 과잉을 제거해야합니다. 투석없이 몇 시간 이상 침전을 유지하는 것은 바이러스에 해롭습니다.
1단에서 수행된 초원심심분리에 의한 아데노바이러스 입자의 정제는 아데노바이러스 재고의 조작을 감소시키고 연이은 초원심분리단계(14,29)를이용한 프로토콜과 비교하여 절차를 용이하게 한다. 정제 된 아데노 바이러스의 투석은 트랜스듀션에 더 영향을 미칠 수있는 염화물 세슘을 제거하는 데 필요합니다. 프로토콜에서, 우리는 MgCl을 포함하는 Tris 버퍼를 사용2 하지만 투석을 위한 자당 하지, 그것은 동결에 대 한 방부제로 그렇지 않으면 필요한 자당 한 양의 거 대 한 필요 하기 때문에. 따라서, 우리는 동결을 위해 준비 된 아데노 바이러스 주식에 직접 자당을 나중에 추가했습니다. 정제 된 아데노 바이러스의 빈번한 동결 및 해동을 피하기 위해, 아데노 바이러스 주식을 알리트및 -80 ° C에 저장하는 것이 좋습니다. 아데노바이러스 티터는 GFP 리포터 유전자와 특정 바이러스 희석을 위한 트랜스포메이션된 세포의 백분율을 고려한 유동 세포측정에 의해 평가되었다. 이 방법은 고전적인 "플라크 분석"과 비교하여 더 빠르며 아데노바이러스 입자의 감염 용량을 밝히지 않는 캡시드 단백질(ELISA 또는 유량 세포측정과 같은 다양한 방법에 의한)의 평가와 비교하여 더 신뢰합니다. 그러나, ELISA 기반 정량화, Q-PCR 또는 플라크 분석시 시판 가능한 키트를 사용하는 대체 방법은 형광 추적자를 포함하지 않는 아데노바이러스의 적정에 특히 유용하다.
pAdTrack adenoviruses는 Coxsackievirus 및 Adenovirus 수용체 (CAR)에 의해 인식되는 인간 아데노바이러스 혈청형 5에서 파생된다는 것을 고려하여, 우리는 인간 기원의 세포 (내피 세포)를 트랜스듀싱하기 위해 GFP-아데노바이러스의 용량을 입증했지만, 또한 다른 기원의 세포인 소 (endothelial cells)와 메우린세포(자궁)와 메파시 세포(암피세포). 데이터는 GFP-아데노바이러스가 트랜스진의 높은 수준의 발현을 유도할 수 있음을 보여주었다.
결론적으로, 우리는 아데노바이러스 입자를 얻는 데 필요한 시간, 비용 및 노력을 줄이기 위해 이 힘든 기술을 최적화했습니다. 준비된 아데노바이러스는 다양한 세포 유형을 감염시키고 관심 있는 유전자의 발현을 유도할 수 있다. 이러한 프로토콜은 아데노바이러스 매개 유전자 전달이 현대 유전자 치료법 개발을 위한 주요 도구 중 하나를 나타내기 때문에 다양한 실험에서 사용될 수 있다.
약어: AdV-GFP, 아데노바이러스 입자; BAEC, 소 대동맥 내피 세포; CsCl, 염화 세슘; GFP, 녹색 형광 단백질; MSC, 중간 기질 세포; TU, 변환 단위.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 사업은 2014-2020년 경쟁력 운영 프로그램(POC-A.1.1.1.1.4-E-2015)을 통해 유럽 지역 개발 기금에서 공동 자금을 조달한 프로젝트에 의해 지원되었습니다. ID: P_37_668; 약어 DIABETER), 루마니아 연구 혁신 PCCDI- UEFISCDI의 루마니아 어 부 교부, 프로젝트 번호 PN-III-P1-1.2-PCCDI-2017-0697 PNCD III 내에서 루마니아 아카데미에 의해. 저자는 Kyriakos Kypreos (파트라스 대학, 그리스) 그의 관대하고 관련 조언, 오비디우 크루토루 (미술 대학, 부쿠레슈티, 루마니아) 촬영, 영화 편집 및 그래픽 디자인, 그리고 기술 지원을위한 미하엘라 브라투에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
참고문헌
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유