Method Article
שיטה יעילה לייצור אדנווירוס
In This Article
Summary
כאן, אנו מציגים פרוטוקול לייצור אדנווירוס באמצעות מערכת pAdEasy. הטכנולוגיה כוללת שילוב מחדש של pAdTrack ו pAdEasy-1 פלסמידים, האריזה וההגברה אדנווירוס, טיהור של חלקיקים אדנו-ויראליים מן מדיום lysate ותרבות התא, titration ויראלי, ואת הבדיקה הפונקציונלית של אדנווירוס.
Abstract
טרנסדוקציה אדנו-ויראלית יש את היתרון של אינדוקציה חזקה וחולפת של הביטוי של הגן של עניין לתוך מגוון רחב של סוגי תאים ואיברים. עם זאת, טכנולוגיה אדנו-ויראלית רקומביננטית היא מייגעת, גוזלת זמן ויקרה. כאן, אנו מציגים פרוטוקול משופר באמצעות מערכת pAdEasy כדי להשיג חלקיקים אדנו-ויראליים מטוהרים שיכולים לגרום לביטוי חלבון פלואורסצנטי ירוק חזק (GFP) בתאים שעברו חילוף. היתרונות של שיטה משופרת זו הם הכנה מהירה יותר וירידה בעלות הייצור בהשוואה לשיטה המקורית שפותחה על ידי ברט פוגלשטיין. השלבים העיקריים של הטכנולוגיה adenoviral הם: (1) שילוב מחדש של pAdTrack-GFP עם pAdEasy-1 פלסמיד בחיידקים BJ5183; (2) האריזה של חלקיקי אדנו-ויראלי; (3) הגברה של אדנווירוס בתאי AD293; (4) טיהור החלקיקים האדנו-ויראליים מהליזאט של התא וממדיום התרבות; ו-(5) הטיטרציה הנגיפית והבדיקות הפונקציונליות של אדנווירוס. השיפורים בשיטה המקורית מורכבים (i) מהשילוב מחדש ב- pAdEasy-1 המכיל BJ5183 על ידי טרנספורמציה כימית של חיידקים; (ii) הבחירה של שיבוטים רקומביננטיים על ידי PCR "שלילי" ו "חיובי"; (iii) ההעתקה של תאי AD293 באמצעות מערכת transfection K2 לאריזה אדנו-ויראלית; (iv) המשקעים עם אמוניום גופרתי של החלקיקים הנגיפיים שפורסמו על ידי תאי AD293 במדיום תרבות התא; ו-(v) טיהור הנגיף על ידי צסיום כלוריד חד-שלבי לא רציף אולטרה-צנטריפוגציה. ביטוי חזק של הגן של עניין (במקרה זה, GFP) הושג בסוגים שונים של תאים transduced (כגון hepatocytes, תאי אנדותל) ממקורות שונים (אדם, שור, מורין). העברת גנים בתיווך אדנו-ויראלי מייצגת את אחד הכלים העיקריים לפיתוח טיפולים גנטיים מודרניים.
Introduction
אדנווירוסים הם וירוסים שאינם מופצים המכילים נוקלאוקפסיד וגנום DNA ליניארי דו-גדילי1,2,3. אדנווירוסים יכולים להדביק מגוון רחב של סוגי תאים וזיהום אינו תלוי בחטיבת תאים מארחים פעילים. לאחר ההדבקה, אדנווירוס מציג את הדנ"א הגנומי שלו לגרעין התא המארח, שם הוא נשאר אפיפרומוסומלי ומתמלל יחד עם הגנים של המארח. לכן, סיכון פוטנציאלי מינימלי עבור רגולציה mutagenesis הכנסה או oncogenes מושגת4,5,6. הגנום האדנו-ויראלי אינו משוכפל יחד עם הגנום המארח ולכן הגנים האדנו-ויראליים מדוללים באוכלוסיית תאים מפרידה. בין היתרונות של התמרה אדנו-ויראלית, יש: (i) רמות גבוהות של ביטוי transgene; (ii) סיכונים מופחתים הקשורים לשילוב הדנ"א הנגיפי בגנום המארח, עקב ביטוי אפיזומלי; (iii) התמרת מגוון רחב של סוגי תאים מתחלקים ולא מפרידים. רוב האדנווירוסים המשמשים במחקר ביו-רפואי אינם משכפלים, ללא אזור E17,8,9. עבור הייצור שלהם, קו תא המספק את רצף E1 (כגון HEK293) נדרש. חוץ מזה, אזור לא חיוני למחזור החיים הנגיפי (E3) נמחק כדי לאפשר החדרה של טרנסג'ין בגנום הנגיפי; אזורים אחרים (E2 ו- E4) נמחקו עוד יותר בכמה אדנווירוסים, אך במקרים אלה, ירידה בתפוקה של ייצור אדנו-ויראלי וביטוי נמוך של הטרנסג'ין דווחו7.
כאן, אנו מציגים פרוטוקול משופר לבנייה, אריזה וטיהור אדנווירוסים באמצעות מערכת AdEasy. שיפורים אלה אפשרו את האריזה של אדנווירוס בצורה מהירה וחסכונית יותר בהשוואה לשיטה המקורית שפותחה על ידי ברט פוגלשטיין2,10, בשל היתרונות הבאים: (i) שילוב מחדש ב pAdEasy-1 המכיל BJ5183 על ידי טרנספורמציה כימית של חיידקים; (ii) הבחירה של שיבוטים רקומביננטי על ידי PCR; (iii) ההעתקה של תאי AD293 באמצעות מערכת transfection K2 לאריזה אדנו-ויראלית; (iv) משקעים של חלקיקים אדנו-ויראליים מדיום תרבות לאחר אריזה והגברה ויראליות; (v) הטיהור האדנו-ויראלי באמצעות שיפוע צסיום כלוריד (CsCl) חד-שלבי.
הפרוטוקול לייצור אדנווירוס באמצעות מערכת AdEasy (איור 1) כולל את השלבים הבאים:
(1) שילוב מחדש של pAdTrack-GFP עם pAdEasy-1 בחיידק BJ5183
(2) אריזת החלקיקים האדנו-ויראליים
(3) הגברה של אדנווירוס
(4) טיהור החלקיקים האדנו-ויראליים מהליזאט של התא וממדיום התרבות
(5) טיטרציה אדנווירוס.
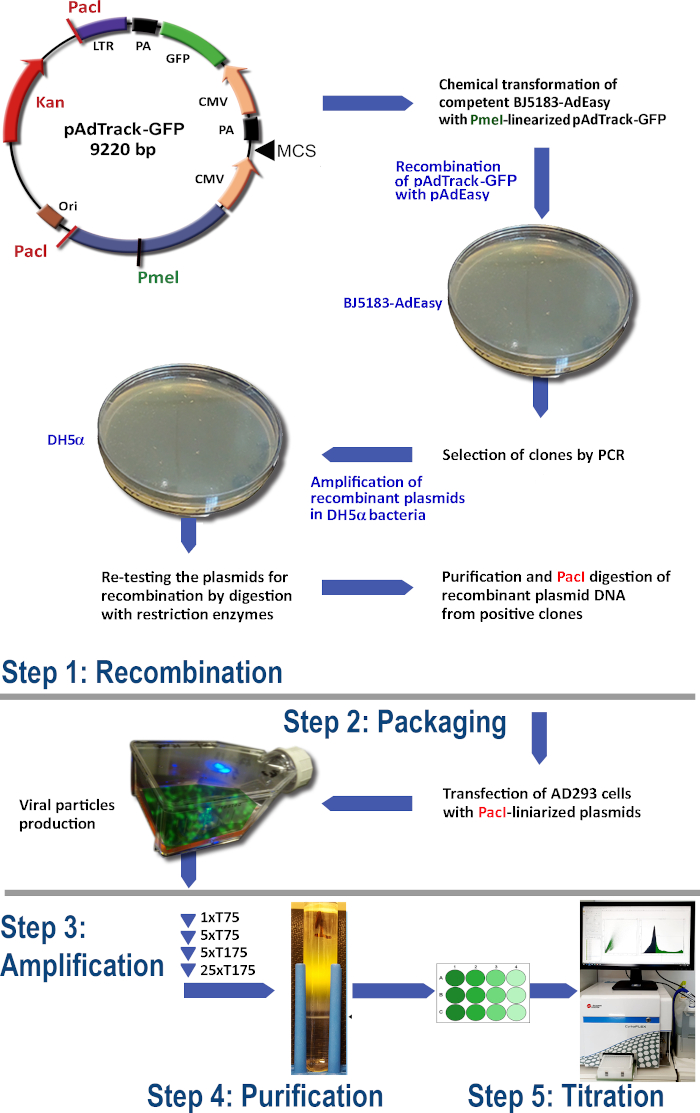
איור 1: טכנולוגיית הייצור של אדנווירוס. השלבים העיקריים של הטכנולוגיה adenoviral הם: (1) שילוב מחדש של pAdTrack-GFP עם pAdEasy-1 פלסמיד בחיידקים BJ5183. הפלסמידים המקומבינים שנבחרו מוגברים בחיידקי DH5α ולאחר מכן מטוהרים; (2) האריזה של החלקיקים אדנו-ויראלי בתאי AD293, המייצרים חלבוני אדנו-E1; (3) הגברה של אדנווירוס בתאי AD293; (4) טיהור החלקיקים האדנו-ויראליים מהליזאט של התא וממדיום התרבות על ידי אולטרה-צנטריפוגציה במעבר צבע של צפיפות CsCl; (5) הטיטרציה של אדנווירוס והבדיקות הפונקציונליות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
בפרוטוקול זה, אנו מדגים את הטכנולוגיה לייצור אדנווירוס, אשר יכול לגרום לביטוי של GFP בתאים המארחים. GFP כבר מוכנס לעמוד השדרה של וקטור המעבורת pAdTrack-CMV (Addgene #16405), תחת מקדם CMV שני ומשמש כגן כתב(איור 1). מסיבה זו, כאן ייעדנו את וקטור pAdTrack-CMV כ- pAdTrack-GFP והערכנו את הביטוי של GFP למטרות הפגנה. מלבד ביטוי GFP, המערכת יכולה לשמש כדי להגזים בגן מעניין, אשר עשוי להיות משובט באתרי שיבוט מרובים של pAdTrack-CMV. גן או מיניגן משובטים pAdTrack-CMV הוא בדרך כלל יעיל יותר עבור אינדוקציה ביטוי לעומת cDNA11. הנתונים הראו ביטוי GFP חזק בתאים transduced (כגון hepatocytes, תאי אנדותל) ממקורות שונים (אנושי, שור, מורין). העברת גנים בתיווך אדנו-ויראלי מייצגת את אחד הכלים העיקריים לפיתוח טיפולים גנטיים מודרניים.
Protocol
הערת בטיחות: באופן כללי, adenoviruses מסווגים biosafety רמה 2 אורגניזמים ולכן, כל המניפולציות חייב להיעשות בארון biosafety Class II על ידי אדם מאומן, לובש ציוד מגן biohazard (כולל כפפות, מסכת פנים עבור אירוסולים ביולוגיים, חלוק מעבדה, וכו '). כל החומרים המוצקים מזוהמים עם אדנווירוס חייב להיות מחוטא עם תמיסת אקונומיקה 10% במשך 30 דקות ו autoclaved במשך 30 דקות ב 121 מעלות צלזיוס ו 1 בר. בהתאם לגן מוכנס, אדנווירוס שנוצר עשוי להיות פוטנציאל מסוכן, עשוי להיות מסווג ברמות biosafety אחרות.
1. הכנה ניסיונית
- השתמש מכסה המנוע של תרבות התא נפרד עבור מניפולציות adenoviral, חממה נפרדת עבור כל סוג אדנווירוס. השתמש צלושי T עם כובעי מסנן עבור אריזה ויראלית הגברה; להימנע ככל האפשר ניסויים transduction בלוחות פטרי מאוורר.
- רוקן את מכסה המנוע של תרבות התא לאחר כל שימוש וחשוף אותו ל- UV במשך 15 דקות.
- אוטוקלאב מעת לעת סיוע פיפטה, פיפטות, וכלים אחרים. במידת האפשר, תרבות במעבדה נפרדת לתרבות התא / מכסה המנוע התאים לאריזה אדנו-ויראלית (תאי AD293) והתאים שישמשו בניסויי התמרה. אצוות של אדנווירוסים שונים מוגברת באותה תקופה יש לבדוק זיהום צולב על ידי PCR.
- הכן את הפתרונות הבאים.
- הכן SOB (מרק סופר אופטימלי) בינוני: 20 גרם של טריפטון, 5 גרם של תמצית שמרים, 0.5 גרם של NaCl (10 mM הריכוז הסופי), 2.5 מ"ל של 1 M KCl (2.5 מ"מ ריכוז סופי), amd H2O עד 1 L. לאחר אוטוקלאבינג ב 121 °C (70 °F), להוסיף את הפתרונות סטריליים הבאים: 5 מ"ל של 1 M MgCl2 ו 5 מ"ל של 1 M MgSO4.
- הכן SOC (מרק סופר אופטימלי עם דיכוי קטבוליט) בינוני: ב 1 L סטרילי SOB להוסיף את הפתרונות הסטריליים הבאים: 20 מ"ל של 1 M גלוקוז, 5 מ"ל של 1 M MgCl2, ו 5 מ"ל של 1 M MgSO4.
- הכן פתרון משקעים: להמיס 29.5 גרם של אצטט אשלגן ב 60 מ"ל של H2O, להוסיף 11.5 מ"ל של חומצה אצטית, ו H2O כדי 100 מ"ל.
- הכן מאגר ההשעיה: 95 מ"ל של 20% גלוקוז, 5 מ"ל של 1 M Tris-Cl pH 8, 4 מ"ל של 0.5 M EDTA pH 8, ולהוסיף H2O ל 200 מ"ל.
- הכן פתרון תמוגה: 4.8 מ"ל של 8.3 M NaOH, 10 מ"ל של 20%SDS ו- H2O עד 200 מ"ל.
2. שילוב מחדש של וקטור ויראלי pAdTrack-GFP עם pAdEasy-1 פלסמיד בחיידקי BJ5183
- ליניאריזציה של pAdTrack-GFP וטיהור של פלסמיד ליניארי.
- הכינו את תערובת העיכול הבאה על הקרח:
10 מיקרוגרם של pAdTrack-GFP
5 μL של מאגר חסר צבע 10x
2 μL של Pme I
H2O של לנפח הסופי של 50 μL. - דגירה ב 37 מעלות צלזיוס במשך 3 שעות באמבט מים.
- להשבית ב 65 מעלות צלזיוס במשך 20 דקות.
- בדוק את היעילות של העיכול של pAdTrack-GFP עם Pme I: לרוץ 1 מיקרוגרם של פלסמיד מתעכל במקביל 1 מיקרוגרם של פלסמיד מעוכל על 0.8% ג'ל agarose.
- הכינו את תערובת העיכול הבאה על הקרח:
- בידוד וטיהור דנ"א
הערה: שלבים 1-6 צריכים להתבצע במכסה המנוע אדים.- הוסף נפח שווה של פנול / כלורופורם / אלכוהול איזואמיל (25:24:1) על תערובת העיכול והפך את הצינור עד התערובת הומוגנית.
- צנטריפוגה במשך 3 דקות ב 16,200 x g, ולאחר מכן להעביר את השלב מימית העליונה לצינור איסוף.
- הוסף נפח שווה של פנול / כלורופורם / אלכוהול איזואמיל (25:24:1) על פני השלב האורגני התחתון מערבולת.
- צנטריפוגה במשך 3 דקות ב 16,200 x g, ולאחר מכן להעביר את השלב העליון לאותו צינור איסוף.
- הוסף נפח שווה של כלורופורם על השלב מימית שנקטפו בצינור האיסוף ומערבולת.
- צנטריפוגה במשך 3 דקות ב 16,200 x g, ולאחר מכן להעביר את השלב מימית העליונה צינור אוסף חדש.
- הוסף נפח 1/10 של 3 אצטט נתרן M, ו 2 כרכים של קר 100% אתנול ומערבולת.
- דגירה במשך שעה אחת ב -70 מעלות צלזיוס או לילה ב -20 מעלות צלזיוס.
- להפשיר את המדגם על קרח צנטריפוגה אותו במשך 10 דקות ב 16,200 x גרם ו 4 מעלות צלזיוס.
- הסר את supernatant ולהוסיף 750 μL של 75% אתנול.
- צנטריפוגה במשך 3 דקות ב 16,200 x גרם ו 4 מעלות צלזיוס ולהסיר את supernatant.
- בקצרה לסובב את הצינור כדי להסיר את כל supernatant ולייבש את גלולה במכסה המנוע. אין לייבש את גלולת ה-DNA במשך זמן רב כי זה מסובך להתמוסס.
- להמיס את גלולה ב 15 μL של H2O.
- למדוד את ריכוז ה-DNA באמצעות ספקטרופוטומטר (למשל, Nanodrop).
- טרנספורמציה של חיידקי AdEasier-1 עם pAdTrack-GFP
הערה: בשלב זה, שילוב מחדש של pAdTrack-GFP עם pAdEasy-1 פלסמיד מתרחש.- הכן AdEasier-1 (BJ5183-המכיל pAdEasy-1, Addgene #16399) חיידקים כימיים מוסמכים, באמצעות ערכת טרנספורמציה מסחרית, בהתאם להוראות היצרנים. שמור aliquots של 100 μL חיידקים מוסמכים ב -80 מעלות צלזיוס.
- להפשיר aliquot של חיידקים מוסמכים AdEasier-1 על הקרח ולהוסיף 1 מיקרוגרם של Pme אני מטוהרים pAdTrack-GFP. מערבבים בעדינות על ידי הבהוב הצינור (לא פיפטה התערובת). דגירה במשך 10 דקות על קרח.
- הוסף 900 μL של בינוני SOC ודגר במשך שעה אחת ב 37 מעלות צלזיוס עם רועד.
- מיקרופוגה למשך 5 דקות ב 600 x גרם.
- הסר 900 μL של supernatant, לערבב את גלולה supernatant, וזרע את החיידקים שהשתנו על צלחות LB-אגר עם קנאמיצין.
- דגירה ~ 16 שעות ב 37 °C (לא יעלה על 18 שעות).
- בחירת השיבוטים החיוביים האפשריים על ידי PCR
- מחלקים את הקיסמים לשני חצאים ומחטאים את חצי הקיסמים על ידי שיקום אוטומטי.
- לאסוף מושבות קטנות ושקוף באמצעות חצי קיסמים סטריליים.
- בקצרה, לסובב את חצי קיסם עם חיידקים ב 10 μL מים (בצינור PCR) ולאחר מכן לשים את חצי קיסם בצינור 1.5 מ"ל אפנדורף המכיל 100 μL SOC בינוני עם קנאמיצין. דגירה במשך 4-6 שעות ב 37 מעלות צלזיוס, בזמן שאתה בודק את השיבוטים על ידי PCR "שלילי" ו "חיובי".
- דגירה צינורות PCR המכילים 10 מים μL עם חיידקים במשך 5 דקות ב 95 מעלות צלזיוס כדי להשיג את המדגם חיידקי ולהפעיל במקביל "שלילי" ו "חיובי" PCR.
- PCR "שלילי" - כדי לבדוק את שלמות pAdTrack-GFP: הכן את תערובת PCR הבאה עבור PCR שלילי על קרח.
5 μL של מדגם חיידקי
0.1 μL של פריימר קדימה (4631 F: 5'-CAGTAGTCGGTGCTCGTCCAG)
0.1 μL של פריימר הפוך (5616 R: 5'-TATGGGGGCTGTAATGTTGTC)
0.1 μL של dNTP 10 מ"מ
3 μL של חיץ 5x
1.5 μL של MgCl2 25m
0.1 μL של גוטק פולימראז
H2O לנפח סופי של 15 μL
הערה: יש לכלול את הפקד החיובי שבו תבנית ה- DNA היא הווקטור pAdTrack-GFP. - PCR "חיובי" - כדי לבדוק את נוכחותו של הגן של עניין. השתמש פרייומרים ספציפיים עבור הגן מוכנס ולהכין את התערובת כמו בשלב הקודם. להלן מספר פריימנים המשמשים עבור GFP:
ו: 5'-CAAGGACGACGGACTACA
R: 5'-ATGGGGGGTTCTGCTGGGGTA - הפעל במקביל את ה- PCR "השלילי" וה- PCR "החיובי". תוכנית PCR היא: 5 דקות, 95 °C (69 °F); 40 מחזורים של השלבים הבאים: 30 שניות, 95 מעלות צלזיוס; 30 שניות, 68 °C (68 °F); דקה, 72 מעלות צלזיוס; התארכות סופית: 10 דקות, 72 מעלות צלזיוס.
הערה: להתאים את טמפרטורת חישול להגברת הגן של עניין. - להעריך את מוצרי PCR על 1% ג'ל agarose ולעשות את הבחירה של שיבוטים.
- שקול לעיבוד נוסף של השיבוטים שאינם מעניקים מוצרי PCR עבור "PCR שלילי" ואת המוצר PCR ספציפי לאחר "PCR חיובי".
- לגדל את תרביות החיידקים של שיבוטים רקומביננטיים נבחרים
- לדלל את התרבויות של שיבוטים חיוביים המשוער (הביא את הצעד 2.4.3.) ב 4 מ"ל של מדיום SOC עם kanamycin, ולהדגיר אותם לילה ב 37 מעלות צלזיוס עם רועד.
- בידוד דנ"א פלסמיד מחיידק AdEasier-1 (Miniprep באמצעות תמוגה אלקליין)
- להעביר 1.5 מ"ל של תרבות החיידקים בצינורות microcentrifuge, צנטריפוגה במשך 1 דקות ב 16,200 xg , ולהסיר את supernatant.
- להעביר עוד 1.5 מ"ל תרבות חיידקים באותו צינור, צנטריפוגה לחזור, ולהסיר את supernatant.
- הוסף 200 μL של מאגר ההשעיה (50 מ"מ גלוקוז, 10 מ"מ EDTA, 25 מ"מ Tris-HCl pH 8).
- הוסף 200 μL של פתרון תמוגה (0.2 N NaOH, 1% SDS), לערבב בעדינות על ידי היפוך הצינור.
- הוסף 200 μL של פתרון משקעים (60 מ"ל של 5 מ אשלגן אצטט, 11.5 מ"ל של חומצה אצטית קרחונית, להוסיף H2O עד 100 מ"ל), ומערבבים בעדינות על ידי היפוך הצינור.
- צנטריפוגה במשך 3 דקות ב 16,200 x g.
- מעבירים את supernatant בצינור microcentrifuge חדש, להוסיף 500 μL isopropanol, לערבב דגירה במשך 20 דקות על קרח.
- צנטריפוגה במשך 15 דקות ב 16,200 x g ולהוסיף 500 μL של 75% אתנול.
- צנטריפוגה במשך 10 דקות ב 16,200 x g ולהסיר את supernatant.
- צנטריפוגה במשך 3 דקות ב 16,200 xg , להסיר את supernatant ולהוסיף 15 μL של H2O.
- הגברה, בידוד ובדיקה חוזרת של הפלסמידים המחודשים
- טרנספורמציה של חיידקי DH5α עם DNA מבודד מתאי AdEasier-1.
- הכינו חיידקים מוסמכים DH5α באמצעות ערכת הטרנספורמציה המסחרית, בהתאם להוראות היצרנים.
- להפשיר 100 μL של חיידקים מוסמכים DH5α על קרח, להוסיף את ה-DNA רקומביננטי, ולהדגיר 10 דקות על קרח. ואז לזרוע את החיידקים על צלחות LB-אגר עם קנמיצין.
- דגירה ב 37 מעלות צלזיוס לילה.
- לאסוף כמה מושבות ולגדול כל אחד 2 מ"ל של מדיום LB עם קנמיצין, ב 37 °C (69 °F), לילה, עם רעידות.
- לבודד את ה-DNA (Miniprep באמצעות תמוגה אלקליין) ו resuspend ה-DNA המתקבל ב 25 μL H2O.
- אשר את השיבוטים החיוביים על ידי עיכול אנזימטי.
- הכינו את התערובת הבאה על הקרח:
5 μL של דנ"א רקומביננטי
1.5 μL של 10x חוצץ חסר צבע
0.5 μL של הינד III או Pst I
H2O לנפח סופי של 15 μL - דגירה ב 37 מעלות צלזיוס במשך 30 דקות.
הערה: כפקד, לעכל גם pAdTrack-GFP ו pAdEasy-1 פלסמידים. - בכל דגימה להוסיף 3 μL של מאגר טעינה Sx6 עם RNase A (אם RNase A אינו קיים במאגרי miniprep).
- הפעל את שברי ה-DNA מתעכל על 1% אלקטרופורזה ג'ל agarose.
הערה: דפוס העיכול של שיבוט חיובי כולל את רוב שברי pAdEasy פלסמיד מתעכל, חושף שילוב מחדש pAdEasy עם וקטור pAdTrack. הגן של עניין צריך להיות מעיד על ידי עיכול עם אנזימי ההגבלה המשמשים לשיבוט.
- הכינו את התערובת הבאה על הקרח:
- הכנת DNA פלסמיד (כיתה transfection) לאריזת אדנווירוס.
- לגדל 200 מ"ל תרבות של חיידקים מתוך שיבוט חיובי כדי לבודד את ה-DNA פלסמיד.
- לבודד את ה-DNA פלסמיד באמצעות ערכה מסחרית עבור midiprep DNA פלסמיד (למשל, Qiagen Plasmid Midi Kit) בעקבות הוראות היצרן.
- טרנספורמציה של חיידקי DH5α עם DNA מבודד מתאי AdEasier-1.
3. אריזת החלקיקים האדנו-ויראליים
- היום הראשון. זרע את תאי AD293
- לשטוף את התאים AD293 עם PBS ולהדגיר אותם עם 0.125% טריפסין במשך 2-5 דקות ב 37 °C (69 °F).
- לאסוף את התאים במדיום קר עם סרום.
- צנטריפוגה במשך 5 דקות ב 400 x גרם ב 4 מעלות צלזיוס.
- משענים מחדש את התאים במדיום עם סרום וזרעים את התאים בצפיפות של ~ 2 x 106/T25 בקבוק. רצוי, להשתמש בבקבוקון עם מסנן.
- היום הראשון. לעכל את הדנ"א הרקומביננטי עם פאק 1
- הכן את התערובת הבאה:
6 μL של DNA רקומביננטי (1 מיקרוגרם / μL)
2 μL של פאק I
2.5 μL של 10x חוצץ חסר צבע
H2O לנפח סופי של 25 μL - דגירה במשך 3 שעות (או לילה) ב 37 °C (67 °F), ולאחר מכן להשבית את האנזים ב 65 °C (65 °F) במשך 20 דקות.
- משקעים DNA עם אתנול: להוסיף 2.5 μL של (1/10 v / v) 3 אצטט נתרן M ו 2-3 כרכים של 100% אתנול. דגירה במשך 30 דקות ב -70 מעלות צלזיוס או לילה ב -20 מעלות צלזיוס.
- צנטריפוגה ב 16,200 x גרם במשך 30 דקות ב 4 מעלות צלזיוס ו resuspend גלולה במים סטריליים.
- הכן את התערובת הבאה:
- יום 2: החלקה של תאי AD293 באמצעות מגיב K2
- הוסף 40 μL של מכפיל K2 על התאים, שעתיים לפני transfection.
- הכן פתרונות A ו- B:
פתרון A: להוסיף 6 מיקרוגרם של Pac l-ליניארי DNA ב 260 μL של Opti-MEM.
פתרון ב': הוסף 21.6 μL של ריאגנט K2 ב 248.4 μL של Opti-MEM. - הוסף פתרון A מעל פתרון B ומערבבים בעדינות על ידי pipetting.
- דגירה את התערובת במשך 20 דקות בטמפרטורת החדר. הוסף לערבב dropwise A ו- B לתאים.
- יום 3-11: ניטור ביטוי GFP על ידי מיקרוסקופיה פלואורסצנטית
הערה: תאים צריכים להופיע ירוקים מיקרוסקופיה פלואורסצנטי צריך להתנתק בהדרגה. - יום 11: לקצור את החלקיקים אדנו-ויראלי F1
- לאסוף את התאים המנותקים ואת המדיום בצינור 50 מ"ל, לגרד את התאים חסידי, ולהוסיף אותם באותו צינור.
- צנטריפוגה במשך 5 דקות ב 400 x g, לאסוף את supernatant בצינור חדש ולהשתוב מחדש את גלולת התא ב 0.5 מ"ל של PBS.
- הפרעה לתאים
- העבר את השעיית התא בצינור מיקרוצנטריפוגה.
- בצע שלושה מחזורי הקפאה/הפשרה (להקפיא חנקן נוזלי או ב -80 מעלות צלזיוס / להפשיר ב 37 מעלות צלזיוס לכל היותר 7 דקות).
- להעביר את התאים השבורים דרך מחט מזרק 23 G שלוש פעמים.
- הסר את פסולת התא על ידי צנטריפוגה ב 9,600 x g במשך 12 דקות.
- להעביר את supernatant לצינור 50 מ"ל עם המדיום שנאסף.
4. הגברה של אדנווירוס
הערה: אם תאי AD293 לא הגיעו להתכנסות הדרושה, ניתן לאחסן את ה aliquots של המניות אדנו-ויראלי (lysate המתקבל מהתאים המייצרים וירוסים) כדי לשמש לזיהום ב -80 °C (60 °F).
- הכינו את החלקיקים האדנו-ויראליים F2.
- זרע את תאי AD293 בבקבוק T75 (5 x 106 תאים / בקבוק).
- להדביק ~ 90% תאי AD293 משולבים באמצעות חלקיקים אדנו-ויראליים F1: להוסיף את תא הומוגנט ואת המדיום מבקבוק T25 על התאים הגדלים בבקבוק T75.
- נטר את ביטוי GFP באמצעות מיקרוסקופיה פלואורסצנטית.
- לקצור את התאים המייצרים וירוסים כאשר ~ 90% של AD293 transduced מנותקים (~ היוםהחמישי לאחר התמרה). שמור על תרבות התא בינונית ב 4 מעלות צלזיוס.
- לשבש את התאים (באופן דומה עם אלה עבור F1) ב 1 מ"ל PBS.
- הכינו את החלקיקים האדנו-ויראליים F3.
- להדביק ~ 90% תאי AD293 confluent זרעים בבקבוקון T175 עם חלקיקים אדנו-ויראליים F2 ואת מדיום תרבות התא מן החלקיקים אדנו-ויראלי F2.
- לקצור את התאים (~ 5 ימים לאחר התמרה).
- לשבש את התאים (באופן דומה עם אלה עבור F1) ב 2 מ"ל של PBS.
- הכינו את החלקיקים האדנו-ויראליים F4.
- להדביק 5 צלושי T175 המכיל ~ 90% תאים AD293 confluent עם חלקיקים אדנו-ויראלי F3 ובינוני תרבות התא.
- לקצור את התאים (~ 5 ימים לאחר התמרה).
- לשבש את התאים (באופן דומה עם אלה עבור F1) ב 3 מ"ל של PBS.
- הכינו את החלקיקים האדנו-ויראליים F5.
- להדביק 25 T175 בקבוקים המכילים ~ 90% תאי AD293 confluent עם מלאי adenoviral F4 מדיום תרבות התא.
5. טיהור של אדנווירוס מן מדיום ליסטו התא ותרבות
- קצירת התאים המייצרים את הנגיף ואת מדיום התרבות.
- לקצור את התאים AD293 של F5 לאחר 5 ימים מן התמרה.
- שמור את המדיום בבקבוק סטרילי עבור משקעים של חלקיקים אדנו-ויראלי.
הערה: לשמור את המדיום במקרר עד טיהור של אדנווירוס. - צנטריפוגה התאים ב 400 x g, במשך 5 דקות, ב 4 oC.
- Resuspend גלולה הסופית ב 5 מ"ל של 10 מ"מ טריס HCl, pH 8 עם 2 mM MgCl2.
- אלקוט ההשעיה בצינורות 1.5 מ"ל.
- לשבש את התאים (באופן דומה עם אלה עבור F1): שלושה מחזורים של הקפאה / הפשרה.
הערה: אם לא ניתן לבצע את ultracentrifugation באופן מיידי, לשמור את הדגימות ב -80 מעלות צלזיוס. - להעביר את ההשעיה התא דרך מחט מזרק 23G במשך שלוש פעמים.
- צנטריפוגה הומוגנט ב 9 600 x g, במשך 12 דקות.
- שמור את supernatant עבור טיהור אדנווירוס על ידי CsCl שיפוע ultracentrifugation.
- משקעים של אדנווירוס שוחרר במדיום התרבות.
- הביאו את הבקבוק עם מדיום תרבות תאים שמור בטמפרטורת החדר.
- הוסף 121 גרם אמוניום גופרתי לכל 500 מ"ל של מדיום תרבות התא (רוויה של הפתרון צריך להיות בין 40 - 42%).
- מערבבים בזהירות עד אמוניום גופרתי מומס לחלוטין.
- דגירה למשך שעתיים וחצי לפחות בטמפרטורת החדר.
- צנטריפוגה ב 1600 x g, במשך 15 דקות, ב 22 oC ולשמור את גלולה.
- Resuspend גלולה ב 4 מ"ל של 10mM Tris HCl pH 8 עם 2mM MgCl2; השעיה זו צריכה להיות מטוהרת באופן מיידי על ידי שיפוע CsCl ultracentrifugation.
הערה: אם לא ניתן לבצע את שלב הטיהור לאחר מכן, dialyze לילה גלולה בשימוש חוזר נגד 10mM Tris HCl, pH 8 עם 2mM MgCl2.
- טיהור אדנווירוס על ידי אולטרה צנטריפוגה.
- הכינו שיפוע CsCl לא רציף בצינורות פוליפרופילן לרוטור SW41Ti. הוסף 3 מ"ל של 765 מ"ג / מ"ל CSCl (צפיפות גבוהה: 1.4 גרם / ליטר) בתחתית הצינור. יש להוסיף באיטיות 3 מ"ל של 288.5 מ"ג/מ"ל CsCl (צפיפות נמוכה: 1.2 גרם/ל') מעל שכבת CsCl הראשונה.
- כיסוי עדין 3 - 4 מ"ל של השעיית חלקיקים אדנו-ויראלית ששוחררו מהתאים או זירזו את מדיום תרבות התא (כמתואר קודם) על גבי השיפוע.
- ממלאים את הצינורות בשמן מינרלי, ומכניסים את הצינורות לדליי SW41Ti הקרים.
- השווה את הצינורות. ודא כי צינורות פוליפרופילן מלאים נטענים באופן סימטרי לתוך הרוטור. שים את הרוטור באולטרה-סנטריפוגה.
- צנטריפוגה ב 210,000 x גרם ו 4 מעלות צלזיוס, במשך 18 שעות, ללא בלם.
- מניחים את צינורות ultracentrifuge על דוכן עם נייר שחור מאחורי כדי לקבל את הרצועות.
- השלך את השלב העליון ברור, פסולת התא, ואת הרצועה העליונה במיכל פסולת עם פתרון הלבנה.
- לקצור את הרצועה הנמוכה ביותר המכילה adenovirus המלא (~ 700 μL - 1 מ"ל) בצינור סטרילי 1.5 מ"ל ולשמור אותו על קרח.
- רטוב מראש קלטת דיאליזה במאגר דיאליזה (10 mM Tris-Cl חיץ pH 8, 2 mM MgCl2).
- להזריק אדנווירוס מטוהר לתוך קלטת דיאליזה באמצעות מזרק 2 מ"ל.
- Dialyze לילה נגד 10 mM Tris-Cl מאגר pH 8, 2 mM MgCl2 (לשנות את מאגר הדיאליזה 3 - 4 פעמים).
- לקצור את המלאי אדנו-ויראלי מתוך קלטת דיאליזה ב aliquots של 10 - 100 μL.
- מוסיפים סוכרוז לריכוז סופי של 4% לאליקוטים ויראליים (להקפאה).
- לאחסן aliquots ב -80 מעלות צלזיוס.
6. טיטרציה אדנווירוס
- יום 1: ציפוי התאים
- זרעו את תאי AD293 בצפיפות של 2.5 ×10 5 תאים לבאר (בצלחת תרבות של 12 בארות) באמצעי צמיחה מלא של 1 מ"ל, כפי שמוצג באיור 2. ודא כי התאים מפוזרים באופן שווה בכל באר לקביעת טיטר מדויקת.
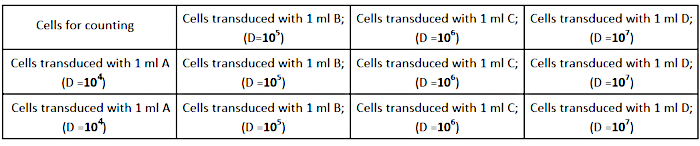
איור 2: עיצוב לוחית טייטרציה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- יום 2: התמתנות של תאים
- נתק את התאים מבאר אחת עם טריפסין וספור אותם. שים לב למספר זה מכיוון שהוא ישמש לחישוב הטיטר הנגיפי.
- בצע דילול סדרתי (1/104; 1/105; 1/106; 1/107) של המניה ויראלי ב 1 מ"ל של מדיום צמיחה מלאה כדלקמן:
- 1/103: דילול מלאי הנגיף - להוסיף 2 μL של מלאי ויראלי 1998 μL של מדיום מלא.
- 1/104: הפוך 1:10 דילול של 1/103 על ידי דילול 120 μL ל 1080 μL של מדיום מלא (A).
- 1/105: הפוך 1:10 דילול של B על ידי דילול 120 μL של A עד 1080 μL של מדיום מלא (B).
- 1/106: הפוך 1:10 דילול של C על ידי דילול 120 μL של B ל 1080 μL של מדיום מלא (C).
- 1/107: הפוך 1:10 דילול של D על ידי דילול 120 μL של C כדי 1080 μL של מדיום מלא (D).
הערה: הכן 3 צינורות של כל דילול (A, B, C, D) כדי לבצע את הניסוי בטריפליסטים. - הסירו את מדיום תרבות התאים מהבארות והוסיפו את הדילול המוכן של הנגיף, כפי שמוצג באיור 2.
- יום 3: ניטור ביטוי GFP
- בדוק את הבארות לנוכחות של תאים ירוקים באמצעות מיקרוסקופ פלואורסצנטי.
- יום 4: ניתוח ציטומטריה זרימה של תאים חיוביים GFP
- הכינו ותייגו 12 צינורות 1.5 מ"ל.
- לאסוף את המדיום תרבות התא (יחד עם התאים המנותקים) בצינורות 1.5 מ"ל ולשמור אותם על הקרח.
- הוסף 200 μL של טריפסין בכל באר.
- דגירה את הצלחת במשך 2 - 3 דקות ב 37 מעלות צלזיוס באינקובטור CO2.
- לקצור את התאים באותם צינורות Eppendorf עם מדיום תרבות התא. תשאיר את הצינורות על הקרח.
- גלולה התאים ב 400 x g, במשך 5 דקות, ב 4 מעלות צלזיוס.
- הסר את העל-טבעי; לשמור את הצינורות על קרח.
- Resuspend גלולה ב 250 μL של PBS + 2% FBS; לשמור את הצינורות על קרח.
- להעביר את המתלה התא בצינורות cytometry זרימה או צלחת.
- הפעל את הדגימות על סיטרומטר זרימה המתעד את הפלואורסצנטיות של תאי ההבעה של GFP.
חישוב טיטר: יש לקחת בחשבון את הדגימות עם 5 - 20% תאים חיוביים של GFP מאוכלוסיית האב לחישוב של titer ויראלי באמצעות הנוסחה הבאה:
טיטר (TU/mL) = D x F/100 x C/V
D = גורם דילול
F = אחוז מהתאים החיוביים / 100
C = מספר תאים / באר
V = נפח של אינקולום ויראלי
7. התמרה אדנו-ויראלית של תאי יעד ובדיקה של ביטוי החלבון המושרה
- יום 1: זריעת התאים
- זרעו את תאי המטרה ומבטיחים שהם יתפשטו באופן שווה בבארות.
- יום 2: התמתנות של התאים
- נתק את תאי המטרה מבאר אחת וספור אותם.
- לחשב את הנפח המתאים של השעיה adenoviral הנדרש כדי לתמר את התאים עם המספר הרצוי של חלקיקים זיהומיות לכל תא.
- הוסף את הכמות המתאימה של השעיה ויראלית לתאי היעד.
- יום 3: הסרת ההשעיה הנגיפית ובדיקת ביטוי GFP
- החלף את מדיום תרבית התא המכיל חלקיקים אדנו-ויראליים במדיום טרי.
- בדוק את ביטוי GFP במיקרוסקופ הפלואורסצנטי.
תוצאות
שינינו ושיפרנו את הפרוטוקול המקורי של פוגלשטיין על מנת להשיג ייצור אדנווירוס מהיר ויעיל יותר. ראשית, שינינו את המתודולוגיה כדי להשיג מבחר קל יותר של רקומביננטים. לאחר שילוב מחדש, שיבוטי החיידקים BJ5183 נבדקו על ידי "PCR שלילי" כדי להעריך את שלמות pAdTrack-GFP כאינדיקטור לחוסר שילוב מחדש (איור 3A), או על ידי "PCR חיובי" כדי לזהות את גן העניין, מוטמע במקרה שלנו ל- GFP (איור 3B). הן ב- PCRs "שליליים" והן ב- PCRs "חיוביים", השתמשנו ב- pAdTrack-GFP כתבנית בקרה, שנתנה רצועה של 986 bp עבור שלמות pAdTrack (איור 3A, נתיב 1), ולהקה של 264 bp עבור GFP (איור 3B, נתיב 3). פריימרים המשמשים "PCR שלילי" נועדו להגביר קטע של 986 bp המכיל את אתר PmeI ב pAdTrack-GFP. שבר DNA זה מוגדל באופן דרסטי לאחר רקומבינציה ואינו מוגבר בשיבוטים רקומביננטיים חיוביים. שיבוטים שליליים לשילוב מחדש, שבהם pAdTrack-GFP נשאר שלם, מיוצגים באיור 3A, נתיבים 3, 4 ו-6. פריימרי anneal על רצפי ה-DNA הסמוכים לאתר רקומביניזציה. שיבוטים רקומביננטיים חיוביים פוטנציאליים(איור 3A, נתיבים 2 ו-5) הביעו GFP כפי שמוצג באיור 3B, נתיב 1 ו-2. DNA פלסמיד מן השיבוטים האלה היה מבודד ושימש עבור טרנספורמציה DH5α כדי לקבל כמות גבוהה יותר של DNA. פלסמידים רקומביננטיים אלה שנבחרו מראש מוגברת ב- DH5α נבדקו לאחר מכן על ידי עיכול אנזימטי. באיור 3C-E מודגמים תוצאות העיכול האנזימטי של שיבוט אחד חיובי רקומביננטי מתעכל עם Hind III, PstI, אנזימי הגבלה BamHI(איור 3C, D, E נתיב 2). דפוסי העיכול ההינדית וה-PstI של השיבוט הרקומביננטי היו דומים לאלה שהושגו עבור pAdEasy-1 מאז HindIII ו- PstI חתכו את הפלסמיד pAdEasy-1 24 ו-25 פעמים, בהתאמה,(איור 3C ו- D, נתיב 3); הינדיל חותכים פעם אחת ו-PstI חותכים פי ארבעה מהווקטור pAdTrack-GFP(איור 3C ו-D, נתיב 1). BamHI חתך פעמיים את הווקטור PAdEasy-1(איור 3C, נתיב 3) ופעם pAdTrack-GFP(איור 3C, נתיב 1).
PacI חתך קטע של 4.5 קילו-בייט מהפלסמיד הרקומביננטי(איור 3F, נתיב 2), שבר של 2863 bp מ- pAdTrack-GFP(איור 3F, נתיב 1) ו- vector pAdEasy-1(איור 3F, נתיב 3). סולם הדנ"א מיוצג באיור 3C-F, בנתיבים 4. פלסמיד רקומביננטי היה מתעכל עם Pac I לשימוש נוסף עבור TRANSFection AD293.
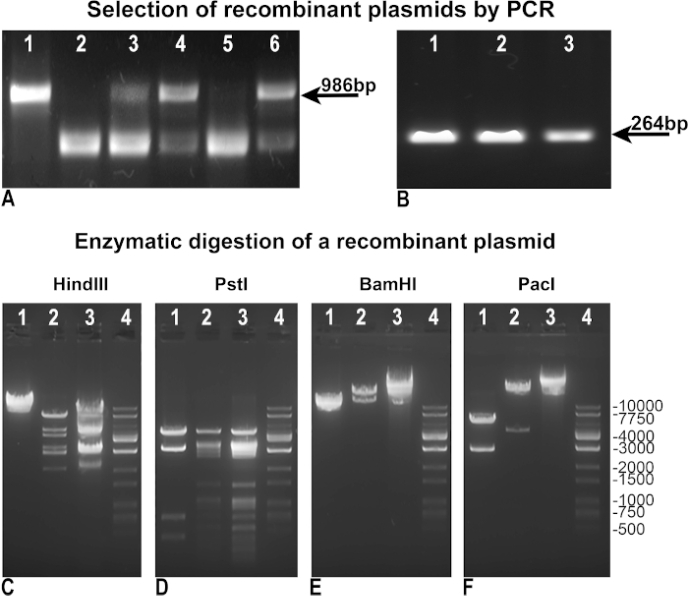
איור 3: שילוב מחדש של pAdTrack-GFP עם הפלסמיד pAdEasy-1. הפלסמידים שהושגו לאחר שילוב מחדש של pAdTrack-GFP ו pAdEasy-1 נבדקו על ידי PCR "שלילי" עבור שלמות pAdTrack-GFP (A). השיבוטים שאינם רקומביננטיים הוכחו על ידי נוכחות של רצועת 986 bp המתאימה לרצף המוגבר מהפלסמיד pAdTrack-GFP (A, נתיבים 3, 4 ו - 6). השיבוטים שעשויים להיות חיוביים לשילוב מחדש (A, נתיבים 2 ו -5) התקבלו גם כן. כאשר וקטור pAdTrack-GFP שימש כתבנית, הושגה רצועה של 986 bp עבור pAdTrack-GFP (A, נתיב 1). שיבוטים רקומביננטיים חיוביים פוטנציאליים נבדקו עבור ביטוי GFP על ידי PCR "חיובי" (B); להקה של 264 bp מופיעה הן עבור שיבוטים שעשויים להיות משולבים מחדש (B, נתיב 1 ו- 2), כמו גם עבור פלסמיד pAdTrack-GFP. הדנ"א של שיבוט רקומביננטי פוטנציאלי אחד נבדק עם הינדיל, PstI, BamHI, ואנזים הגבלת PacI (C-F, נתיבים 2). בפקדים, הווקטור pAdEasy-1 (C-F, נתיבים 3) ופלסמיד pAdTrack-GFP (C-F, נתיבים 1) התעכלו עם אותם אנזימים. סולם הדנ"א מיוצג בנתיב סי-אף 4. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
האריזה וההגברה האדנו-ויראלית בוצעו בתאי AD293. החלקיקים האדנו-ויראליים (AdV-GFP) טוהרו מן lysate התא AD293, כמו גם מן המדיום תרבות התא, שם הם שוחררו על ידי התאים הנגועים. כדי לרכז את אדנווירוס נמצא במדיום תרבות התא, החלקיקים היו זירז עם אמוניום גופרתי ולאחר מכן resuspended ב 10 mM Tris HCl pH 8 עם 2 mM MgCl2, אותו חיץ כמו זה המשמש תמוגה התא. לאחר מכן, החלקיקים האדנו-ויראליים מהליזאט של התא וממדיום התרבות טוהרו על ידי אולטרה-צנטריפוגציה לא רציפה של CsCl. לאחר התרכזות, הושגה רצועה חזקה של AdV-GFP מטוהרת, כפי שמוצג באיור 4.

איור 4: הטיהור האדנו-ויראלי על-ידי אולטרה-צנטריפוגה במעבר צבע לא רציף של CsCl. הומוגנט התא ואת אדנווירוס זירז מן המדיום היו נתונים ultracentrifugation על שיפוע רציפה שנוצר על ידי פתרונות CsCl בצפיפות נמוכה וגבוהה. להקות חזקות של GFP- אדנווירוס הוכחו בשני המקרים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
כדי לקבוע את titer ויראלי לידי ביטוי יחידות מתמר לכל mL אחד (TU / mL), התאים AD293 היו נגועים בדילול סדרתי של AdV-GFP. לאחר 48 שעות, התאים הנגועים הביעו GFP, בקורלציה הפוכה עם גורם הדילול של ההשעיה הנגיפית. זה נצפתה על ידי מיקרוסקופיה פלואורסצנטית ואחוז התאים החיוביים של GFP נקבע על ידי ציטומטריית זרימה(איור 5). כדי לחשב את הטיטר, נחשב הדילול הנגיפי שגרם ל-5 - 20% מהתאים החיוביים של GFP (איור 5C). בדרך כלל, אנו מקבלים טיטר ויראלי של ~ 1010 (TU / mL) עבור GFP-אדנווירוס.
להלן, אנו מספקים דוגמה לחישוב טיטר אדנו-ויראלי עבור אצווה אדנו-ויראלית ספציפית שבה 300000 תאים (C) הועברו עם פתרון אדנו-ויראלי 1 מ"ל (V), בגורם דילול של 106 (D), שעבורו התקבלו 6% תאים חיוביים ל- GFP (F):
טיטר (TU/mL) = D x F/100 x C/V = 106 x 6/100 x 300000/1 = 1.8 x 1010 TU/mL
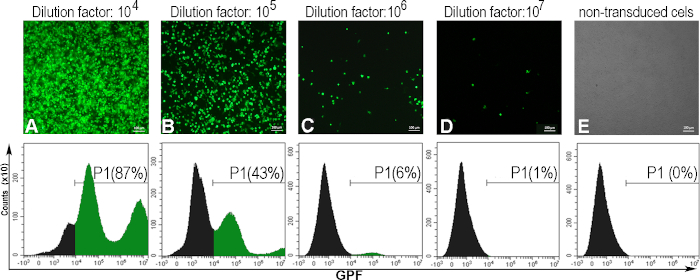
איור 5: הערכת הטיטר האדנו-ויראלי. תאי AD293 היו נגועים בדילול אדנו-ויראלי שונים. ארבעים ושמונה שעות מאוחר יותר, התאים נצפו על ידי מיקרוסקופיה פלואורסצנטית ונותחו על ידי cytometry זרימה כדי לקבוע את אחוז התאים החיוביים GFP המושרה על ידי דילול אדנו-ויראלי שונה (A-D). כדי להקים את השער עבור cytometry זרימה, תאים שאינם transduced נותחו גם (E). Titer מחושב עבור גורם הדילול 106, כאשר 6% מהתאים היו חיוביים GFP היה 1.8 x 1010 TU / mL. עבור לוחות A-E, עמודות: 100μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
כדי לבדוק את פוטנציאל התמרה של אדנווירוס מוכן, ארבעה קווי תאים שימשו: תאי אנדותל אנושיים (EA.hy926), תאי אנדותל שלאבי העורקים (BAEC), hepatocytes מורין (Hepa 1-6), ותאי סטרומה mesenchymal מורין (MSC). תאי אנדותל (EA.hy926 ו BAEC) היו transduced עם 25 TU / תא, hepatocytes היו transduced עם 5 TU / תא MSC היו transduced עם 250 TU / תא.
הנה דוגמה כיצד נפח ההשעיה אדנו-ויראלי צריך להדביק 3 x 106 תאים עם 25 TU / תא, באמצעות השעיה אדנו-ויראלי עם 1.8 x 1010 TU / mL, חושב.
לתא אחד .............. 25 TU
3 x 106 תאים .............. x TU  x =75 x 106 TU
x =75 x 106 TU
אם המניה הנגיפית מכילה
1.8 x 1010 TU .............. 1 מ"ל
75 x 106 TU .............. y mL  y = 4.2 x 10-3 מ"ל = 4.2μL של מלאי ויראלי
y = 4.2 x 10-3 מ"ל = 4.2μL של מלאי ויראלי
ארבעים ושמונה שעות לאחר ההשתנות, התאים נותחו על ידי מיקרוסקופ פלואורסצנטי. כפי שמוצג באיור 6, תאי אנדותל אנושיים או שור הועברו ביעילות טובה (~ 50%) עבור 25 TU/תא(איור 6 EA.hy926 ו-BAEC). Hepatocytes מורין (Hepa 1-6) הועברו ביעילות על ידי אדנווירוס בכמות נמוכה של חלקיקי אדנווירוס (5 TU / תא), אבל הם גם רגישים אדנווירוס מאז אחוז גבוה יותר של תאים מתים (תאים חיוביים PI) נרשם (~ 16%) בהשוואה לסוגי התאים האחרים. תאים סטרומה Mesenchymal היו הקשים ביותר לתמר (איור 6), בשל היעדר קולטנים אדנו-ויראליים ספציפיים (נתונים שלא פורסמו).
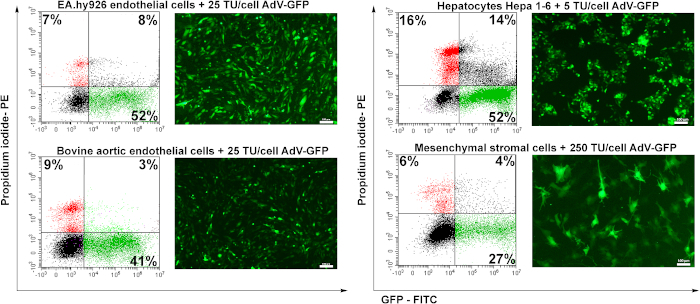
איור 6: ההדבקה של אדנווירוס והאינקדוקציה של ביטוי GFP בתאים שעברו עירוי. תאי אנדותל אנושיים (EA.hy926), תאי אנדותל שלאבי העורקים (BAEC), הפטוציטים מורין (Hepa 1-6) ותאי סטרומה מסנצ'ימליים מורין (MSC) הועברו עם הכמות המצוינת של אדנווירוס. GFP זוהה על ידי מיקרוסקופיה פלואורסצנטית ואחוז התאים החיוביים של GFP נותח על ידי ציטומטריית זרימה. תאים חיוביים PI שנקבעו על ידי cytometry זרימה להראות את תמותת התא נקבע על ידי התמרות נגיפית. תאי EA.hy926, תאי אנדותל שלאבי העורקים, ותאי Hepa 1-6 הועברו מאוד על ידי אדנווירוס, התשואה של התמרה הנעה בין 41 - 52%. עבור MSC, כמות גבוהה יותר של וירוס (250 TU /תאים) המושרה רק 27% GFP חיובי של התאים transduced. עמודות: 100μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
Discussion
אדנווירוסים רקומביננטיים הם כלי רב-תכליתי להעברת גנים וביטוי12,13,14. כדי לגרום לביטוי חלבון חזק על ידי התמרה אדנו-ויראלית, רצף הקידוד של גן העניין מוכנס לגנום של אדנווירוס. המערכת האדנו-ויראלית AdEasy, שפותחה במעבדתו של ברט פוגלשטיין, כוללת פלסמיד עמוד שדרה (pAdEasy-1) המכיל את רוב הגנום אדנווירוס מסוג פראי 5, וקטור מעבורת (pAdTrack), המיועד לשיבוטגנים 2,10. מחיקת הגנים האדנו-ויראליים E1 (האחראים להרכבת חלקיקי וירוסים זיהומיים) ו- E3 (קידוד חלבונים המעורבים בהתחמקות מחסינות מארח) יצרו מרחב בגנום האדנו-ויראלי, שבו ניתן להכניס גן מעניין של 6.5-7.5 ק"ג2,3. גודל זה מספיק עבור גנים רבים, במיוחד עבור אלה עם מבוא קצר יותר15,16,17. ישנם גם חוקרים המדווחים על ייצור אדנווירוסים הנושאים את ה- cDNA של טרנסג'ין18,19,20. עם זאת, השגנו תשואה נמוכה יותר של ביטוי transgene עבור אדנווירוסים נושאי cDNA מאשר עבור עמיתיהם הנושאים גן או מיני גן (נתונים לא מוצגים).
שיפור והתאמת השיטות הקודמות2,10,14,18,21, הטכנולוגיה לייצור אדנו-ויראלי דורשת זמן קצר יותר, עלות נמוכה יותר ופחות מאמץ. ה- DNA אדנו-ויראלי באורך מלא מתקבל על ידי שילוב מחדש בין וקטור המעבורת לבין pAdEasy-1 plasmid ב זן recombination הומולוגי נוטה E. coli, BJ5183. הפרוטוקול מרמז על הטרנספורמציה הכימית של תאי AdEasier-1 (חיידקי BJ5183 המכילים pAdEasy-1). טכניקה זו אינה דורשת electroporator כי לא יכול להיות זמין במעבדות מסוימות, הוא פשוט מאוד, מגביר את התשואה רקומביניזציה, ומפחית את הזמן הדרוש כדי להשיג תאים מוסמכים ולבצע את השינוי. בחירתם המוקדמת של שיבוטים רקומביננטיים המבוצעים על ידי PCR מקצרת עוד יותר את הזמן ומקלה על ההליך כולו. הליך דומה שימש את זאו ועמיתים לעבודה22, עם זאת, בפרוטוקול, אנחנו אופטימיזציה הרצפים של פרייומרים.
עבור האריזה וההגברה של GFP-adenovirus, נעשה שימוש בקו תאים נגזר HEK293, כלומר תאי AD293, אשר חסידים יותר לצלחת התרבות. קווי תאים אחרים המשמשים בדרך כלל לייצור אדנו-ויראלי הם כדלקמן: 911, 293FT, pTG6559 (נגזרת A549), PER. C6 (נגזרת שלה), GH329 (נגזרת HeLa), N52. ה6, והלה-E123,24,25,26. בידינו, לא הושג שיפור בייצור אדנו-ויראלי כאשר נעשה שימוש בתאי 911 (נתונים שלא הוצגו). transfection של תאי AD293 עם פלסמיד רקומביננטי באמצעות מגיב K2 מאוד הגדיל את היעילות של שלב האריזה ויראלי. לאחר ייצור אדנווירוס, עד ~ 70% של אדנווירוס הוא עדיין בתוך התאים והוא שוחרר על ידי שלושה מחזורי הקפאה והפשרה. הגדלת מספר המחזורים אינה מתאימה כי זה הורס את אדנווירוס.
לאורך כל תהליך הייצור השגרתי אדנו-ויראלי, חלקיקים נגיפיים רבים משתחררים במדיום תרבות התא. השלכת מדיום תרבות התא הזה במהלך הקציר של התאים הנגועים AD293 יגרום לאובדן ויראלי חשוב. אופטימיזציה הפרוטוקול המתואר על ידי שיגן ועמיתים לעבודה כדי לטהר את החלקיקים אדנו-ויראלי מן המדיום תרבות התא על ידי משקעים עם אמוניום גופרתי27. שיטה זו יש יעילות גבוהה יותר התאוששות אדנווירוס מן המדיום תרבות התא לעומת השיטה באמצעות פוליאתילן גליקול28. אדנווירוס מזרז צריך להיות מטוהר מיד על ידי ultracentrifugation או לשמור במקרר במשך כמה ימים, אבל רק לאחר דיאליזה, כדי להסיר את עודף מלח. שמירה על משקעים יותר מכמה שעות ללא דיאליזה מזיקה לנגיף.
טיהור החלקיקים האדנו-ויראליים על ידי אולטרה-צנטריפוגציה המבוצעת בצעד אחד מפחית את המניפולציה של המלאי האדנו-ויראלי ומקל על ההליך בהשוואה לפרוטוקולים באמצעות אולטרה-צנטריפוגציה רצופים שלבים14,29. דיאליזה של אדנווירוס מטוהר יש צורך להסיר צסיום כלורי שעלול להשפיע עוד יותר על התמרה. בפרוטוקול, השתמשנו במאגר Tris המכיל MgCl2 אך לא סוכרוז לדיאליזה, שכן הוא דורש כמות עצומה ולא מוצדקת של סוכרוז הדרושה אחרת כחומר משמר להקפאה. לכן, הוספנו סוכרוז מאוחר יותר, ישירות לתוך המניות אדנווירי מוכן להקפאה. כדי למנוע הקפאה תכופה והפשרה של אדנווירוס מטוהרים, מומלץ aliquot את המניות adenoviral ולאחסן אותם ב -80 מעלות צלזיוס. טיטר אדנו-ויראלי הוערך על ידי cytometry זרימה בהתחשב בגן כתב GFP ואת אחוז התאים transduced עבור דילול ויראלי ספציפי. שיטה זו מהירה יותר בהשוואה ל"פלאק אסאי" הקלאסי והיא אמינה יותר בהשוואה להערכת החלבונים הקפסידים (בשיטות שונות כגון ELISA או cytometry זרימה) שאינה חושפת את יכולת ההדבקה של החלקיקים האדנו-ויראליים. עם זאת, כימות מבוסס ELISA, Q-PCR, או פלאק assay באמצעות ערכות זמינות מסחרית הן שיטות חלופיות, שימושי במיוחד עבור titration של אדנווירוסים אשר אינם מכילים מעקב פלואורסצנטי.
בהתחשב בכך אדנווירוסים pAdTrack נגזרים adenoviruses אנושי serotype 5 אשר מוכר על ידי קולטני Coxsackievirus ו אדנווירוס (CAR), הדגמנו את היכולת של GFP-עדן וירוס כדי לתמר תאים ממוצא אנושי (תאי אנדותל), אלא גם תאים ממוצאים אחרים: שור (תאי אנדותל) ו murine (תאים סטרומה mesenchymal ו hepatocytes). הנתונים הראו כי GFP-אדנווירוס יכול לגרום לרמה גבוהה של ביטוי של טרנסג'ין.
לסיכום, אופטימיזציה זו טכנולוגיה מייגעת כדי להפחית את הזמן, את העלויות, ואת המאמץ הדרוש כדי להשיג את החלקיקים adenoviral. אדנווירוס מוכן הוא מסוגל להדביק סוגי תאים שונים כדי לגרום לביטוי של הגן של עניין. פרוטוקול זה עשוי לשמש במגוון ניסויים מאז העברת גנים בתיווך אדנו-ויראלי מייצג את אחד הכלים העיקריים לפיתוח טיפולים גנטיים מודרניים.
קיצורים: AdV-GFP, חלקיקים אדנו-ויראליים; BAEC, תאי אנדותל שלאבי העורקים; CsCl, צסיום כלוריד; GFP, חלבון פלואורסצנטי ירוק; MSC, תאים סטרומה mesenchymal; TU, יחידות מתמרות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי פרויקט במימון משותף של הקרן האירופית לפיתוח אזורי באמצעות התוכנית התפעולית התחרותית 2014-2020 (POC-A.1-A.1.1.4-E-2015, מזהה: P_37_668; ראשי תיבות DIABETER), מענק של משרד המחקר והחדשנות הרומני PCCDI- UEFISCDI, פרויקט מספר PN-III-P1-1.2-PCCDI-2017-0697 בתוך PNCD III ועל ידי האקדמיה הרומנית. המחברים מודים לקיריאקוס קיפריוס (אוניברסיטת פטרס, יוון) על עצתו הנדיבה וה הרלוונטית, אובידיו קרויטורו (האוניברסיטה לאמנויות יפות, בוקרשט, רומניה) על הצילומים, עריכת הסרטים והעיצוב הגרפי, ומיכאלה ברטו על סיוע טכני.
Materials
| Name | Company | Catalog Number | Comments |
| AD293 cells | Agilent Technologies | 240085 | |
| AdEasier-1 cells | Addgene | 16399 | |
| Agarose I (for electrophoresis) | Thermo Scientific | 17850 | |
| Ammonium sulfate | Sigma | A4418 | |
| Ampicillin sodium salt | Sigma | A0166 | |
| BamH I | Thermo Scientific | FD0054 | |
| Cell culture plates 100 mm | Eppendorf | 30702115 | |
| Cesium chloride | Sigma | L4036 | |
| DH5alpha bacteria | Thermo Scientific | 18265017 | |
| DMEM (GlutaMAX, 4.5g/L D-Glucose) | Gibco | 3240-027 | |
| EA.hy926 cells | ATCC | CRL-2922 | |
| EDTA | Sigma | E5134 | |
| Ethanol (99.8%) | Roth | 5054.2 | |
| Fetal Bovine Serum | Sigma | F7524 | |
| Flasks T25, T75, T175 | Eppendorf | 30712129 | |
| Glucose | Sigma | G7021 | |
| Hepa 1-6 murine hepatocytes | ATCC | CRL-1830 | |
| Hind III | Thermo Scientific | FD0504 | |
| Kanamycin Sulfate | Thermo Scientific | 15160054 | |
| K2 Transfection System | Biontex | T060-5.0 | |
| LB medium | Formedium | LBx0102 | |
| LB-agar | Formedium | LBx0202 | |
| Mix & Go E. coli Transformation kit | Zymo Research | T3001 | |
| Midori Green Advanced DNA stain | Nippon Genetics Europe | MG-04 | |
| NaOH | Sigma | S8045 | |
| Opti-MEM | Thermo Scientific | 31985070 | |
| Pac I | Thermo Scientific | FD2204 | |
| pAdEasy-1 | Addgene | 16400 | |
| pAdTrack-CMV | Addgene | 16405 | |
| Phenol:chloroform:isoamyl alcohol (24:24:1) | Invitrogen | 15593-031 | |
| Polymerase GoTaq | Promega | M3005 | |
| Pme I (Mss I) | Thermo Scientific | FD1344 | |
| Potassium acetate | VWR Chemicals | 43065P | |
| Pst I | Thermo Scientific | FD0614 | |
| Qiagen Midi Prep kit | Qiagen | 12125 | |
| Cell Scraper | TPP | 99003 | |
| SDS | Thermo Scientific | 28365 | |
| Slide-A-Lyzer dialysis cassettes | Thermo Scientific | 66330 | |
| Sodium pyruvate | SIGMA | P5280-100G | |
| Syringe with 23G neeedle | B Braun | 464BR | |
| Tris HCl | Sigma | 1185-53-1 | |
| Trypan blue | Roth | CN76.1 | |
| Tubes 50ml | TPP | 91050 | |
| Ultra-Clear Tubes (14x89 mm) | Beckman Coulter | 344059 | |
| Centrifuge (refrigerated) | Sigma Sartorius | 3-19KS | |
| HeraeusFresco 17 Microcentrifuge | Thermo Scientific | 75002420 | |
| Ultracentrifuge with SW41Ti rotor | Beckman Coulter | Optima L-80 XP | |
| Culture Hood | Thermo Scientific | Class II | |
| Pipettes (0-2µl, 1-10µl, 2-20µl, 10-100µl, 20-200µl, 100-1000µl) | Thermo Scientific | ||
| Dry Block Heating Thermostat | Biosan | TDB-120 | |
| Thermocycle | SensoQuest | 012-103 | |
| Water Bath | Memmert | WNB 14 |
References
- Lee, C. S., et al. Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine. Genes and Diseases. 4 (2), 43-63 (2017).
- He, T. C., et al. A simplified system for generating recombinant adenoviruses. Proceedings of the National Academy of Sciences of the United States of America. 95 (5), 2509-2514 (1998).
- Russell, W. C. Update on adenovirus and its vectors. The Journal of General Virology. 81, 2573-2604 (2000).
- Rauschhuber, C., Noske, N., Ehrhardt, A. New insights into stability of recombinant adenovirus vector genomes in mammalian cells. European Journal of Cell Biology. 91 (1), 2-9 (2012).
- Saha, B., Wong, C. M., Parks, R. J. The adenovirus genome contributes to the structural stability of the virion. Viruses. 6 (9), 3563-3583 (2014).
- Kreppel, F., Kochanek, S. Modification of adenovirus gene transfer vectors with synthetic polymers: a scientific review and technical guide. Molecular Therapy: the Journal of the American Society of Gene Therapy. 16 (1), 16-29 (2008).
- Dormond, E., Perrier, M., Kamen, A. From the first to the third generation adenoviral vector: what parameters are governing the production yield. Biotechnol Advances. 27 (2), 133-144 (2009).
- Parks, R. J., et al. A helper-dependent adenovirus vector system: removal of helper virus by Cre-mediated excision of the viral packaging signal. Proceedings of the National Academy of Sciences of the United States of America. 93 (24), 13565-13570 (1996).
- Jager, L., Ehrhardt, A. Emerging adenoviral vectors for stable correction of genetic disorders. Current Gene Therapy. 7 (4), 272-283 (2007).
- Luo, J., et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system. Nature Protocols. 2 (5), 1236-1247 (2007).
- Dumitrescu, M., et al. Adenovirus-Mediated FasL Minigene Transfer Endows Transduced Cells with Killer Potential. International Journal of Molecular Sciences. 21 (17), (2020).
- Campos, S. K., Barry, M. A. Current advances and future challenges in Adenoviral vector biology and targeting. Current Gene Therapy. 7 (3), 189-204 (2007).
- Khare, R., Chen, C. Y., Weaver, E. A., Barry, M. A. Advances and future challenges in adenoviral vector pharmacology and targeting. Current Gene Therapy. 11 (4), 241-258 (2011).
- Jager, L., et al. A rapid protocol for construction and production of high-capacity adenoviral vectors. Nature Protocols. 4 (4), 547-564 (2009).
- Zvintzou, E., et al. Pleiotropic effects of apolipoprotein C3 on HDL functionality and adipose tissue metabolic activity. Journal of Lipid Research. 58 (9), 1869-1883 (2017).
- Karavia, E. A., et al. Apolipoprotein A-I modulates processes associated with diet-induced nonalcoholic fatty liver disease in mice. Molecular Medicine. 18, 901-912 (2012).
- Lampropoulou, A., Zannis, V. I., Kypreos, K. E. Pharmacodynamic and pharmacokinetic analysis of apoE4 [L261A, W264A, F265A, L268A, V269A], a recombinant apolipoprotein E variant with improved biological properties. Biochemical Pharmacology. 84 (11), 1451-1458 (2012).
- Zheng, S. Y., Li, D. C., Zhang, Z. D., Zhao, J., Ge, J. F. Adenovirus-mediated FasL gene transfer into human gastric carcinoma. World Journal of Gastroenterology. 11 (22), 3446-3450 (2005).
- Ambar, B. B., et al. Treatment of experimental glioma by administration of adenoviral vectors expressing Fas ligand. Human Gene Therapy. 10 (10), 1641-1648 (1999).
- Okuyama, T., et al. Efficient Fas-ligand gene expression in rodent liver after intravenous injection of a recombinant adenovirus by the use of a Cre-mediated switching system. Gene Therapy. 5 (8), 1047-1053 (1998).
- van Dijk, K. W., Kypreos, K. E., Fallaux, F. J., Hageman, J. Adenovirus-mediated gene transfer. Methods in Molecular Biology. 693, 321-343 (2011).
- Zhao, Y. D., Li, T., Huang, G. A simple negative selection method to identify adenovirus recombinants using colony PCR. Electronic Journal of Biotechnology, North America. 17 (1), 46-49 (2014).
- Kovesdi, I., Hedley, S. J. Adenoviral producer cells. Viruses. 2 (8), 1681-1703 (2010).
- Lin, X. Construction of new retroviral producer cells from adenoviral and retroviral vectors. Gene Therapy. 5 (9), 1251-1258 (1998).
- Fallaux, F. J., et al. Characterization of 911: a new helper cell line for the titration and propagation of early region 1-deleted adenoviral vectors. Human Gene Therapy. 7 (2), 215-222 (1996).
- Altaras, N. E., et al. Production and formulation of adenovirus vectors. Advances in Biochemical Engineering/ Biotechnology. 99, 193-260 (2005).
- Schagen, F. H., et al. Ammonium sulphate precipitation of recombinant adenovirus from culture medium: an easy method to increase the total virus yield. Gene Therapy. 7 (18), 1570-1574 (2000).
- Colombet, J., et al. Virioplankton 'pegylation': use of PEG (polyethylene glycol) to concentrate and purify viruses in pelagic ecosystems. Journal of Microbiological Methods. 71 (3), 212-219 (2007).
- Kypreos, K. E., van Dijk, K. W., van Der Zee, A., Havekes, L. M., Zannis, V. I. Domains of apolipoprotein E contributing to triglyceride and cholesterol homeostasis in vivo. Carboxyl-terminal region 203-299 promotes hepatic very low density lipoprotein-triglyceride secretion. Journal of Biological Chemistry. 276 (23), 19778-19786 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved