Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre Yayma Sırasında Hücre Kenarı Dinamiklerinin Nicel Analizi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokolde canlı hücre mikroskopisi esas alınarak yapılan test yayılan bir hücrenin deneysel prosedürlerini sunuyoruz. Floresan etiketli hücrelerin tarafsız segmentasyonu ve hücre yayılması sırasında lamellipodia dinamiklerinin nicel analizi için açık kaynaklı bir hesaplama aracı sunuyoruz.
Özet
Hücre yayma, medyada asılı bir hücrenin bir substrata bağlandığı ve yuvarlanmış bir şekilden ince ve yayılmış bir şekle düzleştirmesi dinamik bir işlemdir. Hücre-substrat ekini takiben, hücre gövdesinden yayılan ince bir lamellipodia tabakası oluşturur. Lamellipodia'da, globüler aktin (G-actin) monomerleri plazma zarına doğru iten yoğun bir filamentli aktin (F-actin) meshwork'e polimerize olur ve böylece hücrenin yayılması için gereken mekanik kuvvetleri sağlar. Özellikle, lamellipodia'daki aksin polimerizasyonunu kontrol eden moleküler oyuncular, hücre göçü ve endositoz gibi diğer birçok hücresel süreç için gereklidir.
Yayılan hücreler tüm hücre çevresini kapsayan ve sürekli olarak dışa doğru genişleyen sürekli lamellipodia oluşturduğundan, hücre yayma tahlilleri lamellipodial çıkıntıların kinetiğini değerlendirmek için etkili bir araç haline gelmiştir. Hücrenin yayılan tahlillerinin birkaç teknik uygulaması geliştirilmiş olsa da, iş akışının hem adım adım protokol hem de veri analizi için hesaplama araçlarını içerecek ayrıntılı bir açıklaması şu anda eksiktir. Burada, hücre yayılma tahlilinin deneysel prosedürlerini açıklıyoruz ve yayılma sırasında hücre kenar dinamiklerinin nicel ve tarafsız analizi için açık kaynaklı bir araç sunuyoruz. Farmakolojik manipülasyonlar ve/veya gen susturma teknikleri ile birleştirildiğinde, bu protokol lamellipodial çıkıntıları düzenleyen moleküler oyuncuların geniş ölçekli bir ekranına tabidir.
Giriş
Lamellipodial çıkıntılar, göç eden bir hücrenin önünde oluşan belirgin sitoskeletal yapılardır. Lamellipodia'da, Arp2/3 kompleksi ve forminlerin yardımıyla aktinin polimerizasyonu, plazma zarına1,2'ye karşı iten hızlı büyüyen dallı bir aksin meshwork oluşturur. Aktüen meshwork tarafından oluşturulan itme kuvveti, hücreyi fiziksel olarakileriye doğru iterek 1,3,4,5. Arp2/3 kompleksinin tükenmesi veya lamellipodial çıkıntılar için gerekli sinyal yollarının bozulması genellikle hücre göçini bozar6, 7. Lamellipodia eksikliği olan hücrelerin göçü de bildirilmiş olsa da8,9Hücre göçünde lamellipodia'nın önemi, hücrenin karmaşık biyolojik mikroçevremeler 6,10arasında hareket etme yeteneğini besleyen bu çıkıntılı yapının tükenmesi olarak açıktır.
Göç eden hücrelerde lamellipodia'nın düzenlenmesini anlamanın en büyük engeli, lamellipodial çıkıntı kinetiği, boyutu ve şekli11 , 12,13,14'tekidoğal değişkenliktir. Ayrıca, son çalışmalar lamellipodia'nın dalgalanan, periyodik ve hızlanan çıkıntılar da dahil olmak üzere karmaşık çıkıntılı davranışlar sergilediğini göstermiştir14,15. Göç eden hücrelerin son derece değişken lamellipodia ile karşılaştırıldığında6,16, hücre yayılması sırasında oluşan lamellipodia daha düzgün12. Yayılan ve göç eden hücrelerin çıkıntılı aktivitesi, dallı bir aksin ağı, kontrtil akomiyosin demetleri ve integrin bazlı hücre matrisi yapışmaları17,18, yayılan hücreleri içeren özdeş makromoleküler montajlar tarafından yönlendirilmediğinden, yayılan hücreler lamellipodia dinamiklerinin düzenlenmesini araştırmak için yaygın olarak kullanılmıştır.
Hücre yayma, süspansiyondaki bir hücrenin önce integrin bazlı yapıştırmalar17 , 19,20 yoluyla bir substrata yapıştığı ve daha sonra aksin bazlı çıkıntıları21 ,22,23genişleterek yayıldığı dinamik bir mekanokimyasal süreçtir. Yayılma aşamasında, hücre gövdesinden yayılan lamellipodia izotropik olarak ve ısrarlı bir şekilde çok az geri çekilme veya oyalama ile çıkıntı12. En sık kullanılan hücre yayma protokolleri, yayılan hücrelerin kaplamadan sonra çeşitli zamanlarda sabitlendiği uç noktalar tahlilleridir19,24. Bu tahliller, hızlı ve basit olmasına rağmen, lamellipodia'nın dinamik özelliklerindeki değişiklikleri tespit etmek için tanılama güçlerinde sınırlıdır. Lamellipodia dinamiklerini kontrol eden moleküler mekanizmaları belirlemek için Sheetz grubu, canlı yayılan hücrelerin nicel analizinin kullanılmasına öncülük etti ve hücre kenarı çıkıntılarının birçok temel özelliğini ortaya çıkardı11,12,22. Bu çalışmalar, canlı hücre yayma tahlilinin bir hücre biyolojisi laboratuvarının alet çantasında sağlam ve güçlü bir teknik olduğunu göstermiştir. Buna rağmen, canlı hücre yayma tahlilleri için ayrıntılı bir protokol ve açık kaynaklı hesaplama aracı şu anda hücre biyolojisi topluluğu için kullanılamamaktadır. Bu amaçla, protokolümüz canlı yayılan hücreleri görüntüleme prosedürlerini özetler ve otomatik bir görüntü analizi aracı sağlar. Bu yöntemi doğrulamak için deneysel bir tedavi olarak Arp2/3 inhibisyonunu kullandık ve Arp2/3 kompleksinin işlevini engellemenin hücre yayılımını tutuklamadığını, hücre çıkıntı hızında önemli bir azalmaya neden olduğunu ve hücre kenarı çıkıntılarının stabilitesinin pürüzlü hücre kenarlarına yol açtığını gösterdik. Bu veriler, canlı hücre görüntüleme ve otomatik görüntü analizi kombinasyonunun hücre kenar dinamiklerini analiz etmek ve lamellipodia'yı düzenleyen moleküler bileşenleri tanımlamak için yararlı bir araç olduğunu göstermektedir.
Protokol
1. Hücre Tohumlama
NOT: Açıklanan hücre yayma protokolü, PH-Akt-GFP (PIP3 /PI(3,4)P2için floresan belirteç) ifade eden fare embriyonik fibroblastları (MEF'ler) kullanılarak gerçekleştirildi. Bu hücre hattı, CRISPR aracılı gen düzenleme ile PH-Akt-GFP (Addgene #21218) için bir ifade yapısı genomik olarak entegre edilmesiyle oluşturulmuştır. Bununla birlikte, geçici olarak ifade edilen veya genoma entegre edilen diğer floresan belirteçler de bu testte kullanılabilir. En iyi görüntü segmentasyonu için sitoplazmada eşit olarak dağıtılan floresan belirteçler kullanmanızı öneririz, örneğin sitosoleik GFP.
- 10 cm'lik bir hücre çanağını% 90 izdiah eder.
- Hücreler uygun izdiah süresine ulaştıktan sonra, 35 mm hücre kültürü çanağının içine 22 mm x 22 mm kapak kılıfı (#1,5; 0,17 mm kalınlık) yerleştirin. Kapak kapağını PBS'de seyreltilmiş 400 μL fibronektin ile 2,5 μg / mL'lik son konsantrasyona kadar kaplayın.
NOT: Test için gerekli kapak sayısı deneysel koşulların sayısına ve teknik replikaya göre belirlenir. - Fibronektin kaplı kapaklı 35 mm'lik kabı 1 saat boyunca 37 °C, %5 CO2 inkübatöre yerleştirin.
- Kabı kuvözden kapakla çıkarın. Fibronektin aspire edin ve kapak kapağının etrafını iki ila üç kez hafifçe pipetleyerek KAPAK ZARINI PBS ile yıkayın.
- Hücre kültürü medyasını 10 cm'lik hücre kabından emiş ve yemeği PBS ile yıkayın.
- Hücrelerin% 90 birlikte verilen kabına% 0.05 tripsin-EDTA'nın 650 μL'sini ekleyin ve enzimi eşit olarak dağıtmak için kabı eğin. Tripinli yemeği 1 dakika boyunca inkübatöre yerleştirin.
- Kabı inkübatörden hücrelerle birlikte çıkarın. 15 mL santrifüj tüpüne 10 mL hücre kültürü ortamı ekleyin. Trypsin'i söndürmek için yemeğe hızlı bir şekilde 10 mL daha medya ekleyin.
- Hücreleri seyreltmek için 15 mL santrifüj tüpüne tripzillenmiş hücrelerin pipet 1 mL'si. Hücrelerin ortam içinde eşit bir şekilde dağılımını sağlamak için tüpün içeriğini yukarı ve aşağı borun. Yüksek toplama eğilimine sahip hücre tipleri için, hücre topaklanmasının oluşumunu en aza indirmek için hücrelerin bir hücre süzgecinden (100 μm mesh boyutu) filtrelenmesi önerilir.
- Tüpten pipet 500 - 1000 μL seyreltilmiş hücre kapakçığı içeren 35 mm'lik kabın içine.
- Hücreleri eşit bir şekilde yaymak için tabağı hafifçe sallayın. Kapak kapağının ~%10 izdiah (~50.000 hücre/mL) seviyesinde olduğundan emin olun ve seyreltilmiş hücrelerin hacmini gerektiği gibi ayarlayın.
NOT: Hücrelerin bu kadar düşük bir izdiahta olmasının amacı, her görüş alanında, amacı hücre yayılı kazanımı boyunca odaklamak için kullanılacak 1-2 polarize hücre olmasını sağlamaktır. - 10 cm'lik tabaktaki kalan hücrelerin 1/5'ini tedavi durumu başına bir adet 6 cm'lik yemeğe geçirin. Pasajlı yemekleri ve kapaklı 35 mm'lik tabağı bir gecede inkübatöre yerleştirin.
NOT: Bunlar, yayılma dinamikleri için analiz edilecek hücreler olacaktır.
2. İlaç Kuluçka ve Hücre Kurtarma
- İki adet 15 mL santrifüj tüpünün her birine 5 mL hücre kültürü ortamı ve iki adet 50 mL santrifüj tüpünün her birine 20 mL fenol kırmızısı içermeyen DMEM ekleyin.
NOT: Tüp çiftlerinin sayısı (15 mL + 50 mL) deneysel koşulların sayısına karşılık gelmelidir. - Arp2/3'ün hücre yayılımı için önemini test etmek için pipet, Arp2/3, CK-666'nın farmakolojik inhibitörü veya DMSO gibi kontrol tedavisi, istenen konsantrasyona kadar her bir santrifüj tüpü çiftine.
- Geçen 6 cm'lik bulaşıkları (bkz. Adım 1.11) inkübatörden çıkarın ve ortamı aspire edin. Bulaşıkları ılık PBS ile yıkayın.
- CK-666 veya DMSO takviyeli 15 mL santrifüj tüplerinin içeriğini pasaklı yemeklerin her birine ekleyin. Her yemeği doğru ilaç tedavisi ile etiketleyin ve bulaşıkları bir saat boyunca inkübatöre yerleştirin.
- Bulaşıkları inkübatörden çıkarın ve medyayı aspire edin. Kalan tüm fenol kırmızı medyasını iyice çıkarmak için bulaşıkları ılık PBS ile yıkayın.
- Her 6 cm'lik yemeğe 230 μL%0,05 trypsin-EDTA ekleyin ve hücreleri 1 dakika kuluçkaya yatırın.
NOT: Varsa, tripsin proteolitik olmayan bir hücre yapışma engelleyicisi ile değiştirilebilir. - Bulaşıkları inkübatörden çıkarın. Her tedavi için, "Tüp B" olarak belirlenen 15 mL santrifüj tüpüne 5 mL ilaç takviyeli fenol kırmızı içermeyen DMEM ekleyin. Tripsin'i söndürmek için ilgili yemeğe aynı ortamdan 5 mL daha ekleyin. Yemeğin içeriğini "Tüp A" olarak belirlenmiş 15 mL santrifüj tüpüne aktarın.
- 1 mL hücreyi A Tüpünden B Tüpüne aktarın.
- Hücrelerin tripzyasyondan kurtulmasını sağlamak için A ve B tüplerini 45 dakika boyunca inkübatöre yerleştirin. Santrifüj tüplerinin kapağını, CO2 penetrance'a izin vermek için inkübatöre yerleştirmeden önce hafifçe gevşetin.
NOT: İyileşme süresi farklı hücre tipleri için değişebilir. Deneylerimizde 45 dakikalık iyileşme hücre canlılığı üzerinde ihmal edilebilir bir etkiye sahip olsa da, bazı hücre tipleri süspansiyonda çok uzun süre bekletildiğinde anoikis geçirilebilir. Bu nedenle, ampirik olarak en uygun iyileşme süresini belirlemenizi öneririz. En uygun iyileşme süresi, numunede ölü veya apoptotik hücre olmadan hızlı ve senkron hücre yayılmasını sağlar.
3. Manyetik Oda Hazırlama
- 22 mm x 22 mm kare kapak kapağına sığabilen 1 Kuyu Pahlı Hücreli Manyetik Odanın tüm parçalarının kullanımdan önce temizlenmiş olduğundan emin olun.
- Kapaklı 35 mm'lik kabı inkübatörden çıkarın (bkz. Adım 1.11). Hücre kültürü medyasını epire edin ve kapak sapını ılık PBS ile yıkayın.
- Bir çift tokmak kullanarak 35 mm'lik çanaktan kapak kapağını çıkarın ve kapak kapağını hafifçe manyetik odanın alt plakasına yerleştirin.
- Silikon contayı kapak kapağının üzerine yerleştirin.
NOT: Yanlış yerleştirilmiş bir silikon conta, sızdıran bir manyetik odanın en yaygın nedenidir. Contanın alt plakanın girintisinde olduğundan ve girintinin ötesine geçmemesine dikkat edin. - Ana gövdeyi alt plakaya takın.
NOT: Bu bölümü çok yavaş yapın. İyi bir ipucu, ana gövdeyi üste yerleştirirken alt plakayı tek elle basılı tutmaktır. Bu, ana gövdenin mıknatıslarının alt plakayı yukarı kaldırmamasını sağlar, bu da kapak kapağını yerinden ve çatlatabilir. - Manyetik odaya 1 mL ilaç takviyeli fenol kırmızı içermeyen DMEM ekleyin. Tüy bırakmayan bir doku alın ve sızıntı olup olmadığını kontrol etmek için muhafazayı ana gövde ile alt plaka arasında dikkatlice dab.
NOT: Sızıntı varsa, ortamı hızla emiş ve 3.4. - Manyetik odayı çevrelemek için şeffaf kapağı ana gövdeye küt
- Önce bir laboratuvar dokusunu suyla püskürtün ve manyetik odanın altını silin (metal kısmı değil, kapak. Daha sonra, kapak kapağını kırmamaya dikkat derek, ikinci bir laboratuvar dokusunu az miktarda% 70 etanol ve mendille püskürtün.
4. Görüntü Alımı
- Sahne üstü inkübatörü ve objektif ısıtıcıyı önceden 37 °C'ye ısıtın ve sahne üst inkübatöründeki CO2 seviyesini % 5'e ayarlayın.
NOT: Sahne üstü inkübatör bir CO2 kaynağına bağlı değilse, hücre kültürü ortamı sabit pH 7.4'ü korumak için 25 mM HEPES ile desteklenmelidir. - Önceden ısıtılmış 60X, 1.4 N.A. yağ hedefine yeterli miktarda daldırma yağı uygulayın.
NOT: Makul derecede geniş görüş alanı ve olağanüstü ışık toplama verimliliği nedeniyle bu protokolde 60X, 1.4 N.A. yağ daldırma hedefi kullanıyoruz. Daha geniş bir görüş alanı gerekiyorsa, görüntülerin sinyal-gürültü oranı 2,5'ten büyük olduğu sürece daha düşük bir büyütme hedefi(örneğin,20x) kullanılabilir. - Konfokal mikroskopa hem tamamlanmış manyetik bölmeyi hem de B Tüpünü (Adım 2.9) getirin. Manyetik odayı sahne üst inkübatörüne yerleştirin.
NOT: Daldırma yağını kabarcıklar oluşturmamak için manyetik odayı yavaşça sahneye yerleştirin. - GFP kanalını kullanarak odağı floresan hücrelere ayarlayın. Hücre kenarı keskin ve iyi tanımlanmış olduğundan emin olun.
- Manyetik odanın şeffaf kapağını ve pipet 500 μL'yi B Tüpünden manyetik odaya çıkarın. Şeffaf kapağı tekrar manyetik odanın üzerine yerleştirin.
- Hücre yayma analizi için ideal hücreleri tanımlamak için, kapak kılıfına henüz bağlanmamış ancak artık yuvarlanmayan hücrelerin "halelerini" arayın. Kapak ekinin en erken aşamalarında olan hücreler de harika adaylardır, ancak yayılmayı yakalamak için görüntü alımının hızlı olması gerekir.
- Yeşil kanal için zaman aralıklı görüntü alımını, 6 saniyelik aralıklarla görüntülenen dört görüş alanı içerecek şekilde yapılandırın.
NOT: Farklı hücre tipleri arasında lamellipodia çıkıntı hızının yüksek değişkenliği nedeniyle, en uygun kare hızı ampirik olarak belirlenmelidir. Deneylerimizde kullanılan 6 saniyelik görüntüleme aralığı, birçok mezenkimal ve epitel hücrenin analizi için iyi bir başlangıç noktasıdır. Bununla birlikte, çok hızlı yayılan hücreler(örneğin,bağışıklık hücreleri) çok daha yüksek bir kare hızı (daha kısa görüntüleme aralığı) gerektirebilir. Hücre yayma filmleri için en uygun kare hızı, çıkıntılı hücre kenarının sonraki kareler arasında 2-5 piksel yer değiştirmesini sağlar. Hücre yayılma platosunun tanımlanmasında kullanılan eğri bağlantı elemanının doğruluğu göz önüne alındığında, en uygun kare hızı, hücre yayılın hızlı genişleme aşamasında hücre kenarı yer değiştirmesinin 50-100 ölçümünü de sağlamalıdır. Görüş alanlarının sayısı pozlama süresine, alım noktaları arasındaki mesafeye ve sahne alanı hareket hızına bağlı olarak ayarlanmalıdır. Kullanıcıların, istenen kare hızıyla elde edebilecek maksimum görüş alanı sayısını belirlemeleri önerilir. - Uygun bir görüş alanı belirledikten sonra mikroskop aşamasının X ve Y koordinatlarını kaydedin. Kapak arasında birbirine nispeten yakın olan diğer üç görüş alanını tanımlamaya devam edin. Mikroskop aşamasının koordinatlarını istediğiniz her görüş alanına kaydedin.
NOT: Gereksiz numune hareketini en aza indirmek için görüş alanları arasındaki sahne alanı hareket yolunun optimize edilmesiniz önerilir. Bu tür iyileştirmeler manuel veya otomatik olarak gerçekleştirilebilir. Aşırı örnek hareketi alımı yavaşlatır ve hücrelerin alçalırken gözden çıkmasına neden olabilir. - 6 saniyelik kare hızında 15 dakika boyunca görüntü alın ve dosyaları kaydedin. Daha fazla alım gerekiyorsa, Adım 4.6'dan başlayarak yineleyin.
5. Hücre yayılması sırasında hücre alanının, döngüselliğin ve çıkıntı dinamiklerinin analizi
- Görüntüleri veri işleme ve analiz için hazırlama
NOT: Yazılım, giriş parametreleri olarak .tiff biçimde bir görüntü ve piksel boyutu gerektirir. Her iki gereksinim de satın alma yazılımı veya Fiji (bu protokolde) kullanılarak yerine getirilebilir. Bu gereksinimler yerine getirilirse, 5.2 adımına geçin.- Fiji uygulamasının en son sürümünü yükleyin (https://imagej.net/Fiji/Downloads).
- Fiji'yi kullanarak zaman atlamalı bir görüntü açın.
- Görüntü > Özellikleri 'ni seçerek görüntününpiksel boyutunu kopyalayın. Piksel boyutunu μm cinsinden kopyalayıp Not Defteri/Word'e yapıştırın.
- Hücre yayılma alanı ve döngüsellik analizi için, zaman atlamalı görüntüyü tiff görüntü yığını olarak kaydedin. Özel yapı çözümleme yazılımı özel dosya biçimlerini desteklemez. Dosya > Farklı Kaydet > Tiff 'i seçerek tek tek hücre tiff görüntü yığınını kaydedin.
- Veri işleme ve analiz için Python IDE'yi (Spyder) ve gerekli paketleri(PySimpleGUI ve tifffile)yükleyin.
NOT: Python ve paketlerin yüklenmesi yalnızca ilk kurulum için gereklidir.- Hızlandırılmış filmler Spyder IDE'de özel yapım python komut dosyası kullanılarak analiz edilecektir. Spyder IDE'yi indirmek için Spyder IDE'yi ve bu analiz için gerekli kütüphanelerin ve paketlerin çoğunu içeren Anaconda distribütörü (https://www.anaconda.com/products/individual) indirin.
- Anaconda'yı yükleyin ve Spyder'ı Anaconda Navigator aracılığıyla başlatın.
- IPython konsol sekmesinde (Spyder'ın sağ alt bölümünde bulunur), aşağıdaki komutu kopyalayıp yapıştırın: Pip PySimpleGUI'yi yükleyin ve enter tuşuna basın. Bu komutu çalıştırmak, grafik kullanıcı arabirimini (GUI) başlatmak için gereken paketi yükler.
- Aynı konsolda, aşağıdaki komutu kopyalayıp yapıştırın: pip tifffile'ı yükleyin ve Enter tuşuna basın. Bu komutu çalıştırmak, görüntüleri tiff dosyaları olarak kaydetmek için gereken paketi yükler.
- Ek dosyalardan tüm Python komut dosyalarını veya GitHub'dan en güncel komut dosyalarını şu https://github.com/ernestiu/Cell-spreading-analysis.git
- Hücre yayılması sırasında hücre alanını ve hücre şekli faktörlerini ölçme
- Spyder'ın üst panelinde açık dosya seçeneğini belirleyerek veya Ctrl + Okısayolu kullanarak ana analiz komut dosyası "cell_spreading_GUI.py"i açın.
- Üst panelde "Dosyayı çalıştır" seçeneğini belirleyerek veya F5kısayolını kullanarak hücre yayma çözümleme GUI'sini açın.
- Hücre Yayılma Alanı sekmesini tıklatın (Şekil 3A).
- Gözat düğmesi kullanılarak analiz edilecek tiff görüntüsünü seçin.
NOT: Seçili dosya bir tiff dosyası olmalıdır. - Veri çıkışlarının (örneğin, hücre maskeleri, değerler) kaydedileceği hedef dizini belirtin.
- Veri çıkış ayarlarını belirtin:
- Maskeleri kaydetme: Segmentasyon işlemi sırasında oluşturulan hücre maskelerini kaydedin.
- Verileri dışarı aktarma: Tüm çözümleme verilerini içeren bir excel elektronik tablosunu (.xlsx) hedef klasöre verin.
Tüm yayılan hücrelerin hücre alanı, döngüselliği ve en boy oranı hedef klasöre Excel elektronik tablosu olarak kaydedilir. Hücre alanı şu şekilde hesaplanır: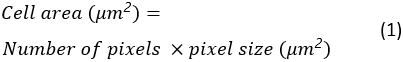
Hücre döngüselliği, bir hücrenin mükemmel yuvarlak bir hücreye ne kadar yakın olduğunun bir ölçüsüdür. Şu şekilde hesaplanır: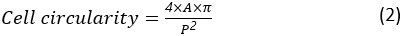
burada A ve P sırasıyla hücre alanı ve hücre çevresidir. Hücrenin en boy oranı, hücrenin ne kadar uzun olduğunu temsil eder. Bir yayılma hücresinin en boy oranı 1'e yakın olmalıdır. En boy oranı şu şekilde hesaplanır: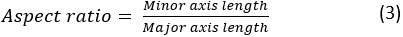
- Konturları kaydetme: Hücre sınırı kontur kaplama görüntülerini hedef klasöre kaydedin.
- Segmentasyon ayarlarını belirtme
- Segmentasyonu göster: Analiz işlemi sırasında Spyder konsolunda segmentasyon sonucunu gösterin.
- En küçük hücre alanı (μm2): Ekin başlangıç aşamalarındaki hücrelerin alan değerleri de dahil olmak üzere hücre alanı için minimum değeri girin. Bu eşikten daha küçük bir alana sahip nesneler, hücre yayma olarak kabul edilir. Bu sayı segmentasyon işlemini etkiler.
- Görüntü parametrelerini belirtin.
- Alım aralığı (lar): Görüntü alma sıklığını saniye cinsinden girin.
- Piksel boyutu (μm): Görüntüleri analize hazırlarken kaydedilen piksel boyutunu girin.
- Görüntü biti derinliği: Kameranın/dedektörün bit derinliğini girin.
- Çalıştır 'ıtıklatın. Bir hata ortaya çıkarsa, Spyder'ın konsolunda bir hata mesajı görünecektir. Aksi takdirde, görüntü analizi işlemi konsolda gösterilir.
NOT: Konsol/Çizimler bölümünde görünen ilk görüntü (Spyder ayarlarına bağlı olarak) görüş alanında tanımlanan tüm hücreleri gösterir. Hücrelerin etrafına yerleştirilen yeşil kutular, segmentasyon ve analiz için uygun olan yayılma hücrelerini gösterir. Gri kutular analiz için uygun olmayan hücreleri gösterir. Tanımlanan toplam yayılan hücre sayısı Konsol sekmesinde de görünür. Yazılım, hücre alanını (mavi) ve hücre döngüselliğini (kırmızı) zamanın bir işlevi olarak çizar. Bu grafikler, kullanıcıların hücre segmentasyonunun doğruluğunu değerlendirmelerini sağlar. Başarılı bir segmentasyon, hücre alanı için monoton olarak artan bir eğri verir. Hücre yayılma alanının temsili bir eğrisini elde etmek için, gecikme aşaması grafikten manuel olarak çıkarılmalıdır. Gecikme aşaması, hücre yayılmaya başlamadan önce hücre alanının ölçümlerini içerir. Gecikme aşaması, hücre alanı çiziminde temsil edildiği gibi hızlı dalgalanmalarla gösterilir(Şekil 3C sağ).
6. Kimograflar kullanarak hücre yayma sırasında hücre kenarı dinamiklerini ölçün
- Analizi çalıştırmadan önce, yayılan hücrelerin ham filmlerini kırparak tek tek yayılan hücrelerin zaman serisini oluşturun.
- Tek bir hücreyikapsülleyen bir ilgi alanı (ROI) el ile seçmek için Fiji araç çubuğundaki Dikdörtgen aracını kullanın. (Yatırım getirisinin yayılma hücresini tam olarak kapsüllemesini sağlamak için, yatırım getirisini tüm zaman noktalarında incelemek üzere kaydırma işlevini kullanın.)
- Yatırım getirisini sağ tıklatın ve Çoğalt 'ıseçin.
- Yığını çoğalt'ı denetleyin ve Tamam 'ıtıklatın.
- Spyder'ın araç çubuğundaki Dosyayı Aç düğmesini seçerek veya Ctrl + Okısayolu kullanarak ana çözümleme komut dosyası "cell_spreading_GUI.py"i açın. GUI zaten açılmışsa, doğrudan Adım 6.3'e gidin.
- Üst panelde Dosya çalıştır'ı seçerek veya F5 ( Şekil 3B) kısayolını kullanarak hücre yayma çözümlemeGUI'siniaçın.
- Kymograph oluşturucu ve analiz sekmesini tıklatın.
- Analiz için tiff görüntüsünü seçmek için gözat düğmesini kullanın.
NOT: Özel dosya biçimleri, örneğin, nd2, lif, zen, komut dosyası tarafından desteklenmez. - Çıktı verilerini (hücre maskeleri ve değerleri) kaydetmek için hedef klasörü belirtin.
- Çıktı ayarlarını belirtin.
- Verileri dışarı aktarma: Bir excel elektronik tablosunu (.xlsx) kymographs'ın göreli hücre kenarı konumlarını ve geri çekme olaylarını içeren hedef klasöre verin.
- Görüntü parametrelerini belirtin:
- Alma aralığı (lar): Görüntü alma sıklığını saniyeler içinde girin.
- Piksel boyutu (μm): Adım 5.1.3'te analiz için görüntüler hazırlanırken kaydedilen piksel boyutunu girin.
- En küçük hücre alanı (μm2): Ekin başlangıç aşamalarındaki hücrelerin alan değerleri de dahil olmak üzere hücre alanı için minimum değeri girin. Bu eşikten daha küçük bir alana sahip nesneler, hücre yayma olarak kabul edilir. Bu sayı segmentasyon işlemini etkiler.
- Görüntü biti derinliği: Kameranın/dedektörün bit derinliğini girin.
- Çalıştır 'ıtıklatın. Bir hata ortaya çıkarsa, Spyder'ın konsolunda bir hata mesajı görünecektir. Aksi takdirde, çıkıntı dinamiği nicelemelerinin bir özeti konsolda gösterilir. Hücrenin üst, alt, sol ve sağ kısımlarından oluşturulan 4 kimograftan çıkarılan 4 çift geri çekilme frekansı ve çıkıntı hızı ölçümü yapılacaktır. Geri çekme sıklığı şu şekilde hesaplanır:
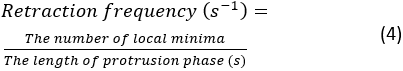
NOT: Bu sayı, lamellipodium'un yayılma boyunca ne sıklıklarda geri çekilir olduğunu gösterir. Ortalama çıkıntı hızı, çıkıntı başlangıcı ile kimograf üzerindeki plato noktası arasındaki eğimle ölçülür. Segmentasyondan sonra konsolda özet bir kimograf figürü gösterilecektir. Özet rakamı kaydetmek için şarakaya sağ tıklayın ve resmi kaydedin.
Sonuçlar
Yukarıdaki protokol, yayılan hücrelerin canlı hücre görüntülemesi için deneysel prosedürleri ve hücre yayma dinamiklerinin nicel analizi için bir hesaplama aracını açıklar. Hesaplama aracı, hücre lideri kenarındaki akrin polimerizasyon makinelerini düzenleyen moleküler oynatıcıları tanımlamak için düşük veya yüksek aktarım hızı biçiminde kullanılabilir.
Deneysel yordamların şematik gösterimi Şekil 1'de tasvir edilir. Test yay...
Tartışmalar
Açıklanan hücre yayma tahlili, çoğu hücre yayma protokolünde eksik olan morfolojik değişikliklerin(örneğin, hücre büyüklüğü ve şekli) ve hücre kenar hareketlerinin(örneğin, çıkıntı hızı ve geri çekme sıklığı) sürekli izlenmesini sağlar19,24. Yaygın olarak kullanılan son nokta hücre yayma tahlilleri hücre yayılma hızının belirlenmesine izin verirken, bu tahliller hücre kenar hareketlerinin zamansal dinam...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma, Connaught Fund New Investigator Award to S.P., Canada Foundation for Innovation, NSERC Discovery Grant Program (RGPIN-2015-05114 ve RGPIN-2020-05881), Manchester Üniversitesi ve Toronto Üniversitesi Ortak Araştırma Fonu ve Toronto Üniversitesi XSeed Programı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin (0.05%), 0.53 mM EDTA | Wisent Bioproducts | 325-042-CL | |
| 10.0 cm Petri Dish, Polystyrene, TC Treated, Vented | Starstedt | 83.3902 | |
| 15 mL High Clarity PP Centrifuge Tube, Conical Bottom, with Dome Seal Screw Cap, Sterile | Falcon | 352097 | |
| 1-Well Chamlide CMS for 22 mm x 22 mm Coverslip | Quorum Technologies | CM-S22-1 | |
| 35 mm TC-treated Easy-Grip Style Cell Culture Dish | Falcon | 353001 | |
| 50 mL Centrifuge Tube, Transparent, Plug Seal | Nest | 602002 | |
| 6.0 cm Cell Culture Dishes Treated for Increased Cell Attachment, Sterile | VWR | 10861-658 | |
| Arp2/3 Complex Inhibitor I, CK-666 | Millipore Sigma | 182515 | |
| Camera, Prime 95B-25MM | Photometrics | ||
| Dimethyl Sulfoxide, Sterile | BioShop | DMS666 | |
| DMEM, 1x, 4.5 g/L Glucose, with L-Glutamine, Sodium Pyruvate and Phenol Red | Wisent Bioproducts | 319-005 CL | |
| DMEM/F-12, HEPES, No Phenol Red | Gibco | 11039021 | |
| D-PBS, 1X | Wisent Bioproducts | 311-425 CL | |
| Fetal Bovine Serum | Wisent Bioproducts | 080-110 | |
| Fiji Software | ImageJ | ||
| HEPES (1 M) | Gibco | 15630080 | |
| Human Plasma Fibronectin Purified Protein 1 mg | Millipore Sigma | FC010 | |
| Immersion Oil | Cargille | 16241 | |
| L-Glutamine Solution (200 mM) | Wisent Bioproducts | 609-065-EL | |
| MEM Non-Essential Amino Acids Solution (100X) | Gibco | 11140050 | |
| Micro Cover Glasses, Square, No. 11/2 22 x 22 mm | VWR | CA48366-227-1 | |
| Microscope Body, Eclipse Ti2-E | Nikon | ||
| Objective, CFI Plan Apo Lambda 60X Oil | Nikon | MRD01605 | |
| Penicillin-Streptomycin | Sigma | P4333 | |
| Spinning Disk, Crest Light V2 | CrestOptics | ||
| Spyder | Anaconda | ||
| Stage top incubator | Tokai Hit | ||
| Statistics Software, Prism | GraphPad | ||
| Tweezers, Style 2 | Electron Microscopy Sciences | 78326-42 |
Referanslar
- Mullins, R. D., Heuser, J. A., Pollard, T. D. The interaction of Arp2/3 complex with actin: Nucleation, high affinity pointed end capping, and formation of branching networks of filaments. Proceedings of the National Academy of Sciences. 95 (11), 6181-6186 (1998).
- Yang, C., Czech, L., Gerboth, S., Kojima, S., Scita, G., Svitkina, T. Novel Roles of Formin mDia2 in Lamellipodia and Filopodia Formation in Motile Cells. PLoS Biology. 5 (11), 317 (2007).
- Mogilner, A., Oster, G. Cell motility driven by actin polymerization. Biophysical Journal. 71 (6), 3030-3045 (1996).
- Mogilner, A., Oster, G. Force Generation by Actin Polymerization II: The Elastic Ratchet and Tethered Filaments. Biophysical Journal. 84 (3), 1591-1605 (2003).
- Pollard, T. D., Borisy, G. G. Cellular Motility Driven by Assembly and Disassembly of Actin Filaments. Cell. 112 (4), 453-465 (2003).
- Wu, C., et al. Arp2/3 is critical for lamellipodia and response to extracellular matrix cues but is dispensable for chemotaxis. Cell. 148 (5), 973-987 (2012).
- Steffen, A., et al. Rac function is crucial for cell migration but is not required for spreading and focal adhesion formation. Journal of cell science. 126, 4572-4588 (2013).
- Gupton, S. L., et al. Cell migration without a lamellipodium. The Journal of Cell Biology. 168 (4), 619-631 (2005).
- Dimchev, V., et al. Induced Arp2/3 Complex Depletion Increases FMNL2/3 Formin Expression and Filopodia Formation. Frontiers in Cell and Developmental Biology. 9, 634708 (2021).
- Leithner, A., et al. Diversified actin protrusions promote environmental exploration but are dispensable for locomotion of leukocytes. Nature cell biology. 18 (11), 1253-1259 (2016).
- Giannone, G., Dubin-Thaler, B. J., Döbereiner, H. -. G., Kieffer, N., Bresnick, A. R., Sheetz, M. P. Periodic Lamellipodial Contractions Correlate with Rearward Actin Waves. Cell. 116 (3), 431-443 (2004).
- Dubin-Thaler, B. J., et al. Quantification of Cell Edge Velocities and Traction Forces Reveals Distinct Motility Modules during Cell Spreading. PLoS ONE. 3 (11), 3735 (2008).
- Suraneni, P., Rubinstein, B., Unruh, J. R., Durnin, M., Hanein, D., Li, R. The Arp2/3 complex is required for lamellipodia extension and directional fibroblast cell migration. The Journal of cell biology. 197 (2), 239-251 (2012).
- Wang, C., et al. Deconvolution of subcellular protrusion heterogeneity and the underlying actin regulator dynamics from live cell imaging. Nature Communications. 9 (1), 1688 (2018).
- Dimchev, G., et al. Lamellipodin tunes cell migration by stabilizing protrusions and promoting adhesion formation. Journal of cell science. 133 (7), 239020 (2020).
- Burnette, D. T., et al. A role for actin arcs in the leading-edge advance of migrating cells. Nature cell biology. 13 (4), 371-381 (2011).
- Yamada, K. M., Kennedy, D. W. Dualistic nature of adhesive protein function: fibronectin and its biologically active peptide fragments can autoinhibit fibronectin function. The Journal of Cell Biology. 99 (1), 29-36 (1984).
- Cai, Y., et al. Nonmuscle Myosin IIA-Dependent Force Inhibits Cell Spreading and Drives F-Actin Flow. Biophysical Journal. 91 (10), 3907-3920 (2006).
- Humphries, M. J. Cell adhesion assays. Molecular Biotechnology. 18 (1), 57-61 (2001).
- Cavalcanti-Adam, E. A., Volberg, T., Micoulet, A., Kessler, H., Geiger, B., Spatz, J. P. Cell Spreading and Focal Adhesion Dynamics Are Regulated by Spacing of Integrin Ligands. Biophysical Journal. 92 (8), 2964-2974 (2007).
- Dubin-Thaler, B. J., Giannone, G., Döbereiner, H. -. G., Sheetz, M. P. Nanometer Analysis of Cell Spreading on Matrix-Coated Surfaces Reveals Two Distinct Cell States and STEPs. Biophysical Journal. 86 (3), 1794-1806 (2004).
- Gauthier, N. C., Fardin, M. A., Roca-Cusachs, P., Sheetz, M. P. Temporary increase in plasma membrane tension coordinates the activation of exocytosis and contraction during cell spreading. Proceedings of the National Academy of Sciences. 108 (35), 14467-14472 (2011).
- Wolfenson, H., Iskratsch, T., Sheetz, M. P. Early Events in Cell Spreading as a Model for Quantitative Analysis of Biomechanical Events. Biophysical Journal. 107 (11), 2508-2514 (2014).
- Guan, J. -. L., Berrier, A. L., LaFlamme, S. E. Cell Migration, Developmental Methods and Protocols. Methods in molecular biology. 294, 55-68 (2004).
- Raucher, D., et al. Phosphatidylinositol 4,5-Bisphosphate Functions as a Second Messenger that Regulates Cytoskeleton-Plasma Membrane Adhesion. Cell. 100 (2), 221-228 (2000).
- Machacek, M., Danuser, G. Morphodynamic Profiling of Protrusion Phenotypes. Biophysical Journal. 90 (4), 1439-1452 (2006).
- Zack, G. W., Rogers, W. E., Latt, S. A. Automatic measurement of sister chromatid exchange frequency. The journal of histochemistry and cytochemistry official journal of the Histochemistry Society. 25 (7), 741-753 (1977).
- Bardsley, W. G., Aplin, J. D. Kinetic analysis of cell spreading. I. Theory and modelling of curves. Journal of cell science. 61, 365-373 (1983).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır