Method Article
In Vitro Gelişimsel Mekanobiyolojiyi İncelemek için Çip Üzerinde Fetal İnsan Gemisi Modeli
Bu Makalede
Özet
Burada açıklanan, endotel hücrelerini insan pluripotent kök hücrelerinden ayırt etmek için basit bir iş akışı ve ardından mekanik stimülasyonları için ayrıntılı bir protokoldür. Bu, endotel hücrelerinin gelişimsel mekanobiyolojisinin incelenmesine izin verir. Bu yaklaşım, mekanik stimülasyondan sonra kültür çipinden toplanan canlı hücrelerin aşağı akış testleriyle uyumludur.
Özet
Kalp, gelişim sırasında işlevsel olarak kurulan ilk organdır, bu nedenle gebeliğin çok erken dönemlerinde kan dolaşımını başlatır. Fetal dolaşım, fetal büyümeyi sağlamak için oksijen ve besinlerin taşınmasının yanı sıra, endotel tabakasında meydana gelen birçok önemli gelişimsel olayı mekanik ipuçları aracılığıyla kontrol eder. Biyomekanik sinyaller kan damarı yapısal değişikliklerini indükler, arteriyovenöz spesifikasyonu oluşturur ve hematopoietik kök hücrelerin gelişimini kontrol eder. Gelişmekte olan dokuların erişilemezliği, dolaşımın erken insan gelişimindeki rolünün anlaşılmasını sınırlar; Bu nedenle, in vitro modeller, damar mekanobiyolojisi çalışması için çok önemli araçlardır. Bu makale, endotel hücrelerini insan kaynaklı pluripotent kök hücrelerden ayırt etmek ve daha sonra mekanik ipuçlarına tepkilerini incelemek için akışkan bir cihaza tohumlanmaları için bir protokolü açıklamaktadır. Bu yaklaşım, mekanik stimülasyon altında endotel hücrelerinin uzun süreli kültürüne ve ardından fenotipik ve fonksiyonel karakterizasyon için endotel hücrelerinin alınmasına izin verir. Burada oluşturulan in vitro model, insan fetal yaşamı boyunca damar gelişimini düzenleyen mekanik ipuçlarının aracılık ettiği sinyallemeyi ileten hücre içi moleküler mekanizmaları aydınlatmak için etkili olacaktır.
Giriş
Embriyonik gelişim sırasında kalp, endokardiyal tüp oluşumunun en erken aşamasından itibaren saptanabilir kasılmalarla1 işlevsellik 1 kuran ilk organdır2. Dolaşım, damar içindeki kan akışının aracılık ettiği mekanik ipuçlarıyla birlikte, erken gelişimin birçok önemli yönünü kontrol eder. Fetal dolaşım kurulmadan önce, vaskülatür primer bir kapiller pleksus halinde düzenlenir; Kardiyak fonksiyon üzerine, bu pleksus venöz ve arteriyel vaskülatür3 olarak yeniden düzenlenir. Arteriyovenöz spesifikasyonda mekanik ipuçlarının rolü, kan akışı başlamadan önce arteriyel ve venöz belirteçlerin pan-endotelyal ekspresyonu ile yansıtılmaktadır4.
Hemodinamik kuvvetler sadece damar sisteminin gelişimini kontrol etmekle kalmaz, aynı zamanda kan hücresi oluşumunun kontrolünde de temel bir rol oynar. Hematopoetik kök ve progenitör hücreler (HSPC'ler), embriyoların farklı anatomik bölgelerinde sadece gelişimin erken evresinde bulunan hemojenik endotel 5,6,7,8 adı verilen özel endotel hücrelerinden ortaya çıkar. Kalp yetmezliği olan modeller, in vitro modellerle birlikte, mekanik ipuçlarının hemonojenik endoteldenHSPC üretimini yönlendirdiğini ve artırdığını göstermiştir 9,10,11,12,13,14.
Farklı akış dinamiğinin, hem hemojenik endotel 16,17 hem de arteriyel hücre spesifikasyonu18'de önemli olduğu bilinen hücre döngüsünü 15 farklı şekilde kontrol ettiği gösterilmiştir. Toplamda, mekanik ipuçları, gelişim sırasında hücre kimliğinin ve işlevinin kritik belirleyicileridir. Yeni in vitro akışkan cihazlar, in vivo insan kanı gelişimi sırasında gelişimsel mekanobiyoloji çalışmasıyla ilgili sınırlamaların üstesinden gelmemizi sağlar.
Bu makaledeki protokolün genel amacı, insan kaynaklı pluripotent kök hücrelerden (hiPSC'ler) in vitro türetilen insan endotel hücreleri üzerindeki kayma geriliminin etkisini incelemek için deneysel boru hattını adım adım tanımlamaktır. Bu protokol, hiPSC'lerin endotel hücrelerine farklılaşması ve daha sonra stimülasyon protokolü için akışkan çiplere tohumlanması hakkında ayrıntılı talimatlar içerir. Bunu kullanarak, farklı in vitro türevli endotel hücreleri, akışa yanıt olarak yönelimlerini analiz ederek kayma stresini algılama yetenekleri açısından test edilebilir. Bu, diğer laboratuvarların kayma stresine verilen yanıt ve bunun farklı endotel hücre kimlikleri üzerindeki fonksiyonel sonuçları hakkındaki soruları ele almasına izin verecektir.
Protokol
NOT: Tüm hücre kültürü teknikleri steril koşullar altında laminer akış başlığında yapılmalı ve hücreler 37 °C'de %5CO2 içeren humifiye bir atmosferde inkübe edilmelidir. Hem idame (rhbFGF) hem de farklılaşma protokolü (rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3) için tüm sitokin preparatları için talimatlar Ek Tablo S1'dedir.
1. hiPSC'lerin kültürlenmesi - hücrelerin çözülmesi, bakımı ve dondurulması
- Bakım ortamının, büyüme faktörlerinin ve diğer reaktiflerin hazırlanması
- Dulbecco'nun Modifiye Eagle Medium/F12 (DMEM/F-12) bazal ortamına tüm hESC'lerin serumsuz ortam takviyesi, 36 mL %25 sığır serum albümini (BSA) ve 1 mL 55 mM β-merkaptoetanol ekleyerek kültür ortamını hazırlayın (bkz.
- 1 mg Rho Kinaz inhibitörünü (iRock) 1 mL DMSO içinde yeniden süspanse edin, 50 μL'lik alikotlar yapın ve bunları -20 ° C'de saklayın.
NOT: Bu alikotlar -20 °C'de 1 yıl saklanabilir. Çözüldükten sonra 4 °C'de 1 hafta bekletilebilir. - Vitronektin (VTN-N) çözeltisini buz üzerinde çözdürün ve -80 ° C'de saklamadan önce flakon başına 60 μL alikotlayın. Plakaları kaplamadan hemen önce, 60 μL'lik stoğu 6 mL Dulbecco'nun fosfat tamponlu salininde (DPBS) seyreltin; 5 μg/mL'lik son konsantrasyon.
- hiPSC hücre hattı çözülmesi
NOT: İnsan pluripotent kök hücre hattı SFCi55 daha önce şirket içinde türetilmiştir ve çeşitli hücre tiplerine ve farklı embriyonik soylarafarklılaşma için yaygın olarak kullanılmıştır 19,20,21,22.- 37 ° C'de 1 saat boyunca 1 mL VTN-N çözeltisi ile 6 oyuklu bir plakanın bir kuyusunu kaplayın.
NOT: İnkübasyondan sonra, kaplanmış plakalar 4 °C'de 1 haftaya kadar saklanabilir. - VTN-N çözeltisini bir aspirasyon pipeti ile aspire edin ve 20 ng/mL rhbFGF ile desteklenmiş 1 mL önceden ısıtılmış kültür ortamı ekleyin (Ek Tablo S1).
- Bir su banyosunda hiPSC'leri içeren şişenin buzunu hızla çözün ve hücreyi 5 mL önceden ısıtılmış kültür ortamına aktarın.
- Hücreleri oda sıcaklığında 300 × g'da 3 dakika döndürün.
- Hücre peletini 20 ng/mL rhbFGF ile takviye edilmiş 0.5 mL kültür ortamında yeniden süspanse edin.
- Hücreleri, zaten 1 mL ortam içeren kaplanmış bir kuyucuğa aktarın.
- Toplam 1,5 mL besiyerinde hücreleri içeren kuyucuklara 5 μL iRock ekleyin.
- Hücreleri inkübatörde kültürleyin, hafta boyunca günlük olarak ortamı değiştirin ve hafta sonu beslenmeyi sağlamak için hücrelere normal hacmin iki katı ortam ekleyerek hücreleri iki kez besleyin.
NOT: Hücreler iRock varlığında yalnızca 24 saat büyütülür.
- 37 ° C'de 1 saat boyunca 1 mL VTN-N çözeltisi ile 6 oyuklu bir plakanın bir kuyusunu kaplayın.
- hiPSC'lerin bakımı ve geçirilmesi
- Ortamı günlük olarak 20 ng / mL rhbFGF ile desteklenmiş taze önceden ısıtılmış kültür ortamı ile değiştirin.
- Hücreleri, genellikle haftada iki kez, yaklaşık% 80 birleşmeye ulaştıklarında geçirin.
- Hücreleri geçmek için, daha önce 1.2.1 ve 1.2.2 adımlarında açıklandığı gibi bir plakayı VTN-N ile kaplayın.
- Ortamı kuyulardan hücrelerle aspire edin ve DPBS ile yıkayın.
- DPBS'yi aspire edin ve 1 mL ayrışma reaktifi ekleyin ( Malzeme Tablosuna bakınız) ve 1 dakika inkübe edin.
- Ayrışma reaktifini aspire edin ve 3 dakika daha inkübe edin. Plakaya her iki taraftan 10 kez sıkıca vurun.
NOT: Ayrışma adımı, inkübasyon süresinde ve kılavuz çekme prosedüründe hücre tipine özel optimizasyona ihtiyaç duyabilir. - Hücrelere 1 mL kültür ortamı ekleyin ve bir Pasteur pipeti ile kolonilerin çoğunun toplanmasını sağlamak için ortamla bir kez yıkayın.
- 6'ya 1 kuyucuklu bir geçiş oranı sağlamak için her bir oyuğa 150 μL hücre süspansiyonu ekleyin.
NOT: Yeni bir şişenin çözülmesinden hemen sonra, hücrelerin 1: 6 oranında geçmeden önce sabit bir büyüme aşamasına ulaşmalarını sağlamak için bir veya iki geçiş için 1: 1 veya 1: 2 gibi daha düşük bir oranda geçmek daha iyidir. - İnkübatördeki hücreleri kültürleyin, ortamı hafta boyunca günlük olarak değiştirin ve hücreleri hafta sonu bir kez iki kez besleyin.
- hiPSC'ler hücre hattı donuyor
NOT: Kültürü başlatmak için sabit bir düşük geçişli donmuş şişe partisinin korunmasını sağlamak için çözdürüldükten sonra hücreleri ilk iki geçişlerinde dondurun. Yaklaşık% 80'lik bir birleşmeye ulaştıklarında hücreleri dondurun.- Ortamı 20 ng/mL rhbFGF ve 5 μL iRock ile desteklenmiş taze önceden ısıtılmış kültür ortamına değiştirin ve en az 1 saat inkübe edin.
- Hücreleri 1.3.2.2-1.3.2.5 adımlarında açıklandığı gibi ayırın.
- Ayrılan hücreleri, 5 mL kültür ortamı içeren 15 mL'lik bir santrifüj tüpünde toplayın.
- Oda sıcaklığında 300 × g'da 3 dakika santrifüjleyin.
- Süpernatanı aspire edin ve 1 mL kriyoprezervasyon solüsyonu ekleyin (bkz.
- Bir Pasteur pipeti kullanarak, kriyoprezervasyon solüsyonunda karıştırmak için hücreleri nazikçe yukarı ve aşağı pipetleyin.
NOT: Hücre kümelerinin ayrışmasına neden olabilecek aşırı pipetlemeden kaçının. - Hücre süspansiyonunu her biri 0,5 mL'lik iki kriyoprezervasyon şişesine bölün.
- Kriyoprezervasyon şişelerini 4 °C'de önceden soğutulmuş bir kriyoprezervasyon kabına aktarın.
- Şişeleri uzun süreli saklama için sıvı nitrojene aktarmadan önce hücrelerle birlikte kabı 24 saat boyunca -80 °C'lik bir dondurucuya aktarın.
2. HiPSC'lerin endotel hücrelerine farklılaşması
- Farklılaşma ortamı, sitokinler ve büyüme faktörlerinin hazırlanması
- Tablo 1'e göre serumsuz farklılaşma ortamı (SFD) hazırlayın. Bu ortamı 0. günden 5. güne kadar kullanın.
- 34 SFM Bazal Ortama 34 besin takviyesi ve 5 mL L-glutamin takviyesi ekleyerek CD34+ hücreleri (SFM-34) için serumsuz ortam hazırlayın (bkz. Bu ortamı, farklılaşmanın 6. gününden itibaren kullanın.
- 3 mM'lik bir çözelti elde etmek için 716 μL DMSO'da 1 mg CHIR99021 yeniden süspanse edin. Tamamen yeniden süspanse olana kadar oda sıcaklığında inkübe edin; gerekirse 37 °C'de hızlı bir şekilde ısıtın. 20 μL'lik alikotlar yapın ve -20 °C'de 6 aya kadar saklayın. Çözdürdükten hemen sonra kullanın ve tekrar dondurmayın veya saklamayın.
- Sitokinleri Ek Tablo S1'deki talimatlara göre yeniden süspanse edin. Tüm sitokinlerin alikotlarını -80 °C'de saklayın.
- Endotel hücrelerinin farklılaşması
NOT: Farklılaşmanın her günü için, 18 mL (3 mL ortam/kuyu) önceden ısıtılmış SFD ortamı, aşağıda açıklanan sitokinlerin karışımlarına göre hazırlayın. Tablo 2.- 0. Gün - embriyoid cisimciklerinin (EB'ler) oluşumu
- Her 6 oyuklu plaka (3 mL / kuyucuk) için Tablo 2'ye göre 1 sitokin ile 18 mL SFD ortamı hazırlayın.
- Hücre itici 6 oyuklu bir plakanın her bir oyuğuna 1 sitokin karıştırarak 2 mL önceden ısıtılmış SFD ortamı ekleyin (bkz.
- EB'leri oluşturmak için 1.3.2.2-1.3.2.4 adımlarında açıklanan adımları izleyin.
NOT: Farklılaşmayı başlatmak için hiPSC'lerin %70-80 oranında birleştiğinden emin olun. - Ayrılmış hücre kümelerinin her bir kuyucuğuna 1 sitokin karıştırarak 1 mL önceden ısıtılmış SFD ortamı ekleyin.
- Hücre kümelerini 1:1 oranında EB oluşumu için tek bir hücre itici kuyuya nazikçe aktarmak için bir Pasteur pipeti kullanın.
- Plakayı inkübatöre yerleştirdikten sonra, EB'leri kuyuya eşit şekilde dağıtmak için ileri ve geri, sağa ve sola hareket ettirin.
- 1. Gün - EB'lerde orta düzeyde değişiklik
NOT: Bu adım yalnızca, farklılaşmanın 1. gününe kadar, EB'lerin yanında süspansiyonda çok sayıda tek hücre varsa gereklidir.- Her 6 oyuklu plaka (3 mL / kuyucuk) için Tablo 2'ye göre 1 sitokin ile 18 mL SFD ortamı hazırlayın.
- Plakayı EB'lerle döndürerek merkeze taşıyın ve bir Pasteur pipeti kullanarak 15 mL'lik bir santrifüj tüpüne toplayın.
NOT: EB'ler dizilerde olduğu gibi kümelenmiş görünüyorsa, 1000 mL'lik santrifüj tüpüne toplamadan önce bir P15 ile yukarı ve aşağı pipetleyerek ayırın. - EB'lerin tüpün dibine yerleşmesi için 5-10 dakika bekleyin.
NOT: EB'ler çok küçükse, yerleşmelerine yardımcı olmak için 100 × g'da 5 dakika santrifüj edin. - Tek hücreleri veya kalıntıları temizlemek için hücre itici plakaları steril su veya DPBS ile yıkayın.
- Süpernatanı EB'lerden yerinden çıkarmadan dikkatlice ve yavaşça aspire edin.
- Hücre itici plakaların her bir oyuğuna Mix 1 sitokin ile 2 mL SFD ekleyin.
- Her başlangıç kuyucuğu için 1 sitokin karışımı ile 1 mL SFD ortamı kullanarak EB'leri yeniden süspanse edin - 6 oyuklu bir plaka için 6 mL ortam ekleyin.
- EB'leri, zaten 2 mL SFD ortamı içeren oyuk başına 1 mL hacimde hücre itici plakalara aktarın.
- Plakayı inkübatöre yerleştirdikten sonra, EB'leri kuyuya eşit şekilde dağıtmak için ileri ve geri, sağa ve sola hareket ettirin.
- 2. Gün - CHIR99021 eklenmesi
- EB'leri plakanın ortasına döndürün ve hücrelerle doğrudan temastan kaçınmak için kuyunun yan tarafına Tablo 2'ye göre CHIR99021 ekleyin.
NOT: Ortam 1. günde değiştirilmediyse, yalnızca CHIR eklemek yerine tüm ortamı değiştirin. Her 6 oyuklu plaka (3 mL/kuyucuk) için Tablo 2'ye göre Karışım 2 ile 18 mL SFD ortamı hazırlayın. - Plakayı inkübatöre yerleştirdikten sonra, EB'leri kuyuya eşit şekilde dağıtmak için ileri ve geri, sağa ve sola hareket ettirin.
- EB'leri plakanın ortasına döndürün ve hücrelerle doğrudan temastan kaçınmak için kuyunun yan tarafına Tablo 2'ye göre CHIR99021 ekleyin.
- 3. Gün - EB'lerde orta değişim ve Mix 3 sitokinlerinin eklenmesi
- Her 6 oyuklu plaka (3 mL / kuyucuk) için Tablo 2'ye göre 3 sitokin karıştırın ile 18 mL SFD ortamı hazırlayın.
- EB'leri 2.2.2.2-2.2.2.4 adımlarında açıklandığı gibi toplayın.
- Hücre itici plakalara 3 sitokin karışımı ile önceden ısıtılmış 2 mL SFD ortamı ekleyin.
- Süpernatanı EB'lerden dikkatlice aspire edin. Mix 3 sitokin ile 1 mL / kuyu SFD ekleyin.
- EB'leri 2.2.2.8-2.2.2.9 adımlarında açıklandığı gibi kuyular arasında dağıtın.
- 6. Gün - SFM-34 için orta değişim ve Mix 4 sitokinlerinin eklenmesi
- Her 6 oyuklu plaka (3 mL / kuyucuk) için Tablo 2'ye göre 4 sitokin karıştırın ile 18 mL SFD ortamı hazırlayın.
- EB'leri 2.2.2.2-2.2.2.4 adımlarında açıklandığı gibi toplayın.
- Hücre itici plakalara 2 mL önceden ısıtılmış SFM-34 ortamı Mix 4 sitokin ekleyin.
- Süpernatanı EB'lerden dikkatlice aspire edin. Mix 4 sitokinleri ile 1 mL / kuyu SFM-34 ekleyin.
- EB'leri 2.2.2.8-2.2.2.9 adımlarında açıklandığı gibi kuyular arasında dağıtın.
- 0. Gün - embriyoid cisimciklerinin (EB'ler) oluşumu
3. CD34 + hücre izolasyonu ve çipe tohumlama
NOT: CD34+ hücreleri, monoklonal fare antikorları, anti-insan CD34 antikorları ve FcR Bloke edici reaktife (İnsan IgG) konjuge CD34 mikroboncukları içeren bir CD34 mikroboncuk kiti (Malzeme Tablosuna bakınız) ile pozitif bir izolasyon yaklaşımı ile izole edilir. Akış sitometrisi analizi için izolasyondan önce ve sonra hücreleri boyayarak kolon izolasyonunun verimliliğini doğrulamak önemlidir, Aşağıda bu analiz için hücrelerin ne zaman alınması gerektiği belirtilmiştir.
- Malzemeleri ve reaktifleri hazırlayın.
- PBS +% 0.5 BSA + 2 mM EDTA elde etmek için 5 mL %5 BSA çözeltisi ve 200 μL EDTA 0.5 M ila 45 mL DPBS ekleyerek yıkama tamponu hazırlayın. Her izolasyon için taze hazırlayın, filtreyle sterilize edin ve kullanıma kadar buzdolabında saklayın.
- Akışkan cipsleri, rhLaminin 521 1:50'nin DPBS Ca 2+ Mg2+ içinde seyreltilmesiyle hazırlanan laminin çözeltisi ile kaplayın. Her bir çipi, kullanılan çip için uygun hacimle kaplayın ve tohumlamadan önce 2 saat inkübatörde inkübe edin.
NOT: Kaplama için başka matrisler kullanılabilir ve spesifik hücre tipi/deney için test edilmelidir. - Tablo 2'ye göre 18 mL SFM-34 ortamını Mix 4 sitokin ile destekleyerek Mix 4 SFM-34 besiyerini hazırlayın ve karışımı, gaz değişimini kolaylaştırmak için kapağı hafifçe çevrilmemiş olarak inkübatörde 50 mL'lik bir tüpe yerleştirin.
- Seçilen perfüzyon setlerini ve inkübatörde kullanılacak diğer boruları gazdan arındırmak için yerleştirin.
- 8. Gün - EB'lerin ayrışması ve CD34+ izolasyonu
- EB'leri 2.2.2.2-2.2.2.5 adımlarında açıklandığı gibi toplayın.
- Toplanan EB'lerin başlangıç kuyucuğu başına 1 mL hücre ayrışma reaktifi ekleyin (6 kuyucuk toplanmışsa, 6 mL ekleyin).
- Hücre ayrışma reaktifindeki EB süspansiyonunun 1 mL'sini hücre itici plakanın her bir oyuğuna geri aktarın.
- Kuluçka makinesinde 10 dakika inkübe edin.
- EB'leri bir P1000 ile en fazla 10 kez olmak üzere kuyuya doğru yukarı ve aşağı nazikçe pipetleyin.
- 3.2.4-3.2.5. adımlarını toplam 3x için tekrarlayın.
NOT: EB'lerin ayrışması zorsa, yukarıdaki adımları toplamda 4 kez tekrarlayın. - Ayrışmış EB'lerin her bir oyuğu için 5 mL yıkama tamponu ekleyin.
- Hücreleri 40 μm'lik bir süzgeçten geçirerek 50 mL'lik bir santrifüj tüpüne toplayın. Hücreleri saymak için 10 μL hücre süspansiyonu alın.
NOT: İzolasyonun etkinliğini test etmek için, 105 hücreyi/tüpü, daha sonra akış sitometrisi için kullanılacak iki farklı tüpe (boyanmamış kontrol ve önceden sıralanmış test numunesi) aktarın (4.3.9-4.3.13 adımlarında açıklandığı gibi). 6 oyuklu bir plaka için, filtrasyondan sonra ~ 106 hücre toplanmalıdır. - Hücreleri 300 × g'da 10 dakika döndürün.
- Hücreleri 300 μL yıkama tamponunda yeniden süspanse edin, topak olmadığından emin olmak için birkaç kez hafifçe pipetleyin. Üreticinin protokolünü takip etmeye devam edin (bkz. Malzeme Tablosu).
- CD34+ hücresinin akışkan çiplere tohumlanması
NOT: Protokolde kullanılan akışkan çip, toplam 2,5cm2 büyüme alanı için 0,6 mm kanal yüksekliğine ve 50 mm uzunluğa sahiptir (Ek Şekil S1). Bu tip çip, toplam 150 μL hücre süspansiyonu hacmi ile tohumlanır. Farklı cipsler kullanılabilir ve tohumlama hacmi ve hücre yoğunluğu büyüme alanına göre uyarlanmalıdır. Kullanılan hücre hattına ve büyümesine bağlı olarak ek optimizasyon gerekebilir.- İzole edilmiş CD34+ hücrelerini, 300 μL önceden ısıtılmış SFM-34 ortamında Mix 4 sitokinleri ile yeniden süspanse edin.
- Hücre süspansiyonunun 10 μL'sini alın ve hücreleri sayın.
- SFM-34 takviyeli 150 μL'lik bir son hacimde 2.5 ×10 5 hücreyi yeniden süspanse edin; 0,5 μL iRock ekleyin.
NOT: İzolasyonun etkinliğini test etmek için, 105 hücreyi/tüpü daha sonra akış sitometrisi için kullanılacak bir tüpe (sıralanmış test numunesi) aktarın (4.3.9-4.3.13 adımlarında açıklandığı gibi). - Bir P200'ün ucunu kanalın kenarındaki rezervuarın içine koyarak laminini akışkan talaşlardan yavaşça aspire edin.
NOT: Sıvının toplanması zorsa, sıvının karşı hazneye hareket etmesine yardımcı olmak için çipin bir tarafını yavaşça kaldırın. - Kabarcık oluşmadığından emin olmak için hücre süspansiyonunu kanala sabit bir şekilde ekleyin.
NOT: Lamininin kurumasını ve çip kanallarında kabarcık oluşumunu önlemek için 3.3.4-3.3.5 adımlarını hızlı ama nazikçe gerçekleştirin. Kabarcıklar oluşursa, çipin bir tarafını kaldırın ve kabarcıkları harekete geçirmek için sürgüye hafifçe vurun; Rezervuara ulaştıklarında hava arayüzüne yükselecekler ve kanalı kiralayamayacaklar. - Çipi inkübatöre aktarın ve gece boyunca bırakın, böylece hücreler kanala tamamen bağlanır ve uzun görünür.
- Hücreler tamamen bağlandığında, besiyerini adım 3.3.4'teki gibi aspire edin ve 200 μL sitokin takviyeli SFM-34 ile değiştirin.
- Şu andan itibaren, hücreler% 90 -% 100 birleşmeye ulaşana kadar ortamı günlük olarak değiştirin.
4. Endotel hücrelerine sürekli akış uygulaması - Aort-on-a-chip
- Malzemeleri ve reaktifleri hazırlayın.
- Tablo 2'ye göre 18 mL SFM-34 ortamını Mix 4 sitokin ile takviye ederek Mix 4 SFM-34 ortamını hazırlayın ve gaz değişimini kolaylaştırmak için kapağı hafifçe çevrilmiş olarak inkübatörde 50 mL'lik bir tüpe yerleştirin.
- Seçilen perfüzyon setlerini ve akışkan kurulumu için kullanılacak herhangi bir boruyu inkübatöre gazdan arındırmak için yerleştirin.
- Akışkan sistem montajı
- Perfüzyon setini üreticinin protokolüne göre üniteye takın.
NOT: cl kullanmayı unutmayınamps sistemde. Bu adım için kayar kelepçeler kullanılıyorsa, çipe bağlanmadan önce boru üzerinde kaydırılmaları gerekir. - Yeni bir akışkan çip takın ve sitokin takviyeli SFM-34 ortamını ekleyin, her iki rezervuarı da başlıktaki steril koşullar altında doldurduğunuzdan emin olun.
- Kabarcık giderme programını ve kalibrasyon adımını gerçekleştirin.
- Bağlı setli akışkan üniteyi inkübatörden çıkarın ve davlumbaza aktarın; Hücreleri içeren cipsleri de inkübatörden alın.
- Boruyu test çipinin her iki tarafına sıkıştırın.
- Hortumu test çipinden çıkarın.
NOT: Borunun ucundaki Luer konektöründe kabarcık olmadığını kontrol edin. Kabarcıklar görünüyorsa, bunları bir P200 pipeti kullanarak dikkatlice aspire edin ve gerekirse konektörün ortamla doldurulduğundan emin olmak için daha fazla ortam ekleyin. - Hücreleri içeren çipi boruya bağlayın.
- Kelepçeleri çıkarın veya açın.
- Sistemi inkübatöre aktarın ve hava pompasını akışkan ünitesine bağlayın.
- Pompaya özel yazılımı (Ek Şekil S2) kullanarak önceden seçilmiş programı, Tablo 3'te açıklanan kesme geriliminin kademeli olarak artırılmasıyla başlatın.
NOT: İhtiyaç duyulan belirli deneye bağlı olarak, stimülasyon programının optimizasyona ihtiyacı olabilir. Burada tarif edilen, fetal dolaşımın başlangıcında dorsal aort duvarı tarafından yaşandığı hesaplanan kayma gerilimini taklit eden 5 dyn/cm2'lik nihai değere yol açan kademeli bir kayma gerilimi artışıdır 9. Kullanılacak son kesme geriliminden bağımsız olarak, hücrelerin çipten ayrılmasına neden olmadan hücrelerin kuvvete uyum sağlamasına izin vermek için zaman içinde kademeli olarak artırmak gerekir. Seçilen stimülasyon protokolü 3 günden uzunsa, normalde 18 mL'ye eklenecek olan Mix 4 sitokinlerini içeren 1 mL SFM-34 eklenerek sitokinler sisteme eklenmelidir. Bunu yapmak için, pompa programı hızlı bir şekilde duraklatılır ve akışkan setindeki iki şırınganın her birine 500 μL ek ortam eklenir.
- Perfüzyon setini üreticinin protokolüne göre üniteye takın.
- Analiz için hücre toplama
- Ayrışma tamponunu bir su banyosunda önceden ısıtın.
- Akışkan üniteyi inkübatörden çıkarın ve davlumbazın içine taşıyın.
- Boruyu her iki taraftan talaşın etrafına sıkıştırın ve boruyu çip üzerindeki rezervuarlardan çıkarın.
- Ortamı çipten yavaşça çıkarın ve hücreleri yıkamak için DPBS Ca 2+ Mg2+ ile değiştirin.
NOT: Hücreler ayrılmaya başlarsa, PBS ile yıkamanın bu adımı atlanabilir. - Yavaşça 150 μL ayrışma tamponu ekleyin ve 37 °C'de 3 dakika inkübe edin.
NOT: Hücrelerin tek ve müstakil olup olmadığını mikroskop altında kontrol edin; Aksi takdirde, 2 dakika daha inkübe edin. Çip, pipetleme yoluyla hücre ayrılmasına yardımcı olmadığından, ortamı aspire etmeden önce hücrelerin kanaldan tamamen ayrılması önemlidir. Hücreleri ayırmak için tripsin veya EDTA bazlı tamponlar gibi başka çözeltiler de kullanılabilir. - Hücreleri içeren ayrışma tamponunu bir rezervuardan toplayın ve 15 mL'lik bir santrifüj tüpüne aktarın ve tüm ayrılmış hücreleri toplamak için kanalı bir kez DPBS ile yıkayın.
- Hücrelerle birlikte 15 mL'lik tüpe 1 mL yıkama tamponu ekleyin ve hücreleri saymak için 10 μL alın.
- Hücre süspansiyonunu akış sitometri tüplerine, test tüpü başına 105 hücreye sahip olacak şekilde bölün.
- Tüpleri 300 × g'da 5 dakika döndürün.
- Boyama solüsyonunu, her test tüpünün boyanması için 50 μL'ye sahip olacak şekilde hazırlayın. CD34 PerCP-efluor710 veya CD34-PE'yi sırasıyla 1:100 ve 1:200 seyreltmede ekleyin.
- Hücreleri 50 μL boyama çözeltisinde yeniden süspanse edin ve 4 ° C'de 30 dakika inkübe edin.
- Hücreleri 2 mL yıkama tamponu ekleyerek yıkayın ve 300 × g'da 5 dakika döndürün.
- Peletleri 100 μL boyama çözeltisinde yeniden süspanse edin ve bir akış sitometresi kullanarak verileri elde edin.
NOT: Hücreler ayrıca 150 μL RNA lizis tamponu kullanılarak RNA ekstraksiyonu için doğrudan çipte parçalanabilir veya oda sıcaklığında 10 dakika boyunca DPBS'de% 4 paraformaldehit kullanılarak görüntüleme için sabitlenebilir.
- Hücre oryantasyon analizi
- FIJI23 (Ek Şekil S3) kullanarak hücre yönündeki değişiklikleri ölçmek için görüntüleri analiz edin.
- İlgi Bölgesi (ROI) yöneticisini Analiz | Araçlar | ROI yöneticisi menüsü.
- Poligon seçim aracını kullanarak hücre konturlarını manuel olarak çizin ve Ekle'ye tıklayarak veya CTRL+T kısayolunu kullanarak bunları ROI yöneticisine ekleyin.
- Analiz | Ölçümler menüsünü ayarlayın .
- Ölçümü Tüm ROI'lere Daha fazla... ROI yöneticisinde çoklu ölçüm komutu.
NOT: Bu adım, her ROI'ye bir elips sığdıracak ve açının yanı sıra büyük ve küçük elips eksenlerinin uzunluğunu içeren bir tablo oluşturacaktır. - Tabloyu, çizmek için başka bir yazılıma aktarılacak bir CSV dosyasına aktarın.
NOT: Çizimler için kullanılan komut dosyası şu adreste mevcuttur: https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ddc'yi seçin.
- FIJI23 (Ek Şekil S3) kullanarak hücre yönündeki değişiklikleri ölçmek için görüntüleri analiz edin.
Sonuçlar
Burada, hiPSC'lerden türetilen endotel hücrelerinin farklılaşması ve mekano-stimülasyonu için mekanik ipuçlarına tepkilerinin incelenmesine izin veren bir protokol açıklıyoruz (Şekil 1). Bu protokol, fonksiyonel olarak mekanosensitif endotel hücrelerinin üretimi ile sonuçlanır. Burada temsili sonuçlar sunuyoruz ve hücrelerin farklılaşma sırasında sitokin stimülasyonuna nasıl tepki verdiğini değerlendirmek için beklenen fenotipi tanımlıyoruz.
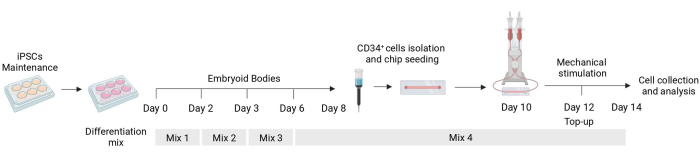
Şekil 1: Diferansiyasyon ve mekanik stimülasyon protokolünün şeması. Farklı sitokin karışımlarının zamanlamasını, CD34+ hücre izolasyonunu, akışkan çip tohumlamasını ve mekanik olarak uyarılan hücrelerin son analizini gösteren farklılaşma protokolünün şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
hiPSC'lerin kültürü
Protokolü, kendini yenileme koşullarında doğru şekilde büyüyen hiPSC'lerden başlatmak önemlidir. Kültürün kalitesinin iyi bir göstergesi, büyümelerinin hızıdır. Çözüldükten sonra, hücrelerin iyi bir farklılaşma sağlayacak doğru büyüme aşamasına ulaşması için 2-3 haftaya ihtiyacı olabilir. Hücreler haftada iki kez 1:6 oranında neredeyse tam birleşmeye ulaşarak geçebildiklerinde, bu, geçişleri gereken gün farklılaşmaya hazır oldukları zamandır.
HiPSC'lerin endotel hücrelerine farklılaşması
Embriyoid cisimciklerinin (EB'ler) oluşumundan oluşan farklılaşmanın ilk adımı, hücre hattına bağlıdır ve kullanımdaki spesifik hücre hattı için bir miktar optimizasyona ihtiyaç duyabilir. Protokol adımları 1.3.2.2-1.3.2.4'te açıklanan ayrışma, ayrışma reaktifi ile inkübasyonun azaltılması veya uzatılması ve ardından Pasteur pipeti ile ayrışma yoluyla değiştirilebilir. Ayrıca, bu adım için kolonilerin bir kesici alet veya bir P100 pipet ucu ile fiziksel olarak ayrıştırılmasına ek olarak başka ayrışma reaktifleri de kullanılabilir. İyi kalitedeki EB'ler, farklılaşmanın 2. gününde tanımlanmış bir kenar gösterir ve mikroskop kullanılarak gözlemlendiğinde net ve parlak görünür; daha koyu alanlar EB'ler içinde hücre ölümünü gösterebilir (Şekil 2).
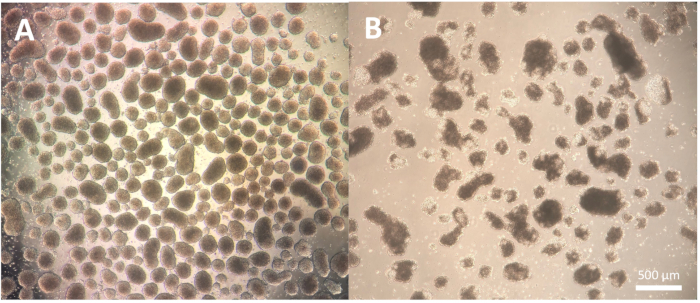
Şekil 2: Embriyoid cisimlerin morfolojisi. (A) İyi tanımlanmış dış kenarları ve tutarlı boyutu gösteren 2. gün embriyoid gövdeleri. (B) Yapının ayrışmasına yol açan geniş hücre ölümü gösteren düşük kaliteli 2. gün embriyoid cisimleri. Ölçek çubuğu = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. günde, EB'lere CHIR99021 eklenmesi GSK-3 proteinini inhibe eder ve bu da Wnt yolunun aktivasyonuna neden olur. Farklı hücre hatlarının CHIR tedavisine farklı yanıtları vardır ve bu, farklı konsantrasyonlar kullanılarak 8. günde elde edilen CD34+ hücrelerinin sayısını ölçerek test edilmelidir (Şekil 3).
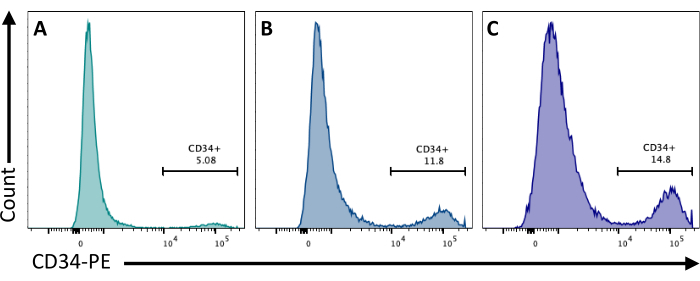
Şekil 3: Farklı CHIR tedavileri ile endotel hücre farklılaşması. Endotel hücre bağlılığı, CD34 membran ekspresyonu ile farklılaşmanın 8. gününde akış sitometrisi ile ölçüldü, 2. günde (A) 3 μM, (B) 5 μM ve (C) 7 μM'de CHIR tedavisini takiben Akış sitometrisi verileri, beş lazerli sitometreler ve özel yazılım kullanılarak elde edildi (bkz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
CD34+ hücre izolasyonu
Manyetik boncuklar kullanılarak yapılan CD34+ zenginleştirmenin, kolonun elüsyonundan sonra en az %80 CD34+ sağladığını doğrulamak önemlidir. Yeterli saflığı sağlamak için, manyetik izolasyondan elde edilen hücrelerin bir kısmı, manyetik zenginleştirme için kullanılandan farklı bir antikor klonu kullanıldığından emin olarak akış sitometrisi ile analiz edilebilir. Burada 4H11 klonu kullanılmış ve zenginleştirme sonrası ~%85 saflık elde edilmiştir (Şekil 4).
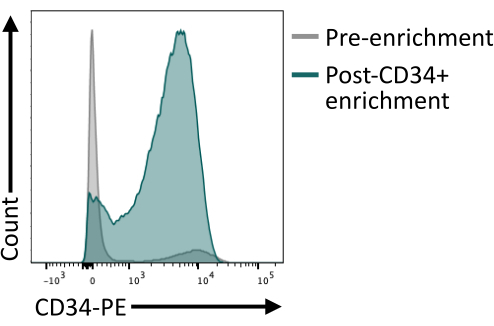
Şekil 4: Manyetik ayıklama ile zenginleştirmeden önce ve sonra CD34'ün membran ekspresyonu. 8. gün ayrışmış embriyoid cisimler (gri) ve manyetik zenginleştirme sonrası hücreler (yeşil) CD34 ekspresyonu için boyandı ve akış sitometrisi ile analiz edildi ve sıralama sonrası başarılı zenginleştirme gösterildi. Akış sitometrisi verileri, beş lazerli sitometre ve özel yazılım kullanılarak elde edildi (bkz. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hücrelerin akışkan kanala tohumlanması
Hücreleri akışkan kanala tohumlarken, endotel hücrelerinin yapışmasını ve çoğalmasını izlemek çok önemlidir. Tohumlamadan sonra, hücrelerin kanala tam olarak yapışması ~ 5 saat sürer (Şekil 5A). Bu aşamada yapışmayı iyileştirmek için alternatif bir kaplama çözeltisi de test edilebilir. Test edilen hücrelerin mekanosensitif olduğunu ve dolayısıyla mekanik stimülasyona cevap verebildiğini doğrulamak için hücre oryantasyonu zaman içinde test edilebilir. Stimülasyondan önceki hücreler rastgele yönelim gösterir (Şekil 5A ve Şekil 5C) ve akış yönüne paralel olarak yeniden yönlendirilirler (Şekil 5B,C). Burada açıklanan protokol, uyarılan hücrelerin endotel kimliğini sağlayan, membran immünofenotiplerinin incelenmesi için akış sitometrisi gibi aşağı akış analizi yapmak için hücrelerin kanaldan toplanmasına izin verir (Şekil 5D, E).
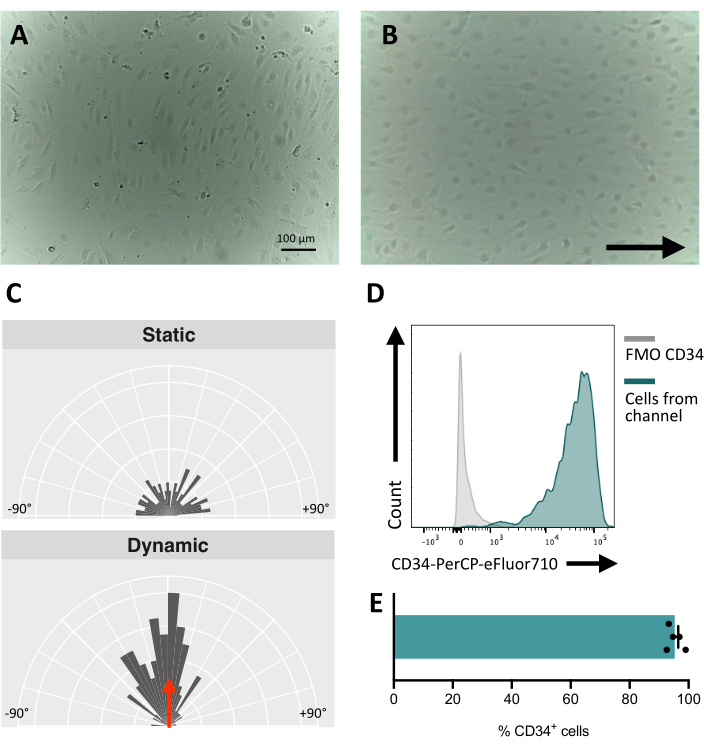
Şekil 5: HiPSC'lerden türetilen endotel hücrelerinin mekanosensitivitesi . (A) Tohumlamadan 48 saat sonra izole edilmiş CD34+ hücrelerinin birleşik tabakası. (B) Dinamik kültür altında 3 gün endotel hücrelerinin yeniden yönlendirilmiş tabakası. (C) 5 günlük dinamik kültürden sonra endotel hücrelerinin oryantasyon analizi. (D) 5 gün boyunca akış altında kültürlenen hücrelerin CD34 ekspresyon profili. (E) Akışkan kanaldan alınan hücre popülasyonunun CD34+ hücrelerinin yüzdesi. Görüntüler, ters çevrilmiş bir inkübatör mikroskobu kullanılarak alındı; akış sitometrisi verileri, beş lazerli sitometreler ve özel yazılım kullanılarak elde edildi (bkz. Ölçek çubukları = 100 μm (A,B). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Reaktif | Stok konsantrasyonu | Birim eklendi | Son konsantrasyon |
| Iscove'un Modifiye Dulbecco'nun Ortamı (IMDM) | - | 333 mL | - |
| Jambon F-12 Besin karışımı (F-12) | - | 167 mL | - |
| N-2 takviyesi (100x) | 100 adet | 5 mL | 1 adet |
| B-27 takviyesi (50x) | 50 adet | 10 mL | 1 adet |
| Askorbik asit | 10 mg/mL | 1.25 mL | 25 μg/mL |
| α-Monotiyogliserol (MTG) | 11,5 milyon | 19,5 μL | 448,5 μM |
| İnsan Serumu Albümini | 100 mg/mL | 2,5 mL | 0.5 mg / mL |
| Holo-Transferrin | 100 mg/mL | 0.75 mL | 150 μg/mL |
Tablo 1: 500 mL Serumsuz Farklılaşma (SFD) ortamı için bileşim ve tarif.
| Farklılaşma günleri | Sitokin Karışımı | Sitokin | Son konsantrasyon |
| Gün 0 - 2 | Karışım 1 | BMP4 | 20 ng/mL |
| 2. Gün | Karışım 2 | CHIR99021 | 7 μM |
| 3. günden itibaren | 3 ve 4'ü karıştırın | VEGF (Türkçe) | 15 ng/mL |
| bFGF (Kadın Sünneti) | 5 ng/mL | ||
| 6. günden itibaren | Karışım 4 | IL6 | 10 ng/mL |
| FLT3L | 10 ng/mL | ||
| IGF1 | 25 ng/mL | ||
| IL11 | 5 ng/mL | ||
| SCF | 50 ng/mL | ||
| EPO (Yurt Sonu T | 3 U/mL | ||
| TPO | 30 ng/mL | ||
| IL3 | 30 ng/mL |
Tablo 2: Endotel hücre farklılaşması için kullanılan sitokinlerin karışımları, SFD ortamına eklendikleri günler ve son konsantrasyon.
| Kayma Gerilimi (dyn/cm2) | Zaman (h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | Deneyin sonuna kadar |
Tablo 3: Dinamik kültür ve uygulama uzunluğu için kesme gerilimi değerleri.
Ek Şekil S1: Bu protokol için kullanılan çip ve boruların geometrisi ve boyutları. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S2: Hava pompasını kontrol eden yazılım için adım adım kılavuz ve her adımın açıklaması. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S3: Hücre şeklinin, eliptik uyumun ve son ölçümün çizimini gösteren FIJI kullanılarak oryantasyon analizi kılavuzu. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Tablo S1: Farklılaşma protokolünde kullanılan sitokinler için birim boyutu, resüspansiyon hacmi ve stok konsantrasyonları. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada tarif ettiğimiz protokol, insan pluripotent kök hücrelerinden mekanosensitif endotel hücrelerinin üretilmesine ve bunların kontrollü kayma gerilmesinin aracılık ettiği mekanik stimülasyona tepkilerinin incelenmesine izin verir. Bu protokol tamamen sitokin bazlıdır ve hücre tedavisi için hücre üretimine potansiyel çeviri için GMP reaktifleri ile tamamen uyumludur.
HiPSC'lerin türetilmesi, bilim insanlarına embriyonik gelişimin erken aşamaları için, aksi takdirde in vivo24 üzerinde çalışılması zor olan süreçlerin incelenmesini sağlayan araçsal bir model sağlar. Aslında, araştırma için mevcut olan insan embriyonik dokuları, dolaşımı olmayan embriyolardan toplanır ve bu, mekanik ipuçları tarafından kontrol edilen moleküler imza üzerinde önemli bir etkiye sahip olabilir. Burada açıklanan yaklaşım, kayma gerilimine hücre tepkisinin canlı görüntülenmesini ve gerçek zamanlı olarak incelenmesini sağlar. HiPSC'lerin akışkanlarla kombinasyonu, dolaşımın başlatılması kardiyovasküler ve kan sistemininkurulmasını yeniden şekillendirdiğinde ve kontrol ettiğinde, gelişmekte olan fetal dokuların sınırlı kullanılabilirliğinin ve erişilemezliğinin üstesinden gelen bir çalışma modeli sağlar 3,9,10,25.
Protokolün bir sınırlaması, bu protokolden türetilen endotel hücrelerinin, gelişmekte olan dokularda bulunan farklı endotel hücrelerinin çeşitli kimliklerini yansıtmayabilmesidir. Bu sınırlamanın üstesinden gelmek için, istenen kimliği veya dokuya özgü fenotip26'yı elde etmek için akışkan stimülasyondan önceki farklılaşma işlemi sırasında spesifik bir sitokin kombinasyonuna ihtiyaç duyulabilir. Endotelyal alt kümelerin izolasyonu, izolasyon adımı sırasında daha rafine bir immünofenotip kullanılarak elde edilebilir. Bu protokol, endotel hücrelerini yalnızca CD34 ekspresyonuna dayalı olarak izole eder, böylece floresanla aktive edilen hücre sınıflandırması (FACS) yerine kolon izolasyonuna izin verir; Bu, hücre ölümünü ve kontaminasyon riskini azaltır. Ayrıca, bu protokol, laminer akışın aracılık ettiği kesme geriliminin rolünü incelemek için özel olarak tasarlanmıştır. Germe veya sıkıştırma gibi diğer mekanik ipuçlarının veya bozulmuş veya bozulmuş akış gibi diğer akış türlerinin etkisini incelemek için alternatif akışkan yaklaşımların kullanılması gerekecektir.
Daha önce iPSC'den türetilen endotel hücrelerinin, fetal dorsal aortta 28,29,30 gözlemlenene benzer heterojen arteriyovenöz hücresel kimlikleri 27 taklit ettiğini göstermiştik. Bu, kan dolaşımı tarafından kontrol edildiği bilinen damar gelişimi ve hücresel spesifikasyon bağlamında özellikle önemlidir. Farklı modellerde yapılan çalışmalar, dolaşım eksikliğinin arteriyovenöz spesifikasyonun değişmesine neden olduğunu göstermiştir11,14,31. Mekanik ipuçlarını hücre spesifikasyonuna bağlayan mekanizmalar hala bilinmemektedir ve burada açıklanan boru hattı, in vivo olarak test edilemeyen rafine fonksiyonel çalışmalara izin vermektedir.
Bu boru hattı, ticari olarak temin edilebilen akışkan kanallar kullanılarak hiPSC'lerden türetilen endotel hücrelerinin üretimini ve uyarılmasını açıklar ve cihazların yaygın olarak kullanılan polidimetilsiloksan (PDMS) cihazlarında olduğu gibi döküm ihtiyacını ortadan kaldırır12. Ayrıca, PDMS çiplerinin kullanılması, uyarılan hücrelerin toplanmasını özellikle zorlaştırırken, bu protokol ile hücreler kanaldan kolayca alınabilir. Bu, proteomik ve transkriptomik analizler, akış sitometrisi ve daha fazla kültüre veya in vivo tahlillere ihtiyaç duyabilecek fonksiyonel tahliller gibi sonraki analizlere izin veren analitik gücü önemli ölçüde artırır.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Avrupa Hematoloji Derneği'nden Research Advanced Grant 2021, Amerikan Hematoloji Derneği'nden 2021 Küresel Araştırma Ödülü ve Welcome Trust ve Edinburgh Üniversitesi tarafından finanse edilen Dahili Strateji Destek Fonu ISSF3 tarafından desteklenmiştir. Flow Sitometri Tesisi'nden Fiona Rossi'ye Flow sitometri analizindeki desteği için teşekkür ederiz. Açık erişim amacıyla, yazar, bu gönderimden kaynaklanan herhangi bir Yazar Tarafından Kabul Edilen Makale sürümüne bir Creative Commons Atıf (CC BY) lisansı uygulamıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
Referanslar
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır