Method Article
In Vitro (시험관내) 발달 기계생물학을 연구하기 위한 태아 인간 혈관 온칩 모델
요약
여기에는 내피 세포와 인간 만능 줄기 세포를 구별하는 간단한 워크플로우와 기계적 자극에 대한 자세한 프로토콜이 설명되어 있습니다. 이를 통해 내피 세포의 발달 역학을 연구할 수 있습니다. 이 접근법은 기계적 자극 후 배양 칩에서 수집된 살아있는 세포의 다운스트림 분석과 호환됩니다.
초록
심장은 발달 과정에서 기능적으로 확립되는 첫 번째 기관으로, 임신 초기에 혈액 순환을 시작합니다. 태아의 성장을 보장하기 위해 산소와 영양분을 운반하는 것 외에도 태아 순환은 기계적 신호를 통해 내피층 내에서 발생하는 많은 중요한 발달 사건을 제어합니다. 생체역학적 신호는 혈관 구조 변화를 유도하고, 동정맥 사양을 확립하며, 조혈모세포의 발달을 조절합니다. 발달 중인 조직에 접근할 수 없다는 것은 초기 인간 발달에서 순환의 역할에 대한 이해를 제한합니다. 따라서 in vitro 모델은 혈관 기계생물학 연구를 위한 중추적인 도구입니다. 이 논문은 내피 세포를 인간 유도 만능 줄기 세포와 구별하고 기계적 신호에 대한 반응을 연구하기 위해 유체 장치에 파종하는 프로토콜을 설명합니다. 이 접근법은 기계적 자극 하에서 내피 세포를 장기간 배양한 후 표현형 및 기능적 특성 분석을 위해 내피 세포를 회수할 수 있습니다. 여기에서 확립된 시험관 내 모델은 궁극적으로 인간 태아의 생애 동안 혈관 발달을 조율하는 기계적 신호에 의해 매개되는 신호를 전달하는 세포 내 분자 메커니즘을 설명하는 데 중요한 역할을 할 것입니다.
서문
배아 발달 과정에서 심장은 기능을 확립하는 첫 번째 기관이며1, 심내막 형성 초기 단계부터 수축이 감지된다2. 혈액 순환은 혈관 내 혈액 흐름에 의해 매개되는 기계적 신호와 함께 초기 발달의 많은 중요한 측면을 제어합니다. 태아 순환 확립 전에 혈관 조직은 1 차 모세 혈관 신경총으로 구성됩니다. 심장 기능에 따라 이 신경총은 정맥 혈관과 동맥 혈관으로 재편성된다3. 동정맥 사양에서 기계적 단서의 역할은 혈류가 시작되기 전에 동맥 및 정맥 표지자의 범내피 발현에 의해 반영된다4.
혈류역학적 힘은 혈관 자체의 발달을 제어할 뿐만 아니라 혈액 세포 형성을 제어하는 데 근본적인 역할을 합니다. 조혈모세포 와 전구세포(HSPC)는 혈원성 내피 5,6,7,8이라고 하는 특수 내피 세포에서 나오며, 발달 초기 단계에서만 배아의 다른 해부학적 영역에 존재합니다. 심장 결핍 모델은 체외 모델과 함께 기계적 단서가 혈구 내피 9,10,11,12,13,14에서 HSPC 생성을 지시하고 증가시킨다는 것을 입증했습니다.
상이한 유형의 유동 역학은 세포 주기(15)를 차등적으로 제어하는 것으로 나타났으며, 이는 혈원성 내피(16,17) 및 동맥 세포 사양(18) 모두에서 중요한 것으로 알려져 있다. 전체적으로, 기계적 신호는 발달 중 세포 정체성과 기능을 결정하는 중요한 요소입니다. 새로운 체외 유체 장치를 통해 생체 내 인간 혈액 발달 중 발달 역학 연구와 관련된 한계를 극복할 수 있습니다.
이 원고에 있는 프로토콜의 전반적인 목표는 인간 유도만능줄기세포(hiPSC)에서 체외 에서 유래한 인간 내피 세포에 대한 전단 응력의 영향을 연구하기 위한 실험 파이프라인을 단계별로 설명하는 것입니다. 이 프로토콜에는 hiPSC를 내피 세포로 분화하고 자극 프로토콜을 위해 유체 칩으로 후속 파종하는 방법에 대한 자세한 지침이 포함되어 있습니다. 이를 사용하여 다양한 체외 유래 내피 세포가 흐름에 반응하여 방향을 분석하여 전단 응력을 감지하는 능력을 테스트할 수 있습니다. 이를 통해 다른 실험실에서는 전단 응력에 대한 반응과 다양한 내피 세포 식별에 대한 기능적 결과에 대한 질문을 해결할 수 있습니다.
프로토콜
참고: 모든 세포 배양 기술은 층류 후드의 멸균 조건에서 수행해야 하며 세포는 5%CO2의 가습 분위기에서 37°C에서 배양해야 합니다. 유지(rhbFGF) 및 분화 프로토콜(rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3)에 대한 모든 사이토카인 전제에 대한 지침은 보충표 S1에 나와 있습니다.
1. hiPSC의 배양 - 세포의 해동, 유지 및 동결
- 유지 배지, 성장 인자 및 기타 시약의 준비
- 전체 hESCs 무혈청 배지 보충제, 25%의 소 혈청 알부민(BSA) 36mL 및 β-메르캅토에탄올 55mL 1mL를 Dulbecco의 Modified Eagle Medium/F12(DMEM/F-12) 기저 배지에 첨가하여 배양 배지를 준비합니다( 재료 표 참조).
- Rho Kinase 억제제(iRock) 1mg을 DMSO 1mL에 재현탁하고 50μL의 부분 표본을 만들어 -20°C에서 보관합니다.
참고: 이 부분 표본은 -20°C에서 1년 동안 보관할 수 있습니다. 해동되면 4°C에서 1주일 동안 보관할 수 있습니다. - 비트로넥틴(VTN-N) 용액을 얼음 위에서 해동하고 -80°C에서 보관하기 전에 바이알당 60μL를 분취합니다. 플레이트를 코팅하기 직전에 60μL 스톡을 Dulbecco의 인산염 완충 식염수(DPBS) 6mL에 희석합니다. 최종 농도는 5μg/mL입니다.
- hiPSC 세포주 해동
참고: 인간 만능 줄기 세포주 SFCi55는 이전에 사내에서 파생되었으며 다양한 세포 유형 및 다양한 배아 계통으로의 분화를 위해 광범위하게 사용되었습니다 19,20,21,22.- 6웰 플레이트의 웰 1개를 VTN-N 용액 1mL로 37°C에서 1시간 동안 코팅합니다.
참고: 배양 후 코팅된 플레이트는 4°C에서 최대 1주일 동안 보관할 수 있습니다. - 흡인 피펫으로 VTN-N 용액을 흡입하고 20ng/mL의 rhbFGF가 보충된 예열 배양 배지 1mL를 추가합니다(보충 표 S1).
- hiPSC가 들어 있는 바이알을 수조에서 빠르게 해동하고 세포를 5mL의 예열된 배양 배지로 옮깁니다.
- 실온에서 300× g 에서 3분 동안 셀을 스핀 다운합니다.
- 20ng/mL의 rhbFGF가 보충된 0.5mL의 배양 배지에 세포 펠릿을 재현탁시킵니다.
- 이미 1mL의 배지를 함유하고 있는 코팅된 웰 1개로 세포를 옮깁니다.
- 총 1.5mL의 배지에 세포가 들어 있는 웰에 5μL의 iRock을 추가합니다.
- 인큐베이터에서 세포를 배양하고, 주중에는 매일 배지를 교체하고, 세포를 이중으로 공급하여 세포에 정상 용량의 두 배를 추가하여 주말 동안 공급할 수 있도록 합니다.
알림: 세포는 iRock이 있는 곳에서 24시간 동안만 성장합니다.
- 6웰 플레이트의 웰 1개를 VTN-N 용액 1mL로 37°C에서 1시간 동안 코팅합니다.
- hiPSC의 유지 관리 및 패세이징
- 20ng/mL의 rhbFGF가 보충된 신선한 예열 배양 배지로 배지를 매일 교체하십시오.
- 세포가 약 80%의 밀도에 도달하면 일반적으로 일주일에 두 번 세포를 통과시킵니다.
- 세포를 통과시키려면 이전에 1.2.1 및 1.2.2단계에서 설명한 대로 플레이트를 VTN-N으로 코팅합니다.
- 세포가 있는 웰에서 배지를 흡인하고 DPBS로 세척합니다.
- DPBS를 흡입하고 해리 시약 1mL( 재료 표 참조)를 추가하고 1분 동안 배양합니다.
- 해리 시약을 흡인하고 3분 더 배양합니다. 플레이트를 양쪽으로 10회 세게 두드립니다.
참고: 해리 단계는 배양 시간 및 태핑 절차에서 세포 유형별 최적화가 필요할 수 있습니다. - 배양 배지 1mL를 세포에 추가하고 파스퇴르 피펫으로 배지로 한 번 세척하여 대부분의 콜로니가 수집되도록 합니다.
- 각 웰에 150μL의 셀 현탁액을 추가하여 1웰을 6으로 통과시킵니다.
참고: 새 바이알을 해동한 직후, 1:6의 비율로 통과하기 전에 꾸준한 성장 단계에 도달할 수 있도록 하나 또는 두 개의 통로에 대해 1:1 또는 1:2와 같은 더 낮은 비율로 세포를 통과시키는 것이 좋습니다. - 인큐베이터에서 세포를 배양하고, 주중에는 매일 배지를 교체하고, 주말에는 세포를 한 번 두 번 공급합니다.
- hiPSCs 세포주 동결
알림: 해동 후 처음 두 통로 내에서 세포를 동결하여 배양을 시작하기 위해 냉동 바이알의 낮은 통로 배치를 일정하게 유지합니다. 세포가 약 80%의 밀도에 도달하면 세포를 동결합니다.- 배지를 20ng/mL의 rhbFGF와 5μL의 iRock이 보충된 신선한 예열 배양 배지로 교체하고 최소 1시간 동안 배양합니다.
- 1.3.2.2-1.3.2.5단계에 설명된 대로 셀을 분리합니다.
- 5mL의 배양 배지가 들어 있는 15mL 원심분리 튜브에 분리된 세포를 수집합니다.
- 실온에서 300× g 에서 3분 동안 원심분리합니다.
- 상층액을 흡인하고 1mL의 동결 보존 용액을 추가합니다( 재료 표 참조).
- 파스퇴르 피펫을 사용하여 세포를 위아래로 부드럽게 피펫팅하여 동결 보존 용액에 혼합합니다.
참고: 셀 클러스터가 해리될 수 있는 과도한 피펫팅을 피하십시오. - 세포 현탁액을 각각 0.5mL가 있는 두 개의 동결 보존 바이알로 나눕니다.
- 동결 보존 바이알을 4°C로 예열된 동결 보존 용기에 옮깁니다.
- 장기 보관을 위해 바이알을 액체 질소로 옮기기 전에 셀이 있는 용기를 -80°C 냉동고로 24시간 동안 옮깁니다.
2. hiPSC를 내피세포로 분화
- 분화 배지, 사이토카인, 성장 인자의 제조
- 표 1에 따라 무혈청 분화 배지(SFD)를 준비합니다. 차별화 0일차부터 5일차까지 이 배지를 사용합니다.
- 34 SFM 기초 배지에 34 영양 보충제와 5mL의 L-글루타민 보충제를 추가하여 CD34+ 세포(SFM-34)용 무혈청 배지를 준비합니다( 재료 표 참조). 감화 6일차부터 이 배지를 사용하십시오.
- 716μL의 DMSO에 1mg의 CHIR99021을 재현탁하여 3mM 용액을 얻습니다. 완전히 재현탁될 때까지 실온에서 배양합니다. 필요한 경우 37°C에서 빠르게 예열하십시오. 20μL 부분 표본을 만들어 -20°C에서 최대 6개월 동안 보관합니다. 해동 후 즉시 사용하고 다시 얼리거나 보관하지 마십시오.
- 보충표 S1의 지시에 따라 사이토카인을 재현탁시킨다. 모든 사이토카인의 부분 표본은 -80°C에서 보관합니다.
- 내피 세포 분화
참고: 분화 매일마다 에 설명된 사이토카인의 혼합물에 따라 18mL(3mL 배지/웰)의 예열된 SFD 배지를 준비합니다. 표 2.- 0일차 - 배아체(EB) 형성
- 각 6-웰 플레이트(3mL/웰)에 대해 표 2에 따라 1 사이토카인을 혼합하여 18mL의 SFD 배지를 준비합니다.
- 예열된 SFD 배지 2mL를 세포 퇴치제 6웰 플레이트의 각 웰에 Mix 1 사이토카인과 함께 추가합니다( 재료 표 참조).
- EB를 형성하려면 1.3.2.2-1.3.2.4단계에 설명된 단계를 따르십시오.
참고: hiPSC가 70-80% 합류하여 분화를 시작하는지 확인하십시오. - Mix 1 사이토카인과 함께 예열된 SFD 배지 1mL를 분리된 세포 클러스터의 각 웰에 추가합니다.
- 파스퇴르 피펫을 사용하여 1:1의 비율로 EB 형성을 위해 세포 클러스터를 단일 세포 퇴치 웰로 부드럽게 옮깁니다.
- 플레이트를 인큐베이터에 넣은 후 앞뒤, 좌우로 움직여 EB를 웰에 고르게 분산시킵니다.
- 1일차 - EB에 대한 중간 변화
참고: 이 단계는 분화 1일차까지 EB와 함께 현탁 상태에 있는 단일 세포가 많은 경우에만 필요합니다.- 각 6-웰 플레이트(3mL/웰)에 대해 표 2에 따라 1 사이토카인을 혼합하여 18mL의 SFD 배지를 준비합니다.
- EB로 플레이트를 소용돌이쳐 중앙으로 이동하고 파스퇴르 피펫을 사용하여 15mL 원심분리 튜브에 수집합니다.
참고: EB가 스트링처럼 뭉쳐 있는 것처럼 보이면 15mL 원심분리 튜브에 모으기 전에 P1000으로 위아래로 피펫팅하여 분리합니다. - EB가 튜브 바닥에 안착할 때까지 5-10분 정도 기다립니다.
알림: EB가 너무 작으면 5g 에서 100× 동안 원심분리하여 가라앉도록 합니다. - 세포 퇴치 플레이트를 멸균수 또는 DPBS로 세척하여 단일 세포나 파편을 제거합니다.
- EB에서 상층액을 빼내지 않고 조심스럽게 천천히 흡인합니다.
- Mix 1 사이토카인과 함께 SFD 2mL를 세포 퇴치 플레이트의 각 웰에 추가합니다.
- 각 시작 웰에 대해 1mL의 SFD 배지와 Mix 1 사이토카인을 사용하여 EB를 재현탁시킵니다 - 6웰 플레이트의 경우 6mL의 배지를 추가합니다.
- 이미 2mL의 SFD 배지가 들어 있는 웰당 1mL 용량의 EB를 세포 퇴치 플레이트로 옮깁니다.
- 플레이트를 인큐베이터에 넣은 후 앞뒤, 좌우로 움직여 EB를 웰에 고르게 분산시킵니다.
- 2일차 - CHIR99021 추가
- EB를 플레이트 중앙으로 소용돌이치고 셀과의 직접적인 접촉을 피하기 위해 웰 측면의 표 2 에 따라 CHIR99021 추가합니다.
알림: 1일차에 배지를 변경하지 않은 경우 CHIR만 추가하는 대신 전체 배지를 교체하십시오. 각 6-웰 플레이트(3mL/웰)에 대해 표 2에 따라 Mix 2와 함께 18mL의 SFD 배지를 준비합니다. - 플레이트를 인큐베이터에 넣은 후 앞뒤, 좌우로 움직여 EB를 웰에 고르게 분산시킵니다.
- EB를 플레이트 중앙으로 소용돌이치고 셀과의 직접적인 접촉을 피하기 위해 웰 측면의 표 2 에 따라 CHIR99021 추가합니다.
- 3일차 - EB에 대한 배지 변화 및 Mix 3 사이토카인 첨가
- 각 6-웰 플레이트(3mL/웰)에 대해 표 2에 따라 3개의 사이토카인을 혼합하여 18mL의 SFD 배지를 준비합니다.
- 2.2.2.2-2.2.2.4단계에서 설명한 대로 EB를 수집합니다.
- Mix 3 사이토카인과 함께 예열된 2mL의 SFD 배지를 세포 퇴치 플레이트에 추가합니다.
- EB에서 상층액을 조심스럽게 흡입합니다. 1mL/웰의 SFD를 Mix 3 cytokine과 함께 추가합니다.
- 2.2.2.8-2.2.2.9단계에 설명된 대로 웰 간에 EB를 분배합니다.
- 6일차 - SFM-34에 대한 배지 변화 및 Mix 4 사이토카인 추가
- 각 6-웰 플레이트(3mL/웰)에 대해 표 2에 따라 4개의 사이토카인을 혼합하여 18mL의 SFD 배지를 준비합니다.
- 2.2.2.2-2.2.2.4단계에서 설명한 대로 EB를 수집합니다.
- Mix 4 사이토카인과 함께 예열된 SFM-34 배지 2mL를 세포 퇴치 플레이트에 추가합니다.
- EB에서 상층액을 조심스럽게 흡입합니다. 1mL/웰의 SFM-34를 Mix 4 사이토카인과 함께 추가합니다.
- 2.2.2.8-2.2.2.9단계에 설명된 대로 웰 간에 EB를 분배합니다.
- 0일차 - 배아체(EB) 형성
3. CD34+ 세포 분리 및 칩 파종
참고: CD34+ 세포는 단클론 마우스 항체 항인간 CD34 항체 및 FcR 차단 시약(인간 IgG)에 접합된 CD34 마이크로비드가 포함된 CD34 마이크로비드 키트( 재료 표 참조)를 사용한 양성 분리 접근 방식을 통해 분리됩니다. 유세포 분석을 위해 분리 전후에 세포를 염색하여 컬럼 분리의 효율성을 검증하는 것이 중요하며, 아래에는 이 분석을 위해 세포를 채취해야 하는 시기가 표시됩니다.
- 재료와 시약을 준비합니다.
- 5% BSA 용액 5mL와 EDTA 200μL, DPBS 0.5M 내지 45mL를 첨가하여 세척 완충액을 제조하여 PBS + 0.5% BSA + 2mM EDTA를 수득한다. 각 격리를 위해 신선하게 준비하고 필터 멸균 및 사용할 때까지 냉장 보관하십시오.
- rhLaminin 521 1:50을 DPBS Ca 2+ Mg2+로 희석하여 제조한 라미닌 용액으로 유체 칩을 코팅합니다. 사용 중인 칩에 적합한 부피로 각 칩을 코팅하고 파종하기 전에 인큐베이터에서 2시간 동안 배양합니다.
참고: 코팅에 다른 매트릭스를 사용할 수 있으며 특정 셀 유형/실험에 대해 테스트해야 합니다. - 표 2에 따라 18mL의 SFM-34 배지에 Mix 4 사이토카인을 보충하여 Mix 4 SFM-34 배지를 준비하고 혼합물을 가스 교환을 용이하게 하기 위해 뚜껑을 약간 푼 상태로 인큐베이터의 50mL 튜브에 넣습니다.
- 선택한 관류 세트와 인큐베이터에 사용할 기타 튜브를 배치하여 가스를 제거합니다.
- 8일차 - EB와 CD34+ 분리의 해리
- 2.2.2.2-2.2.2.5단계에 설명된 대로 EB를 수집합니다.
- 수집된 EB의 시작 웰당 1mL의 세포 해리 시약을 추가합니다(6개의 웰을 수집한 경우 6mL 추가).
- 세포 해리 시약에 있는 EB 현탁액 1mL를 세포 퇴치 플레이트의 각 웰로 다시 옮깁니다.
- 인큐베이터에서 10분 동안 배양합니다.
- EB를 P1000으로 웰에 대고 위아래로 부드럽게 피펫팅하여 10회 이하로 합니다.
- 3.2.4-3.2.5단계를 총 3회 반복합니다.
참고: EB를 분리하기 어려운 경우 위의 단계를 총 4번 반복합니다. - 해리된 EB의 각 웰에 대해 5mL의 세척 완충액을 추가합니다.
- 세포를 40μm 스트레이너에 통과시켜 50mL 원심분리 튜브에 세포를 수집합니다. 세포 현탁액 10μL를 취하여 세포 수를 계산합니다.
참고: 분리 효율성을 테스트하려면 105 개의 세포/튜브를 나중에 유세포 분석에 사용할 두 개의 다른 튜브(염색되지 않은 대조군 및 사전 보존된 테스트 샘플)로 옮깁니다(4.3.9-4.3.13단계 참조). 6웰 플레이트의 경우 여과 후 ~106 개의 세포를 수집해야 합니다. - 300 ×g에서 10분 동안 세포를 아래로 돌립니다.
- 300μL의 세척 버퍼에 세포를 재현탁하고 덩어리가 없는지 확인하기 위해 몇 번 부드럽게 피펫팅합니다. 제조업체의 프로토콜을 계속 따르십시오( 재료 표 참조).
- 유체 칩에 CD34+ 세포 파종
참고: 프로토콜에 사용된 유체 칩은 채널 높이가 0.6mm이고 길이가 50mm이며 총 성장 면적은 2.5cm2입니다(보충 그림 S1). 이 유형의 칩은 총 150μL의 셀 현탁액으로 시딩됩니다. 다른 칩을 사용할 수 있으며 파종의 부피와 세포 밀도는 성장 영역에 따라 조정되어야 합니다. 사용된 세포주와 그 성장에 따라 추가적인 최적화가 필요할 수 있습니다.- 분리된 CD34+ 세포를 Mix 4 사이토카인을 사용하여 300μL의 예열된 SFM-34 배지에 재현탁시킵니다.
- 세포 현탁액 10μL를 취하여 세포 수를 세십시오.
- 보충된 SFM-34 150μL의 최종 부피에 2.5 × 105 세포를 재현탁시킵니다. 0.5μL의 iRock을 추가합니다.
참고: 분리 효율성을 테스트하려면 105 개의 세포/튜브를 튜브(사후 분류된 테스트 샘플)에 넣어 나중에 유세포 분석에 사용할 것입니다(4.3.9-4.3.13단계 참조). - 채널 가장자리의 저장소 내부에 P200의 팁을 넣어 유체 칩에서 라미닌을 천천히 흡입합니다.
알림: 액체를 모으기 어려운 경우 칩의 한쪽을 천천히 들어 올려 액체가 반대쪽 저장소로 이동할 수 있도록 합니다. - 기포가 형성되지 않도록 셀 현탁액을 채널에 꾸준히 추가합니다.
알림: 3.3.4-3.3.5 단계를 빠르고 부드럽게 수행하여 라미닌이 건조되고 칩 채널에 기포가 형성되지 않도록 합니다. 기포가 형성되면 칩의 한쪽을 들어 올리고 슬라이드를 부드럽게 두드려 기포를 동원합니다. 저수지에 도달하면 공기 인터페이스로 상승하여 채널을 임대할 수 없어야 합니다. - 칩을 인큐베이터로 옮기고 세포가 채널에 완전히 부착되어 길쭉해 보이도록 밤새 그대로 둡니다.
- 세포가 완전히 부착되면 3.3.4단계에서와 같이 배지를 흡인하고 200μL의 사이토카인이 보충된 SFM-34로 교체합니다.
- 이제부터 세포가 90%-100% 밀도에 도달할 때까지 매일 배지를 교체하십시오.
4. 내피세포에 연속 흐름 적용 - Aorta-on-a-chip
- 재료와 시약을 준비합니다.
- 표 2에 따라 SFM-34 배지 18mL를 Mix 4 사이토카인으로 보충하여 Mix 4 SFM-34 배지를 준비하고 가스 교환을 용이하게 하기 위해 뚜껑을 약간 푼 상태로 인큐베이터의 50mL 튜브에 넣습니다.
- 선택한 관류 세트와 인큐베이터의 유체 설정에 사용할 튜브를 배치하여 가스를 제거합니다.
- 유체 시스템 조립
- 제조업체의 프로토콜에 따라 장치에 관류 세트를 설치합니다.
알림: cl을 사용하는 것을 잊지 마십시오.amps 시스템에서. 이 단계에 슬라이딩 클램프를 사용하는 경우 칩에 연결하기 전에 튜브에서 밀어 넣어야 합니다. - 새 유체 칩을 부착하고 사이토카인이 보충된 SFM-34 배지를 추가하여 후드의 멸균 상태에서 두 저장소를 모두 채웁니다.
- 기포 제거 프로그램과 보정 단계를 수행합니다.
- 인큐베이터에서 연결된 세트가 있는 유체 장치를 제거하고 후드로 옮깁니다. 인큐베이터에서 세포가 들어있는 칩도 가져 가십시오.
- 테스트 칩의 양쪽에 있는 튜브를 Clamp.
- 테스트 칩에서 튜브를 제거합니다.
알림: 튜브 끝의 루어 커넥터에 기포가 없는지 확인하십시오. 기포가 보이면 P200 피펫을 사용하여 조심스럽게 흡입하고 필요한 경우 더 많은 매체를 추가하여 커넥터가 매체로 채워지도록 합니다. - 셀이 포함된 칩을 튜브와 연결합니다.
- 클램프를 제거하거나 엽니다.
- 시스템을 인큐베이터로 옮기고 공기 펌프를 유체 장치에 연결합니다.
- 표 2에 설명된 전단 응력을 점진적으로 증가시키는 펌프 전용 소프트웨어(보충 그림 S3)를 사용하여 사전 선택된 프로그램을 시작합니다.
알림: 필요한 특정 실험에 따라 자극 프로그램에 최적화가 필요할 수 있습니다. 여기에 기술된 것은 5 dyn/cm2의 최종 값으로 이어지는 점진적인 전단 응력 증가이며, 이는 태아 순환 9 개시 시 등쪽 대동맥 벽에 의해 경험되도록 계산된 전단 응력을 모방한다. 사용될 최종 전단 응력과는 별개로, 셀이 칩에서 분리되지 않고 셀이 힘에 적응할 수 있도록 시간이 지남에 따라 점진적으로 증가해야 합니다. 선택한 자극 프로토콜이 3일 이상인 경우 일반적으로 18mL에 첨가되는 Mix 4 사이토카인을 포함하는 SFM-34 1mL를 추가하여 사이토카인을 시스템에 보충해야 합니다. 이를 위해 펌프 프로그램을 빠르게 일시 중지하고 500μL의 보충된 배지를 유체 세트의 두 주사기 각각에 추가합니다.
- 제조업체의 프로토콜에 따라 장치에 관류 세트를 설치합니다.
- 분석을 위한 세포 수집
- 수조에서 해리 버퍼를 예열합니다.
- 인큐베이터에서 유체 장치를 제거하고 후드로 옮깁니다.
- Clamp 양쪽의 칩 측면에 있는 튜빙을 칩의 저장소에서 튜빙을 제거합니다.
- 칩에서 배지를 부드럽게 제거하고 DPBS Ca 2+ Mg2+ 로 교체하여 세포를 세척합니다.
알림: 세포가 분리되기 시작하면 PBS로 세척하는 이 단계를 건너뛸 수 있습니다. - 150μL의 해리 완충액을 부드럽게 첨가하고 37°C에서 3분 동안 배양합니다.
알림: 세포가 단일하고 분리되어 있는지 현미경으로 확인하십시오. 그렇지 않으면 추가로 2분 동안 배양합니다. 배지를 흡입하기 전에 세포를 채널에서 완전히 분리하는 것이 중요한데, 이는 칩이 피펫팅을 통한 세포 분리를 도울 수 없기 때문입니다. 트립신 또는 EDTA 기반 완충액과 같은 다른 용액을 사용하여 세포를 분리할 수 있습니다. - 하나의 저장소에서 세포가 포함된 해리 완충액을 수집하여 15mL 원심분리 튜브로 옮기고 DPBS로 채널을 한 번 세척하여 분리된 모든 세포를 수집합니다.
- 세포가 있는 15mL 튜브에 세척 완충액 1mL를 추가하고 10μL를 사용하여 세포를 계수합니다.
- 유세포 분석 튜브의 세포 현탁액을 나누어 시험관당 10개의5 개 세포를 갖도록 합니다.
- 300× g에서 5분 동안 튜브를 돌립니다.
- 염색할 각 시험관에 대해 50μL가 되도록 염색 용액을 준비합니다. CD34 PerCP-efluor710 또는 CD34-PE를 각각 1:100 및 1:200 희석으로 첨가합니다.
- 50μL의 염색 용액에 세포를 재현탁시키고 4°C에서 30분 동안 배양합니다.
- 세척 완충액 2mL를 첨가하여 세포를 세척하고 300× g에서 5분 동안 회전시킵니다.
- 펠릿을 100μL의 염색 용액에 재현탁시키고 유세포 분석기를 사용하여 데이터를 획득합니다.
참고: 세포는 150μL의 RNA 용해 완충액을 사용하여 RNA 추출을 위해 칩에서 직접 용해하거나 실온에서 10분 동안 DPBS에서 4% 파라포름알데히드를 사용하여 이미징을 위해 고정할 수도 있습니다.
- 세포 배향 분석
- FIJI23 (보충 그림 S3)을 사용하여 세포 방향의 변화를 정량화하기 위해 이미지를 분석합니다.
- 분석 | 툴 | ROI 관리자 메뉴.
- 다각형 선택 도구를 사용하여 셀 윤곽선을 수동으로 그리고 추가를 클릭하거나 Ctrl+T 단축키를 사용하여 ROI 관리자에 추가합니다.
- 분석 | 측정 메뉴를 설정합니다.
- 측정을 통해 모든 ROI에 적용 자세히... ROI 관리자의 다중 측정 명령입니다.
참고: 이 단계에서는 각 ROI에 타원을 맞추고 주 타원 축과 보조 타원 축의 길이와 각도를 포함하는 테이블을 생성합니다. - 테이블을 CSV 파일로 내보내 플롯할 다른 소프트웨어로 가져옵니다.
참고 : 플롯에 사용 된 스크립트는 https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885 에서 사용할 수 있습니다.
0ddc입니다.
- FIJI23 (보충 그림 S3)을 사용하여 세포 방향의 변화를 정량화하기 위해 이미지를 분석합니다.
결과
여기서는 기계적 신호에 대한 반응을 연구할 수 있는 hiPSC에서 유래한 내피 세포의 분화 및 기계적 자극을 위한 프로토콜을 설명합니다(그림 1). 이 프로토콜은 기능적으로 기계에 민감한 내피 세포를 생산합니다. 여기에 대표적인 결과를 제공하고 분화 중에 세포가 사이토카인 자극에 어떻게 반응하는지 평가하기 위해 예상되는 표현형을 설명합니다.
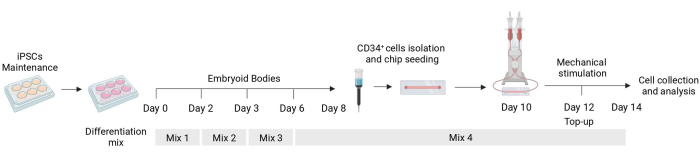
그림 1: 차별화 및 기계적 자극 프로토콜의 개략도. 사이토카인의 다양한 혼합물, CD34+ 세포 분리, 유체 칩 파종 및 기계적으로 자극된 세포의 최종 분석의 타이밍을 보여주는 분화 프로토콜의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
hiPSC의 배양
자가 갱신 조건에서 올바르게 성장하는 hiPSC에서 프로토콜을 시작하는 것이 중요합니다. 문화의 질을 나타내는 좋은 지표는 성장 속도입니다. 해동 후 세포는 좋은 분화를 보장하는 올바른 성장 단계에 도달하는 데 2-3주가 필요할 수 있습니다. 세포가 일주일에 두 번 1:6의 비율로 거의 완전한 밀도에 도달하여 통과할 수 있을 때, 이것은 세포가 통과해야 하는 당일에 분화할 준비가 된 시간입니다.
hiPSC를 내피세포로 분화
배아체(EB)의 형성으로 구성된 분화의 첫 번째 단계는 세포주에 따라 다르며 사용 중인 특정 세포주에 대해 약간의 최적화가 필요할 수 있습니다. 프로토콜 단계 1.3.2.2-1.3.2.4에 설명된 해리는 해리 시약을 사용한 배양을 줄이거나 연장하고 파스퇴르 피펫을 사용한 후속 해리를 통해 수정할 수 있습니다. 또한, 절삭 공구 또는 P100 피펫 팁을 사용한 콜로니의 물리적 해리 외에도 다른 해리 시약을 이 단계에 사용할 수 있습니다. 좋은 품질의 EB는 분화 2일차에 정의된 가장자리를 나타내며 현미경을 사용하여 관찰할 때 선명하고 밝게 나타납니다. 어두운 영역은 EB 내의 세포 사멸을 나타낼 수 있습니다(그림 2).
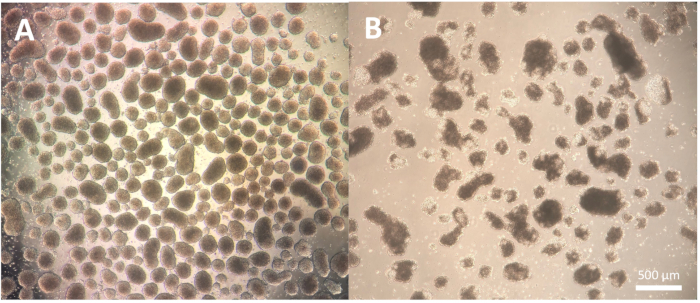
그림 2: 배아체 형태. (A) 잘 정의된 바깥쪽 가장자리와 일관된 크기를 보여주는 2일차 배아체. (B) 구조의 분해를 초래하는 광범위한 세포 사멸을 보여주는 품질이 좋지 않은 2일차 배아체. 스케일 바 = 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2일째에 EB에 CHIR99021을 추가하면 GSK-3 단백질이 억제되어 Wnt 경로가 활성화됩니다. 세포주마다 CHIR 처리에 대한 반응이 다르기 때문에 다른 농도를 사용하여 8일째에 얻은 CD34+ 세포의 수를 정량화하여 테스트해야 합니다(그림 3).
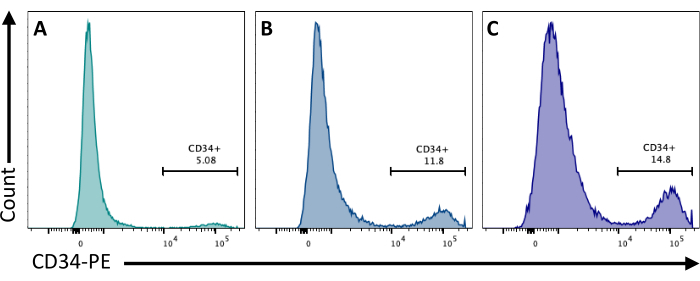
그림 3: 다양한 CHIR 처리를 사용한 내피 세포 분화. CD34 막 발현에 의한 분화 8일차에 유세포 분석으로 정량화한 내피 세포 투입, (A) 3μM, (B) 5μM 및 (C) 7μM에서 2일차에 CHIR 처리 후. 유세포 분석 데이터는 5개의 레이저 유세포분석기와 전용 소프트웨어를 사용하여 획득했습니다( 재료 표 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CD34+ 세포 분리
마그네틱 비드를 사용한 CD34+ 농축이 컬럼 용출 후 최소 80%의 CD34+를 제공하는지 검증하는 것이 중요합니다. 충분한 순도를 보장하기 위해 자기 분리에서 얻은 세포의 부분 표본을 유세포 분석으로 분석하여 자기 농축에 사용된 것과 다른 항체 클론을 사용할 수 있습니다. 여기서, 4H11 클론을 사용하였고 농축 후 ~85%의 순도를 달성하였다(도 4).
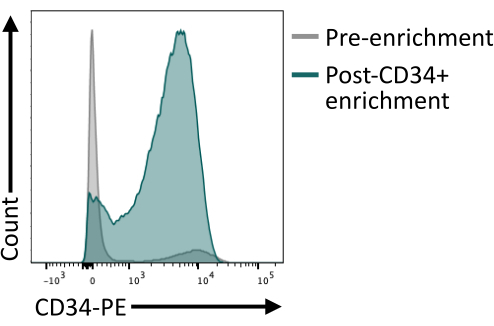
그림 4: 자기 분류에 의한 농축 전후의 CD34 막 발현. 8일째 해리된 배아체(회색)와 자기 농축 후 세포(녹색)를 CD34 발현을 위해 염색하고 유세포 분석으로 분석하여 성공적인 농축 후 분류를 보여주었습니다. 유세포 분석 데이터는 5개의 레이저 유세포분석기와 전용 소프트웨어를 사용하여 획득했습니다( 재료 표 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
유체 채널에 세포 파종
유체 채널에서 세포를 파종할 때 내피 세포의 접착 및 증식을 추적하는 것이 중요합니다. 파종 후 세포가 채널에 완전히 부착되는 데 ~5시간이 걸립니다(그림 5A). 이 단계에서 접착력을 향상시키기 위해 대체 코팅 용액을 테스트할 수도 있습니다. 테스트된 세포가 기계에 민감하여 기계적 자극에 반응할 수 있는지 확인하기 위해 시간이 지남에 따라 세포 방향을 테스트할 수 있습니다. 자극 전의 세포는 무작위 배향을 나타내고(그림 5A 및 그림 5C) 흐름 방향과 평행하게 방향을 바꿉니다(그림 5B, C). 여기에 설명된 프로토콜은 채널에서 세포를 수집하여 막 면역표현형을 연구하기 위한 다운스트림 분석(예: 유세포 분석)을 수행할 수 있도록 하여 자극된 세포의 내피 식별을 제공합니다(그림 5D,E).
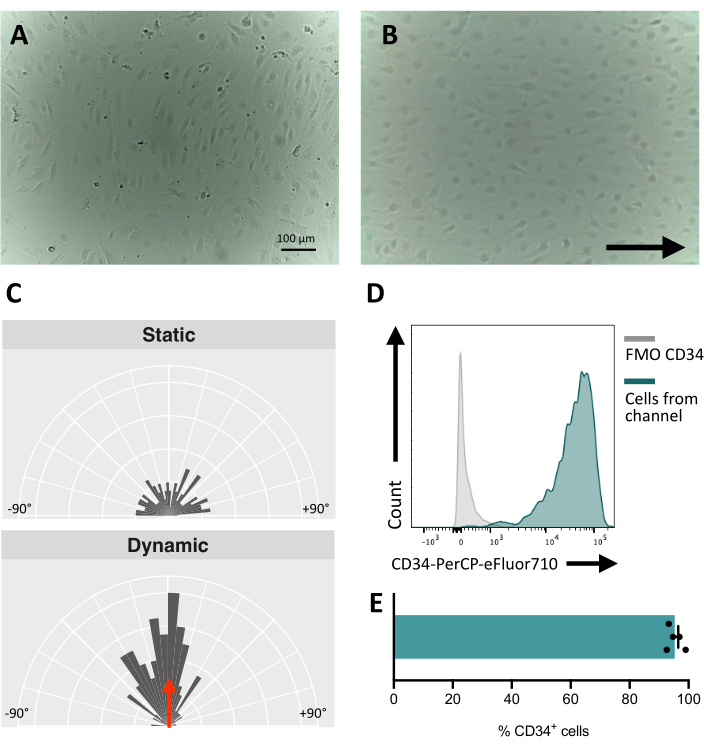
그림 5: hiPSC 유래 내피 세포의 기계적 반응성 . (A) 파종 후 48시간 동안 분리된 CD34+ 세포의 합류층. (B) 동적 배양 하에서 3일 동안 내피 세포의 방향 전환된 층. (C) 동적 배양 5일 후 내피 세포의 방향 분석. (D) 5일 동안 유동 상태에서 배양된 세포의 CD34 발현 프로파일. (E) 유체 채널에서 회수된 세포 집단의 CD34+ 세포의 백분율. 이미지는 도립된 인큐베이터 현미경을 사용하여 촬영되었습니다. 유세포 분석 데이터는 5개의 레이저 유세포분석기와 전용 소프트웨어를 사용하여 획득했습니다( 재료 표 참조). 스케일 바 = 100 μm (A,B). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시약 | 재고 집중 | 볼륨 추가됨 | 최종 농도 |
| Iscove의 수정된 Dulbecco's Medium(IMDM) | - | 333 mL | - |
| 함의 F-12 영양 혼합물 (F-12) | - | 167 mL | - |
| N-2 서플리먼트(×100) | 100 배 | 5 mL | 1배 |
| B-27 서플리먼트(×50) | 50 배 | 10mL | 1배 |
| 아스코르브산 | 10mg/mL | 1.25 mL | 25μg/mL |
| α-모노티오글리세롤(MTG) | 11.5 미터 | 19.5 μL | 448.5 마이크로미터 |
| 인간 혈청 알부민 | 100mg/mL | 2.5 mL | 0.5mg/mL |
| 홀로-트랜스페린 | 100mg/mL | 0.75 mL | 150μg/mL |
표 1: 500mL의 무혈청 분화(SFD) 배지의 조성 및 제조법.
| 차별화의 시대 | 사이토카인 믹스 | 사이토카인(Cytokine) | 최종 농도 |
| 0 - 2일차 | 믹스 1 | BMP4 시리즈 | 20ng/mL |
| 2일차 | 믹스 2 | CHIR99021 | 7 μM의 |
| 3일차부터 | 믹스 3과 4 | 베지에프 | 15ng/mL |
| bFGF (비FGF) | 5ng/mL | ||
| 6일째부터 | 믹스 4 | IL6 시리즈 | 10ng/mL |
| FLT3L 시리즈 | 10ng/mL | ||
| IGF1 (IGF1) | 25ng/mL | ||
| IL11 시리즈 | 5ng/mL | ||
| 증권 시세 표시기 | 50ng/mL | ||
| 유럽 특허청(EPO) | 3 U/mL | ||
| TPO (TPO) | 30ng/mL | ||
| 일리노이3 | 30ng/mL |
표 2: 내피 세포 분화에 사용되는 사이토카인의 혼합물, SFD 배지에 첨가된 일수 및 최종 농도.
| 전단 응력(dyn/cm2) | 시간(h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | 실험이 끝날 때까지 |
표 3: 동적 배양 및 적용 길이에 대한 전단 응력 값.
보충 그림 S1: 이 프로토콜에 사용되는 칩 및 튜브의 형상 및 치수. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 각 단계에 대한 설명과 함께 공기 펌프를 제어하는 소프트웨어에 대한 단계별 가이드입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S3: FIJI를 사용한 방향 분석 가이드는 셀 모양, 타원 피팅 및 최종 측정의 도면을 보여줍니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충표 S1: 분화 프로토콜에 사용되는 사이토카인에 대한 단위 크기, 재현탁 부피 및 스톡 농도. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서 설명하는 프로토콜은 인간 만능 줄기 세포로부터 기계에 민감한 내피 세포를 생성하고 제어된 전단 응력에 의해 매개되는 기계적 자극에 대한 반응을 연구할 수 있도록 합니다. 이 프로토콜은 완전히 사이토카인 기반이며 세포 치료용 세포 생산으로 전환될 수 있는 GMP 시약과 완벽하게 호환됩니다.
hiPSC의 유도는 과학자들에게 배아 발달의 초기 단계를 위한 도구 모델을 제공하여 생체 내에서 연구하기 어려운 과정을 연구할 수 있도록 합니다 24. 사실, 연구에 사용할 수 있는 인간 배아 조직은 순환이 부족한 배아에서 수집되며, 이는 기계적 신호에 의해 제어되는 분자 서명에 상당한 영향을 미칠 수 있습니다. 여기에 설명된 접근 방식을 통해 전단 응력에 대한 세포 반응의 실시간 이미징 및 실시간 연구가 가능합니다. hiPSC와 유체 공학의 조합은 순환 개시가 심혈관 및 혈액 시스템의 확립을 리모델링하고 제어할 때 발달 중인 태아 조직의 제한된 가용성과 접근 불가능성을 극복하는 연구 모델을 제공합니다 3,9,10,25.
프로토콜의 한계는 이 프로토콜로부터 유도된 내피 세포가 발달 조직에 존재하는 상이한 내피 세포의 다양한 정체성을 반영하지 않을 수 있다는 것이다. 이러한 한계를 극복하기 위해, 원하는 동일성 또는 조직-특이적 표현형을 얻기 위해 유체 자극에 선행하는 분화 과정 동안 사이토카인의 특정 조합이 필요할 수있다 26. 내피 서브세트의 분리는 분리 단계 동안 보다 정제된 면역표현형을 사용하여 얻을 수 있습니다. 이 프로토콜은 CD34의 발현만을 기반으로 내피 세포를 분리하여 형광 활성화 세포 분류(FACS) 대신 컬럼 분리를 허용합니다. 이를 통해 세포 사멸과 오염 위험을 줄일 수 있습니다. 또한 이 프로토콜은 층류에 의해 매개되는 전단 응력의 역할을 연구하기 위해 특별히 설계되었습니다. 스트레칭 또는 압축과 같은 다른 기계적 단서 또는 교란 또는 교란된 흐름과 같은 다른 유형의 흐름의 영향을 연구하기 위해 대체 유체 접근 방식을 사용해야 합니다.
우리는 이전에 iPSC-유래 내피 세포가 태아 등쪽 대동맥(28,29,30)에서 관찰된 것과 유사한 이질적인 동정맥 세포 정체성(27)을 모방한다는 것을 보여주었다. 이는 혈관 발달 및 세포 사양의 맥락에서 특히 중요하며, 혈액 순환에 의해 조절되는 것으로 알려져 있습니다. 다른 모델에 대한 연구는 순환 부족으로 인해 동정맥 사양이 변경된다는 것을 보여주었습니다11,14,31. 기계적 단서와 세포 사양을 연결하는 메커니즘은 아직 알려지지 않았으며 여기에 설명된 파이프라인을 통해 생체 내에서 테스트할 수 없는 정교한 기능 연구를 수행할 수 있습니다.
이 파이프라인은 상업적으로 이용 가능한 유체 채널을 사용하여 hiPSC로부터 유래된 내피 세포의 생산 및 자극을 설명하며, 널리 사용되는 폴리디메틸실록산(PDMS) 장치(12)와 같이 장치를 주조할 필요가 없습니다. 또한 PDMS 칩을 사용하면 자극된 세포를 수집하기가 특히 까다로워지는 반면, 이 프로토콜을 사용하면 채널에서 세포를 쉽게 검색할 수 있습니다. 이를 통해 분석 성능이 크게 향상되어 단백질체 및 전사체 분석, 유세포 분석 및 기능 분석과 같은 후속 분석이 가능하며, 추가 배양 또는 생체 내 분석이 필요할 수 있습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 유럽 혈액학 협회(European Hematology Association)의 2021년 연구 고급 보조금(Research Advanced Grant 2021), 미국 혈액학회(American Society of Hematology)의 2021년 글로벌 연구상(Global Research Award 2021), 웰컴 트러스트(Welcome Trust)와 에든버러 대학교(University of Edinburgh)가 자금을 지원하는 내부 전략 지원 기금 ISSF3의 지원을 받았습니다. 유세포 분석 분석을 지원해 주신 유세포 분석 시설의 Fiona Rossi에게 감사드립니다. 오픈 액세스를 위해, 저자는 이 제출물에서 발생하는 모든 저자 수락 원고 버전에 크리에이티브 커먼즈 저작자표시(CC BY) 라이선스를 적용했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
참고문헌
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유