Method Article
In vitro Modello di vaso umano fetale su chip per studiare la meccanobiologia dello sviluppo
In questo articolo
Riepilogo
Di seguito è descritto un semplice flusso di lavoro per differenziare le cellule endoteliali dalle cellule staminali pluripotenti umane, seguito da un protocollo dettagliato per la loro stimolazione meccanica. Ciò consente lo studio della meccanobiologia dello sviluppo delle cellule endoteliali. Questo approccio è compatibile con i saggi a valle di cellule vive raccolte dal chip di coltura dopo la stimolazione meccanica.
Abstract
Il cuore è il primo organo ad essere funzionalmente stabilito durante lo sviluppo, avviando così la circolazione sanguigna molto presto nella gestazione. Oltre a trasportare ossigeno e sostanze nutritive per garantire la crescita fetale, la circolazione fetale controlla molti eventi cruciali dello sviluppo che si verificano all'interno dello strato endoteliale attraverso segnali meccanici. I segnali biomeccanici inducono cambiamenti strutturali dei vasi sanguigni, stabiliscono le specifiche arterovenose e controllano lo sviluppo delle cellule staminali ematopoietiche. L'inaccessibilità dei tessuti in via di sviluppo limita la comprensione del ruolo della circolazione nelle prime fasi dello sviluppo umano; Pertanto, i modelli in vitro sono strumenti fondamentali per lo studio della meccanobiologia dei vasi. Questo articolo descrive un protocollo per differenziare le cellule endoteliali dalle cellule staminali pluripotenti indotte umane e la loro successiva semina in un dispositivo fluidico per studiare la loro risposta a segnali meccanici. Questo approccio consente la coltura a lungo termine di cellule endoteliali sotto stimolazione meccanica, seguita dal recupero delle cellule endoteliali per la caratterizzazione fenotipica e funzionale. Il modello in vitro qui stabilito sarà strumentale per chiarire i meccanismi molecolari intracellulari che trasducono la segnalazione mediata da segnali meccanici, che alla fine orchestrano lo sviluppo dei vasi durante la vita fetale umana.
Introduzione
Durante lo sviluppo embrionale, il cuore è il primo organo a stabilire la funzionalità1, con contrazioni rilevabili fin dalla prima fase di formazione del tubo endocardico2. La circolazione, insieme ai segnali meccanici mediati dal flusso di sangue all'interno del vaso, controlla molti aspetti cruciali dello sviluppo precoce. Prima dell'instaurazione della circolazione fetale, la vascolarizzazione è organizzata in un plesso capillare primario; Durante il funzionamento cardiaco, questo plesso si riorganizza in vascolarizzazione venosa e arteriosa3. Il ruolo dei segnali meccanici nella specificazione arterovenosa si riflette nell'espressione pan-endoteliale dei marcatori arteriosi e venosi prima dell'inizio del flusso sanguigno4.
Le forze emodinamiche non solo controllano lo sviluppo della vascolarizzazione stessa, ma svolgono anche un ruolo fondamentale nel controllo della formazione delle cellule del sangue. Le cellule staminali e progenitrici ematopoietiche (HSPC) emergono da cellule endoteliali specializzate chiamate endotelio emogenico 5,6,7,8, presenti in diverse regioni anatomiche degli embrioni esclusivamente nella fase iniziale dello sviluppo. Modelli con deficit cardiaci, insieme a modelli in vitro, hanno dimostrato che i segnali meccanici istruiscono e aumentano la produzione di HSPC dall'endotelio emogenico 9,10,11,12,13,14.
È stato dimostrato che diversi tipi di dinamiche di flusso controllano in modo differenziato il ciclo cellulare15, noto per essere importante sia nell'endotelio emogenico 16,17 che nella specificazione delle cellule arteriose18. Nel complesso, i segnali meccanici sono determinanti critici dell'identità e della funzione cellulare durante lo sviluppo. Nuovi dispositivi fluidici in vitro ci consentono di superare i limiti legati allo studio della meccanobiologia dello sviluppo durante lo sviluppo del sangue umano in vivo.
L'obiettivo generale del protocollo in questo manoscritto è quello di descrivere, passo dopo passo, la pipeline sperimentale per studiare l'effetto dello shear stress sulle cellule endoteliali umane derivate in vitro da cellule staminali pluripotenti indotte umane (hiPSCs). Questo protocollo contiene istruzioni dettagliate sulla differenziazione delle hiPSC in cellule endoteliali e la loro successiva semina in chip fluidici per il protocollo di stimolazione. In questo modo, diverse cellule endoteliali derivate in vitro possono essere testate per la loro capacità di rilevare lo sforzo di taglio analizzando il loro orientamento in risposta al flusso. Ciò consentirà ad altri laboratori di affrontare domande sulla risposta allo stress da taglio e sulle sue conseguenze funzionali su diverse identità di cellule endoteliali.
Protocollo
NOTA: Tutte le tecniche di coltura cellulare devono essere eseguite in condizioni sterili in una cappa a flusso laminare e le cellule devono essere incubate a 37 °C in atmosfera umificata con il 5% di CO2 . Le istruzioni per tutti i preparati di citochine sia per il mantenimento (rhbFGF) che per il protocollo di differenziazione (rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3) sono riportate nella Tabella supplementare S1.
1. Coltura di hiPSC - scongelamento, mantenimento e congelamento delle cellule
- Preparazione del terreno di mantenimento, dei fattori di crescita e di altri reagenti
- Preparare il terreno di coltura aggiungendo l'intero substrato privo di siero, 36 mL di albumina sierica bovina (BSA) al 25% e 1 mL di 55 mM di β-mercaptoetanolo al terreno basale Modified Eagle Medium/F12 (DMEM/F-12) di Dulbecco (vedere la tabella dei materiali).
- Risospendere 1 mg di inibitore della Rho chinasi (iRock) in 1 mL di DMSO, effettuare aliquote di 50 μL e conservarle a -20 °C.
NOTA: Queste aliquote possono essere mantenute a -20 °C per 1 anno. Una volta scongelati, possono essere conservati a 4 °C per 1 settimana. - Scongelare la soluzione di vitronectina (VTN-N) su ghiaccio e aliquotare 60 μL per flaconcino prima di conservarla a -80 °C. Poco prima di rivestire le piastre, diluire la scorta di 60 μL in 6 mL di soluzione salina tamponata con fosfato di Dulbecco (DPBS); concentrazione finale di 5 μg/mL.
- Scongelamento di linee cellulari hiPSC
NOTA: La linea di cellule staminali pluripotenti umane SFCi55 è stata precedentemente derivata internamente e ampiamente utilizzata per la differenziazione in vari tipi di cellule e diverse linee embrionali 19,20,21,22.- Rivestire un pozzetto di una piastra a 6 pozzetti con 1 mL di soluzione VTN-N per 1 ora a 37 °C.
NOTA: Dopo l'incubazione, le piastre rivestite possono essere conservate a 4 °C per un massimo di 1 settimana. - Aspirare la soluzione VTN-N con una pipetta di aspirazione e aggiungere 1 mL di terreno di coltura preriscaldato integrato con 20 ng/mL di rhbFGF (Tabella supplementare S1).
- Scongelare rapidamente il flaconcino contenente le hiPSC a bagnomaria e trasferire la cellula in 5 mL di terreno di coltura preriscaldato.
- Centrifugare le celle per 3 minuti a 300 × g a temperatura ambiente.
- Risospendere il pellet cellulare in 0,5 mL di terreno di coltura integrato con 20 ng/mL di rhbFGF.
- Trasferire le cellule in un pozzetto rivestito contenente già 1 mL di terreno.
- Aggiungere 5 μL di iRock nei pozzetti contenenti le cellule per un totale di 1,5 mL di terreno.
- Coltiva le cellule nell'incubatrice, cambia il terreno ogni giorno durante la settimana e alimenta due volte le cellule, aggiungendo il doppio del normale volume di terreno alle cellule per garantire l'alimentazione durante il fine settimana.
NOTA: Le cellule vengono coltivate in presenza di iRock solo per 24 ore.
- Rivestire un pozzetto di una piastra a 6 pozzetti con 1 mL di soluzione VTN-N per 1 ora a 37 °C.
- Mantenimento e passaggio di hiPSCs
- Sostituire il terreno ogni giorno con terreno di coltura fresco preriscaldato integrato con 20 ng/mL di rhbFGF.
- Far passare le cellule quando raggiungono circa l'80% di confluenza, generalmente due volte a settimana.
- Per far passare le celle, rivestire una piastra con VTN-N come descritto in precedenza nei passaggi 1.2.1 e 1.2.2.
- Aspirare il terreno dai pozzetti con le celle e lavarli con DPBS.
- Aspirare il DPBS e aggiungere 1 mL di reagente di dissociazione (vedere la tabella dei materiali) e incubare per 1 min.
- Aspirare il reagente di dissociazione e incubare per altri 3 minuti. Picchiettare con decisione la piastra 10 volte su ciascun lato.
NOTA: La fase di dissociazione potrebbe richiedere un'ottimizzazione specifica per tipo di cellula nel tempo di incubazione e nella procedura di spillatura. - Aggiungere 1 mL di terreno di coltura alle cellule e, con una pipetta Pasteur, lavare una volta con il terreno per assicurarsi che la maggior parte delle colonie venga raccolta.
- Aggiungere 150 μL di sospensione cellulare a ciascun pozzetto per fornire un rapporto di passaggio di 1 pozzetto in 6.
NOTA: Subito dopo lo scongelamento di un nuovo flaconcino, è meglio far passare le cellule con un rapporto inferiore come 1:1 o 1:2 per uno o due passaggi per consentire loro di raggiungere una fase di crescita costante prima di passare in un rapporto di 1:6. - Coltiva le cellule nell'incubatrice, cambia il terreno ogni giorno durante la settimana e alimenta due volte le cellule una volta durante il fine settimana.
- Congelamento della linea cellulare delle hiPSCs
NOTA: Congelare le cellule nei primi due passaggi dopo lo scongelamento per garantire il mantenimento di un lotto di fiale congelate a basso passaggio costante per avviare la coltura. Congelare le cellule quando raggiungono una confluenza di circa l'80%.- Sostituire il terreno con terreno di coltura fresco preriscaldato integrato con 20 ng/mL di rhbFGF e 5 μL di iRock e incubare per almeno 1 ora.
- Staccare le celle come descritto nei passaggi 1.3.2.2-1.3.2.5.
- Raccogliere le cellule staccate in una provetta da centrifuga da 15 mL contenente 5 mL di terreno di coltura.
- Centrifugare per 3 minuti a 300 × g a temperatura ambiente.
- Aspirare il surnatante e aggiungere 1 mL di soluzione di crioconservazione (vedere Tabella dei materiali).
- Utilizzando una pipetta Pasteur, pipettare delicatamente le cellule su e giù per mescolarle nella soluzione di crioconservazione.
NOTA: Evitare un pipettaggio eccessivo, che potrebbe causare la dissociazione dei gruppi di cellule. - Dividere la sospensione cellulare in due fiale di crioconservazione da 0,5 mL ciascuna.
- Trasferire i flaconcini di crioconservazione in un contenitore di crioconservazione preraffreddato a 4 °C.
- Trasferire il contenitore con le cellule in un congelatore a -80 °C per 24 ore prima di trasferire i flaconcini in azoto liquido per la conservazione a lungo termine.
2. Differenziamento delle hiPSCs in cellule endoteliali
- Preparazione del terreno di differenziazione, delle citochine e dei fattori di crescita
- Preparare il terreno di differenziazione privo di siero (SFD) secondo la Tabella 1. Utilizzare questo mezzo dal giorno 0 al giorno 5 di differenziazione.
- Preparare un terreno privo di siero per le cellule CD34+ (SFM-34) aggiungendo 34 integratori alimentari e 5 mL di integratore di L-glutammina al terreno basale 34 SFM (vedere la tabella dei materiali). Usa questo mezzo dal giorno 6 di differenziazione in poi.
- Risospendere 1 mg di CHIR99021 in 716 μL di DMSO per ottenere una soluzione di 3 mM. Incubare a temperatura ambiente fino a completa risospendimento; se necessario, riscaldare rapidamente a 37 °C. Effettuare aliquote da 20 μL e conservarle a -20 °C per un massimo di 6 mesi. Utilizzare immediatamente dopo lo scongelamento e non congelare o conservare.
- Risospendere le citochine secondo le istruzioni riportate nella Tabella supplementare S1. Conservare tutte le aliquote delle citochine a -80 °C.
- Differenziamento delle cellule endoteliali
NOTA: Per ogni giorno di differenziazione, preparare 18 mL (3 mL di terreno/pozzetto) di terreno SFD preriscaldato, secondo le miscele di citochine descritte in Tabella 2.- Giorno 0 - formazione dei corpi embrioidi (EBs)
- Preparare 18 mL di terreno SFD con la citochina Mix 1 secondo la Tabella 2, per ogni piastra a 6 pozzetti (3 mL/pozzetto).
- Aggiungere 2 mL di terreno SFD preriscaldato con Miscelare 1 citochina in ciascun pozzetto di una piastra a 6 pozzetti repellente per cellule (vedere Tabella dei materiali).
- Per formare EB, seguire i passaggi descritti nei passaggi 1.3.2.2-1.3.2.4.
NOTA: Assicurarsi che le hiPSC siano confluenti al 70-80% per avviare la differenziazione. - Aggiungere 1 mL di terreno SFD preriscaldato con citochine Mix 1 a ciascun pozzetto di cluster di cellule distaccate.
- Utilizzare una pipetta Pasteur per trasferire delicatamente i cluster cellulari in un singolo pozzetto di repellente cellulare per la formazione di EB in un rapporto di 1:1.
- Dopo aver posizionato la piastra nell'incubatrice, muoverla avanti e indietro, a destra e a sinistra, per disperdere uniformemente gli EB nel pozzetto.
- Giorno 1 - cambio medio agli EB
NOTA: Questo passaggio è necessario solo se, entro il giorno 1 di differenziamento, ci sono molte cellule singole in sospensione accanto agli EB.- Preparare 18 mL di terreno SFD con la citochina Mix 1 secondo la Tabella 2, per ogni piastra a 6 pozzetti (3 mL/pozzetto).
- Agitare la piastra con gli EB per spostarli al centro e raccoglierli utilizzando una pipetta Pasteur in una provetta da centrifuga da 15 mL.
NOTA: Se gli EB appaiono raggruppati come in stringhe, separarli pipettandoli su e giù con un P1000 prima di raccoglierli nella provetta da centrifuga da 15 mL. - Attendere 5-10 minuti affinché gli EB si depositino sul fondo del tubo.
NOTA: Se gli EB sono troppo piccoli, centrifugarli per 5 minuti a 100 × g per aiutarli a stabilizzarsi. - Lavare le piastre repellenti per cellule con acqua sterile o DPBS per rimuovere eventuali singole cellule o detriti.
- Aspirare con cautela e lentamente il surnatante dagli EB senza spostarli.
- Aggiungere 2 mL di SFD con citochine Mix 1 a ciascun pozzetto delle piastre repellenti per cellule.
- Risospendere gli EB utilizzando 1 mL di terreno SFD con citochine Mix 1 per ogni pozzetto di partenza - per una piastra a 6 pozzetti, aggiungere 6 mL di terreno.
- Trasferire gli EB sulle piastre repellenti per cellule in un volume di 1 mL per pozzetto, che contiene già 2 mL di terreno SFD.
- Dopo aver posizionato la piastra nell'incubatrice, muoverla avanti e indietro, a destra e a sinistra, per disperdere uniformemente gli EB nel pozzetto.
- Giorno 2 - aggiunta di CHIR99021
- Far roteare gli EB al centro della piastra e aggiungere CHIR99021 secondo la Tabella 2 sul lato del pozzetto per evitare il contatto diretto con le cellule.
NOTA: Se il mezzo non è stato cambiato al giorno 1, sostituire l'intero mezzo invece di aggiungere solo CHIR. Preparare 18 mL di terreno SFD con Mix 2 secondo la Tabella 2, per ogni piastra a 6 pozzetti (3 mL/pozzetto). - Dopo aver posizionato la piastra nell'incubatrice, muoverla avanti e indietro, a destra e a sinistra, per disperdere uniformemente gli EB nel pozzetto.
- Far roteare gli EB al centro della piastra e aggiungere CHIR99021 secondo la Tabella 2 sul lato del pozzetto per evitare il contatto diretto con le cellule.
- Giorno 3 - cambiamento medio degli EB e aggiunta di citochine Mix 3
- Preparare 18 mL di terreno SFD con Mix 3 citochine secondo la Tabella 2, per ogni piastra a 6 pozzetti (3 mL/pozzetto).
- Raccogliere gli EB come descritto nei passaggi 2.2.2.2-2.2.2.4.
- Aggiungere 2 mL preriscaldati di terreno SFD con le citochine Mix 3 alle piastre repellenti per le cellule.
- Aspirare con cautela il surnatante dagli EB. Aggiungere 1 mL/pozzetto di SFD con Mix 3 citochine.
- Distribuire gli EB tra i pozzetti come descritto nei passaggi 2.2.2.8-2.2.2.9.
- Giorno 6 - cambiamento medio per SFM-34 e aggiunta di citochine Mix 4
- Preparare 18 mL di terreno SFD con Mix 4 citochine secondo la Tabella 2, per ogni piastra a 6 pozzetti (3 mL/pozzetto).
- Raccogliere gli EB come descritto nei passaggi 2.2.2.2-2.2.2.4.
- Aggiungere 2 mL di terreno SFM-34 preriscaldato con le citochine Mix 4 alle piastre repellenti per le cellule.
- Aspirare con cautela il surnatante dagli EB. Aggiungere 1 mL/pozzetto di SFM-34 con Mix 4 citochine.
- Distribuire gli EB tra i pozzetti come descritto nei passaggi 2.2.2.8-2.2.2.9.
- Giorno 0 - formazione dei corpi embrioidi (EBs)
3. Isolamento e semina delle cellule CD34+ nel chip
NOTA: Le cellule CD34+ vengono isolate tramite un approccio di isolamento positivo con un kit di microsfere CD34 (vedere Tabella dei materiali), che contiene microsfere CD34 coniugate ad anticorpi monoclonali di topo anticorpi anti-CD34 umani e reagente bloccante FcR (IgG umane). È importante convalidare l'efficienza dell'isolamento della colonna colorando le cellule prima e dopo l'isolamento per l'analisi della citometria a flusso, di seguito è indicato quando le cellule devono essere prelevate per questa analisi.
- Preparare materiali e reagenti.
- Preparare il tampone di lavaggio aggiungendo 5 mL di soluzione BSA al 5% e 200 μL di EDTA 0,5 M a 45 mL di DPBS per ottenere PBS + 0,5% BSA + 2 mM EDTA. Preparare fresco per ogni isolamento, sterilizzare con filtro e conservare in frigorifero fino all'uso.
- Rivestire i trucioli fluidici con una soluzione di laminina preparata diluendo la rhLaminin 521 1:50 in DPBS Ca 2+ Mg2+. Rivestire ogni truciolo con il volume appropriato per il truciolo in uso e incubare nell'incubatrice per 2 ore prima della semina.
NOTA: Altre matrici possono essere impiegate per il rivestimento e devono essere testate per il tipo di cella/esperimento specifico. - Preparare il terreno Mix 4 SFM-34 integrando 18 mL di terreno SFM-34 con le citochine Mix 4 secondo la Tabella 2 e posizionare la miscela in una provetta da 50 mL nell'incubatrice con il coperchio leggermente svitato per facilitare lo scambio gassoso.
- Posizionare i set di perfusione selezionati e qualsiasi altro tubo da utilizzare nell'incubatore per degassare.
- Giorno 8 - dissociazione degli EB e isolamento CD34+
- Raccogliere gli EB come descritto nei passaggi 2.2.2.2-2.2.2.5.
- Aggiungere 1 mL di reagente di dissociazione cellulare per ogni pozzetto iniziale di EB raccolti (se sono stati raccolti 6 pozzetti, aggiungere 6 mL).
- Trasferire 1 mL della sospensione EB nel reagente di dissociazione cellulare in ciascun pozzetto della piastra repellente per cellule.
- Incubare per 10 minuti nell'incubatrice.
- Pipettare delicatamente gli EB su e giù contro il pozzetto con un P1000, non più di 10 volte.
- Ripetere i passaggi 3.2.4-3.2.5.per un totale di 3 volte.
NOTA: Se gli EB sono difficili da dissociare, ripetere i passaggi precedenti 4 volte in totale. - Aggiungere 5 mL di tampone di lavaggio per ogni pozzetto di EB dissociati.
- Raccogliere le cellule in una provetta da centrifuga da 50 mL facendole passare attraverso un colino da 40 μm. Prelevare 10 μL della sospensione cellulare per contare le cellule.
NOTA: Per verificare l'efficienza dell'isolamento, trasferire 105 cellule/provetta in due provette diverse (controllo non colorato e campione preselezionato) che verranno utilizzate successivamente per la citometria a flusso (come descritto nei passaggi 4.3.9-4.3.13). Per una piastra a 6 pozzetti, ~106 cellule devono essere raccolte dopo la filtrazione. - Centrifugare le celle per 10 minuti a 300 × g.
- Risospendere le cellule in 300 μL di tampone di lavaggio, pipettando delicatamente alcune volte per assicurarsi che non siano presenti grumi. Continuare a seguire il protocollo del produttore (vedere la tabella dei materiali).
- Semina di cellule CD34+ in chip fluidici
NOTA: Il chip fluidico utilizzato nel protocollo ha un'altezza del canale di 0,6 mm e una lunghezza di 50 mm, per un'area di crescita totale di 2,5 cm2 (Figura supplementare S1). Questo tipo di chip viene seminato con un volume totale di sospensione cellulare di 150 μL. È possibile utilizzare diversi chip e il volume di semina e la densità cellulare devono essere adattati in base all'area di crescita. Potrebbe essere necessaria un'ulteriore ottimizzazione a seconda della linea cellulare utilizzata e della sua crescita.- Risospendere le cellule CD34+ isolate in 300 μL di terreno SFM-34 preriscaldato con citochine Mix 4.
- Prelevare 10 μL di sospensione cellulare e contare le cellule.
- Risospendere 2,5 × 105 cellule in un volume finale di 150 μL integrato SFM-34; aggiungere 0,5 μL di iRock.
NOTA: Per verificare l'efficienza dell'isolamento, trasferire 105 cellule/provetta in una provetta (campione post-selezionato) che verrà utilizzata successivamente per la citometria a flusso (come descritto nei passaggi 4.3.9-4.3.13). - Aspirare lentamente la laminina dai trucioli fluidici inserendo la punta di un P200 all'interno del serbatoio sul bordo del canale.
NOTA: Se il liquido è difficile da raccogliere, sollevare lentamente un lato del truciolo per aiutare il liquido a spostarsi verso il serbatoio opposto. - Aggiungere costantemente la sospensione cellulare nel canale per assicurarsi che non si formino bolle.
NOTA: Eseguire i passaggi 3.3.4-3.3.5 rapidamente ma delicatamente per evitare che la laminina si secchi e si formino bolle nei canali del truciolo. Se si formano delle bolle, sollevare un lato del chip e picchiettare delicatamente il vetrino per mobilitare le bolle; Quando raggiungono il serbatoio, saliranno verso l'interfaccia dell'aria e non dovrebbero essere in grado di entrare nel canale. - Trasferisci il chip nell'incubatrice e lascialo per una notte in modo che le cellule siano completamente attaccate al canale e appaiano allungate.
- Quando le cellule sono completamente attaccate, aspirare il terreno come al punto 3.3.4 e sostituirlo con 200 μL di SFM-34 integrato con citochine.
- D'ora in poi, sostituire il terreno ogni giorno fino a quando le cellule non avranno raggiunto il 90%-100% di confluenza.
4. Applicazione del flusso continuo alle cellule endoteliali - Aorta-on-a-chip
- Preparare materiali e reagenti.
- Preparare il terreno Mix 4 SFM-34 integrando 18 mL di terreno SFM-34 con le citochine Mix 4 secondo la Tabella 2 e inserirlo in una provetta da 50 mL nell'incubatore con il coperchio leggermente svitato per facilitare lo scambio gassoso.
- Posizionare i set di perfusione selezionati e gli eventuali tubi da utilizzare per la configurazione fluidica nell'incubatore per degasare.
- Assemblaggio del sistema fluidico
- Installare il set di perfusione nell'unità secondo il protocollo del produttore.
NOTA: Ricordarsi di utilizzare clamps nel sistema. Se si utilizzano morsetti scorrevoli per questo passaggio, è necessario farli scorrere sul tubo prima di collegarli al chip. - Collegare un nuovo chip fluidico e aggiungere il terreno SFM-34 integrato con citochine, assicurandosi di riempire entrambi i serbatoi in condizioni sterili nella cappa.
- Eseguire il programma di rimozione delle bolle e la fase di calibrazione.
- Rimuovere dall'incubatrice l'unità fluidica con il set collegato e trasferirla nella cappa; Prendi anche i chip contenenti le cellule dall'incubatrice.
- Clamp il tubo su entrambi i lati del chip di prova.
- Rimuovere il tubo dal chip di prova.
NOTA: Verificare che non siano presenti bolle nel connettore Luer all'estremità del tubo. Se sono visibili bolle, aspirarle con cautela utilizzando una pipetta P200 e, se necessario, aggiungere altro terreno per assicurarsi che il connettore sia pieno di fluido. - Collegare il chip contenente le celle con il tubo.
- Rimuovere o aprire i morsetti.
- Trasferire il sistema nell'incubatrice e collegare la pompa dell'aria all'unità fluidica.
- Avviare il programma preselezionato utilizzando il software dedicato alla pompa (Figura supplementare S2) con l'aumento graduale della sollecitazione di taglio descritta nella Tabella 3.
NOTA: A seconda dell'esperimento specifico necessario, potrebbe essere necessario ottimizzare il programma di stimolazione. Qui viene descritto un graduale aumento dello sforzo di taglio che porta al valore finale di 5 dyn/cm2, che imita lo sforzo di taglio calcolato per essere sperimentato dalla parete dell'aorta dorsale all'inizio della circolazione fetale 9. Indipendentemente dallo sforzo di taglio finale che verrà impiegato, è necessario aumentare gradualmente nel tempo per consentire alle celle di adattarsi alla forza senza causare il distacco delle celle dal chip. Se il protocollo di stimolazione selezionato è più lungo di 3 giorni, le citochine devono essere rabboccate nel sistema aggiungendo 1 mL di SFM-34 contenente le citochine Mix 4 che normalmente verrebbero aggiunte in 18 mL. A tale scopo, il programma della pompa viene rapidamente messo in pausa e vengono aggiunti 500 μL di terreno integrato a ciascuna delle due siringhe del set fluidico.
- Installare il set di perfusione nell'unità secondo il protocollo del produttore.
- Raccolta di cellule per l'analisi
- Preriscaldare il tampone di dissociazione a bagnomaria.
- Rimuovere l'unità fluidica dall'incubatrice e spostarla nella cappa.
- Clamp il tubo che fiancheggia il chip su entrambi i lati e rimuovere il tubo dai serbatoi sul chip.
- Rimuovere delicatamente il terreno dal chip e sostituirlo con DPBS Ca 2+ Mg2+ per lavare le cellule.
NOTA: Questa fase del lavaggio con PBS può essere saltata se le celle iniziano a staccarsi. - Aggiungere delicatamente 150 μL di tampone di dissociazione e incubare per 3 minuti a 37 °C.
NOTA: Controllare al microscopio se le cellule sono singole e staccate; in caso contrario, incubare per altri 2 minuti. È essenziale che le cellule siano completamente staccate dal canale prima di aspirare il terreno, in quanto il chip non consente di favorire il distacco cellulare mediante pipettaggio. Altre soluzioni possono essere impiegate per staccare le cellule, come i tamponi a base di tripsina o EDTA. - Raccogliere il tampone di dissociazione contenente le cellule da un serbatoio e trasferirlo in una provetta da centrifuga da 15 ml e lavare il canale una volta con DPBS per raccogliere tutte le cellule staccate.
- Aggiungere 1 mL di tampone di lavaggio alla provetta da 15 mL con le cellule e prendere 10 μL per contare le cellule.
- Dividere la sospensione cellulare in provette per citometria a flusso per avere 105 cellule per provetta.
- Centrifugare i tubi per 5 minuti a 300 × g.
- Preparare la soluzione colorante in modo che abbia 50 μL per ogni provetta da colorare. Aggiungere il CD34 PerCP-efluor710 o il CD34-PE rispettivamente a una diluizione di 1:100 e 1:200.
- Risospendere le cellule in 50 μL di soluzione colorante e incubare per 30 minuti a 4 °C.
- Lavare le celle aggiungendo 2 ml di tampone di lavaggio e centrifugare per 5 minuti a 300 × g.
- Risospendere i pellet in 100 μL di soluzione colorante e acquisire i dati utilizzando un citometro a flusso.
NOTA: Le cellule possono anche essere lisate direttamente nel chip per l'estrazione dell'RNA utilizzando 150 μL di tampone di lisi dell'RNA o fissate per l'imaging utilizzando paraformaldeide al 4% in DPBS per 10 minuti a temperatura ambiente.
- Analisi dell'orientamento delle celle
- Analizzare le immagini per quantificare i cambiamenti nell'orientamento delle celle utilizzando FIJI23 (Figura supplementare S3).
- Aprire il gestore dell'area di interesse (ROI) dalla finestra di dialogo Analizza | Strumenti | Menu Gestione ROI.
- Disegna manualmente i contorni delle celle utilizzando lo strumento di selezione dei poligoni e aggiungili a Gestione ROI facendo clic su Aggiungi o utilizzando la scorciatoia CTRL+T .
- Misurare l'orientamento di ogni ROI scegliendo la misura Adatta ellisse nella finestra di dialogo Analizza | Menu Imposta misure .
- Applica la misurazione a tutti i ROI attraverso il Altro... Comando Misura multipla in Gestione ROI.
NOTA: questo passaggio adatterà un'ellisse a ciascuna ROI e genererà una tabella contenente la lunghezza degli assi dell'ellisse maggiore e minore, nonché l'angolo. - Esporta la tabella in un file CSV da importare in un altro software per stampare.
NOTA: Lo script utilizzato per i grafici è disponibile all'indirizzo https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ddc.
- Analizzare le immagini per quantificare i cambiamenti nell'orientamento delle celle utilizzando FIJI23 (Figura supplementare S3).
Risultati
Descriviamo qui un protocollo per il differenziamento e la meccanostimolazione di cellule endoteliali derivate da hiPSCs che permette di studiare la loro risposta a segnali meccanici (Figura 1). Questo protocollo si traduce nella produzione di cellule endoteliali funzionalmente meccanosensibili. Forniamo qui risultati rappresentativi e descriviamo il fenotipo atteso per valutare come le cellule rispondono alla stimolazione delle citochine durante il differenziamento.
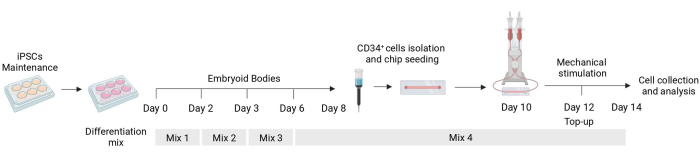
Figura 1: Schema del protocollo di differenziazione e stimolazione meccanica. Schema del protocollo di differenziamento che mostra la tempistica delle diverse miscele di citochine, l'isolamento cellulare CD34+ , la semina fluidica del chip e l'analisi finale delle cellule stimolate meccanicamente. Fare clic qui per visualizzare una versione più grande di questa figura.
Cultura delle hiPSC
È importante iniziare il protocollo dalle hiPSC che crescono correttamente in condizioni di auto-rinnovamento. Una buona indicazione della qualità della cultura è la velocità della loro crescita. Dopo lo scongelamento, le cellule potrebbero aver bisogno di 2-3 settimane per raggiungere la corretta fase di crescita che garantirà una buona differenziazione. Quando le cellule possono essere passate due volte alla settimana nel rapporto di 1:6 raggiungendo quasi la piena confluenza, questo è il momento in cui sono pronte per essere differenziate lo stesso giorno in cui devono essere attraversate.
Differenziamento delle hiPSC in cellule endoteliali
La prima fase del differenziamento, che consiste nella formazione di corpi embrioidi (EB), è dipendente dalla linea cellulare e può richiedere alcune ottimizzazioni per la specifica linea cellulare in uso. La dissociazione descritta nei passaggi 1.3.2.2-1.3.2.4 del protocollo può essere modificata riducendo o prolungando l'incubazione con il reagente di dissociazione e la successiva dissociazione con la pipetta Pasteur. Inoltre, altri reagenti di dissociazione possono essere utilizzati per questa fase oltre alla dissociazione fisica delle colonie con uno strumento da taglio o un puntale per pipette P100. Gli EB di buona qualità mostrano un bordo definito entro il giorno 2 della differenziazione e appaiono chiari e luminosi se osservati al microscopio; Le aree più scure potrebbero indicare la morte cellulare all'interno degli EB (Figura 2).
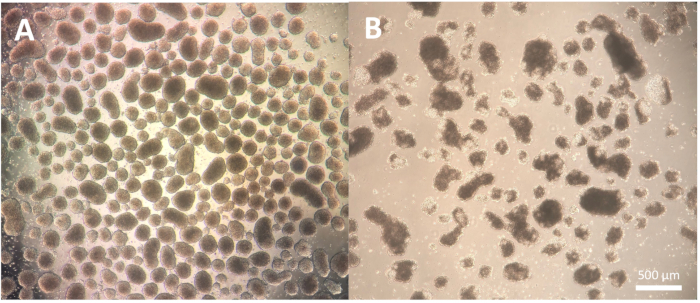
Figura 2: Morfologia dei corpi embrioidi. (A) Corpi embrioidi del giorno 2 che mostrano bordi esterni ben definiti e dimensioni consistenti. (B) Corpi embrioidi di scarsa qualità che mostrano un'estesa morte cellulare che porta alla disaggregazione della struttura. Barra della scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Al giorno 2, l'aggiunta di CHIR99021 agli EB inibisce la proteina GSK-3 con conseguente attivazione della via Wnt. Diverse linee cellulari hanno risposte diverse al trattamento con CHIR, e questo dovrebbe essere testato quantificando il numero di cellule CD34+ ottenute al giorno 8 utilizzando concentrazioni diverse (Figura 3).
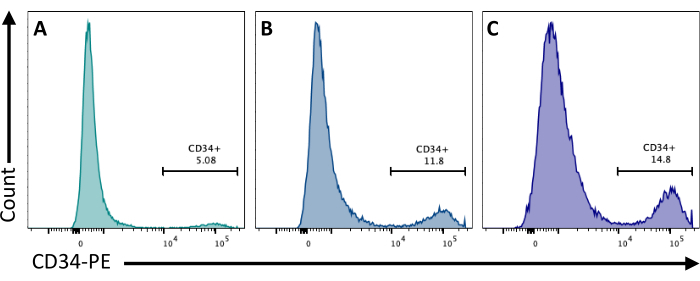
Figura 3: Differenziamento delle cellule endoteliali con diversi trattamenti CHIR. Impegno delle cellule endoteliali quantificato mediante citometria a flusso al giorno 8 di differenziamento mediante espressione di membrana CD34, dopo il trattamento CHIR al giorno 2 a (A) 3 μM, (B) 5 μM e (C) 7 μM. I dati della citometria a flusso sono stati ottenuti utilizzando citometri a cinque laser e un software dedicato (vedi Tabella dei materiali). Fare clic qui per visualizzare una versione più grande di questa figura.
Isolamento di cellule CD34+
È importante verificare che l'arricchimento di CD34+ utilizzando le biglie magnetiche fornisca almeno l'80% di CD34+ dopo l'eluizione della colonna. Per garantire una purezza sufficiente, un'aliquota di cellule ottenuta dall'isolamento magnetico può essere analizzata mediante citometria a flusso avendo cura di utilizzare un clone di anticorpo diverso da quello utilizzato per l'arricchimento magnetico. In questo caso, è stato utilizzato il clone 4H11 e la purezza di ~85% è stata raggiunta dopo l'arricchimento (Figura 4).
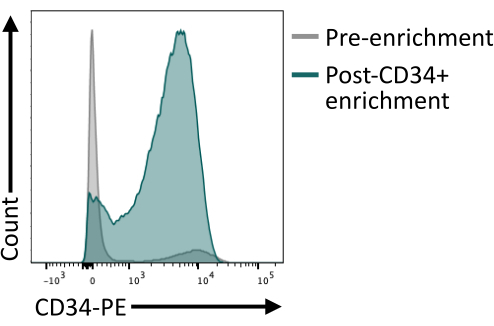
Figura 4: Espressione di membrana di CD34 prima e dopo l'arricchimento mediante selezione magnetica. I corpi embrioidi dissociati del giorno 8 (grigio) e le cellule dopo l'arricchimento magnetico (verde) sono stati colorati per l'espressione di CD34 e analizzati mediante citometria a flusso, mostrando un arricchimento di successo dopo lo smistamento. I dati della citometria a flusso sono stati ottenuti utilizzando citometri a cinque laser e un software dedicato (vedi Tabella dei materiali). Fare clic qui per visualizzare una versione più grande di questa figura.
Semina delle cellule nel canale fluidico
Quando si seminano le cellule nel canale fluidico, è fondamentale monitorare l'adesione e la proliferazione delle cellule endoteliali. Dopo la semina, le cellule impiegano ~5 ore per aderire completamente al canale (Figura 5A). In questa fase può essere testata anche una soluzione di rivestimento alternativa per migliorare l'adesione. Per confermare che le cellule testate sono meccanosensibili e quindi in grado di rispondere alla stimolazione meccanica, l'orientamento cellulare può essere testato nel tempo. Le cellule prima della stimolazione mostrano un orientamento casuale (Figura 5A e Figura 5C) e si riorientano parallelamente alla direzione del flusso (Figura 5B,C). Il protocollo qui descritto consente di prelevare le cellule dal canale per eseguire analisi a valle, ad esempio la citometria a flusso, per lo studio del loro immunofenotipo di membrana, fornendo l'identità endoteliale delle cellule stimolate (Figura 5D,E).
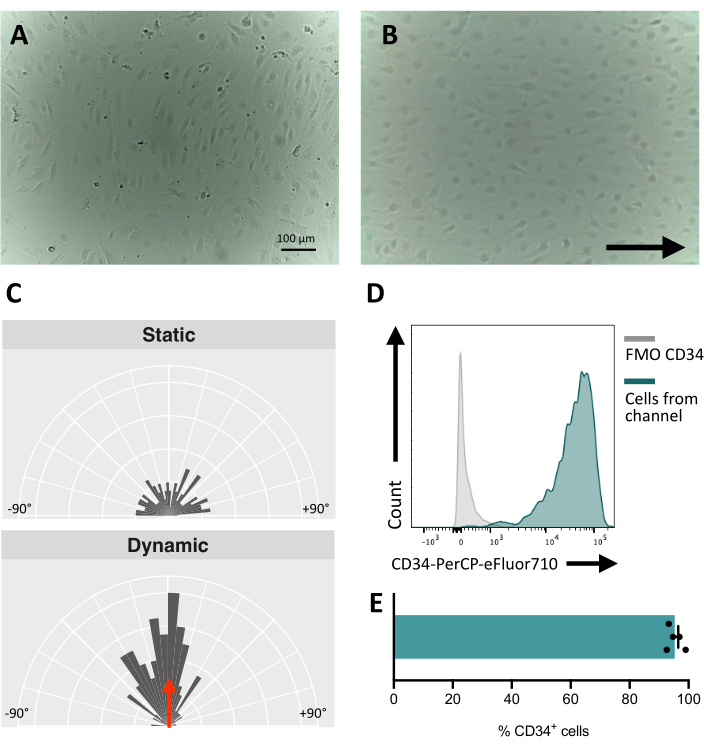
Figura 5: Meccanoresponsività delle cellule endoteliali derivate da hiPSCs . (A) Strato confluente di cellule CD34+ isolate 48 ore dopo la semina. (B) Strato riorientato di cellule endoteliali 3 giorni in coltura dinamica. (C) Analisi dell'orientamento delle cellule endoteliali dopo 5 giorni di coltura dinamica. (D) Profilo di espressione di CD34 di cellule coltivate sotto flusso per 5 giorni. (E) Percentuale di cellule CD34+ della popolazione cellulare recuperate dal canale fluidico. Le immagini sono state scattate utilizzando un microscopio invertito in incubatrice; I dati della citometria a flusso sono stati ottenuti utilizzando citometri a cinque laser e un software dedicato (vedi Tabella dei materiali). Barre di scala = 100 μm (A,B). Fare clic qui per visualizzare una versione più grande di questa figura.
| Reagenti | Concentrazione delle scorte | Volume aggiunto | Concentrazione finale |
| Terreno di Dulbecco modificato di Iscove (IMDM) | - | 333 ml | - |
| Miscela nutritiva F-12 di prosciutto (F-12) | - | 167 ml | - |
| Supplemento N-2 (100x) | 100 x | 5 mL | 1x |
| Supplemento B-27 (50x) | 50 x | 10 ml | 1x |
| Acido ascorbico | 10 mg/mL | 1,25 ml | 25 μg/mL |
| α-Monotioglicerolo (MTG) | 11,5 mio. | 19,5 μL | 448,5 μM |
| Albumina sierica umana | 100 mg/mL | 2,5 mL | 0,5 mg/mL |
| Olo-transferrina | 100 mg/mL | 0,75 mL | 150 μg/mL |
Tabella 1: Composizione e ricetta per 500 mL di terreno di differenziazione senza siero (SFD).
| Giorni di differenziazione | Miscela di citochine | Citochine | Concentrazione finale |
| Giorno 0 - 2 | Miscela 1 | BMP4 | 20 ng/mL |
| Giorno 2 | Miscela 2 | CHIR99021 | 7 μM |
| Dal giorno 3 in poi | Mescolare 3 e 4 | VEGF | 15 ng/mL |
| bFGF | 5 ng/mL | ||
| Dal giorno 6 in poi | Miscela 4 | IL6 | 10 ng/mL |
| FLT3L | 10 ng/mL | ||
| IGF1 | 25 ng/mL | ||
| IL11 | 5 ng/mL | ||
| SCF | 50 ng/mL | ||
| Olio di protezione europeo | 3 U/mL | ||
| TPO | 30 ng/mL | ||
| IL3 | 30 ng/mL |
Tabella 2: Miscele di citochine utilizzate per la differenziazione delle cellule endoteliali, giorni in cui vengono aggiunte al terreno SFD e concentrazione finale.
| Sforzo di taglio (dyn/cm2) | Tempo (h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | Fino alla fine dell'esperimento |
Tabella 3: Valori di sforzo di taglio per la coltura dinamica e la durata della loro applicazione.
Figura supplementare S1: Geometria e dimensioni del chip e del tubo utilizzati per questo protocollo. Fare clic qui per scaricare il file.
Figura supplementare S2: Guida passo-passo per il software di controllo della pompa dell'aria con una descrizione di ogni fase. Fare clic qui per scaricare il file.
Figura supplementare S3: Guida per l'analisi dell'orientamento utilizzando FIJI che mostra il disegno della forma della cella, l'adattamento ellittico e la misura finale. Fare clic qui per scaricare il file.
Tabella supplementare S1: Dimensioni dell'unità, volume di risospensione e concentrazioni di stock per le citochine utilizzate nel protocollo di differenziazione. Fare clic qui per scaricare il file.
Discussione
Il protocollo che qui descriviamo consente la generazione di cellule endoteliali meccanosensibili da cellule staminali pluripotenti umane e lo studio della loro risposta alla stimolazione meccanica mediata da stress di taglio controllato. Questo protocollo è interamente basato su citochine e pienamente compatibile con i reagenti GMP per la potenziale traduzione nella produzione di cellule per la terapia cellulare.
La derivazione delle hiPSC fornisce agli scienziati un modello strumentale per le prime fasi dello sviluppo embrionale che consente lo studio di processi altrimenti difficili da studiare in vivo24. Infatti, i tessuti embrionali umani disponibili per la ricerca vengono raccolti da embrioni privi di circolazione, e questo potrebbe avere un impatto significativo sulla firma molecolare controllata da segnali meccanici. L'approccio qui descritto consente l'imaging dal vivo e lo studio in tempo reale della risposta cellulare allo stress da taglio. La combinazione delle hiPSC con la fluidica fornisce un modello di studio che supera la limitata disponibilità e l'inaccessibilità dei tessuti fetali in via di sviluppo quando l'inizio della circolazione rimodella e controlla l'instaurazione del sistema cardiovascolare e sanguigno 3,9,10,25.
Una limitazione del protocollo è che le cellule endoteliali derivate da questo protocollo potrebbero non riflettere le varie identità delle diverse cellule endoteliali presenti nei tessuti in via di sviluppo. Per superare questa limitazione, potrebbe essere necessaria una specifica combinazione di citochine durante il processo di differenziazione che precede la stimolazione fluidica per ottenere l'identità desiderata o il fenotipotessuto-specifico 26. L'isolamento di sottogruppi endoteliali può essere ottenuto utilizzando un immunofenotipo più raffinato durante la fase di isolamento. Questo protocollo isola le cellule endoteliali basandosi solo sull'espressione di CD34, consentendo così l'isolamento della colonna invece del cell sorting attivato dalla fluorescenza (FACS); In questo modo si riduce la morte cellulare e il rischio di contaminazione. Inoltre, questo protocollo è specificamente progettato per studiare il ruolo dello sforzo di taglio mediato dal flusso laminare. Dovranno essere impiegati approcci fluidici alternativi per studiare l'effetto di altri segnali meccanici, come l'allungamento o la compressione, o altri tipi di flusso come il flusso perturbato o disturbato.
Abbiamo precedentemente dimostrato che le cellule endoteliali derivate da iPSC imitano le identità cellulari arterovenoseeterogenee 27 in modo simile a quello osservato nell'aorta dorsale fetale28,29,30. Ciò è di particolare importanza nel contesto dello sviluppo dei vasi e della specificazione cellulare, nota per essere controllata dalla circolazione sanguigna. Studi su diversi modelli hanno dimostrato che la mancanza di circolazione provoca un'alterazione delle specifiche arterovenose11,14,31. I meccanismi che collegano i segnali meccanici con la specificazione cellulare sono ancora sconosciuti e la pipeline qui descritta consente studi funzionali raffinati che non possono essere testati in vivo.
Questa pipeline descrive la produzione e la stimolazione di cellule endoteliali derivate da hiPSC utilizzando canali fluidici disponibili in commercio, evitando la necessità di fondere i dispositivi come per i dispositivi in polidimetilsilossano (PDMS) ampiamente utilizzati12. Inoltre, l'utilizzo di chip PDMS rende particolarmente impegnativa la raccolta delle cellule stimolate, mentre con questo protocollo le cellule possono essere facilmente recuperate dal canale. Ciò migliora significativamente la potenza analitica consentendo analisi successive come analisi proteomiche e trascrittomiche, citometria a flusso e saggi funzionali, che potrebbero richiedere ulteriori colture o saggi in vivo .
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Research Advanced Grant 2021 della European Hematology Association, dal Global Research Award 2021 dell'American Society of Hematology e dall'Internal Strategy Support Fund ISSF3 finanziato dal Welcome Trust e dall'Università di Edimburgo. Ringraziamo Fiona Rossi della Flow Cytometry Facility per il supporto nell'analisi della citometria a flusso. Ai fini dell'accesso aperto, l'autore ha applicato una licenza Creative Commons Attribution (CC BY) a qualsiasi versione del manoscritto accettato dall'autore derivante da questa presentazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
Riferimenti
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon