Method Article
Hücre Döngüsünün G1 Fazında Tek Sarmallı DNA Odaklarının Görselleştirilmesi
Bu Makalede
Özet
Aşağıdaki protokol, hücre döngüsü senkronizasyonu ve ardından RPA2 immünofloresan boyama kullanılarak hücre döngüsünün G1 fazında tek sarmallı DNA odaklarının saptanmasını sunar.
Özet
DNA, hem endojen hem de eksojen kaynaklardan kaynaklanabilecek lezyonlarla başa çıkabilen özel hücresel onarım yollarına sahiptir. DNA onarımı, bir DNA lezyonunun varlığını tanımaktan ve işaret etmekten fiziksel olarak onarmaya kadar çok çeşitli görevleri kapsamaktan sorumlu çok sayıda protein arasında işbirliğini gerektirir. Bu işlem sırasında, genellikle tek sarmallı DNA (ssDNA) izleri oluşturulur ve bunlar sonunda DNA polimerazlar tarafından doldurulur. Bu ssDNA izlerinin doğası (hem uzunluk hem de sayı açısından), bu boşlukları doldurmak için işe alınan polimeraz ile birlikte, onarım yoluna özgüdür. Bu ssDNA izlerinin görselleştirilmesi, DNA onarım mekanizmalarının karmaşık dinamiklerini anlamamıza yardımcı olabilir.
Bu protokol, genotoksik stres üzerine ssDNA odaklarının oluşumunu ölçmek için G1 senkronize hücrelerin hazırlanması için ayrıntılı bir yöntem sağlar. Kullanımı kolay bir immünofloresan yaklaşımı kullanarak, heterotrimerik replikasyon proteini A kompleksinin (RPA) bir bileşeni olan RPA2'yi boyayarak ssDNA'yı görselleştiriyoruz. RPA2, DNA onarımını ve DNA hasarı kontrol noktası aktivasyonunu kontrol etmek için genotoksik stres veya replikasyon üzerine ortaya çıkan ssDNA ara ürünlerine bağlanır ve stabilize eder. 5-Etinil-2'-deoksiüridin (EdU) boyama, herhangi bir S fazı hücresini dışlamak için DNA replikasyonunu görselleştirmek için kullanılır. Bu protokol, geleneksel, denatüre olmayan 5-bromo-2'-deoksiüridin (BrdU) bazlı tahlillere alternatif bir yaklaşım sağlar ve S fazı dışındaki ssDNA odaklarının tespiti için daha uygundur.
Giriş
Yaşamı sürdürmek için hücreler, genomik bütünlüklerini korumak için DNA'yı sürekli olarak araştırır ve onarır. Hücreler, hem endojen (örneğin, oksidasyon, alkilasyon, deaminasyon, replikasyon hataları) hem de eksojen (örneğin, UV, iyonlaştırıcı ışınlama) DNA stresör kaynakları nedeniyle çeşitli DNA hasarı türleri biriktirebilir. Bu lezyonların onarılmaması, apoptoz, hücre döngüsü durması veya yaşlanma ile sonuçlanır ve hastalıklara yol açabilir1. DNA lezyonları, aşağıdaki ana DNA onarım yollarından herhangi biri ile ele alınabilir: DR (doğrudan ters onarım), esas olarak alkillenmiş bazlarıonarır 2; Hacimli olmayan DNA baz hatalarını ve tek sarmallı DNA kırılmalarını (SSB'ler) hedefleyen BER (baz eksizyon onarımı)3; NER (nükleotid eksizyon onarımı) hacimli, sarmal bozucu DNA lezyonlarını düzeltir4; MMR (uyumsuzluk onarımı) esas olarak DNA uyumsuzluklarını, ekleme/silme döngülerini (IDL'ler) ve belirli baz hasarlarını hedef alır5; Her ikisi de çift sarmallı DNA kırılmalarında (DSB'ler) aktif olan NHEJ (homolog olmayan uç birleştirme) ve HRR (homolog rekombinasyon onarımı)6; ve bir DNA lezyonu baypas mekanizması olan TLS (translezyon sentezi)7. Bu yolların farklı alt tabaka özellikleri olmasına rağmen, verimli onarım için yedekliliği sağlamak için aralarında belirli örtüşmeler vardır. Çeşitli hücre döngüsü aşamalarında farklı DNA onarım yollarının etkisini anlamak çok önemlidir, çünkü bu DNA onarım faktörleri kanser, yaşlanma ve nörolojik bozuklukları tedavi etmek için terapötik yaklaşımlar için temel hedefler olarak hizmet edebilir 8,9.
Tek sarmallı DNA (ssDNA), hem endojen hem de eksojen DNA'ya zarar veren ajanlar tarafından üretilen DNA lezyonlarının onarımı nedeniyle hücre döngüsü boyunca üretilir. Genotoksik stres üzerine, ssDNA, HRR ve MMR'nin en yüksek aktiviteye sahip olduğu S ve G2 fazlarında ve DNA lezyonlarıyla karşılaşıldığındareplikasyon mekanizması durduğunda veya çöktüğünde bol miktarda üretilir 6,10,11. Diğer DNA onarım yolları (örneğin, NHEJ / mikrohomoloji aracılı uç birleştirme (MMEJ) / tek iplikli tavlama [SSA]) da DSB onarımı sırasında ssDNA üretir12. Bu ssDNA izleri genellikle HR ve MMR sırasında EXO1, DNA2 ve CtIP gibi eksonükleazlar, NER sırasında XPF ve XPG gibi endonükleazlar veya BER 4,13,14,15,16,17,18,19 sırasında POLB ve FEN1'in birleşik etkisi yoluyla gerçekleştirilen DNA rezeksiyonundan kaynaklanır . Replikasyon mekanizmasının çalışması nedeniyle, DNA helikazları PCNA'ya bağlı replikatif polimerazların20 önünde DNA'yı çözdüğünde ssDNA izleri de üretilir. Buna karşılık, G1 fazında, HRR ve DNA replikasyonunun olmaması ve MMR'nin sınırlı aktivitesi, üretilen ssDNA izlerinin kapsamını azaltır ve bu nedenle tespit edilmesi daha zordur 10,11,21.
Hücresel ssDNA izleri, DSB'lerin oluşumunu önlemek için korunması gereken oldukça hassas yapılardır. Bu, ssDNA izlerinin RPA ile kaplanmasıyla elde edilir. RPA, hücre döngüsü22 boyunca her yerde eksprese edilen çoklu alt birimlerden (sırasıyla RPA70, RPA32 ve RPA14 olarak da adlandırılan RPA1, RPA2 ve RPA3) oluşan bol miktarda heterotrimerik protein kompleksidir. Her RPA alt birimi, 4-6 nükleotid ile etkileşime girebilen bir DNA bağlama alanı (DBD) içerir ve birleşik alt birimler, kararlı bir trimerizasyon çekirdeği oluşturur. Toplamda, RPA, nanomolar altı afinite 23,24 ile yaklaşık20-30 nükleotidi bağlar.
Konvansiyonel yöntemler, BrdU antikorları25 kullanılarak genomik DNA'ya dahil edilen 5-bromo-2'-deoksiüridin (BrdU) etiketleyerek ssDNA odaklarını görselleştirmek için immünofloresan (IF) mikroskobu kullanır. Bu yaklaşım, BrdU antikorlarının yalnızca maruz kalan ssDNA25'te BrdU'yu tespit edebildiği gerçeğine dayanır. Bu yaklaşım basit olsa da, belirli sınırlamalar da gösterir. Örneğin, hücreler, deney başlamadan önce BrdU'yu dahil etmek için ön işleme tabi tutulur, bu da zaman alıcıdır ve aşağı akış efektörlerine müdahale edebilir. Bu nedenle, BrdU tabanlı ssDNA tespiti, çoğalan hücrelerle sınırlıdır ve hareketsiz hücreler için kullanılamaz. Bu, kanser ve nörodejenerasyon gibi çeşitli hastalıklardaki önemine rağmen, çoğalmayan hücrelerde DNA onarımını incelemek için bu yöntemin uygulanmasını hariç tutar 5,26. Ek olarak, BrdU ve EdU'nun yapıları çok benzer olduğundan, çoğu BrdU antikoru, çift etiketleme deneylerini hedeflerken dikkate alınması gereken EdU'ya karşı çapraz reaktivite gösterir27. RPA boyama daha önce esas olarak S fazı hücrelerinde ssDNA odaklarını göstermek için kullanılmıştır; ancak bazı makaleler bunu S fazı 28,29,30,31,32,33,34,35 dışında da başarıyla kullanmıştır. Aşağıdaki protokol, RPA'nın özelliklerini verimli bir şekilde kullanır ve hücre döngüsünün G1 fazında DNA hasarını takiben ssDNA odaklarının görselleştirilmesine izin verir (ancak tüm hücre döngüsü fazlarında kullanılabilir).
Protokol
1. hTERT-ölümsüzleştirilmiş retina pigment epitel hücrelerinin (RPE1) bakımı
- RPE1 hücre hatlarını, 37 ° C'de% 5 CO2 ile nemlendirilmiş bir inkübatörde% 10 ısıyla inaktive edilmiş fetal sığır serumu (Hi-FBS) ve% 100 μg / mL Penisilin-Streptomisin (bundan sonra kültür ortamı olarak anılacaktır) ile desteklenmiş Dulbecco'nun Modifiye Eagle Medium'unda (DMEM) koruyun. Rutin kültürleme için, RPE1 hücrelerini 15 cm'lik doku kültürü ile muamele edilmiş bir kapta büyütün ve %80-90 birleşmeye ulaştığında bölün (~ 16-18 × 15 cm'lik tabak başına 106 hücre).
- Bölerken, ortamı çıkarın ve hücreleri 10 mL 1x fosfat tamponlu salin (PBS) ile durulayın.
- Yemeğin tüm yüzeyini kaplamak için 3 mL% 0.05 Tripsin-EDTA ekleyin. Hücreleri ayrılana kadar tripsin ile 37 ° C'de tutun.
- Tripsinizasyondan sonra, hücreleri kültür ortamı ile tekrar süspanse edin ve oda sıcaklığında (RT, 22-25 ° C) 5 dakika boyunca 150 × g'da döndürün. Süpernatanı çıkarın ve hücreleri 10 mL kültür ortamında nazikçe yeniden süspanse edin.
- 1.6-1.8 × 106 hücreyi 15 cm'lik yeni bir tabağa (~ 1 mL hücre süspansiyonu) tohumlayın.
NOT: Tüm doku kültürü çalışmaları BSL-2 güvenlik seviyeleri altında yapılmalıdır. Tripsinizasyon için kuluçka süresi hücre birleşmesine bağlıdır. Genellikle, %90 birleşik bir plaka için işlemin tamamlanması 2-3 dakika sürer. Hücreler, piyasada bulunan kitlerle düzenli olarak Mycoplasma kontaminasyonu açısından taranmalıdır ( Malzeme Tablosundaki örneklere bakınız).
2. ilgilenilen genin siRNA'sının yıkılması (GOI)
- 1.0 × 106 RPE1 hücrelerini, transfeksiyondan önceki gün 10 mL kültür ortamı ile 10 cm'lik doku kültürü ile muamele edilmiş bir plakaya tohumlayın.
- Transfeksiyon gününde, siRNA'yı karmaşıklaştırın. 10 cm'lik bir plaka için, 500 μL düşük serum transfeksiyon ortamında 20 nM siRPA2 ve 12 μL lipid bazlı transfeksiyon reaktifinin nihai konsantrasyonunu kullanın. Tüpü hafifçe vurarak tüm bileşenleri nazikçe karıştırın ve RT'de (22-25 °C) 5 dakika inkübe edin.
- Kompleksleştirilmiş siRNA karışımını hücrelere damla damla ekleyin ve hücreleri siRNA ile 48 saat inkübe edin.
3. RPE1 hücrelerinin G0 fazına senkronizasyonu
- RPE1 hücrelerini bölüm 1'de belirtildiği gibi adım 2.3'ten (~2 × 106 hücre) tripsinize edin.
- Hücre süspansiyonunu 15 mL'lik santrifüj tüplerine aktarın ve 150 × g, RT'de (22-25 °C) 5 dakika santrifüjleyin.
- Süpernatanı çıkarın ve hücreleri 12 mL PBS'de yeniden süspanse edin. Hücreleri RT'de (22-25 ° C) 150 × g'da 5 dakika santrifüjleyin. Süpernatantın çıkarılmasını ve santrifüjlemeyi iki kez tekrarlayın.
- Hücreleri, 100 μg / mL Penisilin-Streptomisin, 1 mM Sodyum Piruvat, 15 mM HEPES ile desteklenmiş 10 mL serumsuz DMEM'de yeniden süspanse edin ve 10 cm'lik bir doku kültürü kabına koyun.
NOT: Hücreler topaklanma eğilimindeyse, bunları sadece 1 mL serumsuz DMEM'de yeniden süspanse edin ve süspansiyonu 5 mL'lik bir son hacme kadar seyreltmeden önce kümeleri yerinden çıkarmak için bir P1000 ucu kullanarak 10 kez yukarı ve aşağı pipetleyin. - 24 saatlik serum açlığından sonra, kompleks siRNA'yı serum açlığı çeken hücrelere ekleyerek bölüm 2'de tarif edilenle aynı prosedürü kullanarak ikinci susturma turunu uygulayın.
- G1 salınımına geçmeden önce RPE1 hücrelerini 72 saat boyunca serumsuz DMEM'de tutun.
4. Lamel kaplama ve hücrelerin G1 fazına bırakılması
- Cımbızları% 70 etanol ile sterilize edin ve 24 oyuklu bir plakanın kuyucuğuna tek bir cam lamel (12 mm çapında ve # 1.5 kalınlığında [0.17 mm]) yerleştirin.
- 10 μg/mL'lik bir nihai konsantrasyon elde etmek için vitronektin kaplama matrisini PBS ile seyreltin. Lamelleri içeren her bir oyuğa 500 μL vitronektin çözeltisi ekleyin ve RT'de 1 saat inkübe edin.
- Kaplama solüsyonunu çıkarın ve lamelleri 1 mL PBS ile yıkayın.
- 37 ° C'de 1 dakika boyunca bir PBS yıkamasından sonra 1 mL %0.05 Tripsin kullanarak seruma aç RPE1 hücrelerini 10 cm doku kültürü ile tedavi edilmiş plakadan ayırın.
NOT: Serum açlığından sonra hücreler çok daha hızlı ayrılır. Hücreleri PBS ile yıkarken dikkatli olun ve kısa tripsinizasyon süreleri kullanın. - Tripsini etkisiz hale getirmek için, RPE1 hücrelerini toplam 6 mL kültür ortamında yeniden süspanse edin. 5 dakika boyunca RT'de (22-25 ° C) 150 × g kullanarak hücreleri döndürerek inaktive edilmiş tripsini çıkarın.
- Hücreleri 1 mL kültür ortamında yeniden süspanse edin ve hücre sayısını ölçün.
- 4 × 104 RPE1 hücrelerini, toplam 500 μL kültür ortamında kaplanmış lamel üzerine tohumlayın.
NOT: Aşağı akış adımlarına geçmeden önce hücre canlılığının %90'ın üzerinde olduğundan emin olun. Hücre canlılığı, hücre sayımı adımı sırasında tripan mavisi boyama ile hızlı bir şekilde değerlendirilebilir. - Hücrelerin kültür ortamına kaplanmasından 6 saat sonra, G0 salınan hücreler erken G1 fazında olacaktır. Hücreler S fazına girmeden önce bu 6-12 saatlik pencerede G1'de deneyler yapın.
- DNA hasarı vermeden önce, hücreleri 10 μM 5-etinil-2'-deoksiüridin (EdU) ile 37 ° C'de 30 dakika boyunca nabız atın, kültür ortamında seyreltin.
- EdU içeren ortamı çıkarın ve DNA hasarı indüksiyonu sırasında kalan EdU katılımını önlemek için hücreleri 10 μM timidin ile 37 ° C'de 10 dakika kovalayın.
- Ortamı timidin ile çıkarın ve hücrelere 1 saat boyunca 250 μM H2O2 ile muamele edin, kültür ortamında seyreltin.
5. ssDNA'nın immünofloresan boyaması
- Ortamı ve serum bileşenlerini çıkarmak için hücreleri 1 mL RT (22-25 ° C) PBS ile bir kez yıkayın.
NOT: Ayrılmayı ve kurumayı önlemek için hücreleri yıkarken nazik olun. Aynı anda birçok kuyu işlemeyin. - Ön ekstraksiyon: Yıkanmış hücreleri 1 mL CSK ekstraksiyon tamponunda (Tablo 1) RT'de (22-25 °C) 5 dakika inkübe edin.
NOT: CSK ön ekstraksiyonu, çözünür RPA2 dahil olmak üzere kromatine bağlı olmayan tüm proteinleri uzaklaştırır.
DİKKAT: Triton X-100 yutulduğunda zararlıdır ve cilt tahrişine ve göz hasarına neden olabilir. - CSK tamponunu hücrelerden çıkarın ve RT'de (22-25 °C) 10 dakika boyunca% 0.05 Triton X-100 içeren 0.5 mL% 3.6 paraformaldehit çözeltisi (PBS içinde) ekleyerek doğrudan sabitleyin.
DİKKAT: %32 PFA stoğundan %3,6 PFA'yı taze olarak hazırlamak önemlidir. Paraformaldehit ciddi göz hasarına, cilt tahrişine ve solunum yolu tahrişine neden olabilir. - PFA'yı çıkarmak için hücreleri bir kez% 0.05 Triton X-100 içeren 1 mL PBS ile yıkayın.
- RT'de (22-25 °C) 15 dakika boyunca% 0.5 Triton X-100 içeren 1 mL PBS kullanarak hücreleri daha fazla geçirgenleştirin.
- Çoğalan hücreleri görselleştirmek için EdU click-IT reaksiyonu (S fazı)
- Geçirgenleştirme solüsyonunu çıkarın ve hücreleri 1 mL bloke edici tampon kullanarak 2 kez yıkayın (Tablo 1).
DİKKAT: Sığır serum albümini (BSA) solunum yolu tahrişine neden olabilir. - 1 mL bloke edici tampon ekleyin (Tablo 1) ve lamel içeren plakayı RT'de (22-25 °C) 10 dakika hafifçe sallayın.
- Bloke edici tamponu çıkarın ve pikolil azid 647 içeren 500 μL tıklama reaksiyonu kokteyli ekleyin (Tablo 1). Lamelleri RT'de (22-25 °C) hafif sallama kullanarak 30 dakika inkübe edin ve karanlıkta aşağı akış inkübasyonları yapın.
NOT: BrdU antikorlarını kullanırken, reaksiyonun doymuş olduğundan ve dahil edilen EdU'nun etiketlendiğinden emin olmak için üretici tarafından önerildiği şekilde tıklama reaksiyonu için iki kat miktar (1 mL) ve süre (60 dakika) kullanın. Bu, BrdU antikorlarının çapraz reaktivitesini sınırlar27.
- Geçirgenleştirme solüsyonunu çıkarın ve hücreleri 1 mL bloke edici tampon kullanarak 2 kez yıkayın (Tablo 1).
- Tıklama reaksiyonu karışımını çıkarın ve hücreleri RT'de (22-25 °C) 10 dakika boyunca% 0.05 Triton X-100 ile PBS ile 2x yıkayın (Şekil 1 ve Şekil 2).
- 1 mL bloke edici tampon ekleyin ve RT'de (22-25 °C) 30 dakika inkübe edin. Alternatif olarak, hücreleri gece boyunca 4 ° C'de bloke edici tamponda tutun.
- Birincil antikoru (anti-RPA2 sıçan, 1: 1.000 seyreltme) RT'de (22-25 ° C) 2 saat boyunca 250-500 μL bloke edici tamponda hafif sallama ile uygulayın.
- Antikor çözeltisinin çoğunu hızlı bir şekilde çıkarmak için% 0.05 Triton X-100 içeren hücreleri 2x PBS ile yıkayın.
- RT'de (22-25 °C) bloke edici tampon ile hücreleri 3 x 10 dakika yıkamaya devam edin.
- İkincil antikor (sıçan önleyici Alexa-488, 1: 1.000 seyreltme) 250-500 μL bloke edici tamponda RT'de (22-25 ° C) 2 saat boyunca hafifçe sallanarak uygulayın.
- İkincil antikorun çoğunu hızlı bir şekilde çıkarmak için hücreleri bloke edici tampon 2x ile yıkayın. RT'de (22-25 °C)% 0.05 Triton X-100 içeren PBS ile hücreleri 3 x 10 dakika yıkamaya devam edin.
- Çekirdekleri boyamak için, hücreleri bir kez% 0.05 Triton X-100 ve 1 μg / mL 4',6-diamidino-2-fenilindol (DAPI) içeren PBS ile RT'de (22-25 °C) 10 dakika boyunca yıkayın. Hücreleri bir kez PBS ile RT'de (22-25 °C) 5 dakika yıkayın.
- Kapak camını 10 μL montaj ortamı/lamel kullanarak mikroskop slaytlarına monte edin. Tuz kristallerinden kurtulmak için montajdan önce lamelleri damıtılmış suya batırın. Slaytları ertesi gün görüntüleyin ve haftalarca 4 °C'de saklayın (Şekil 3).
6. Görüntü elde etme ve ölçme
- Görüntüleri yakalamak için, DAPI, FITC ve Cy5 kanallarını en az 60-63x büyütme, yüksek sayısal açıklık ve nükleer odakları görselleştirmek için yağ objektifleri ile görüntülemek için rutin filtre setleriyle donatılmış mevcut herhangi bir epifloresan mikroskobu kullanın.
NOT: Optimal DAPI uyarımı ~ 359 nm'dir; Alexa 488 uyarımı ~ 488 nm'dir; Alexa 647 uyarımı ~647 nm'dir. - Görüntü analizi için görüntü dosyalarını Fiji/ImageJ'de açın.
- DAPI boyamayı kullanarak nükleer maskeler yapın (Şekil 4A-F ve Ek Video S1).
- DAPI görüntüsünü açın.
- İşlem Seç | Kontrastı Geliştirin ve doygun pikseli 0,35 olarak ayarlayın.
- İşlem | İkili | Maskeye Dönüştür. İkili Seç | Delikleri Doldurun ve Analiz Et'e tıklayın | Parçacıkları analiz edin. Boyutu 10-Sonsuz olarak ayarlayın.
- ROI yöneticisinde Tümünü göster'e tıklayın.
- Çekirdekte RPA2 odaklarının bulunması (Şekil 4G,H ve Ek Video S1)
- RPA2 görüntüsünü açın.
- İşlem Seçin | Maxima'yı bulun. Belirginliği, RPA2 odaklarını (500 ile 750 arasında) vurgulayan ve arka plandan ayıran bir değere ayarlayın.
- Son olarak, ROI Manager'da Ölç düğmesine tıklayın.
- RawinDen sütunundaki değeri 255'e (her odaktaki piksel yoğunluğunun maksimum değeri) bölerek toplam nükleer ssDNA odağı sayısını hesaplayın.
- Tercih edilen istatistiksel yazılım aracını kullanarak istatistiksel analiz gerçekleştirin.
NOT: Tüm EdU pozitif hücreleri ve yanlış bölümlere ayrılmış DAPI maskelerini analizden hariç tutun.
- DAPI boyamayı kullanarak nükleer maskeler yapın (Şekil 4A-F ve Ek Video S1).
Sonuçlar
G1'de ssDNA'yı tespit etme sınırlamalarının üstesinden gelmek için, ssDNA odaklarının tespitinin hem özgüllüğünü hem de yoğunluğunu artıran RPA2'yi kullandık35. Hassas hücre senkronizasyonu elde etmek için, verimli bir şekilde serumdan aç bırakılabilen ve G0 fazına senkronize edilebilen RPE1 hücreleri kullandık. Daha sonra serum yoksunluğunu takiben serum ilavesiyle hücre döngüsüne yeniden girmeleri için indüklenebilirler. Senkronizasyon verimliliğini doğrulamak için, hücreleri EdU ile ve DNA içeriğini propidium-iyodür ile etiketledik. Ayrıca akış sitometrisi ile kalitatif ve kantitatif sonuçlar topladık (Ek Şekil S1A). Nokta grafikleri, 72 saatlik serum açlığından sonra, hücrelerin ~% 98'inin G0 fazında olduğunu göstermektedir. 6 saat boyunca serum içeren ortamın eklenmesini takiben, hücreler hücre döngüsüne yeniden girer (Şekil 1A'daki p27 seviyelerindeki artışta görüldüğü gibi), G1'deki hücrelerin ~%97'sine sahipken, S fazında sadece %<1 hücreye sahipken, G2 fazında %<2 hücreye sahiptir (Ek Şekil S1A). Hücrelere serum eklendikten 20-28 saat sonra, akış sitometrisi grafiklerinde gösterildiği gibi yavaş yavaş S fazından geçerler (Ek Şekil S1A). Bu hücre senkronizasyon protokolü, ~% 97 saf G1 popülasyonu verir (72 saatlik serum açlığını takiben serum ilavesinden 6 saat sonra). Senkronizasyon verimliliğini daha da doğrulamak için, western blotlama (Şekil 1A ve Ek Şekil S1B) kullanarak serum salınımını takiben hücre döngüsü belirteçlerinin ekspresyonunu karşılaştırdık ve paralel olarak, DNA replikasyonunu görselleştirmek için bir EdU birleştirme testi gerçekleştirdik. EdU boyaması ayrıca senkronizasyon verimliliğini ve G1 fazında DNA replikasyonunun eksikliğini vurgular (Şekil 1B,C).
Memeli hücrelerinde ssDNA'yı tespit etmek için kullanılan geleneksel yöntemler, ssDNA'da BrdU'nun saptanmasına dayanır. Şekil 2A,H2O2ve neokarzinostatin (NCS) tedavisi üzerine, BrdU odaklarının sadece S fazı hücrelerinde saptanabildiğini, S fazı olmayan hücrelerde ise hiçbir ssDNA odağının saptanamadığını göstermektedir. BrdU antikor boyaması ayrıca, hücre döngüsü aşamasından veya uygulanan tedavilerden bağımsız olarak tüm çekirdeklerde tespit edilebilen gözle görülür bir nükleolar arka plan boyaması gösterdi. Burada açıklanan EdU tıklama protokolünü kullanarak, Şekil 2A'nın işlenmemiş örneklerinde belirgin olan EdU ve BrdU odaklarının birlikte lokalize edilmesini tespit edemedik. Çapraz reaktiviteden kaynaklanan herhangi bir BrdU sinyalini tamamen ekarte etmek için EdU etiketlemesinden kaçındık ve bunun yerine siklin A2'yi bir S-G2 belirteci olarak kullandık. Bununla birlikte, siklin A2 boyaması CSK ön ekstraksiyonuna izin vermedi ve bu koşul altında, genotoksik stresten sonra bile herhangi bir BrdU odağı görmedik (Ek Şekil S2A). Bu, anti-BrdU bazlı ssDNA boyaması için CSK ön ekstraksiyonunun gerekli olduğu gerçeğini vurgulamaktadır. Kontrol olarak, denatüre edici koşullar altında BrdU antikor boyamasını test ettik. Bu, dahil edilmiş BrdU'yu ortaya çıkarmak için DNA'yı açar, bu da BrdU'nun düzgün bir şekilde dahil edildiğini ortaya çıkarır (Ek Şekil S2B).
Buna karşılık, RPA2 boyaması sadece S fazında değil, aynı zamanda diğer hücre döngüsü fazlarında da NCS veH2O2'yebağlı odakların oluşumunu gösterir (Şekil 2B). Kontrol olarak, hücreleri sadece replikasyon geçiren hücrelerde ssDNA birikimine neden olan HU ile de tedavi ettik. Beklendiği gibi, EdU pozitif hücrelerde RPA2 antikoru ile HU tedavisi sırasında sadece bir sinyal artışı tespit ettik ve bu yaklaşımın özgüllüğünü vurguladık. RPA2 antikoru, eksojen genotoksik stres yokluğunda replikasyon sırasında doğal olarak oluşan ssDNA oluşumunu da tespit edebilir (Şekil 2B). RPA2 antikorunun son derece hassas doğası, konvansiyonel BrdU boyamanın genotoksik stres üzerine herhangi bir sinyal tespit edemediği G1 fazında onu kullanmaya çalışmamızı sağladı (Ek Şekil S2C). Şekil 3A,H2O2tedavisi üzerine ssDNA odaklarının oluşumunun, G1'de bile bir anti-RPA2 antikoru kullanıldığında tespit edilebilir olduğunu göstermektedir. H2O2tedavisi üzerine bu çekirdeklerdeki RPA2 odaklarının sayısında önemli bir artış olmuştur (Şekil 3B). RPA2'nin susturulması IF sinyalini ortadan kaldırdığı için bu odaklar RPA2'ye özgüydü (Şekil 3A,B). Şekil 3C ve Ek Şekil S1C, bu hücrelerde RPA2 susturmanın etkinliğini göstermektedir. Geleneksel yöntemlerle karşılaştırıldığında, ssDNA'nın RPA2 tabanlı tespiti oldukça hassastır ve bu nedenle uygulaması G1 faz hücrelerine genişletilebilir.
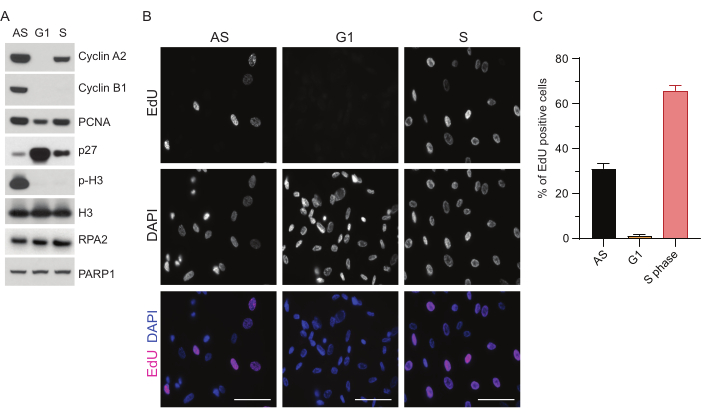
Şekil 1: Serum açlığını takiben RPE1 hücrelerinin senkronizasyon etkinliği. (A) İmmünoblotlar, asenkron, G1 ve S fazı senkronize RPE1 hücrelerinde belirtilen protein seviyelerini gösterir. (B) Temsili görüntüler, fiksasyondan önce 30 dakika boyunca 10 μM EdU'ya maruz bırakılan ve Click-IT reaksiyonu ile görselleştirilen asenkron, G1 ve S fazı senkronize RPE1 hücrelerini gösterir. DAPI, nükleer DNA'ya karşı koymak için kullanıldı. Ölçek çubukları = 50 μm. (C) Grafik, DAPI tarafından değerlendirilen toplam hücre popülasyonu üzerindeki EdU pozitif hücrelerin yüzdesini gösterir. Hata çubuğu, ortalamanın standart hatasını temsil eder ve analiz edilen çekirdek sayıları aşağıdaki gibidir: AS n = 219, G1 n = 630, S n = 437. Kısaltmalar: RPE1 = hTERT-ölümsüzleştirilmiş retina pigment epitel hücreleri; AS = eşzamansız; EdU = 5-etinil-2'-deoksiüridin; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
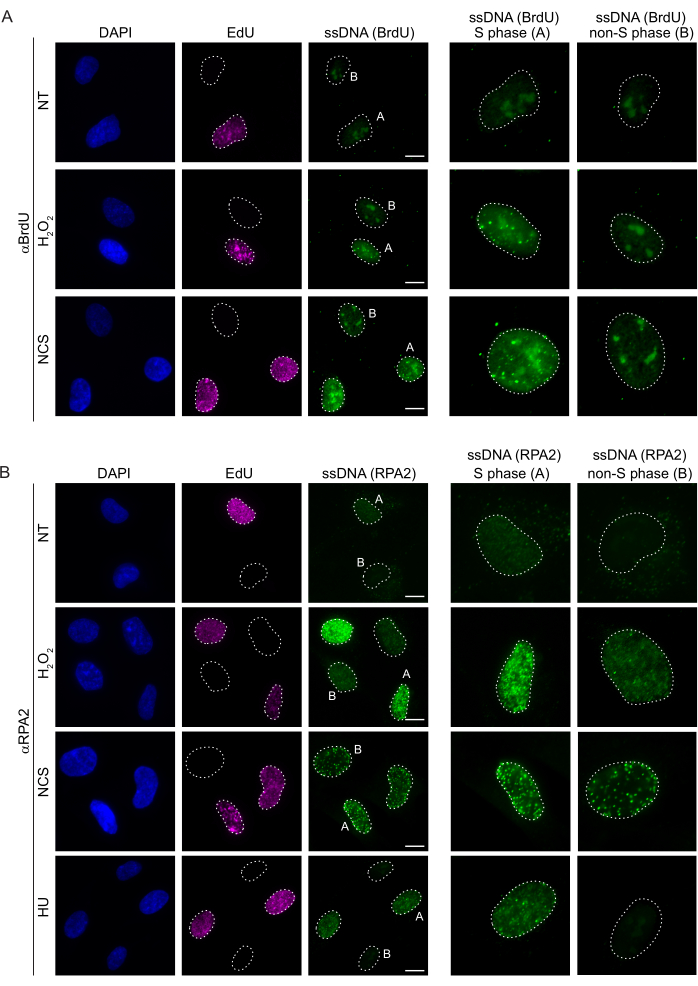
Şekil 2: DNA hasarı üzerine BrdU antikoru veya RPA2 antikoru ile ssDNA tespiti. (A) Temsili görüntüler, αBrdU (yeşil) kullanılarak ssDNA odaklarını göstermektedir, S fazı hücreleri EdU (mor) ile vurgulanmıştır ve DAPI, nükleer DNA'ya karşı boyama (mavi) için kullanılmıştır. RPE1 hücreleri, herhangi bir ek tedaviden önce 48 saat boyunca 10 μM BrdU'da tutuldu. 48 saat sonra, hücreler 30 dakika boyunca 10 μM EdU ile darbelendi, ardından 1 saat boyuncaH2O2(250 μM) veya 4 saat boyunca Neokarzinostatin (0.5 μg / mL) tedavisi uygulandı. Hücreler CSK ön ekstraksiyonundan sonra sabitlendi. Beyaz kesikli bir çizgi, her çekirdeğin sınırını gösterir. Ölçek çubuğu = 5 μm. Sağdaki paneller, belirtilen S fazı veya S fazı olmayan çekirdeklerin büyütülmüş görüntüleridir. (B) Temsili görüntüler, αRPA2 antikoru (yeşil) kullanan ssDNA odaklarını göstermektedir. S fazı hücreleri EdU (mor) ile vurgulanır ve DAPI, nükleer DNA'ya (mavi) karşı koymak için kullanılmıştır. RPE1 hücreleri, 30 dakika boyunca 10 μM EdU ile darbelendi, ardından 1 saatH2O2(250 μM), 4 saat Hidroksiüre (2 mM) veya 4 saat NCS (0.5 μg / mL) uygulandı. Hücreler CSK ön ekstraksiyonundan sonra sabitlendi. Beyaz kesikli bir çizgi, her çekirdeğin sınırını gösterir. Ölçek çubuğu = 10 μm. Sağdaki paneller, belirtilen S fazı veya S fazı olmayan çekirdeklerin büyütülmüş görüntüleridir. Kısaltmalar: ssDNA = tek sarmallı DNA; BrdU = 5-bromo-2'-deoksiüridin; DAPI = 4',6-diamidino-2-fenilindol; RPE1 = hTERT-ölümsüzleştirilmiş retina pigment epitel hücreleri; EdU = 5-etinil-2'-deoksiüridin; NCS = Neokarzinostatin; HU = hidroksiüre. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
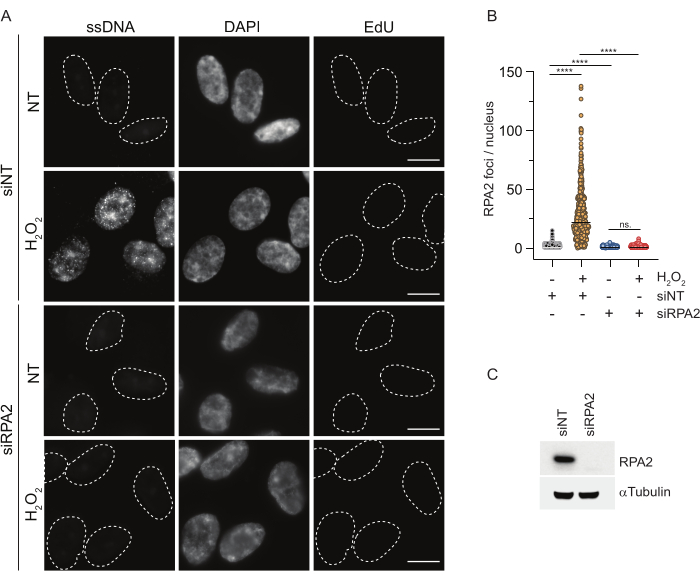
Şekil 3: RPA2 antikoru kullanılarak G1 fazında ssDNA odaklarının saptanması. (A) RPE1 hücreleri, RPA2'yi hedefleyen siRNA'lar veya hedeflemeyen bir siRNA kontrolü ile transfekte edildi ve daha sonra G1'de senkronize edildi ve 10 μM EdU ile 30 dakika boyunca nabız etiketliH2O2(250 μM) ile muamele edilmeden önce 1 saat boyunca belirtildi. DAPI, nükleer DNA'ya karşı koymak için kullanıldı. Hücreler CSK ön ekstraksiyonundan sonra sabitlendi. Beyaz kesikli bir çizgi, her çekirdeğin sınırını gösterir. Ölçek çubuğu = 5 μm. (B) RPA2 odaklarının/çekirdeğinin sayısı için ölçümler iki bağımsız deneyden gerçekleştirilmiştir. Analiz sırasında sadece EdU-negatif hücreler dikkate alındı. Çizgiler, grafiklerdeki ortalama değeri temsil eder. İstatistiksel analiz için non-parametrik ANOVA testi (Kruskal-Wallis) uygulandı. Yıldızlar P < 0.0001'i gösterir. Analiz edilen çekirdek sayısı şunlardı: siNT noH2O2n= 513, siNTH2O2n= 603, siRPA2 hayırH2O2 n = 266, siRPA2 H2O2 n = 536. (C) siRNA yıkımının etkinliği immünoblotlamada gösterilir. Kısaltmalar: siNT = hedeflemeyen siRNA kontrolü; BrdU = 5-bromo-2'-deoksiüridin; DAPI = 4',6-diamidino-2-fenilindol; RPE1 = hTERT-ölümsüzleştirilmiş retina pigment epitel hücreleri; EdU = 5-etinil-2'-deoksiüridin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Fiji kullanılarak ssDNA odaklarının miktarının belirlenmesi. Fiji'de çekirdekteki RPA2 odak sayılarının nasıl değerlendirileceğini gösteren ayrıntılı adımlar. (A-E) DAPI kanalını kullanarak bir nükleer maske oluşturulması. (F-H) Arka plan sinyalinden bireysel nükleer ssDNA odaklarını tanımlamak için eşikleme. Kısaltmalar: ssDNA = tek sarmallı DNA; DAPI = 4',6-diamidino-2-fenilindol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Hücre iskeleti (CSK) tamponu | |
| BORULAR pH 7.0 | 10 milyon |
| NaCl (Sıvı Değeri) | 100 mM |
| EDTA pH 8 | 1 milyon |
| MgCl2 | 3 mM |
| D-sükroz | 300 milyon |
| Triton X-100 | 0.20% |
| Fosfataz inhibitör kokteyli | 10 mL'de 1 tablet |
| Proteaz inhibitör kokteyli | 10 mL'de 1 tablet |
| ddH2O'daseyreltilmiş | Yok |
| Yıkama tamponu | |
| Triton X-100 | 0.05% |
| PBS'de seyreltilmiş | Yok |
| Geçirgenleştirme tamponu | |
| Triton X-100 | 0.50% |
| PBS'de seyreltilmiş | Yok |
| Fiksasyon çözümü | |
| Paraformaldehit | 3.60% |
| Triton X-100 | 0.05% |
| PBS'de seyreltilmiş | Yok |
| Engelleme arabelleği | |
| Sığır serum albümini (BSA) | 5% |
| Triton X-100 | 0.10% |
| PBS'de seyreltilmiş | Yok |
| Click-iT Plus reaksiyon kokteyli | |
| 1x Click-iT reaksiyon tamponu | 435 mL |
| Alexa Fluor PCA çözümü | 5 mL |
| CuSO4-bakır koruyucu premiks | 10 mL |
| 1x Click-iT tampon katkı maddesi | 50 mL |
| Toplam hacim | 500 mL |
Tablo 1: Bu protokolde kullanılan tamponların bileşimi.
Ek Şekil S1. (A) RPE1 hücreleri, 72 saat boyunca serum açlığı kullanılarak G0 fazına senkronize edildi ve daha sonra serumun yeniden eklenmesiyle farklı hücre döngüsü fazlarına salındı. Nokta grafikleri, G0 / G1, S veya G2 / M fazlarındaki hücreleri gösterir, burada saatler, serum açlığını takiben serumun yeniden eklenmesinden sonraki süreyi gösterir. Sağdaki grafik, her koşuldaki G0/G1, S ve G2/M hücrelerinin yüzdesini gösterir. FACS analizi, üreticinin tavsiyelerine göre EdU ve propidyum iyodür kullanılarak ticari olarak temin edilebilen bir hücre proliferasyon kiti kullanılarak gerçekleştirildi. (B) Şekil 1 için kırpılmamış batı lekesi taramaları. Sayılar, kDa'da moleküler ağırlık belirteçlerini gösterir. PARP1 bir yükleme kontrolü olarak kullanıldı ve membranı keserek CCNA2, p27 (PCNA için daha fazla sıyrılmış) ve pH3'e (S10) (H3 için daha fazla sıyrılmış) karşı geliştirilen jel üzerine yüklendi. CCNB1 ve RPA2, karşılaştırılabilirliği sağlamak için aynı miktarda protein lizat kullanılarak ayrı bir jel üzerine yüklendi. (C) Şekil 3 için kırpılmamış batı lekesi taramaları. Sayılar, kDa'da moleküler ağırlık belirteçlerini gösterir. Kısaltma: EdU = 5-etinil-2'-deoksiüridin. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil S2: (A) Temsili görüntüler, BrdU antikoru (yeşil) kullanan ssDNA odaklarını göstermektedir; S fazı hücreleri, siklin A2 (kırmızı) ile vurgulanır; ve DAPI, nükleer DNA'ya (mavi) karşı koymak için kullanıldı. RPE1 hücreleri, ileri tedaviden önce 48 saat boyunca 10 μM BrdU'da tutuldu. 48 saat sonra, hücreler fiksasyondan önce 1 saat boyunca H2O2(250 μM) veya 4 saat boyunca Neokarzinostatin (0.5 μg / mL) ile muamele edildi. Beyaz kesikli bir çizgi, her çekirdeğin sınırını gösterir. Ölçek çubuğu = 5 μm. (B) RPE1 hücrelerinin denatüre koşulu olan ve olmayan BrdU boyama. Asenkron RPE1 hücreleri, 48 saat boyunca 10 μM BrdU ile ön işleme tabi tutuldu. Ölçek çubuğu = 10 μm. (C) BrdU odaklarının/çekirdeğinin sayısı için ölçümler, G1 senkronize RPE1 hücrelerinde yapılan iki bağımsız deneyden gerçekleştirilmiştir. Analiz sırasında sadece EdU-negatif hücreler dikkate alındı. Çizgiler, grafiklerdeki ortalama değeri temsil eder. İstatistiksel analiz için non-parametrik ANOVA testi (Kruskal-Wallis) uygulandı. 'ns' anlamlı olmayan farkı gösterir. Analiz edilen çekirdek sayısı şunlardı: NT n = 52, NCS n = 105,H2O2n= 82. Kısaltmalar: siNT = hedeflemeyen siRNA kontrolü; BrdU = 5-bromo-2'-deoksiüridin; DAPI = 4',6-diamidino-2-fenilindol; RPE1 = hTERT-ölümsüzleştirilmiş retina pigment epitel hücreleri; NCS = Neokarzinostatin. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Video S1: Fiji tabanlı RPA2 odak analizinin ekran kaydı. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Sağlıklı, mikoplazma içermeyen bir hücre kültürünün sürdürülmesi, yukarıda açıklanan tüm deneyler için kritik öneme sahiptir. RPE1 hücreleri, normal kültür ortamı altında doku kültürü ile muamele edilmiş plastik eşyalara güçlü bir bağlanmaya sahiptir; Bununla birlikte, serumsuz koşullarda tutulduğunda bağlanma özellikleri önemli ölçüde azalır. Ek olarak, mikroskop altında ssDNA odaklarının yüksek çözünürlüklü görüntülerini yakalamak için, hücrelerin, RPE1 hücrelerinin uygun şekilde bağlanmasını destekleyecek kadar hidrofilik olmayan 0,17 mm kalınlığında bir kapak camına kaplanması gerekir. Düzgün düzleştirilmiş ve eşit dağılmış hücreler olmadan, tek tek ssDNA odaklarını görselleştirmek çok zordur. Bu nedenle, uygun kaplama malzemesinin (örneğin vitronektin) seçilmesi ve hücrelerin G1 fazına bırakıldıktan sonra yayılması ve yapışması için yeterli zaman (6-12 saat) bırakılması çok önemlidir.
Protokolün zorlu bir kısmı, homojen G1 senkronize RPE1 hücreleri elde etmektir. Bu iki kritik adım gerektirir. İlk olarak, etkili serum açlığı için, hücrelerin tripnize edilmesi, PBS ile iyice yıkanması ve serumsuz ortam kullanılarak doğrudan yeni doku kültürü kaplarına ekilmesi gerekir. Serumu çıkarmak için hücreleri doğrudan doku kültürü kaplarında yıkamak, verimli G0 senkronizasyonu sağlamayacaktır. İkincisi, hücreleri G1 fazına bırakırken, hücreler tekrar tripsinizlenmeli ve taze doku kültürü plakalarına tohumlanmalıdır. Benzer şekilde, sadece besiyerini değiştirmek ve hücrelere serum içeren kültür besiyeri eklemek, senkron bir G1 girişi ile sonuçlanmayacaktır. Ek olarak, uygun G1 girişi için, kaplanmış örtü camları üzerindeki hücrelerin tohumlama yoğunluğu belirli birleşme seviyelerinde olmalıdır. Mükemmel hücre senkronizasyonu genellikle elde edilemezken, burada açıklanan bu senkronizasyon protokolü ~% 97 saf G1 popülasyonu verir. 12 mm çapında bir lamel üzerinde RPE1 için önerilen tohumlama yoğunluğu, görüntüleme için homojen bir görüş alanı elde etmek için ~4 × 104'tür ve yaklaşık% 70 birleşme ile. Daha yüksek tohumlama yoğunluğu, CSK ekstraksiyonundan sonra hücrelerin ayrılmasına ve "soyulmasına" neden olur ve görüntü alımı sırasında daha yüksek bir arka plan sinyaline neden olur.
Herhangi bir arka plan sinyalini azaltmak ve uygun bir sinyal-gürültü oranı elde etmek için, birincil ve ikincil antikor inkübasyonundan sonra kapsamlı yıkama gereklidir. Çok sayıda yıkama adımı uygulanacağından, her yıkama adımında kuyunun kurumasını önlemek de önemlidir. Tüm yıkama ve inkübasyon adımlarında minimum %0,05 Triton X-100 uygulayarak bu artefaktı en aza indiriyoruz. Kuyular kuruduktan sonra, hücreler değişmiş bir sinyal-gürültü oranı gösterdi; Bu, mikroskop altında mozaik benzeri bir desene yol açar ve değerlendirmeyi engelleyebilir. Evrişim bozukluğu ile birlikte Z-yığını görüntü alımı, analizi iyileştirmek için farklı odak düzlemlerinde odakların yakalanmasına yardımcı olabilir.
Konvansiyonel yöntemler, denatüre olmayan koşullar altında dahil edilmiş BrdU'nun saptanmasına dayanır. Bununla birlikte, bu yöntemler, tek tip genomik birleşmeyi sağlamak için hücrelerin en az 1-2 gün (veya kullanılan hücre hattındaki tam hücre döngüsüne eşdeğer süre) boyunca yüksek dozlarda BrdU ile ön işlemine bağlıdır. İstenmeyen bir şekilde, kapsamlı BrdU dahil edilmesi hücre döngüsü girişimineneden olabilir 36. Bu sınırlamaları ele almak için bu yöntem, ssDNA odaklarını tespit etmek için endojen RPA2'yi kullanır. Bu yaklaşım, replikasyon güdümlü BrdU dahil edilmesini gerektirmez, ayrıca post-mitotik hücrelerde de kullanılabilir. Kapsamlı BrdU dahil edilmesi gerekmediğinden, bu zaman kazandırır ve deneysel karmaşıklığı azaltır. ssDNA'yı görselleştirmek için RPA2 boyamayı kullanarak, BrdU antikorlarının EdU 27,37,38'e karşı olası çapraz reaktivitesinden kaçınırken DNA replikasyonunu işaretlemek için 2'-deoksi-5-etiniluridin (EdU) ve tıklama kimyası kullanabiliriz. BrdU antikorlarının EdU27,39 ile çapraz reaksiyona girmemesi için tıklama reaksiyonu sırasında dahil edilen EdU'yu uygun şekilde maskelemek için özel dikkat gösterilmelidir.
Son olarak, BrdU yerine RPA2 kullanmanın önemli bir yararı, S fazı dışındaki BrdU boyamaya kıyasla üstün bir sinyal-gürültü oranına sahip olmasıdır. Denatüre olmayan BrdU boyamanın ve ssDNA'yı görselleştirme yeteneğinin, replikasyon yapan hücrelerde bile S fazı ile sınırlı olduğunu bulduk (Şekil 2). BrdU antikoru, ssDNA uzantılarında yalnızca yeterince maruz kalan BrdU'ya bağlanır. RPA2 dahil olmak üzere onarım proteinlerinin ssDNA uzantılarına bağlanması, ssDNA'da BrdU'nun yeterli maruziyetini baskılayabilir veya engelleyebilir. Ayrıca, BrdU antikoru kullanılarak ssDNA görselleştirmesi için CSK ön ekstraksiyonunun gerekli olduğunu bulduk. Bu mümkündür, çünkü ssDNA izleri, hafif bağlı protein bileşenlerini çıkarmadan antikor için erişilebilir değildir.
Bununla birlikte, bu protokolle ilgili bazı sınırlamalar vardır. ssDNA tespiti için RPA2 kullanmanın bir sınırlaması, CSK ön ekstraksiyon adımını optimize etme ihtiyacıdır. Bağlanmamış, fazla RPA2, hücreleri sabitlemeden önce DNA'dan yıkanmalıdır. Bir yandan, yetersiz ekstraksiyon, ssDNA'ya bağlı olmayan RPA2 protein fraksiyonu nedeniyle yüksek bir arka plana yol açar. Öte yandan, aşırı ekstraksiyon sinyal kaybına yol açacaktır. BrdU tespiti için, bu bir değişken değildir, çünkü BrdU DNA'ya kararlı bir şekilde dahil edilmiştir ve ön ekstraksiyon ile yıkanamaz. Bu nedenle, CSK ön ekstraksiyonunun zamanı, tampondaki Triton X-100 miktarı, hacim ve ön ekstraksiyonun gerçekleştirildiği sıcaklık dikkatlice düşünülmelidir. CSK ön ekstraksiyonu ayrıca G0/G1 hücrelerini S/G2 hücrelerinden ayırt etmek için çekirdek boyutunun kullanımını sınırlar.
Ek olarak, RPA2'den gelen sinyalin bir kısmının, diğer kromatin bağlayıcı protein etkileşimcilerine bağlı olmasından kaynaklanma olasılığını göz ardı edemeyiz. RPA2 antikorunun tür özgüllüğü de dikkate alınmalıdır. Bu protokolde kullanılan antikor, insan, fare, sıçan, hamster ve maymun RPA2'yi tanıyabilir. Bu yaklaşımın bir başka sınırlaması, tüm hücre hatlarının G0 senkronizasyonu için serumdan aç bırakılamamasıdır. Çoğu kanser hücre hattı, hücre döngüsü kontrol noktalarını atlayabilir ve serumdan yoksun ortamlarda bile çoğalabilir. Serum açlığı faydalı olsa da, DNA hasarına neden olmadığından, uygun hücre döngüsü faz zenginleşmesinin sağlandığından emin olmak için hücre senkronizasyon verimliliklerini dikkatle izlemelisiniz. Serum yoksunluğuna cevap vermeyen hücreler için, diğer hücre senkronizasyon yöntemleri düşünülmelidir (ör., mitotik sallama, G2 tutuklaması için CDK1 inhibisyonu veya santrifüjlü elütriasyon gibi invaziv olmayan teknikler). Başka bir olası yöntem, asenkron hücrelerin hücre döngüsü profillemesi için EdU ve nükleer DNA içeriğini ölçmek için yüksek içerikli görüntüleme kullanmaktır31. Aşağı akış analizine müdahaleyi önlemek için alternatif senkronizasyon yöntemlerinin kullanılmasının sonuçları göz önünde bulundurulmalıdır. Örneğin, literatürde sıklıkla kullanılan çift timidin bloğu veya aphidikolin kullanımı, replikasyon stresi ve DNA hasarı ile sonuçlanacaktır40.
DNA onarım mekanizmalarının araştırılması, kanser ve hücre biyolojisi alanlarında tartışmaların odak noktası olmaya devam etmektedir. Burada sunulan protokol, hücrelerin hazırlanması için değerli bir yaklaşım sunarak, DNA'ya zarar veren ajanlara maruz kaldıktan sonra ssDNA'nın görselleştirilmesini ve kantitatif analizini sağlar. Özellikle, bu protokol, tüm hücre döngüsü aşamalarında istenmeyen çapraz reaktiviteden kaçınırken, küçük miktarlarda ssDNA odaklarını görselleştirmek için yüksek özgüllüğünü gösteren ssDNA bağlayıcı protein RPA2'nin kullanımını vurgular. RPA2'nin kullanılması, özellikle hücre döngüsünün G1 fazındaki hücreleri analiz etmeyi amaçlayan araştırmacılar için çok sayıda avantaj sağlar. Bu protokol, çeşitli sınırlamaları göz önünde bulundurur ve ssDNA'yı tespit etmek için RPA2 veya BrdU boyama kullanılırken sinyal paraziti, istenmeyen arka plan gürültüsü ve çapraz reaktivite ile ilgili endişeleri giderir.
Açıklamalar
Yazarların beyan etmek için rekabet eden çıkarları yoktur.
Teşekkürler
Yazarlar, desteği ve yararlı görüşleri için Michele Pagano'ya, makaleyi eleştirel bir şekilde okuduğu için Ashley Chui ve Sharon Kaisari'ye ve sürekli destekleri için Jeffrey Estrada ve Vilma Diaz'a teşekkür eder. Bu çalışma, Ulusal Sağlık Enstitüleri hibe GM136250 bir çeşitlilik eki ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alpha-tubulin antibody | Sigma-Aldrich | T6074 | primary antibody (1:5,000) |
| Axio Observer Inverted Microscope | Zeiss | na | microscope |
| Bis-Tris Plus Mini Protein Gels, 4-12% | Invitrogen | NW04127BOX | Western Blot |
| Bovine Serum Albumin | Jackson ImmunoResearch | 001-000-162 | blocking |
| BrdU (5-Bromo-2'-deoxyuridine) | Sigma-Aldrich | B5002-100MG | nucleotide analogue |
| BrdU antibody BU1/75 | Abcam | ab6326 | primary antibody (1:500) |
| CellAdhere Dilution Buffer | Stemcell Technologies | 07183 | coating reagent |
| Click-iT Plus EdU Flow Cytometry Assay Kits | Invitrogen | C10632 | flow cytomery |
| Click-iT Plus EdU Cell Proliferation Kit for Imaging, Alexa Fluor 647 dye | Thermo Fisher Scientific | C10640 | click-reaction kit |
| cOmplete ULTRA Protease inhibitor tablets | Sigma-Aldrich | 5892791001 | reagent |
| Countess 3 Automated cell counter | Thermo Scientific | AMQAX2000 | cell counter |
| Coverslip | neuVitro | GG12PRE | tissue culture |
| Cyclin A2 antibody | Santa Cruz Biotechnology | sc-271682 | primary antibody (1:1,000) for IF and WB |
| Cyclin B1 antibody | Santa Cruz Biotechnology | sc-245 | primary antibody (1:5,000) |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650-100ML | vehicle control |
| DMEM, high glucose, with HEPES | Gibco | 12430051 | cell culture medium for RPE cells |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | the PBS used throughout the protocol |
| D-Sucrose | Thermo Fisher Scientific | bp220-1 | reagent |
| Eclipse Ti2 Series Epifluorescent Microscope | Nikon | na | microscope |
| EdU (5-Ethynyl-2'-deoxyuridine) | Thermo Fisher Scientific | C10637 | nucleotide analogue |
| Falcon 24-well plate | Corning | 351147 | tissue culture |
| Falcon Cell Culture Dishes 100 mm | Corning | 353003 | tissue culture |
| Fetal Bovine Serum, heat inactivated | Gibco | 16140071 | media supplement |
| Fiji (ImageJ) | NIH | version 1.54f | software and algorithms |
| FxCycle PI/RNase Staining Solution | Invitrogen | F10797 | PI staining |
| Goat anti-mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 555 | Thermo Fisher Scientific | A21422 | secondary antibody (1:1,000) |
| Goat anti-rat IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | Thermo Fisher Scientific | A48262 | secondary antibody (1:1,000) |
| Histone H3 antibody | Abcam | ab1791 | primary antibody (1:10,000) |
| hTERT RPE1 | ATCC | CRL-3216 | cell line |
| Hydrochloric acid | Sigma-Aldrich | H1758-100ML | reagent |
| Hydrogen peroxide 30% soultion | Sigma-Aldrich | H1009-100ML | reagent |
| Hydroxyurea,98% powder | Sigma-Aldrich | H8627-5G | reagent |
| Invitrogen Ultra Pure 0.5 M EDTA pH 8.0 | Thermo Fisher Scientific | 15-575-020 | reagent |
| Lipfectamine RNAiMAX Transfection Reagent | Invitrogen | 13778150 | transfection reagent |
| Magnesium chloride solution 1 M | Sigma-Aldrich | M1028-100ML | reagent |
| MycoFluor | Thermo Fisher | M7006 | Mycoplasma Detection Kit |
| Neocarzinostatin from Streptomyces carzinostaticus | Sigma-Aldrich | N9162-100UG | reagent |
| NuPage MES SDS Running Buffer (20x) | Invitrogen | NP0002 | Western Blot |
| onTARGETplus Human RPA2 siRNA | Dharmacon | L-017058-01-0005 | siRNA |
| p27 antibody | BD Biosciences | 610241 | primary antibody (1:1,000) |
| Paraformaldehyde aqueous solution (32%) | Electron Microscopy Sciences | 50-980-494 | fixative |
| PARP1 antibody | Cell Signaling Technology | 9542S | primary antibody (1:1,000) |
| PCNA antibody | Cell Signaling Technology | 13110S | primary antibody (1:2,000) |
| Penicillin-Streptomycin | Gibco | 15140163 | media supplement |
| pH3 antibody | Cell Signaling Technology | 3377S | primary antibody (1:2,000) |
| PhosSTOP phosphatase inhibitor tablets | Sigma-Aldrich | 4906837001 | reagent |
| PIPES Buffer 0.5 M solution, pH 7.0 | Bioworld | 41620034-1 | reagent |
| Precision Plus Protein Kaleidoscope Prestained Protein Standards | Bio-Rad | 1610395 | Western Blot |
| Prism | GraphPad | version 10 | statistical analysis and graph |
| ProLong Diamond Antifade Mountant | Thermo Scientific | P36961 | mounting media |
| Reduced serum media (Opti-MEM) | Gibco | 31985070 | used for transfection |
| Rpa32/rpa2 antibody (mouse) | EMD Millipore | NA19L | primary antibody (1:1,000) for WB |
| Rpa32/rpa2 antibody (rat) | Cell Signaling Technology | 2208S | primary antibody (1:1,000) for IF |
| Sodium Chloride solution (5 M) | Sigma-Aldrich | S5150 | reagent |
| Sodium Pyruvate (100 mM) | Gibco | 11360070 | media supplement |
| Sodium tetraborate decahydrate | Sigma-Aldrich | B3535-500G | reagent |
| Thermo Scientific Pierce DAPI Nuclear Counterstain | Thermo Scientific | 62248 | nucleic acid stain |
| Thymidine,powder | Sigma-Aldrich | T1985-1G | reagent |
| Triton X-100 aqueous solution (10%) | Sigma-Aldrich | 11332481001 | detergent |
| Trypsin-EDTA (0.5%), no phenol red | Gibco | 1540054 | cell dissociation agent |
| Vitronectin XF | Stemcell Technologies | 07180 | coating reagent |
| ZE5 Cell Analyzer | Bio-Rad | na | flow cytomery |
Referanslar
- Hakem, R. DNA-damage repair; the good, the bad, and ugly. EMBO J. 27 (4), 589-605 (2008).
- Gutierrez, R., O'Connor, T. R. DNA direct reversal repair and alkylating agent drug resistance. Cancer Drug Resist. 4 (2), 414-423 (2021).
- Krokan, H. E., Bjoras, M. Base excision repair. Cold Spring Harb Perspect Biol. 5 (4), a012583 (2013).
- Marteijn, J. A., Lans, H., Vermeulen, W., Hoeijmakers, J. H. Understanding nucleotide excision repair and its roles in cancer and ageing. Nat Rev Mol Cell Biol. 15 (7), 465-481 (2014).
- Li, G. M. Mechanisms and functions of DNA mismatch repair. Cell Res. 18 (1), 85-98 (2008).
- Hustedt, N., Durocher, D. The control of DNA repair by the cell cycle. Nat Cell Biol. 19 (1), 1-9 (2016).
- Yang, W., Gao, Y. Translesion and repair DNA polymerases: diverse structure and mechanism. Annu Rev Biochem. 87, 239-261 (2018).
- Bhat, D. S., et al. Therapeutic disruption of RAD52-ssDNA complexation via novel drug-like inhibitors. NAR Cancer. 5 (2), zcad018 (2023).
- Gupta, P., Saha, B., Chattopadhyay, S., Patro, B. S. Pharmacological targeting of differential DNA repair, radio-sensitizes WRN-deficient cancer cells in vitro and in vivo. Biochem Pharmacol. 186, 114450 (2021).
- Pena-Diaz, J., et al. Noncanonical mismatch repair as a source of genomic instability in human cells. Mol Cell. 47 (5), 669-680 (2012).
- Schroering, A. G., Edelbrock, M. A., Richards, T. J., Williams, K. J. The cell cycle and DNA mismatch repair. Exp Cell Res. 313 (2), 292-304 (2007).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nat Rev Mol Cell Biol. 20 (11), 698-714 (2019).
- Escribano-Diaz, C., et al. A cell cycle-dependent regulatory circuit composed of 53BP1-RIF1 and BRCA1-CtIP controls DNA repair pathway choice. Mol Cell. 49 (5), 872-883 (2013).
- Genschel, J., Modrich, P. Mechanism of 5'-directed excision in human mismatch repair. Mol Cell. 12 (5), 1077-1086 (2003).
- Hu, J., et al. Nucleotide excision repair in human cells: fate of the excised oligonucleotide carrying DNA damage in vivo. J Biol Chem. 288 (29), 20918-20926 (2013).
- Huertas, P., Jackson, S. P. Human CtIP mediates cell cycle control of DNA end resection and double strand break repair. J Biol Chem. 284 (14), 9558-9565 (2009).
- Keijzers, G., et al. Human exonuclease 1 (EXO1) regulatory functions in DNA replication with putative roles in cancer. Int J Mol Sci. 20 (1), 74 (2018).
- Symington, L. S. End resection at double-strand breaks: mechanism and regulation. Cold Spring Harb Perspect Biol. 6 (8), a016436 (2014).
- Liu, Y., et al. DNA polymerase beta and flap endonuclease 1 enzymatic specificities sustain DNA synthesis for long patch base excision repair. J Biol Chem. 280 (5), 3665-3674 (2005).
- Wold, M. S., Kelly, T. Purification and characterization of replication protein A, a cellular protein required for in vitro replication of simian virus 40 DNA. Proc Natl Acad Sci U S A. 85 (8), 2523-2527 (1988).
- Wienholz, F., Vermeulen, W., Marteijn, J. A. Amplification of unscheduled DNA synthesis signal enables fluorescence-based single cell quantification of transcription-coupled nucleotide excision repair. Nucleic Acids Res. 45 (9), e68 (2017).
- Wold, M. S. Replication protein A: a heterotrimeric, single-stranded DNA-binding protein required for eukaryotic DNA metabolism. Annu Rev Biochem. 66, 61-92 (1997).
- Chen, R., Wold, M. S. Replication protein A: single-stranded DNA's first responder: dynamic DNA-interactions allow replication protein A to direct single-strand DNA intermediates into different pathways for synthesis or repair. Bioessays. 36 (12), 1156-1161 (2014).
- Kang, Y., et al. Alteration of replication protein A binding mode on single-stranded DNA by NSMF potentiates RPA phosphorylation by ATR kinase. Nucleic Acids Res. 51 (15), 7936-7950 (2023).
- Kilgas, S., Kiltie, A. E., Ramadan, K. Immunofluorescence microscopy-based detection of ssDNA foci by BrdU in mammalian cells. STAR Protoc. 2 (4), 100978 (2021).
- Madabhushi, R., Pan, L., Tsai, L. H. DNA damage and its links to neurodegeneration. Neuron. 83 (2), 266-282 (2014).
- Liboska, R., Ligasova, A., Strunin, D., Rosenberg, I., Koberna, K. Most anti-BrdU antibodies react with 2'-deoxy-5-ethynyluridine -- the method for the effective suppression of this cross-reactivity. PLoS One. 7 (12), e51679 (2012).
- Biehs, R., et al. DNA double-strand break resection occurs during non-homologous end joining in G1 but is distinct from resection during homologous recombination. Mol Cell. 65 (4), 671-684.e5 (2017).
- Cruz-Garcia, A., Lopez-Saavedra, A., Huertas, P. BRCA1 accelerates CtIP-mediated DNA-end resection. Cell Rep. 9 (2), 451-459 (2014).
- Ercilla, A., et al. Physiological tolerance to ssDNA enables strand uncoupling during DNA replication. Cell Rep. 30 (7), 2416-2429.e7 (2020).
- Lezaja, A., et al. RPA shields inherited DNA lesions for post-mitotic DNA synthesis. Nat Commun. 12 (1), 3827 (2021).
- Mukherjee, B., Tomimatsu, N., Burma, S. Immunofluorescence-based methods to monitor DNA end resection. Methods Mol Biol. 1292, 67-75 (2015).
- Ochs, F., et al. 53BP1 fosters fidelity of homology-directed DNA repair. Nat Struct Mol Biol. 23 (8), 714-721 (2016).
- Raderschall, E., Golub, E. I., Haaf, T. Nuclear foci of mammalian recombination proteins are located at single-stranded DNA regions formed after DNA damage. Proc Natl Acad Sci U S A. 96 (5), 1921-1926 (1999).
- Forment, J. V., Walker, R. V., Jackson, S. P. A high-throughput, flow cytometry-based method to quantify DNA-end resection in mammalian cells. Cytometry A. 81 (10), 922-928 (2012).
- Mistrik, M., et al. Cells and stripes: A novel quantitative photo-manipulation technique. Sci Rep. 6, 19567 (2016).
- Aten, J. A., Bakker, P. J., Stap, J., Boschman, G. A., Veenhof, C. H. DNA double labelling with IdUrd and CldUrd for spatial and temporal analysis of cell proliferation and DNA replication. Histochem J. 24 (5), 251-259 (1992).
- Podgorny, O., Peunova, N., Park, J. H., Enikolopov, G. Triple S-phase labeling of dividing stem cells. Stem Cell Reports. 10 (2), 615-626 (2018).
- Cappella, P., Gasparri, F., Pulici, M., Moll, J. Cell proliferation method: click chemistry based on BrdU coupling for multiplex antibody staining. Curr Protoc Cytom. Chapter 7, (2008).
- Ligasova, A., Koberna, K. Strengths and weaknesses of cell synchronization protocols based on inhibition of DNA synthesis. Int J Mol Sci. 22 (19), 10759 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır