Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
NMR Bazlı Metabolomikler Kullanılarak Kritik Hastalarda Düzensiz Metabolitlerin Tanımlanması ve Miktar Tayini
Bu Makalede
Özet
Nükleer manyetik rezonans (NMR) spektroskopisi, çeşitli hastalıkları olan hastalarda metabolitlerdeki düzensizliği tanımlamak için kullanılır. Bu teknik, patofizyolojik içgörüleri çözerek düzensiz metabolitlerin nicelleştirilmesine izin verir. Burada, hastaların metabolik karakterizasyonu için NMR tabanlı yaklaşımın adım adım prosedürünü açıklıyoruz.
Özet
Metabolomik, bireyin patofizyolojik durumlara verdiği yanıtı yansıtmak için önemli bir yaklaşım olarak ortaya çıkmaktadır. Nükleer manyetik rezonans (NMR) spektroskopisi, akut solunum sıkıntısı sendromu (ARDS), şiddetli akut pankreatit (SAP), akut böbrek hasarı (AKI) ve sepsis gibi durumlardan muzdarip kritik hastalarda metabolik düzensizlikleri tanımlamak için bir araç olarak gelişmiştir. Çalışma ve kontrol grubunun serum örneğinden elde edilen spektral veriler, 800 MHz NMR spektrometresi kullanılarak kaydedildi ve NMR işleme ve analiz araçları kullanılarak işlendi. Ayrıca, önemli metabolitleri belirlemek için tek değişkenli ve çok değişkenli testler gibi titiz bir istatistiksel analiz yapılır ve bunlar daha sonra NMR metabolit miktar tayin yazılımı kullanılarak doğru bir şekilde tanımlanır ve niceliklendirilir. Ek olarak, yol analizi, hastalığın ciddiyetine neden olan düzensiz biyokimyasal döngüleri vurgular. Bu kapsamlı yaklaşım sayesinde araştırmacılar, bu kritik hastalıklarla ilişkili metabolik değişiklikler hakkında daha derin bilgiler edinmeyi, potansiyel olarak hastalığın daha iyi anlaşılmasının ve teşhis ve tedavi stratejilerinin iyileştirilmesinin yolunu açmayı amaçlamaktadır.
Giriş
Dünya çapında etkili hastalık teşhisi sağlamaya yönelik sürekli çabalara rağmen, hedefe yönelik tedavi hala gerçek potansiyeline ulaşmamıştır. Transkriptomik, proteomik vb. gibi çeşitli yaklaşımlar, birkaç biyobelirteçin tanımlanmasıyla sonuçlanmıştır, ancak bunlar, duyarlılık ve özgüllük eksikliği nedeniyle yeterli klinik faydaya sahip değildi 1,2. Hedefe yönelik tedavi, bazı multifaktöriyel hastalıklarda büyük bir zorluktur ve sonunda daha yüksek mortaliteye yol açar. Geniş heterojenliğe sahip kompleks hastalıkların altında yatan mekanizmanın ve patofizyolojinin daha iyi anlaşılmasına ihtiyaç vardır. Bu nedenle, bu bağlamda, metabolomiklerin evrimi, sonunda akut solunum sıkıntısı sendromu (ARDS), sepsis ve şiddetli akut pankreatit (SAP) gibi çeşitli kritik hastalıklar için tedavi rejimlerinin uyarlanmasına yardımcı olabilecek terapötik gelişimde devrim yaratmıştır.
Metabolomik, çeşitli biyosıvılar, hücreler veya doku ekstraktları arasında küçük moleküler ağırlıklı molekülleri (amino asitler, lipitler, peptitler, organik asitler ve vitaminler gibi metabolitler) tanımlamayı ve ölçmeyi amaçlayan kapsamlı bir yaklaşımdır. Tipik olarak 1500 Da'dan daha hafif olan bu metabolitler, organizmanın biyolojik durumunun ilerleyici bir taslağını yansıtan biyokimyasal süreçlerde aktif rol oynar. Anahtar enzimatik süreçler için substratları, biyolojik yollardaki ara ürünleri ve hücresel metabolizmanın yan ürünlerini içerirler. Sonuç olarak, metabolomik, diyet etkilerinin, ilaç etkileşimlerinin ve hastalık durumlarının ayrıntılı bir parmak izini yakalar. Metabolit değişiklikleri, metabolizmanın ve biyolojik yolların oldukça hassas göstergeleridir ve fenotipik ekspresyonlar ve bunun sonucunda ortaya çıkan patofizyolojik anormallikler ile korelasyonlara izin verir 3,4. Metabolitlerdeki ilk varyasyonlar, hastalık şiddetinin erken göstergeleri olarak hizmet edebilirken, zamansal değişiklikler tedavi etkinliğinin, hastalığın ilerlemesinin ve klinik sonuçların izlenmesine yardımcı olabilir 5,6,7. Metabolomikler böylece klinik, fizyolojik ve biyokimyasal uç noktalar aracılığıyla hastalıkları yeniden tanımlayarak klinik tahlilleri ve diğer çeşitli omik yaklaşımları geliştirir 8,9,10,11,12,13. Metabolomiklerin analitik yetenekleri, değişmiş metabolit konsantrasyonları14,15 yoluyla hastalığa yatkınlığı izlemek ve belirlemek için kullanılır.
Bu bağlamda, hem kütle spektrometresi (MS) hem de nükleer manyetik rezonans (NMR) spektroskopisi, biyolojik örneklerde metabolit profillemesi için birincil analitik platformlar olarak ortaya çıkmıştır. Bu yöntemler, metabolitlerin hem hedefli hem de hedefsiz tanımlanması ve miktar tayini için kullanılır 16,17,18. Her platformun avantajları ve sınırlamaları vardır, ancak NMR'nin tahribatsız doğası, çeşitli in vivo çalışmalarda ve özellikle metabolomik araştırmaların ilk aşamalarında bilinmeyen bileşiklerin yapısının karakterizasyonu için tercih edilmesini sağlar. MS'den önce gerekli olan numune fraksiyonlama, türevlendirme ve iyonizasyon, yanlılıklara neden olabilir ve genellikle numune kaybına neden olabilir, bu da NMR spektroskopisinin minimum numune hazırlığı ile veya hiç numune hazırlığı olmadan yakalayabileceği dinamik özellikleri etkiler. NMR'nin birincil sınırlaması, daha düşük bir tespit limiti sunan MS'ye kıyasla daha düşük duyarlılığıdır ve daha az miktarda metabolitin tespit edilmesini zorlaştırır19. Bununla birlikte, yüksek çözünürlüklü süper iletken mıknatıslar, kriyojenik olarak soğutulmuş NMR probları ve hassasiyeti artıran teknikler gibi gelişmeler bu sınırlamayı azaltmıştır20,21,22. Genomik ve proteomiklere tamamlayıcı bir yaklaşım olarak, NMR spektroskopisi kullanılarak metabolik profilleme tercih edilen bir teknik olarak ilgi görmektedir 23,24,25. NMR'nin minimum numune hazırlama, tekrarlanabilirliği ve tekrarlanabilirliği, hassasiyet zorluklarına rağmen onu metabolitlerin doğal dinamik özelliklerini yakalamak için değerli bir araç haline getirir26.
Çeşitli araştırma grupları, ARDS28,29,30,31,32,33, pnömoni34, sepsis7, safra kesesi taşları 35 ve pankreatit36 gibi çeşitli hastalıklar27 için hastaların düzensiz metabolik profilini belirleyerek metabolomikleri başarılı bir şekilde gerçekleştirmiştir. Kritik hastaların NMR tabanlı metabolomik çalışmaları, sistemik inflamatuar yanıt sendromundan (SIRS) yoğun bakım ünitesi (YBÜ) mortalite ve morbiditesinin önde gelen nedeni olan çoklu organ disfonksiyonu sendromuna (MODS) ilerlemenin izlenmesinde etkili olmuştur37. Stringer ve arkadaşları tarafından yapılan bir çalışmada, sepsise bağlı akut akciğer hasarı (ALI) olan hastalarda kontrol hastalarına kıyasla metabolik değişiklikleri incelemek için plazma örnekleri kullanılmıştır38. Bu pilot çalışmada yüksek bulunan anahtar metabolitler, ilgili metabolik yolları ve bunların klinik puanlarla ilişkisini yansıtıyordu. Bu araştırma, ARDS32'de sepsisi akciğer hasarı mekanizmalarının erken evrelerinden ayırt etmek için serum metabolomiklerine genişletildi. Ek olarak, ARDS'de yapılan başka bir çalışma, akut akciğer hasarı/ARDS ile sağlıklı kontroller arasında belirgin bir ayrım yapan ve akciğer hasarının akut başlangıcına karşılık gelen sistemik metabolik değişiklikler hakkında içgörüler sunan güçlü serum biyobelirteçlerini tanımlamıştır39,40.
NMR spektroskopisi, altta yatan patofizyolojiyi ortaya çıkaran metabolik parmak izi hakkında sağlam ve tarafsız bilgiler sağlayan yüksek verimli ve otomatik bir analitik tekniktir38. NMR verilerinin klinik uygulaması ve biyolojik yorumlanması, zengin bilgi içeren yüksek kaliteli spektrumların elde edilmesine bağlıdır. Bu nedenle, doğru, tek tip ve iyi formüle edilmiş veri toplama, işleme ve analiz sağlamak çok önemlidir. Bu nedenle, bu çalışmanın amacı, metabolitlerin tanımlanması ve miktarının belirlenmesi için NMR tabanlı metabolomiklerin temel adımlarından yararlanmaktır. Bu çalışma, klinik metabolomik çalışma için gerekli protokolün temel adımlarını vurgulamaktadır (Şekil 1), örneğin uygun örneklerin seçimi, toplama ve saklama, örnek işleme ve hazırlama, veri toplama ve analizi, ilgilenilen metabolitin tanımlanması ve niceliklerinin belirlenmesi ve sonuç olarak, ilgili içgörüler elde etmek için sonuçların klinik bağlamda yorumlanması. Bu adımların her biri, önemli biyolojik ve klinik içgörüleri ortaya çıkarmak için metabolomikte NMR spektroskopisinden yararlanmak için gereklidir.
Protokol
Etik onay (IEC kodu: 2022-71-PhD-126), Lucknow'daki Sanjay Gandhi Tıp Bilimleri Lisansüstü Enstitüsü (SGPGIMS) IEC'den alınmıştır. Çalışmanın gerçekleştirilmesi ve verilerin araştırma amaçlı yayınlanması için hasta veya yakınlarından yazılı ve bilgilendirilmiş onam alındı. Ayrıca, araştırma kurumsal yönergelere uygun olarak yürütülmüştür.
1. Çalışma tasarımı ve etik izin
- Her grup için örnek boyutunu belirleyin. Katılımcılar için seçim kriterlerini dikkatlice gözden geçirin ve oluşturun. Ek olarak, çalışma tasarımı insan veya hayvan örneklerinin dahil edilmesini gerektiriyorsa, örnek toplamaya başlamadan önce uygun kurumsal etik komiteden (IEC) etik izin alın.
- Arteriyel kandaki oksijenin kısmi basıncının (PaO2) solunan oksijen (FiO2) fraksiyonuna (P/F) oranına dayalı Berlin 2012 tanımının tanı kriterlerine göre hafif, orta ve şiddetli olarak kategorize edilen ARDS hastalarını seçin. P/F aralığı 300-200 arasında olan ARDS hastaları hafif, 200-100 yaş arası orta, 100'ün altı olanlar ise ağır olarak kabul edilir38. Burada hafif ve orta şiddette ARDS hastaları olmak üzere iki grup üzerinde yoğunlaştık (bakınız Tablo 1).
NOT: Çalışma, NMR bazlı metabolomikleri gerçekleştirmek için kan örneklerinden elde edilen serumun kullanımını içermektedir. Bu çalışmada, referans olarak dahil edilen katılımcıların yaş ortalaması 42 (± 10.9 yıl) olup, cinsiyet dağılımı 2 erkek ve 6 kadındır.
| Kategori | F/K oranı |
| Hafif | 300-200 |
| Ilımlı | 200-100 |
| Şiddetli | 100-0 |
Tablo 1: ARDS hastalarının kategorizasyonu.
2. Numune seçimi, toplanması ve işlenmesi
- Aşağıda açıklanan adımları izleyerek serum izolasyonu gerçekleştirin.
- Deney için, düz (hiçbir katkı maddesi içermeyen) ve steril bir şişede steril bir iğne kullanarak arterlerden 2 mL kan örneği toplayın. Numuneyi oda sıcaklığında 30 dakika pıhtılaşmaya bırakın. Bu çalışma için hafif derecede ARDS tanısı alan 4 hasta ve orta derecede ARDS tanısı alan 4 hasta seçildi.
- Serumu25 ayırmak için numuneyi 3100 x g'da 15 dakika santrifüjleyin. Serumu steril mikrosantrifüj tüplerine aktarın, daha küçük hacimli (yani 400-500 μL) alikotlar yapın, uygun şekilde etiketleyin (Hasta adı, CR no., gün noktası, vb.) ve gelecekteki analizler için -80 ° C'de saklayın.
NOT: Bu noktada, deney uygun bir zamanda duraklatılabilir ve devam ettirilebilir.
- Aşağıdaki adımları kullanarak NMR deneylerinden önce serum örneğini işleyin.
- NMR deneylerini gerçekleştirmeden önce numuneyi çözün. PH değişimini en aza indirmek için serumun 250 μL alikotunu 250 μL tuzlu fosfat tampon çözeltisi (% 100 D2O,% 0.9 NaCl, 50 mM sodyum fosfat tamponu, pH 7.4 içeren) ile karıştırın.
- Homojen bir şekilde karıştığından emin olmak için karışımı birkaç saniye (~ 15 sn) vorteksleyin. Son olarak, hazırlanan numuneyi, kalibrasyon ve miktar tayini için harici bir standart görevi gören 0,05 mM'lik bir konsantrasyonda trimetilsilil propiyonat (TSP) içeren bir koaksiyel ek parçaya sahip temiz bir NMR tüpüne aktarın41.
NOT: Referans olarak, analitlerle etkileşime girmeyen inert ve reaktif olmayan bir bileşik kullanılır. Yaygın olarak kullanılan diğer referans bileşikler arasında Tetrametilsilan (TMS) ve sodyum trimetilsililpropansülfonat (DSS) bulunur.
3. NMR deneyi
NOT: Odak noktası, serum örneklerindeki küçük molekülleri tanımlamaktır, bu nedenle, makromolekül sinyallerini baskılayan Carr-Purcell-Meiboom-Gill (CPMG) darbe dizisini kullandık. Bu çalışmadaki tüm serum örnekleri, kriyojenik olarak soğutulmuş üçlü rezonans TCI 5 mm geniş bant ters prob kafası ve korumalı z-gradyanı ile donatılmış 800 MHz NMR spektrometresi kullanılarak kaydedildi.
- Numuneyi mıknatısın içine yerleştirin. cpmg nabız programı ile bir proton deneyi ayarlamak için wrpa (deney numarasını belirtin) komutunu yazın ve enter tuşuna basın. Başlık seçeneğine tıklayarak hastanın adını ve gerekli diğer ayrıntıları belirtin.
- Lock komutunu yazarak manyetik alanı kilitleyin, enter tuşuna basın ve %90 H2O ve %10 D2O seçeneğini daha fazla seçin. Radyo frekansı darbelerinin verimliliğini optimize etmek ve hassasiyeti en üst düzeye çıkarmak için probu ATMM ile manuel olarak ayarlayın ve eşleştirin. Topshim'e tıklayarak 1D gradyan şimleme gerçekleştirin.
- 5 s'lik bir gevşeme gecikmesi, milyonda 12 parça (ppm) spektral tarama genişliği ve 300 μs'lik bir yankı süresi dahil olmak üzere aşağıdaki alım parametrelerini ayarlayın. Tüm bu parametreler, üst paneldeki Edinme Parametreleri seçeneği seçilerek kolayca değiştirilebilir.
- Üstel pencere işlevini kullanarak 0,3 Hz'lik çizgi genişletme uygulayın ve verileri 128 taramada 64.000 noktada toplayın. Bu parametreler, üst paneldeki Edinme Parametreleri seçeneği seçilerek benzer şekilde değiştirilebilir. Edinme Parametreleri'ne tıklandığında, bir spesifikasyon listesi görünecektir ve belirtilen özellikler, diğer parametrelerle birlikte optimizasyon sırasında değiştirilebilir.
- NMR işleme ve analiz araçlarını kullanarak NMR spektrumlarını elde edin. Son spektrumlar elde edildikten sonra, apk ve absn komutunu yazın ve sırasıyla faz düzeltmesi ve taban çizgisi düzeltmesi yapmak için enter tuşuna basın. Üst panelde bulunan Ekseni Kalibre Et seçeneğine tıklayın ve ardından TSP tepe noktasını otomatik veya manuel olarak 0 ppm'ye kalibre edin.
- Elde edilen verileri sistemden iş istasyonuna aktarın, burada daha fazla işlem ve analiz yapılır.
NOT: Deney aşaması artık tamamlanmıştır ve duraklatılabilir. Veri ön işleme, analiz ve yorumlama uygun bir şekilde gerçekleştirilebilir.
4. Veri ön işleme
- NMR işleme ve analiz araçlarını ve NMR metabolit niceleme yazılımını kullanarak veri ön işlemeyi gerçekleştirin.
- Bazen sadece otomatik düzeltme yeterli değildir ve bu durumda manuel düzeltme de gereklidir. Faz düzeltmesini manuel olarak gerçekleştirmek için, NMR işleme ve analiz araçlarının üst menü çubuğundaki İşlem seçeneğine tıklayın. Ardından Fazı Ayarla'ya tıklayın, fareyi sürükleyin ve spektrumlar faz düzeltmesi yapılana kadar gözlemleyin. Bittiğinde, aynı menü çubuğunda bulunan Kaydet ve İade Et seçeneğine (bir simge şeklinde bulunur) tıklayın.
- Manuel taban çizgisi (Whittaker yöntemi) düzeltmesi yapmak için, NMR metabolit niceleme yazılımının işlemci modülündeki spektral dosyayı açın. Taban Çizgisi Düzeltme seçeneğini seçin. Ardından Whittaker Yöntemi seçeneğini seçin. Şimdi tabanı ayarlamak için noktaları tüm spektrumlardaki tepe noktalarının tabanına yerleştirin (genellikle serum durumunda veya spektrumdaki metabolitin mevcudiyetine göre 0.0 ila 10 ppm). Tüm spektral dosyalar taban çizgisi düzeltildikten sonra, bunları tek bir klasöre kaydedin. NMR metabolit miktar tayin yazılımının işlemci veya profil oluşturucu modülü kullanılarak daha fazla işlem, belirli formatta kaydedilen aynı dosya kullanılarak gerçekleştirilebilir.
- Aynı yazılımın profil oluşturucu modülünü kullanarak gruplama gerçekleştirin. Araçlar'ı, ardından Toplu İşlem'i ve ardından Spektral Gruplama'yı seçin.
- İstatistiksel analiz için kullanılacak son gruplama sayfasını oluşturmak için, Spektral gruplama'ya tıkladıktan sonra tüm temel düzeltmeli spektral dosyaları içeren klasörü seçin.
- Spektrumları, 0,01 ila 0,04 ppm arasında değişen tanımlanmış bir spektral genişliğe sahip belirli sayıda eşit boyutlu bölmeye bölün (çalışmaya göre optimize edilebilir). Bu süreç, spektral verileri basitleştirir ve düzenleyerek daha tutarlı analizi kolaylaştırır. Başlangıç ve bitiş ppm değerleriyle birlikte kova boyutunu belirtin ve çıktı gruplama sayfalarının kaydedileceği klasörü belirleyin.
- Spektral paraziti42,43,44 önlemek için suya ve çözücü TSP'ye (4.8-5.2 ve 0.0-0.7 ppm) karşılık gelen kimyasal kayma bölgelerini hariç tutun.
- Bu elektronik tablo, bir satırda örnek adları ve diğer satırlarda ppm ile birlikte farklı bölme değerlerini içerir. Bu sayfayı istatistiksel analiz için kullanmadan önce, örnekleri analiz için gruplara ayırarak ve yalnızca virgülle ayrılmış (CSV) biçiminde kaydederek değiştirin.
NOT: Örneğin, hafif grup ile orta ARDS hastaları grubunu karşılaştırırken, verileri hafif ve orta etiketlerle düzenledik, bir seri numarası ekledik ve dosyayı CSV formatında kaydettik.
5. İstatistiksel analiz
NOT: Önceki adımdan elde edilen gruplama sayfası, istatistiksel analiz için giriş dosyası görevi görür. Bu çalışmada metabolomik istatistiksel analiz yazılımının istatistiksel analiz (tek faktör) modülü kullanılmıştır.
- İstatistiksel analizden önce, sum, log ve Pareto kullanarak normalleştirme adımını gerçekleştirin, ancak bu, farklı çalışmalara göre değişebilir45.
- Farklı grupları ayırt etmek ve tanımlanan metabolitlerin doğruluğunu belirlemek için tek değişkenli ve çok değişkenli analiz yapın.
- Metabolik profildeki farktan sorumlu her metabolit için değişken projeksiyon önemi (VIP) skorları veren gruplar arasındaki ayrımı gözlemlemek için temel bileşen analizi (PCA), kısmi en küçük kareler diskriminant analizi (PLS-DA) ve ortogonal kısmi en küçük kareler diskriminant analizi (OPLS-DA) gerçekleştirin.
- P değerinin 0.05'ten düşük olması kriterlerine dayalı olarak önemli metabolitleri belirlemek için öğrenci t-testi ve ANOVA gibi tek değişkenli yöntemler uygulayın. Her iki test de metabolitlerin nispi konsantrasyonundaki farkı gösteren kutu bıyık grafikleri verir.
- Alıcı işletim karakteristik eğrisi (AUROC) grafiğinin altında bir alan veren biyobelirteç analizi gerçekleştirin. 0.8 > AUC (eğrinin altındaki alan) değeri anlamlı46 olarak kabul edilir.
- VIP skoru>1, Bonferroni ile düzeltilmiş p değeri<0.0544 ve AUC > 0.846 kriterlerini kullanarak önemli metabolitlerin son listesini seçin.
- Metabolitleri aşağıda tarif edildiği gibi tanımlayın.
- Binning, isimlerden ziyade ppm değerleri şeklinde önemli metabolitler sağlar. Biyolojik Manyetik Rezonans Bankası (BMRB)47ve İnsan Metabolom Veritabanı (HMDB) gibi veritabanlarını kullanarak belirli ppm değerlerine karşılık gelen metabolitleri tanımlayın.
- Bunların dışında, tanımlama ve doğrulama için daha önce yayınlanmış literatürü42,44 kullanın.
- Tanımlanan metabolitleri ppm değerleriyle doğrulamak için NMR metabolit miktar tayin yazılımının profil modülünü kullanın.
6. NMR metabolit miktar tayin yazılımı kullanılarak metabolitlerin miktar tayini
NOT: Yazılımın profil oluşturucu modülü, tanımlanan metabolitleri ölçmek için yaygın olarak kullanılmaktadır.
- Miktar tayinine başlamadan önce, işlemci modülünü kullanarak çalışma için seçilen referans bileşiği (bu çalışmada kullanılan tsp) kalibre edin. CSI'yi kalibre et (kimyasal şekil göstergesi) seçeneğine tıklayın. Referans bileşiğin konsantrasyonunu belirtin (bu çalışma için 0.05 mM). Ardından, yazılım tepe noktasını spektral referans tepe noktasına sürükleyin ve yüksekliğini ve genişliğini uygun şekilde ayarlayın. Spektral referans tepe noktaları yazılımın tepe noktasına uyduğunda, Kabul Et'e tıklayın.
- Profil oluşturucu modülünde istediğiniz spektrumu açın ve çalışma için uygun bileşik kitaplığı seçin.
- Ekranın alt kısmında, metabolitlerin bir listesi görüntülenir. Bu listeden ilgilendiğiniz metaboliti seçin. Seçildikten sonra, seçilen metabolitin olası ppm'si spektrumun üst köşesinde görünecektir.
- Üst köşedeki Ppm Değerini seçin ve spektrumları metabolitin spesifik ppm ölçeğine yakınlaştırın.
- Bu noktada, ekranda iki tepe noktası görünecektir: biri kaydedilen verileri temsil eder, diğeri ise yazılım tepe noktasını temsil eden noktalı bir çizgi olarak görüntülenir. Her iki tepe noktasını hizalayın. Yazılım tepe noktasını sürükleyin ve yüksekliğini ve konumunu, örnekte bulunan tepe noktasıyla eşleşecek şekilde ayarlayın.
- Düzgün bir şekilde hizalandıktan sonra, metabolitin konsantrasyonu, o metabolit için mM cinsinden konsantrasyon başlığı altında görüntülenen değerden elde edilebilir (Şekil 1).
- Tüm metabolitler ve numuneler için aynı prosedürü izleyin ve niceliksel değerleri bir elektronik tabloda dışa aktarın. Çıktı dosyasını oluşturmak için Araçlar menüsü altındaki Batch Operations seçeneğine tıklayın. Çıktı dosyasını kaydetmek için istediğiniz klasörü belirtin.
7. Yol analizi
NOT: Analizden sonra tanımlanan önemli metabolitler, hastalık gruplarında sonucu doğrudan etkileyen ana yolakları belirlemek için kullanılır. Metabolomik istatistiksel analiz yazılımının yol analizi modülü ve KEGG veri tabanı genellikle bu amaç için kullanılır.
- Elde edilen önemli metabolitlerin listesini modüle girin. Yolların adlarını içeren bir liste oluşturulur.
- 0,1'den büyük bir etki faktörüne sahip olma kriterine dayalı olarak son yolları seçin. Önemli etki değerleri hastalıkla ilgili yolakları gösterir30.
- Hastalığın ciddiyeti ile ilişkili düzensizliği aydınlatmak için ortaya çıkan yolları iyice analiz edin. Bu yöntemin dezavantajlarından biri, önemli metabolitler 3'ten az olduğunda düzensiz yolların tanımlanmasındaki verimsizliğidir.
- Aynı şeyle başa çıkmak için, tanımlanan metabolit ve bunun hastalık şiddeti ile korelasyonu, daha önce yayınlanmış literatür kullanılarak da belirlenebilir. Kapsamlı bir literatür taraması yapın ve tanımlanan metabolitin de ilginize göre aynı eğilimi takip edip etmediğini gözlemleyin.
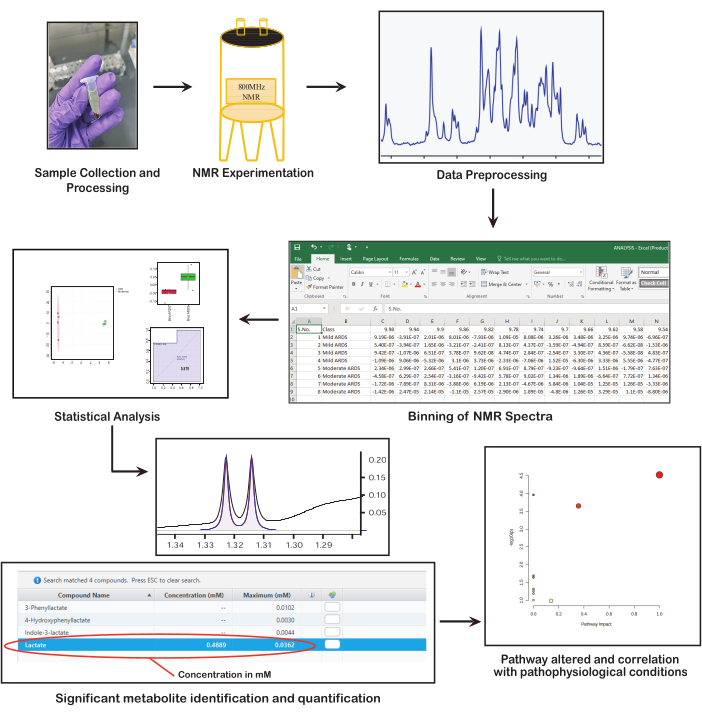
Şekil 1: NMR tabanlı metabolomikte temel adımlar. Şekil, NMR tabanlı metabolomikte temel adımları sunmaktadır: numunelerin toplanması ve hazırlanması, NMR spektroskopisinin gerçekleştirilmesi, verilerin ön işlenmesi, istatistiksel analiz yapılması, metabolitlerin tanımlanması ve miktarının belirlenmesi ve biyolojik önemin yorumlanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Bir metabolomik çalışma yapmak için, örneklem büyüklüğünü ve analiz edilecek spesifik grupları belirlemek önemlidir. Hastalık şiddeti48 ile doğru bir şekilde ilişkili olan önemli sonuçlar elde etmek için yeterli bir örneklem büyüklüğünün seçilmesi esastır. Bununla birlikte, bu özel çalışmada, öncelikle referans amaçlı olan NMR bazlı metabolomikler kullanılarak metabolitlerin tanımlanması ve miktarının belirlenmesinde yer ...
Tartışmalar
Metabolomik, hastalık sırasında bozulan metabolik döngüleri hedefleyerek metabolitleri verimli bir şekilde tanımlar ve ölçer. Sonuçların kalitesi, metabolomik yaklaşımdaki her adımın titiz bir şekilde yürütülmesine bağlıdır. Numune seçimi ve toplanmasından yol tanımlamasına kadar her aşama, hastalığa katkıda bulunan birincil faktörlerin doğru bir şekilde tanımlanmasında kritik öneme sahiptir. Metabolomik yapmadan önce, literatürün kapsamlı bir şek...
Açıklamalar
Yazarlar rekabet eden hiçbir mali çıkar beyan etmemektedir.
Teşekkürler
AS, kayıt için Bilimsel ve Yenilikçi Araştırma Akademisi'ne (AcSIR) teşekkür eder (Kayıt No. 10BB22A71002). AS ayrıca burs için Savunma Araştırma ve Geliştirme Teşkilatı'na (DRDO) teşekkür eder. Biyomedikal Araştırma Merkezi'ne (CBMR) 800 MHz NMR spektrometresi tesisini sağladığı ve intramural proje (CBMR/IMR/0008/2021) aracılığıyla finansman sağladığı için teşekkür ederiz. Ayrıca, sürekli destek için Yoğun Bakım Tıbbı Departmanı (CCM), SGPGIMS'e de teşekkür ederiz. Birçok hemşirenin ve en önemlisi bu çalışmaya katılan hastaların yardımına teşekkür ediyoruz. Bu çalışma, Biyomedikal Araştırma Merkezi'nin (CBMR) intramural projesi (CBMR/IMR/0008/2021) ve ekstramural proje (No. LSRB/01/15001/LSRB-404/PEE&BS/2023) Savunma Araştırma ve Geliştirme Teşkilatı'nın (DRDO).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Centirfuge | Sigma aldrich | 3-18KS | |
| Chenomx NMR suite | NMR Suite, v9, Chenomx Inc., Edmonton, Canada | NMR metabolite quantification software | |
| Co-axial insert | Sigma aldrich | Z278513 | |
| Deuterim oxide | Sigma aldrich | 151882 | |
| Eppendorf tubes | Tarsons | 500020 | |
| Metaboanalyst | Wishart Research Group | Metabolomics statistical analysis software | |
| NMR tube | Wilmad | Z412007 | 5mm diameter |
| Pipette | Eppendorf research plus | 3123000039 | 0-100 μl |
| Sample collection vials | Tarsons cryo chill vials | 523194 | |
| Sodium azide | Sigma aldrich | S2002 | |
| Sodium chloride crystal | Sigma aldrich | S9625 | |
| Sodium phosphate dibasic | Sigma aldrich | 567550 | |
| Sodium phosphate monobasic | Sigma aldrich | S0751 | |
| Topspin 3.6.4 | Bruker | NMR processing and analysis tool | |
| Tsp salt | Sigma aldrich | 269913 |
Referanslar
- Rubenfeld, G. D. Confronting the frustrations of negative clinical trials in acute respiratory distress syndrome. Ann. Am. Thorac. Soc. 12 (Supplement 1), S58-S63 (2015).
- Ware, L. B., et al. Prognostic and pathogenetic value of combining clinical and biochemical indices in patients with acute lung injury. Chest. 137 (2), 288-296 (2010).
- Johnson, C. H., Julijana, I., Gary, S. Metabolomics: beyond biomarkers and towards mechanisms. Nat Rev Mol Cell Biol. 17 (7), 451-459 (2016).
- Patti, G. J., Oscar, Y., Gary, S. Metabolomics: the apogee of the omics trilogy. Nat Rev Mol Cell Biol. 13 (4), 263-269 (2012).
- Nicholson, J. K., John, C. L. Metabonomics. Nature. 455 (7216), 1054-1056 (2008).
- Schnackenberg, L. K., Beger, R. D. Monitoring the health to disease continuum with global metabolic profiling and systems biology. Pharmacogenomics. 7 (7), 1077-1086 (2006).
- Pandey, S., Siddiqui, M. A., Azim, A., Sinha, N. Metabolic fingerprint of patients showing responsiveness to treatment of septic shock in intensive care unit. Magn Reson Mater Phys Biol Med. 36 (4), 659-669 (2023).
- Mamas, M., Dunn, W. B., Neyses, L., Goodacre, R. The role of metabolites and metabolomics in clinically applicable biomarkers of disease. Arch. Toxicol. 85, 5-17 (2011).
- Dunn, W. B., Broadhurst, D. I., Atherton, H. J., Goodacre, R., Griffin, J. L. Systems level studies of mammalian metabolomes: the roles of mass spectrometry and nuclear magnetic resonance spectroscopy. Chem Soc Rev. 40 (1), 387-426 (2011).
- Dettmer, K., Bruce, D. H. Metabolomics--a new exciting field within the" omics" sciences. Environ Health Perspect. 112 (7), A396-A397 (2004).
- Goodacre, R., Vaidyanathan, S., Dunn, W. B., Harrigan, G. G., Kell, D. B. Metabolomics by numbers: acquiring and understanding global metabolite data. Trends Biotechnol. 22 (5), 245-252 (2004).
- Lindon, J. C., Nicholson, J. K., Holmes, E., Everett, J. R. Metabonomics: metabolic processes studied by NMR spectroscopy of biofluids. Concepts Magn Reson Educ J. 12 (5), 289-320 (2000).
- Bernini, P., et al. Individual human phenotypes in metabolic space and time. J Proteome Res. 8 (9), 4264-4271 (2009).
- Nicholson, J. K., et al. Metabolic phenotyping in clinical and surgical environments. Nature. 491 (7424), 384-392 (2012).
- Vinayavekhin, N., Homan, E. A., Saghatelian, A. Exploring disease through metabolomics. ACS Chem Biol. 5 (1), 91-103 (2010).
- Dunn, W. B., Ellis, D. I. Metabolomics: current analytical platforms and methodologies. TrAC Trends Anal Chem. 24 (4), 285-294 (2005).
- Dunn, W. B., Bailey, N. J. C., Johnson, H. E. Measuring the metabolome: current analytical technologies. Analyst. 130 (5), 606-625 (2005).
- Bingol, K. Recent advances in targeted and untargeted metabolomics by NMR and MS/NMR methods. High-throughput. 7 (2), 9 (2018).
- Emwas, A. H. M. The strengths and weaknesses of NMR spectroscopy and mass spectrometry with particular focus on metabolomics research. Methods Mol Biol. 1277, 161-193 (2015).
- Markley, J. L., et al. The future of NMR-based metabolomics. Curr Opin Biotechnol. 43, 34-40 (2017).
- Marchand, J., Martineau, E., Guitton, Y., Dervilly-Pinel, G., Giraudeau, P. Multidimensional NMR approaches towards highly resolved, sensitive and high-throughput quantitative metabolomics. Curr Opin Biotechnol. 43, 49-55 (2017).
- Eghbalnia, H. R., et al. Increasing rigor in NMR-based metabolomics through validated and open source tools. Curr Opin Biotechnol. 43, 56-61 (2017).
- Vignoli, A., et al. High-throughput metabolomics by 1D NMR. Angew Chem Int Ed. 58 (4), 968-994 (2019).
- Sundekilde, U. K., Eggers, N., Bertram, H. C. NMR-based metabolomics of food. Methods Mol Biol. 2037, 335-344 (2019).
- Garcia-Perez, I., et al. Identifying unknown metabolites using NMR-based metabolic profiling techniques. Nat Protoc. , 1-30 (2020).
- Dona, A. C., et al. A guide to the identification of metabolites in NMR-based metabonomics/metabolomics experiments. Comput Struct Biotechnol J. 14, 135-153 (2016).
- Siddiqui, M. A., Pandey, S., Azim, A., Sinha, N., Siddiqui, M. H. Metabolomics: an emerging potential approach to decipher critical illnesses. Biophys Chem. 267, 106462 (2020).
- McNicholas, B. A., et al. Impact of early acute kidney injury on management and outcome in patients with acute respiratory distress syndrome: a secondary analysis of a multicenter observational study. Crit. Care Med. 47 (9), 1216-1225 (2019).
- Ambruso, S. L., et al. Inter-organ communication in homeostasis and disease: Lung metabolomics after ischemic acute kidney injury reveals increased oxidative stress, altered energy production, and ATP depletion. Am J Physiol Lung Cell Mol Physiol. 321 (1), L50 (2021).
- Viswan, A., et al. Metabolomics based predictive biomarker model of ARDS: A systemic measure of clinical hypoxemia. PloS One. 12 (11), e0187545 (2017).
- Metwaly, S. M., Brent, W. W. Systems biology ARDS research with a focus on metabolomics. Metabolites. 10 (5), 207 (2020).
- Stringer, K. A., et al. Metabolic consequences of sepsis-induced acute lung injury revealed by plasma 1H-nuclear magnetic resonance quantitative metabolomics and computational analysis. Am J Physiol Lung Cell Mol Physiol. 300 (1), L4-L11 (2011).
- Singh, A., Siddiqui, M. A., Pandey, S., Azim, A., Sinha, N. Unveiling Pathophysiological Insights: Serum Metabolic Dysregulation in Acute Respiratory Distress Syndrome Patients with Acute Kidney Injury. J Proteome Res. 23 (10), 4216-4228 (2024).
- Slupsky, C. M. NMR-based analysis of metabolites in urine provides rapid diagnosis and etiology of pneumonia. Biomark Med. 4 (2), 195-197 (2010).
- Siddiqui, M. A., et al. NMR spectroscopy-based analysis of gallstones of cancerous and benign gallbladders from different geographical regions of the Indian subcontinent. Plos One. 18 (6), e0286979 (2023).
- Li, J., et al. 1HNMR-based metabolomic profile of rats with experimental acute pancreatitis. BMC Gastroenterol. 14, 1-7 (2014).
- Mao, H., et al. Systemic metabolic changes of traumatic critically ill patients revealed by an NMR-based metabonomic approach. J Proteome Res. 8 (12), 5423-5430 (2009).
- Stringer, K. A., Jones, A. E., Puskatich, M. A., Karnovsky, A., Serkova, N. J. 1H-nuclear magnetic resonance (NMR)-detected lipids associated with apoptosis differentiate early acute respiratory distress syndrome (ARDS) from sepsis. C63. LUNG INJURY AND REPAIR: TWO TO TANGO. Am J Resp Crit Care Med. 189, A5000 (2014).
- Viswan, A., Singh, C., Kayastha, A. M., Azim, A., Sinha, N. An NMR based panorama of the heterogeneous biology of acute respiratory distress syndrome (ARDS) from the standpoint of metabolic biomarkers. NMR Biomed. 33 (2), e4192 (2020).
- Singh, C., et al. Metabolic profiling of human lung injury by 1 H high-resolution nuclear magnetic resonance spectroscopy of blood serum. Metabolomics. 11, 166-174 (2015).
- Pandey, S., Siddiqui, M. A., Trigun, S. K., Azim, A., Sinha, N. Gender-specific association of oxidative stress and immune response in septic shock mortality using NMR-based metabolomics. Mol Omics. 18 (2), 143-153 (2022).
- Nagana, G. A., Gowda, Y. N., Raftery, D. Expanding the limits of human blood metabolite quantitation using NMR spectroscopy. Anal Chem. 87 (1), 706-715 (2015).
- Gowda, G. A. N., Raftery, D. Quantitating metabolites in protein precipitated serum using NMR spectroscopy. Anal Chem. 86 (11), 5433-5440 (2014).
- Gowda, G. A. N., Raftery, D. NMR-based metabolomics. Adv Exp Med Biol. 1280, 19-37 (2021).
- Xia, J., Psychogios, N., Young, N., Wishart, D. S. MetaboAnalyst: a web server for metabolomic data analysis and interpretation. Nucleic Acids Res. 37 (suppl_2), W652-W660 (2009).
- orbacıoğlu, &. #. 3. 5. 0. ;. K., Aksel, G. Receiver operating characteristic curve analysis in diagnostic accuracy studies: A guide to interpreting the area under the curve value. Turk J Emerg Med. 23 (4), 195 (2023).
- Ulrich, E. L., et al. BioMagResBank. Nucleic Acids Res. 36 (suppl_1), D402-D408 (2007).
- Nyamundanda, G., Gormley, I. C., Fan, Y., Gallagher, W. M., Brennan, L. MetSizeR: selecting the optimal sample size for metabolomic studies using an analysis based approach. BMC bioinformatics. 14, 1-8 (2013).
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat Protoc. 2 (11), 2692 (2007).
- Dona, A. C., et al. Precision high-throughput proton NMR spectroscopy of human urine, serum, and plasma for large-scale metabolic phenotyping. Anal Chem. 86 (19), 9887-9894 (2014).
- Ala-Korpela, M. Potential role of body fluid 1H NMR metabonomics as a prognostic and diagnostic tool. Expert Rev Mol Diagn. 7 (6), 761-773 (2007).
- Takeda, I., et al. Understanding the human salivary metabolome. NMR Biomed. 22 (6), 577-584 (2009).
- Callejon-Leblic, B. e. m., García-Barrera, T., Pereira-Vega, A., Gómez-Ariza, J. L. Metabolomic study of serum, urine and bronchoalveolar lavage fluid based on gas chromatography mass spectrometry to delve into the pathology of lung cancer. J Pharm Biomed Anal. 163, 122-129 (2019).
- Van Oort, P. M. P., et al. Exhaled breath metabolomics for the diagnosis of pneumonia in intubated and mechanically-ventilated intensive care unit (ICU)-patients. Int J Mol Sci. 18 (2), 449 (2017).
- Serkova, N. J., Niemann, C. U. Pattern recognition and biomarker validation using quantitative 1H-NMR-based metabolomics. Expert Rev Mol Diagn. 6 (5), 717-731 (2006).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation times. Rev Sci Instrum. 29 (8), 688-691 (1958).
- Xi, Y., Rocke, D. M. Baseline correction for NMR spectroscopic metabolomics data analysis. BMC bioinformatics. 9, 1-10 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır