Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Serbestçe Hareket Eden Zebra Balıklarında Anestezisiz Kalp Atışı Ölçümleri
Bu Makalede
Özet
Çalışma, hareketli zebra balıklarında anestezisiz kalp atışı ölçümleri için teknoloji geliştirmeyi amaçlamaktadır. Yaklaşımımız, kısa dalga-kızılötesi görüntüleme ve kalbin makine öğrenimi tabanlı takibini birleştirir. Zebra balığı modeli üzerine çok çeşitli çalışmalara uygun, invaziv olmayan, etiketsiz ve kullanıcı dostu bir tekniktir.
Özet
Zebra balığı (Danio rerio), insanlara genetik benzerliği ve non-invaziv kardiyovasküler çalışmaları kolaylaştıran şeffaf embriyonik evresi nedeniyle fizyolojik, farmakolojik ve toksikolojik araştırmalarda yaygın olarak kullanılan bir model organizmadır. Bununla birlikte, zebra balıklarında kalp atış hızı değerlendirmesi için mevcut yöntemler genellikle konuyu hareketsiz hale getirmek için anesteziye dayanır ve veri doğruluğunu ve tekrarlanabilirliğini tehlikeye atan fizyolojik değişiklikler getirir. Bu çalışma, kardiyovasküler araştırmalarda kritik bir sınırlamayı ele alan, serbestçe hareket eden zebra balığı larvalarında kalp atışını ölçmek için yeni, anestezisiz bir teknik sunmaktadır. Önerilen yaklaşım, kısa dalga kızılötesi görüntülemeyi makine öğrenimi tabanlı kalp takibi ile entegre ederek, hareketsiz hale getirilmemiş örneklerde hassas ve sürekli kardiyak aktivite izlemeye olanak tanır. Kalp bölgesini tespit etmek için evrişimli bir sinir ağı eğitildi ve kalp atış hızını belirlemek için görüntü dizilerinden bir fotopletismografik sinyal çıkarıldı. Deneysel doğrulama, yöntemin güvenilirliğini ve tutarlılığını birden fazla test koşulunda gösterdi. Metodolojinin önemli bir yararı, zebra balığının doğal fizyolojik durumunu koruma ve strese bağlı artefaktları en aza indirme yeteneğidir. Bu non-invaziv, etiketsiz teknik, kardiyovasküler fizyoloji, ilaç kardiyotoksisitesi ve çevresel toksikoloji çalışmaları için önemli avantajlar sunar ve zebra balığının biyomedikal araştırmalar için bir model olarak potansiyel uygulamalarını genişletir.
Giriş
Küçük bir cyprinid balığı olan zebra balığı (Danio rerio), küçük boyutu, yüksek üreme oranı ve genetik manipülasyon kolaylığı nedeniyle önemli bir model organizma haline gelmiştir 1,2,3. Şeffaf zebra balığı embriyolarında kalp atış hızının değerlendirilmesi fizyoloji, embriyoloji, toksikoloji ve diğer alanlarda giderek daha fazla kullanılmaktadır 4,5,6,7,8. Bir yandan, bu fayda, zebra balığı genomunun insan kardiyovasküler hastalıklarıyla ilişkili genleri içermesi9 ve Danio rerio kalbinin insanlarla benzer yapıları ve sinyal yollarını paylaşması10,11 gerçeğinden kaynaklanmaktadır. Zebra balığını kalp gelişimi ve hastalıklarını incelemek için paha biçilmez bir model yapar 11,12,13. Öte yandan, zebra balığı kalp atış hızı dış etkilere karşı hassastır, bu da onu tedavi edilmiş ve tedavi edilmemiş balıklarda kalp fonksiyonlarını karşılaştırarak fizyolojik ve toksikolojik çalışmalar için mükemmel bir model haline getirir 7,8,14.
Şeffaf balık embriyolarında kalp atış hızını değerlendirmek için non-invaziv optik yöntemlerin geliştirilmesinde önemli ilerleme kaydedilmiştir15,16. Bu teknikler, büyük örneklem boyutlarından hızlı veri toplama avantajı sunar. Sonuç olarak, balık embriyolarında kalp atış hızı değerlendirmesi için tam otomatik yaklaşımlar geliştirilmiştir 4,5,6,17.
Bununla birlikte, bazı sınırlamalar şu anda bu tekniklerin kullanımını 3-4 dpf periyodu ile sınırlamaktadır. İlk sınırlama, balık gövdesinin pigmentasyonundan dolayı şeffaflık kaybıdır. İkincisi ise embriyoların zamanla hareket kabiliyetinin artmasıdır. Zebra balığının optik yaklaşımların kullanılabileceği erken gelişim döneminin uzatılması, faydalarını artıracak ve uzun vadeli deneysel tasarımların kardiyomiyopati, konjenital kalp kusurları ve zaman içindeki etkilerin dinamiklerini izlemek de dahil olmak üzere kardiyovasküler sistem üzerindeki çeşitli etkileri incelemesine olanak sağlayacaktır. Grubumuz kısa süre önce 900-1700 nm18 kısa dalga kızılötesi aralığında görüntüleme kullanarak şeffaflık kaybı konusunu ele aldı. Bu makale, embriyo hareketliliği konusunu ele almaya odaklanmaktadır.
Tipik olarak, trikasil metansülfonat (MS-222) gibi anestezikler, görüntülemeden önce serbest yüzen balık embriyolarını ve larvalarını hareketsiz hale getirmek için kullanılır 14,19,20. Bununla birlikte, MS-222, diğer anestezikler21,22 gibi kalp atış hızını23 önemli ölçüde azaltır. Kalp fonksiyonunda gözlenen değişikliklerin deneysel tedaviden mi, anesteziden mi yoksa ikisi arasındaki etkileşimden mi kaynaklandığını ayırt etmek zorlaşır. Embriyonun düşük hareketlilik süresini uzatmanın bir başka yolu da erken gelişim sırasında sıcaklığı azaltmaktır8. Bununla birlikte, bu yaklaşım her zaman araştırma hedefleriyle uyumlu değildir ve kayıt süresini yalnızca asgari düzeyde uzatır.
Bu çalışmada, kalp atış hızı kaydı sırasında embriyo hareketliliğini ele almak için yeni bir yöntem sunuyoruz. Serbest yüzen zebra balığı embriyolarının kayıtlarında kalbin ilgi alanını belirlemek için evrişimli bir sinir ağı eğittik. Bu alandaki piksel yoğunluğundaki periyodik değişim, daha sonra kalp atış hızını hesaplamak için kullanılan fotopletismogramı (PPG) türetmek için kullanılır. Geliştirilen masaüstü uygulaması AutoHR, hem sinir ağı eğitimini hem de görüntü yığını işlemeyi kullanarak kullanım kolaylığı ve protokol tekrarlanabilirliği sağladı.
Protokol
Zebra balığı, yerleşik ZFIN protokollerine göre yetiştirildi ve yetiştirildi24. Tüm prosedürler, Rusya Bilimler Akademisi Benzersiz Enstrümantasyon Bilimsel ve Teknolojik Merkezi (STC UI RAS) Biyoetik Komitesi, 08/21/2024 tarihli protokol #3/24 tarafından onaylanmıştır ve STC UI RAS'ın zebra balığı bakım yönergelerini takip etmektedir. Bireysel versiyonlar için kılavuzlar istek üzerine temin edilebilir.
1. Ölçüm için ekipmanın hazırlanması
- Ekipman seçimi
- Bir ışık kaynağı seçin: Yakın kızılötesi aralığında, özellikle 800 nm'den itibaren yayılan ve minimum 3 W güç çıkışı olan bir LED ışık kaynağı seçin. Bu çalışmada, 940 nm merkezi dalga boyuna ve 40 nm bant genişliğine sahip LED kullanılmıştır.
- Bir video kamera seçin: Işık kaynağının yaydığı dalga boyu aralığına duyarlı bir sensörle donatılmış ve en az 60 fps kare hızına sahip bir kamera seçin. Piksel aralığı p'yi, kısa kenarı h boyunca sensör boyutunu ve kare hızını belirlemek için kameranın veri sayfasına bakın. Bu çalışmada kameranın piksel aralığı p = 5 μm ve sensör genişliği h = 5.12 mm'dir.
- Larva B'nin uzunluğundan en az 1,5 kat daha büyük bir agaroz küf boyutu seçin. Sağlanan ifadeleri kullanarak optik sistemin izin verilen minimum ve maksimum büyütme oranlarını hesaplayın. Mmax ≤ Mmin. Bu koşul karşılanmazsa, daha büyük h ve/veya daha küçük ve/veya daha küçük S değerine sahip bir kamera seçin.
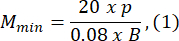

burada Smax , kalıp setinin en büyük agaroz kalıbının uzunluğudur. Çeşitli ebatlarda bir dizi kalıp hazırlanabilir. Bu çalışmada S = 10 mm kullanılmıştır.
NOT: Denklemler, zebra balığının optik şema geometrisine ve vücut oranlarına dayalı olarak türetilmiştir. Ayrıntılı açıklamalar Tartışma bölümünde verilmiştir. - Bir lens seçin: Bu çalışmada, MOSmin = 0,4x ile MOSmax = 1,5x arasında değişen değişken büyütme oranlarına, maksimum fmax = 150 mm odak uzaklığına ve mm çalışma mesafesine sahip bir optik sistem kullanılmıştır.
NOT: x sembolü, optik sistemin büyütme faktörünü belirtir.- İzin verilen aralıkta (M min - M maks.) kalan bir büyütme aralığına (MOSmin - MOSmax) sahip değişken büyütmeli mikroskop tipi bir sistem seçin. MOSmax için maksimum f max odak uzaklığını ve karşılık gelen çalışma mesafesini L belirlemek için lens veri sayfasına bakın.
- fmax ≤ Mmax • L koşulunun karşılandığından emin olun. Bu koşul karşılanmazsa, farklı f max ve/veya L'ye sahip bir lens seçin. Kamera ve lensin montaj tipinin uyumlu olduğundan emin olun.
- Bilinen bir perdeye ve en az toplam uzunluğa sahip bir test nesnesi (cetvel veya ızgara) seçin. Bilinen bir perdeye ve toplam boyutu en az Smaks olan bir cetvel veya ızgara şeklinde bir test nesnesi seçin.
- Görüntü elde etmek için bir standın montajı (Şekil 1).
- Yuvarlak çubuğu sabit bir tabana monte edin. Lensi kameraya takarak görüntüleme sistemini monte edin. Görüntüleme kanalını, giriş penceresi yukarı bakacak şekilde çubuğa monte edin.
- Odaklama mekanizmasını çubuğa monte edin. Odaklama mekanizmasına en az 30 mm çapında bir cam çalışma yüzeyine sahip bir sahne takın.
- Aydınlatıcıyı monte edin: Verimli ısı dağılımı sağlamak için LED'i metal bir alt tabakaya yerleştirin. LED'den 30 mm mesafede 23 mm çapında ve 30 mm odak uzaklığına sahip dışbükey düz bir kolimatör lensi yerleştirin.
- Aydınlatıcıyı, lens aşağı bakacak şekilde çalışma yüzeyinin üzerine yerleştirerek, üç eksenli ayarlanabilir bir braket kullanarak sahneye monte edin.
- Aydınlatıcıyı ve görüntüleme sistemini ayarlayın. Aydınlatıcıyı görüntüleme sistemi ile eş eksenli olarak konumlandırın. Aydınlatıcıyı açın ve kamerayı bilgisayara bağlayın.
- Kamera uygulamasını başlatın ve kamera kılavuzundaki talimatları izleyerek önizleme modunu etkinleştirin. Test nesnesini sahne alanına yerleştirin. Boyutun görüş alanına tamamen sığdığından emin olmak için mikroskobun çalışma mesafesini ve büyütmesini ayarlayın.
NOT: Agaroz kalıbının tam olarak görselleştirilmesini sağlamak için boyut, çerçevenin kısa kenarına tamamen sığmalıdır. - Görüntünün odaklandığından ve aydınlatıcının konumunun eşit şekilde aydınlatıldığından emin olmak için sahnenin konumunu görüntüleme sistemine göre ayarlayın.
- Agaroz küfünün hazırlanması
- 20 mL damıtılmış suyu 0.4 g düşük erimiş agaroz ile karıştırın ve karışımı agaroz tamamen eriyene kadar ısıtın. Örneğin, 700 W gücünde 20 saniye boyunca bir mikrodalgada.
- Agaroz kalıbını şekillendirin (Yöntem 1): Isıtılmış çözeltiyi Petri kabına dökün ve 1,5-2 mm'lik bir çözelti yüksekliği sağlayın. Petri kabını agaroz çözeltisi katılaşana kadar soğutun. 17 °C sıcaklıkta bu işlem yaklaşık 5 dakika sürer. Bir kırtasiye bıçağı kullanarak kenar uzunluğuna sahip bir kare kesin ve belirtilen alan içindeki agaroz tabakasını dikkatlice çıkarın.
- Agaroz kalıbını şekillendirin (Yöntem 2): 10 mm'lik (S) × (S) × oluşturun, plastikten formlar. Basılı formu kare tarafı gelecek şekilde bir Petri kabına yerleştirin ve 1.5-2 mm'lik bir çözelti yüksekliği sağlayacak şekilde ısıtılmış çözelti ile doldurun. Petri kabını agaroz çözeltisi katılaşana kadar soğutun ve formu katılaşmış çözeltiden dikkatlice çıkarın.
NOT: Formlar bir 3D yazıcı kullanılarak kolayca yazdırılabilir.
2. Görüntü edinme
- Görüntü yakalama ayarlarını yapın.
- Fotoğraf makinesini bilgisayara bağlayın. Kamera uygulamasını başlatın ve önizleme modunu etkinleştirin. Aydınlatıcıyı açın.
NOT: Kullanılacak agaroz kalıbının boyutu adım 1.3.3'tekinden farklıysa, adım 1.3.3'ü tekrarlayın ve bundan sonra test nesnesini sahneden çıkarın. - Zebra balığı larvalarını bir Pasteur pipeti ile bir agaroz kalıba yerleştirin. Sahneye bir agaroz kalıbı yerleştirin. Maruz kalma süresi ve aydınlatıcı gücünün bir kombinasyonunu ayarlayarak larva kafasının neredeyse tamamen aydınlatılmasını sağlayın (Şekil 2A-C). Maruz kalma süresi 1,5 ms'yi geçmemelidir.
NOT: Bu çalışmada, döllenmeden 12 ila 21 gün sonra (dpf) yaşlanan yabani tip zebra balığı larvaları için veriler sunuyoruz.
- Fotoğraf makinesini bilgisayara bağlayın. Kamera uygulamasını başlatın ve önizleme modunu etkinleştirin. Aydınlatıcıyı açın.
- Görüntü alımı gerçekleştirin
- Kare hızını en az 60 fps'ye ayarlayın. Görüntü bit derinliğini 12 bit olarak ayarlayın. En az 10 saniye boyunca görüntü alın. Çerçeve adlandırma biçimini yyyy_mm_dd_hh_ss_mm_mss olarak ayarlayın ve dosya türü BMP değil, PNG veya TIFF olmalıdır.
3. Sinir ağını etiketleme için eğitme
- Etiketleme için verilerin hazırlanması
NOT: Görüntü Etiketleyici Uygulaması, MATLAB'da etiketleme işlemi açıklanmıştır.- Alınan en az 256 görüntüyü ayrı bir dizinde toplayın. Uygulamayı çalıştırın. Dosyaları İçe Aktar'a gidip > Dosyadan İçe Aktar'a giderek ve belirtilen dizindeki tüm görüntüleri seçerek görüntüleri içe aktarın.
- Ağ etiketleme için sınıflar oluşturun. ROI Etiketleri sekmesinde Etiket'e tıklayın, Etiket Adı alanına gövdeyi girin, etiket türü için açılır menüden Piksel Etiketi'ni seçin ve Tamam'a tıklayın. ROI Etiketleri sekmesinde Etiket'e tıklayın, Etiket Adı alanına göz girin, etiket türü için açılır menüden Piksel Etiketi'ni seçin ve Tamam'a tıklayın. ROI Etiketleri sekmesinde Etiket'e tıklayın, Etiket Adı alanına balık girin, etiket türü için açılır menüden Dikdörtgen'i seçin ve Tamam'a tıklayın.
- Çerçevelerin etiketlenmesi
- ROI Etiketleri sekmesinde, daha önce oluşturulan ek açıklama sınıfını, gözü seçin. Farenin sol düğmesini kullanarak çevresi boyunca noktalar yerleştirerek numunenin bir gözünü ana hatlarıyla belirtin. Gözün ek açıklamasını tamamlamak için, anahattın başlangıç noktasına tıklayın (Şekil 3B).
- Numunenin başka bir gözünü adım 3.1.2'de açıklandığı gibi ana hatlarıyla belirtin.
- ROI Etiketleri sekmesinde, oluşturulan ek açıklama sınıfını, gövdeyi seçin. Farenin sol düğmesini kullanarak çevresi boyunca noktalar yerleştirerek, gözler hariç numunenin gövdesini ana hatlarıyla belirtin. Gözün ek açıklamasını tamamlamak için, Anahattın Başlangıç Noktasına tıklayın.
- ROI Etiketleri sekmesinde, daha önce oluşturulan ek açıklama sınıfı olan fish'i seçin. Dikdörtgen bir sınırlayıcı kutu çizerek numunenin tüm gövdesini ana hatlarıyla belirtin (Şekil 4). Bunu yapmak için, farenin sol tuşu ile istenen dikdörtgenin Bir Köşesine tıklayın, ardından dikdörtgen balığı tamamen kaplayana kadar düğmeyi basılı tutarken imleci sürükleyin.
- LABEL (ETİKET) sekmesinde Export > To File (Dosyaya Aktar ) seçeneğini tıklatarak anahatları images adlı yeni bir dizine kaydedin.
- Sinir Ağı Eğitimi için Veri Kümelerinin Hazırlanması
- MATLAB'ı başlatın. DatasetsPreparation.m betik dosyasını (Ek Dosya 1) açmak için Aç'ı seçin > Açın.
- Çalıştır'ı tıklatarak komut dosyasını çalıştırın. Açılan pencerede, seviyelendirilmiş görüntüleri içeren dizini, PixelLabelData klasörünü ve adım 3.2.5'te dışa aktarılan gTruth.mat dosyasını seçin.
NOT: Komut dosyası yürütme işlemi tamamlandıktan sonra, iki klasör - RPN Eğitimi ve CNN Eğitimi - otomatik olarak oluşturulacaktır. Sonraki sinir ağı eğitimi için gereklidirler. Bu klasörlerin içeriğini değiştirmeyin.
4. Kalp tespiti için sinir ağlarının eğitilmesi
NOT: Bu adım, belirli bir yaş ve görüntüleme durumu için bir kez gerçekleştirilir. NVIDIA GPU, işlemeyi önemli ölçüde hızlandırdığı için eğitim için şiddetle tavsiye edilir.
- AutoHR uygulamasını başlatın. Bölge Teklif Ağı Eğitimi sekmesine gidin. Dizin Seç'e tıklayın ve adım 3.3.2'de oluşturulan RPN Eğitimi klasörünü seçin. Eğitimi Başlat'a tıklayın.
NOT: Eğitimin tamamlanmasının ardından AutoHR.exe dosyası ile aynı dizinde rpn_model.pt adında bir model dosyası oluşturulacaktır. Bu dosya, daha fazla görüntü yığını işleme için gereklidir. - Evrişimli Sinir Ağı'nı eğitmek için Evrişimli Sinir Ağı Eğitimi sekmesine gidin. Dizin Seç'e tıklayın ve adım 3.3.2'de oluşturulan CNN Eğitim klasörünü seçin. Eğitimi Başlat'a tıklayın.
NOT: Eğitimin tamamlanmasının ardından AutoHR.exe dosyası ile aynı dizinde model.pt adlı bir model dosyası oluşturulacaktır. Bu dosya, daha fazla görüntü yığını işleme için gereklidir.
5. Kalp atış hızı ölçümü
- 2. adımda açıklandığı gibi bir dizi görüntü kaydedin. Büyütme, pozlama süresi ve aydınlatma gibi görüntüleme koşullarının sinir ağını eğitmek için kullanılanlarla aynı olduğundan emin olun.
- AutoHR uygulamasını başlatın. İşleniyor sekmesine gidin. Modelleri Seç'e tıklayarak eğitilen sinir ağı modellerini içeren dizini seçin. Alınan görüntüleri analiz üzere içe aktarmak için Dosya Seç'e tıklayın. Dışa aktarma yolu otomatik olarak belirtilir, ancak Dışa Aktarma Yolunu Seç'e tıklayarak bunu değiştirebilirsiniz. Analize başlamak için İşlem'e tıklayın.
NOT: İşlem tamamlandığında, kalp atış hızı değeri AutoHR arayüzündeki Kalp Atış Hızı alanında görünecektir. Dışa aktarılan klasör, kalp atış hızı değerlerini (.xlsx), PPG'yi (.xlsx), dizinin ilk karesini ve ilk kare (.png) için vücut ve göz maskelerini içerecektir.
6. Algoritma sonuçlarının doğrulanması
- Aşağıda açıklandığı gibi hareketsiz bir balıkla test yapın.
- Larvaları 0.168 mg / L MS-222 solüsyonu ile 1 dakika boyunca uyuşturun. Adım 2'de açıklandığı gibi anestezi uygulanmış bir numunenin görüntü yığınını elde edin. Görsel gözlem yoluyla kalp atış hızı sayımı yapın.
- İK yazılımını 5. adımda açıklandığı gibi kullanın. Birkaç örnek için adımları tekrarlayın. Elde edilen kalp atış hızı değerlerinin tüm bireyler için istenen doğrulukta tutarlı olup olmadığını doğrulayın.
- Testi aşağıda açıklandığı gibi bir mobil bireysel ve provokasyon testi ile gerçekleştirin.
- Adım 2'de açıklandığı gibi anestezi uygulanmamış bir numunenin görüntü yığınını elde edin. Kalp atış hızını etkileyen bilinen bir uyaranı kullanarak, dizinin kaydedildiği kişiyle bir provokasyon testi yapın. Çalışma, 5 mg / L konsantrasyonlarına kadar su tuzlanması için sonuçlar sunmaktadır.
- Provokasyon testinden sonra 2. adımda açıklandığı gibi aynı numunenin bir görüntü yığınını elde edin. HR yazılımıyla yapılan her iki deneyde de kalp atış hızını 5. adımda açıklandığı gibi belirleyin. Kalp atış hızında gözlenen değişikliklerin provokasyon testinin bilinen etkileriyle uyumlu olup olmadığını doğrulayın.
Sonuçlar
Zebra balığının 12 dpf'deki kalp atış hızı, yukarıda açıklanan protokol kullanılarak belirlendi (Ek Video 1). Videolar, serbest yüzen zebra balığı larvalarının bir dizi görüntüsünü, önerilen protokol kullanılarak bu dizilerden türetilen bir fotopletismogramı ve fotopletismogramdan hesaplanan karşılık gelen kalp atış hızını içerir.
Etiketlenmiş veriler, eğitim sırasında 3:2:1 oranında rastgele eğitim, t...
Tartışmalar
Bu çalışmada, serbest yüzen zebra balığı larvalarının kalp atışlarını ölçmek için deneysel bir protokol sunuyoruz. Bu yaklaşımı, etkinliğini gösteren çeşitli deneylerle değerlendirdik. Önerilen yöntemin temel bileşenleri hem donanım hem de yazılım çözümlerini içerir. İlk olarak, daha önce gösterildiği gibi, pigmentasyonla ilgili sorunları önleyen ve doku şeffaflığını artıran, doğru kalp atışı belirlemeyi kolaylaştıran görüntüleme iç...
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışmasını açıklamıştır.
Teşekkürler
Bu çalışma, STC UI RAS'ın Federal Devlet Görev Programı (FFNS-2025-0008) tarafından desteklenmiştir. Bu çalışma, STC UI RAS'ın [http:// https://ckp.ntcup.ru/en/] Toplu Kullanım Merkezi'nin ekipmanı kullanılarak gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Low melting agarose | Biozym | 850111 | |
| Table salt | Pegasus | N/A | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | MS-222 |
| Equipment | |||
| Base with rod | Altami | SM-U1 | |
| Collimator lens | JLLSCMGGX | Focal length 30 mm | |
| Focusing mechanism | Altami | SM-12 | D=76 mm |
| LED | Cree | TR-3535IR-3W | |
| Lens | SFK Security | C-Mount, F1.6, 1/3”, | |
| Near infrared camera | ToupTek | SWIR1300KMA | |
| Pasteur pipette | PE-LD | 149293 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Plastic forms | N/A | N/A | Made by 3D printing |
| Power supply | Unit-T | UTP3300TFL-II | |
| Stage | N/A | N/A | Made by 3D printing |
| Stationery knife | ErichKrause | 19145 | |
| Test object | Wally Sky | MS-1-EB | |
| Software | |||
| EfficientDet | N/A | N/A | https://github.com/rwightman/efficientdet-pytorch |
| EfficientNet-b0 model | N/A | N/A | https://arxiv.org/abs/1905.11946 |
| Google API Client | N/A | Google API Client is a Python client library for Google's discovery-based APIs. https://github.com/googleapis/google-api-python-client | |
| Hardware | |||
| Multi-scale attention network | N/A | N/A | https://arxiv.org/abs/2209.14145 |
| NVIDIA DIGITS | NVIDIA | N/A | NVIDIA DIGITS is a wrapper for Caffe that provides a graphical web interface. https://developer.nvidia.com/digits |
| NVIDIA GPU | NVIDIA | N/A | An NVIDIA GPU is needed as some of the software frameworks below will not work otherwise. https://www.nvidia.com |
| OpenCV | Intel | N/A | OpenCV is a library for computer vision. https://opencv.org |
| Python | Python Software Foundation | N/A | Python is a programming language. https://www.python.org |
Referanslar
- Fontana, B. D., Mezzomo, N. J., Kalueff, A. V., Rosemberg, D. B. The developing utility of zebrafish models of neurological and neuropsychiatric disorders: A critical review. Exp Neurol. 299 (Pt A), 157-171 (2018).
- Chen, X., Li, Y., Yao, T., Jia, R. Benefits of zebrafish xenograft models in cancer research. Front Cell Dev Biol. 9, 616551 (2021).
- Lai, K. P., Gong, Z., Tse, W. K. F. Zebrafish as the toxicant screening model: Transgenic and omics approaches. Aquat Toxicol. 234, 105813 (2021).
- Pylatiuk, C., et al. Automatic zebrafish heartbeat detection and analysis for zebrafish embryos. Zebrafish. 11 (4), 379-383 (2014).
- Krishna, S., Chatti, K., Galigekere, R. R. Automatic and robust estimation of heart rate in zebrafish larvae. IEEE Trans Auto Sci Eng. 15 (3), 1041-1052 (2018).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Sci Rep. 10 (1), 2046 (2020).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
- Krylov, V., et al. Influence of hypomagnetic field on the heartbeat in zebrafish embryos. Front Physiol. 13, 1040083 (2022).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Ann Rev Gene. 46, 397-418 (2012).
- Bowley, G., et al. Zebrafish as a tractable model of human cardiovascular disease. Br J Pharmacol. 179 (5), 900-917 (2022).
- Brown, D. R., Samsa, L. A., Qian, L., Liu, J. Advances in the study of heart development and disease using zebrafish. J Cardiovas Dev Dis. 3 (2), 13 (2016).
- Dhillon, S. S., et al. Optimisation of embryonic and larval ECG measurement in Zebrafish for quantifying the effect of QT prolonging drugs. PLoS One. 8 (4), e60552 (2013).
- Bedrossiantz, J., et al. Heart rate and behavioral responses in three phylogenetically distant aquatic model organisms exposed to environmental concentrations of carbaryl and fenitrothion. Sci Total Environ. 865, 161268 (2023).
- Santoso, F., et al. An overview of methods for cardiac rhythm detection in zebrafish. Biomedicines. 8 (9), 329 (2020).
- Ling, D., Chen, H., Chan, G., Lee, S. M. Y. Quantitative measurements of zebrafish heartrate and heart rate variability: A survey between 1990-2020. Comp Biol Med. 142, 105045 (2022).
- Ferreira, M. S., et al. FEHAT: Efficient, large scale and automated heartbeat detection in medaka fish embryos. Bioinformatics. 40 (12), btae664 (2024).
- Volkov, M., et al. Optical transparency and label-free vessel imaging of zebrafish larvae in shortwave infrared range as a tool for prolonged studying of cardiovascular system development. Sci Rep. 12 (1), 20884 (2022).
- Machikhin, A., et al. Microscopic photoplethysmography-based evaluation of cardiotoxicity in whitefish larvae induced by acute exposure to cadmium and phenol. J Biophoton. 17 (9), e202400111 (2024).
- Machikhin, A. S., Burlakov, A. B., Volkov, M. V., Khokhlov, D. D. Imaging photoplethysmography and videocapillaroscopy enable noninvasive study of zebrafish cardiovascular system functioning. J Biophoton. 13 (7), e202000061 (2020).
- Denvir, M. A., Tucker, C. S., Mullins, J. J. Systolic and diastolic ventricular function in zebrafish embryos: Influence of norepenephrine, MS-222 and temperature. BMC Biotechnol. 8 (1), 1-8 (2008).
- Santoso, F., et al. Development of a simple ImageJ-based method for dynamic blood flow tracking in zebrafish embryos and its application in drug toxicity evaluation. Inventions. 4 (4), 65 (2019).
- Vieira, R. S. F., Sousa, D., Félix, L. M., Venâncio, C. A. S. Anaesthetic profile of thymol and menthol in zebrafish larvae model. Aquaculture and Fisheries. , (2024).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Azad, R., et al. Loss functions in the era of semantic segmentation: A survey and outlook. ArXiv. , (2023).
- Machikhin, A. S., et al. Combined optical and acoustic microscopy for non-invasive cardiovascular studies using zebrafish model. IEEE Trans Instrument Measurement. 74, 1-13 (2025).
- Slavin, A. E., Guryleva, A. V., Bukova, V. I., Shuman, L. A., Burlakov, A. B. Wavelet analysis of Photoplethysmogram in zebrafish larvaе cardiovascular system Study. , 1-5 (2024).
- Kumari, S., Singh, D. Phenylthiourea-mediated experimental depigmentation reduces seizurogenic response of pentylenetetrazol in zebrafish larva. J Pharm Toxicol Methods. 128, 107532 (2024).
- Xu, Y., et al. Highly sensitive response to the toxicity of environmental chemicals in transparent casper zebrafish. Sci Total Environ. 948, 174865 (2024).
- Vedder, V. L., et al. pyHeart4Fish: Chamber-specific heart phenotype quantification of zebrafish in high-content screens. Front Cell Dev Biol. 11, 1143852 (2023).
- Lane, S., More, L. A., Asnani, A. Zebrafish models of cancer therapy-induced cardiovascular toxicity. J Cardiovas Dev Dis. (2), 8 (2021).
- Maciag, M., Wnorowski, A., Mierzejewska, M., Plazinska, A. Pharmacological assessment of zebrafish-based cardiotoxicity models. Biomed pharmacother. 148, 112695 (2022).
- Krylov, V. V., et al. Non-invasive recording of heartbeats in Danio rerio and Daphnia magna to assess the toxicity of imidacloprid and glyphosate. Comp Biochem Physiol C Toxicol Pharmacol. 288, 110075 (2025).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır