A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Vibratome Sectioning للحفاظ على المحسن من التهندس الخلوي للجهاز الثدييات كورتي
In This Article
Summary
يوصف إجراء بسيط من vibratome sectioning الجهاز كورتي ، تليها المجهري ومبائر المناعية. يسمح هذا الإجراء للحفاظ على تحسن من التهندس الخلوي غرامة الجهاز الثدييات كورتي ، ويسمح بالتالي لتقدير دقيق لأنواع الخلايا.
Abstract
الجهاز الثدييات كورتي هو أمر غاية الخلوية فسيفساء من الشعر mechanosensory nonsensory والخلايا المساندة
(إعادة النظر في 1،2). التصور من هذه الفسيفساء الخلوية وغالبا ما يتطلب أن جهاز كورتي هو عبر مقطوع. على وجه الخصوص ، يمكن للعمود nonsensory دايترس والخلايا '، التي تقع النواة basally فيما يتعلق خلايا الشعر ، لا يمكن تصور دون sectioning عبر جهاز كورتي. ومع ذلك ، فإن التهندس الخلوي الحساسة للجهاز كورتي الثدييات ، بما في ذلك العمليات السيتوبلازمية الدقيقة للعمود والخلايا دايترس '، من الصعب الحفاظ على النسيجية من خلال إجراءات روتينية مثل البارافين والبرد sectioning ، والتي تتوافق مع معيار تقنيات تلطيخ المناعى.
هنا أصف إجراء بسيط وقوي يتألف من vibratome sectioning من القوقعة ، وتلطيخ المناعى من هذه المقاطع vibratome في جبل بأكمله ، تليها المجهري متحد البؤر. وقد استخدم هذا الإجراء على نطاق واسع لتحليل immunhistochemical أجهزة متعددة ، بما في ذلك الماوس برعم الطرف ، الزرد الأمعاء والكبد والبنكرياس ، والقلب (انظر 3-6 لأمثلة مختارة). بالإضافة إلى ذلك ، كان هذا الإجراء سوسسفول] لكل من التصوير وquantitificaton من عدد الخلايا في العمود أجهزة متحولة والتحكم في كورتي في كل من الأجنة والبالغين 7 الفئران. هذا الأسلوب ، ومع ذلك ، لا يستخدم حاليا على نطاق واسع لفحص الجهاز من الثدييات كورتي. يوصف المحتملة لهذا الإجراء لتوفير الحفاظ على حد سواء المعزز للالتهندس الخلوي غرامة الجهاز الكبار كورتي ، والسماح للالكمي لمختلف أنواع الخلايا.
Protocol
1. العزلة والتثبيت الداخلي للآذان
- لتحليل الزخرفة الخلوية في جهاز كورتي ، والموت ببطء نظموا مناسب الأجنة أو البالغين.
- تشريح الأذن خارج الكبسولة ، التي تحتوي على الأذن الغشائي الداخلي. في الماوس ، يمكن القيام به بسهولة على هذه الأجنة في الجنينية (E) في اليوم 14.5 وكبار السن ، والذي هو اليوم E0.5 التي تم الكشف عن المكونات المهبلية. ويتم إنجاز تشريح الأذن الكبسولة الاولى قطع الرأس وفتح الجمجمة في خط الوسط. إزالة المخ لفضح كل أذن (الشكل 1A). يمكن آذان الداخلية قصفت بها سليمة باستخدام ملقط (مثل دومون # 5 ، الشكل 1B). إذا كان التصوير جهاز كورتي ، وإزالة متأنية لجميع الأنسجة الضامة والعصبية المرتبطة كبسولة أذني ليست ضرورية.
- إصلاح الأذن الداخلية بأكملها من قبل الانغماس في بارافورمالدهيد 4 ٪ (PFA) مع هزاز لطيف في 4 درجات مئوية خلال الليل في 1.8 مل المسمار وتوج قارورة كرو أنبوب نونك ، أو غيرها من حاوية بحجم مناسب. وينبغي بذل PFA حل العذبة في DDH 2 0 ، ثم تخزينها في -20 درجة مئوية لحين الحاجة إليها.
- في اليوم التالي ، وغسل خارج تثبيتي ، مع ثلاثة تغييرات من الفوسفات مخزنة المالحة 1X (PBS). يمكن تخزينها في الأنسجة 1X PBS العقيمة لعدة أيام قد تصل إلى شهور حتى جاهزة للمعالجة. للأنسجة البالغين ، يزيل الكلس في EDTA 10 ٪ (0.27 م) في 4 درجات مئوية لمدة 5 أيام ، تليها الشطف وتخزينها في برنامج تلفزيوني 1X.
2. قطع المقاطع vibratome
- اعداد قليلة 4 ٪ نقطة ذوبان agarose في برنامج تلفزيوني 1X. إضافة نقطة انصهار منخفضة agarose لبرنامج تلفزيوني 1X والميكروويف حتى agarose في الحل. الحرص على أن الحل ليس أكثر من فقاعة -- تتخذ للخروج من دوامة الميكروويف دوريا وإلى المزيج. الحل في الحفاظ على درجة حرارة 55 مئوية حمام ماء حتى جاهزة للاستخدام.
- باستخدام ملقط ، إزالة الأذن الداخلية من حل PBS 1X والموقف في قاع القالب تضمين التقشير - A - واي. الماصة بعيدا 1X PBS أي فائض من العفن. ملء القالب لتغطية الأنسجة مع الكثير من 4 ٪ قليلة السائل نقطة الانصهار agarose (الشكل 2A).
- موقف الأذن الداخلية لsectioning في الطائرة المناسبة. وقد حصلت على مقاطع عرضية جيدة من الجهاز كورتي التي تقارب موقف كبسولة أذني كما لو كان قد تركها في موقعها الأصلي في الرأس وsectioning في الطائرة عرضية. لE14.5 الأجنة للبالغين ، والموقف في الأذن الداخلية بحيث يتم عرضها أفقيا ، مع القناة شبه الدائرية الجانبية مرئية (الشكل 2B). زاوية الأذن الداخلية بحيث شكلت الخط من الجانب الخلفي من الكبسولة أذني تقريبا بزاوية 45 درجة من الطائرة المقصود من sectioning (الشكل 2A ، B). عند عرض كبسولة أذني بحيث الجزء الظهري من الكبسولة أذني في أعلى ، يجب أن يكون موجودا بدوره القاعدية من القوقعة في أسفل (رأس السهم ، الشكل 2B) ويجب الأمامي شبه دائرية قناة (ASC) يكون على رأس (الشكل 2B).
- سوف Agarose وضعت في غضون 30 دقيقة RT. نقل التقشير بعيدا قوالب جزءا لا يتجزأ من النسيج تحتوي على 4 درجات مئوية حتى جاهزة للمقطع. إذا كان سيتم وضع sectioning قبالة حتى اليوم التالي ، إضافة 1X PBS لتغطية agarose في قالب وتخزينها في مربع تحتوي على مناشف ورقية رطبة غارقة في برنامج تلفزيوني 1X.
- قشر بعيدا قالب من البلاستيك. باستخدام شفرة حلاقة ، قطع مربع تحتوي على أنسجة agarose الأذن الداخلية. الحرص على ضمان ان الطائرة من الباب مستقيم مواز وعلى الجانب الآخر من كتلة ، والتي سوف يكون السطح الذي يتم لصقها كتلة agarose أسفل. منذ agarose لا اختراق الأنسجة ، لا تقليم agarose الكثير من أنحاء الأنسجة ، بحيث سيكون جيدا الأنسجة التي تدعمها.
- استخدام superglue تعلق الكتلة إلى سطح القطع.
- في المقطع سمك 4-10 ميكرون بواسطة vibratome. حفظ المقاطع في صحن الأنسجة الثقافة مليئة 1X PBS ، 0.1 ٪ TritonX - 100. ويرد ممثل القسم من خلال القوقعة الحلزونية في الشكل. 2C.
- استخدام ملقط لتشريح بعيدا agarose من الأنسجة. Agarose سوف لا تتمكن من اختراق الأنسجة ، ولكن لن يكون مجرد عالقة على السطح الخارجي من الأذن الداخلية.
- إذا رغبت في ذلك ، تجمع agarose خالية من الأنسجة مقطوع باستخدام الماصة مع فتحة كبيرة حفرة لمنع تقطيع المفرط للنسيج. إذا كان أداء بقع متعددة على الضد أنسجة مختلفة متعددة ، يمكن تنظيم المقاطع في 16 -- أو 24 طبق جيدا زراعة الأنسجة.
3. أقسام الضد تلطيخ vibratome
المضي قدما في الأضداد وصمة عار. المقاطع في جبل لعملية برمتها ، التعويم الحر في الحل. وفيما يلي تلوين الأجسام المضادة للبروتوكول سبيل المثال علامة S100 من خلايا عمود الجهاز كورتي ، ولكن يمكن استخدام أي بروتوكول للجسم. وتجرى جميع يغسل في درجة حرارة الغرفة ما لم يذكر خلاف ذلك.
- في طبق نسيج الثقافة المتعددة أيضا ، احتضان التعويم الحر المقاطع مع هزاز لطيف في PBT (1X PBS ، الأبقار مصل الزلال 1 ٪ ، 0.1 ٪ تريتون X - 100) لمدة 30 دقيقة.
- الماصة قبالة الحل القديمة وكتلة حرة - FLoating المقاطع مع هزاز لطيف في + PBT مصل الماعز العادي (50 م و ع ميكرولتر / 1 مل PBT) لمدة 30 دقيقة.
- الماصة قبالة الحل القديم وإضافة الضد الأولية مخففة في PBT NGS + (1:200 تخفيف S100 في PBT NGS +). يحضن بين عشية وضحاها في 4 مع هزاز لطيف درجة مئوية.
- الماصة قبالة الأضداد الحل الأساسي. غسل 3X ، و 5 دقائق. مع PBT ، ثم 4X ، 30 دقيقة. مع PBT.
- كتلة مع PBT NGS + و 30 دقيقة.
- احتضان مع الأجسام المضادة الثانوية fluorescently - مترافق (التي أثيرت في الماعز) المخفف في PBT NGS +. يحضن بين عشية وضحاها في 4 درجات مئوية ، أو بضع ساعات ، RT ، هزاز لطيف.
- الماصة قبالة حل الضد الثانوية. غسل 3X ، و 5 دقائق. ثم 4X ، 30 دقيقة. مع PBT.
- الماصة قبالة PBT مشاركة يغسل واستبدالها مع الوسط المائي المناسبة المتصاعدة التي تحتوي على ملون مباين النووية.
4. تصاعد المقاطع على الشرائح المجهرية ومبائر
لمنع تكسير أبواب سميكة مع ساترة ، وعندما تصاعد المقاطع الفردية ، لا بد من إدراج فاصل بين شريحة المجهر وساترة ل. وأدناه طريقتين بديلة لتركيب أبواب سميكة vibratome :
- يمكن إنشاء هل من خلال وضع حافة الشحوم فراغ في مربع حول القسم الأنسجة. وهكذا ، عندما إرساء ساترة ، سيتم اغلاق حواف ساترة مع الشحوم فراغ. اضغط لأسفل على حواف ساترة بإبهامك التمسك بحزم وضعها على الشريحة. إذا كانت الشحوم الفراغ الحالي بدقة وبشكل موحد في جميع أنحاء جميع حواف ساترة ، سيتم اغلاق الشريحة بما فيه الكفاية لاستخدامها في المجهر an مبائر مقلوب.
- بدلا من ذلك ، يمكن إنشاء باستخدام agarose هل اللوني راتنج من حجم شبكة المعروفة (مثل جل الأزرق افى جل بيو راد). الماصة 1 ميكرولتر من الراتنج على الشريحة المجهر في كل من الزوايا الأربع ، حيث سيتم وضع ساترة. قسم الأنسجة الماصة واحد وسائل الاعلام المتزايدة في منتصف النقاط الأربع الراتنج. ساترة. إذا باستخدام مجهر مقلوب مبائر ، ختم ساترة على الشريحة باستخدام المجهر nailpolish.
- الحصول على المقاطع البصرية من شرائح vibratome الملون باستخدام المجهر مبائر. لتحديد أنواع الخلايا المختلفة داخل جهاز كورتي ، والحصول على ض المكدس في حجم خطوة محددة (بين 1.5 ميكرون و3). وينبغي أن أبواب مكافحة ملطخة صبغة النووي (الخطوة 3.8). يمكن فحص الصور على أي شاشة الكمبيوتر بعد جمع الصور مبائر. يمكن عدها يدويا الخلايا تكون مراقبة ظهور واختفاء النوى كما يتم فحص الصور بالتتابع من خلال Z - المكدس.
5. ممثل النتائج :
A - Z مبائر ممثل كومة من خلال القسم vibratome ملون للبروتين S100 ، التي هي موجودة في عمود والخلايا دايترس ، وcounterstained مع صبغة نووية (الشكل 3A - F). كل لوحة هي صورة مبائر التي اتخذت في 3 ميكرومتر الخطوات ، مع لوحة وصورة مبائر الحصول على أقرب إلى السطح من المقطع vibratome ولوحة F صورة مبائر الحصول على معظم داخليا داخل القسم vibratome. يظهر الحد الأدنى من تعطل الجهاز مورفولوجية كورتي. على وجه الخصوص ، ليست مقطوعة ملحقات هيولي من خلايا العمود. بالإشارة إلى ظهور واختفاء نوى الخلايا من خلال عمود ض المكدس (الشكل 3A إلى 3F) ، يمكن عدها سواء خلية عمود الداخلي والخارجي رقم (انظر الترقيم ، والشكل 3A -- واو). نظرا لعدد صغير من كل نوع من الخلايا في صورة مبائر ، يمكن استخدام هذا الأسلوب لحساب معظم أنواع الخلايا في جهاز كورتي.
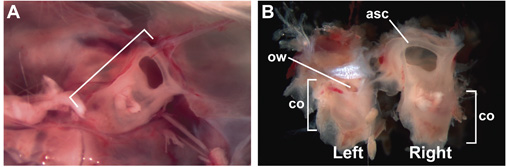
الشكل 1. سليمة ، والمغطى آذان الداخلية البالغين 15 أسبوعا من العمر ، في كبسولة أذني. (A) المغطى الكبسولة أذني اليمنى (بين قوسين) في الجمجمة ، وينظر إليها من وجهة نظر من داخل الرأس ، وبعد إزالة المخ. الأمامي إلى يمين. (ب) سليمة ، ومدتها 15 أسبوعا من العمر بعد تشريح الأذن الداخلية من الجمجمة. السطح الوحشي للالأذن الداخلية اليسار مرئيا ؛ السطح الإنسي من الأذن الداخلية الحق مرئيا. تسميات تشير إلى مواقع القناة شبه الدائرية الأمامي (ASC) ، وشارك (القوقعة) ، وآه (النافذة البيضوية).
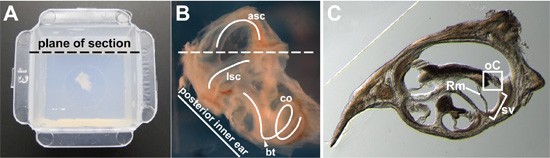
الشكل 2 : (أ) الأذن الداخلية من الجامعة البالغين 15 أسبوعا من العمر ، جزءا لا يتجزأ من agarose في وسط قالب التقشير بعيدا. يشار الطائرة المقصود من المقطع. (ب) عن قرب صورة الأذن 15 أسبوعا من العمر ، كلها داخلية قبل التضمين. وقد تم تشريح جزء من العظام المحيطة بها بعيدا حتى التيه الغشائي يمكن أن ينظر إليها أكثر وضوحا. وتتبع الجانبي نصف دائري قناة (LSC) ، الأمامي شبه دائرية قناة (ASC) ، والقوقعة (شارك) (منحنيات بيضاء). وأشار بدوره القاعدية من القوقعة (رأس السهم) وطائرة المقصود من القسم (خط متقطع). (C) الممثل كروسS - القسم من خلال القوقعة. في مقطع واحد ، عبر من خلال قناة القوقعية ، الجهاز كورتي (درجة مئوية) هو محاصر ، وعائي السطر (اس) هو بين قوسين ، ويشار غشاء رايسنر (روم).
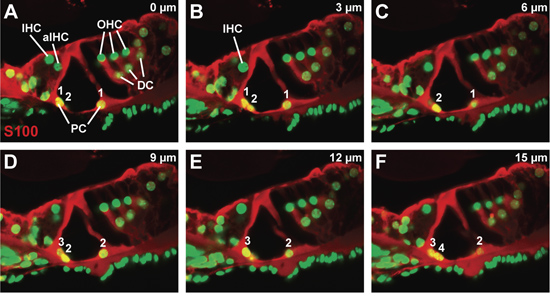
الشكل 3 ، وجهاز كورتي في الماوس من النوع البري في P21. (AF) سلسلة متعاقبة مبائر ، في خطوة الخلايا 3 ميكرومتر الحجم ، عن طريق جهاز الأضداد الملطخة S100 كورتي لتصور خلايا عمود ودايترس. يتم ترقيم بحساب الخلايا عمود الداخلي والخارجي من البداية إلى نهاية السلسلة. الاختصارات : IHC (الخلايا الداخلية الشعر) ، aIHC (الخلية المجاورة الشعر الداخلي) ، OHC (الخلية الخارجي الشعر) ، PC (خلية عمود) ، DC (خلية دايترس ').
Discussion
إجراءات sectioning vibratome ، تليها التصوير المناعية ومبائر يسمح التصور من جهاز كورتي مع الحد الأدنى من تلف الأنسجة. بوضوح ، وصور مأخوذة من مبائر المناطق الداخلية في المقطع vibratome تظهر الحفاظ ممتازة من التشكل الخلوية التي يقتصر فقط التحف التثبيت. صور مبائر المتخذة على مقربة م?...
Disclosures
Acknowledgements
فإن الكاتب يعترف أن استخدام الأطفال الأساسية للأبحاث معهد التصوير المجهري مبائر والدكتور تشانغ جيان لاقتراح تحميل المقاطع باستخدام الخرز agarose. وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة منح DC010387.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| ايكا VT1000S بالاهتزاز بليد مشراح | لايكا | ||
| LSM510 زايس مجهر المسح بالليزر مبائر | زايس | ||
| طالب دومون # 5 الملقط | أدوات العلوم غرامة | 91150-20 | |
| عالى النقاء قليلة نقطة الانصهار Agarose | Invitrogen | 16520-050 | |
| قشر - A - طريق تضمين القالب | Polysciences | 18986 أو 18646A | |
| ألبومين المصل البقري | جاكسون ImmunoResearch | 001-000-162 | |
| مصل الماعز | Invitrogen | 16210-064 | |
| S100 | داكو | Z0311 | |
| الكسا فلور 568 الماعز المضادة للأرنب مفتش | Invitrogen | A - 11036 | 1:1000 تخفيف |
| Vectashield | ناقلات مختبرات | H - 1000 | |
| YO - PRO - 1 | Invitrogen | Y3603 | |
| فراغ الشحوم | الصياد | S41718 | |
| افى جل جل الأزرق | الحيوي راد | 153-7301 |
References
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved