Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Vibratome seccionamiento para la Preservación de Mejora de la citoarquitectura del órgano de Corti mamíferos
En este artículo
Resumen
Un procedimiento simple de vibratome seccionar el órgano de Corti, seguido por microscopía confocal de inmunohistoquímica y se describe. Este procedimiento permite una mejor conservación de la citoarquitectura fino del órgano de Corti de mamíferos, y por lo tanto permite la cuantificación exacta de los tipos de células.
Resumen
El órgano de Corti de mamíferos es un mosaico muy ordenado celular de pelo mechanosensory y apoyo a las células sensoriales
(Revisado en 1,2). La visualización de este mosaico celular a menudo requiere que el órgano de Corti es seccionado. En particular, el pilar sensoriales y las células de Deiters, cuyos núcleos se encuentran basalmente con respecto a las células del cabello, no pueden ser visualizados sin cruz-seccionar el órgano de Corti. Sin embargo, la delicada citoarquitectura del órgano de Corti de mamíferos, incluyendo los procesos citoplásmicos bien de la columna y las células de Deiters, es difícil de mantener por los procedimientos de rutina histológica como la parafina y la crio-corte, que son compatibles con las técnicas estándar de tinción inmunohistoquímica.
Aquí describo un procedimiento simple y robusto, que consiste en seccionar vibratome de la cóclea, la tinción inmunohistoquímica de estas secciones vibratome en el monte entero, seguido por microscopía confocal. Este procedimiento se ha utilizado ampliamente para el análisis immunhistochemical de múltiples órganos, incluyendo la yema del miembro del ratón, pez cebra intestino, el hígado, el páncreas y el corazón (ver 3.6 para algunos ejemplos). Además, este procedimiento fue exitoso para ambas imágenes y quantitificaton del pilar número de células mutantes en los órganos de control y de Corti, tanto en embriones de ratones adultos y 7. Este método, sin embargo, actualmente no se utiliza ampliamente para examinar el órgano de Corti mamíferos. El potencial de este procedimiento tanto para proporcionar una mayor preservación de la citoarquitectura fino del órgano de Corti para adultos y permiten la cuantificación de los diversos tipos de células se describe.
Protocolo
1. El aislamiento y la fijación de oído interno
- Para el análisis de los patrones celulares en el órgano de Corti, la eutanasia adecuadamente organizado de embriones o de adultos.
- Diseccionar la cápsula ótica, que contiene el oído interno membranosa. En el ratón, esto se puede hacer fácilmente en embriones a embriones (E) 14,5 días de edad, en el que E0.5 es el día en que se detectó un tapón vaginal. La disección de la cápsula ótica se lleva a cabo por primera vez por la decapitación y la apertura del cráneo en la línea media. Quitar el cerebro para exponer cada oreja (Fig. 1A). Oído interno puede ser desembolsó intacta pinzas utilizando (como Dumont n º 5, fig. 1B). Si las imágenes del órgano de Corti, la extracción cuidadosa de todo el tejido neuronal y conectivo asociado con la cápsula ótica no es necesario.
- Arreglar todo el oído interno por inmersión en paraformaldehído al 4% (PFA) con suave balanceo a 4 ° C durante la noche en 1,8 ml con tapón de rosca NUNC Cryo-tubo de viales, u otro recipiente de tamaño adecuado. Solución de PFA debe ser fresca en ddH 2 0, luego se almacena a -20 ° C hasta que se necesite.
- Al día siguiente, lavar el fijador con tres cambios de fosfato 1X solución salina (PBS). Los tejidos se pueden almacenar en PBS estéril 1X durante días hasta meses hasta que esté listo para su procesamiento. De tejidos adultos, descalcificación en el 10% EDTA (0,27 M) a 4 ° C durante 5 días, seguido de un enjuague y almacenamiento en 1X PBS.
2. Cortar secciones vibratome
- Prepare un 4% bajo punto de fusión de agarosa en PBS 1X. Agregar bajo punto de fusión de agarosa a 1X PBS y de microondas hasta agarosa en una solución. Tenga cuidado de que la solución no burbuja más - sacar del horno de microondas periódicamente y agitar para mezclar. Mantener la solución en un baño de agua a 55 ° C hasta su utilización.
- Con unas pinzas, retire el oído interno de solución de PBS 1X y la posición en la parte inferior de un molde de incrustación Pele-A-Way. Pipeta de cualquier exceso de PBS 1X del molde. Colocar el molde para cubrir el tejido con un montón de líquido 4% bajo punto de fusión de agarosa (Fig. 2A).
- La posición del oído interno para el corte en el plano adecuado. He obtenido buenos secciones del órgano de Corti mediante la aproximación de la posición de la cápsula ótica, como si se hubiera dejado in situ en la cabeza y el corte en el plano transversal. Por E14.5 embriones a los adultos, la posición del oído interno para que sea visto lateralmente, con el lateral del canal semicircular visible (Fig. 2B). Ángulo en el oído interno para que la línea formada por la parte posterior de la cápsula ótica es aproximadamente en un ángulo de 45 grados desde el plano intención de seccionar (Fig. 2A, B). Cuando la cápsula ótica es visto de manera que la parte dorsal de la cápsula ótica está en la parte superior, la vuelta basal de la cóclea se encuentra en la parte inferior (punta de flecha, fig. 2B) y si el anterior semicircular canal (ASC) en la parte superior (Fig. 2B).
- Agarosa pondrá a temperatura ambiente a 30 minutos. Transferencia desprendible que contiene los moldes de tejido embebido a 4 ° C hasta el momento de la sección. Si el corte se deje para el día siguiente, agregue 1X PBS para cubrir la agarosa en el molde y guardar en una caja que contiene toallas húmedas de papel empapado en 1x PBS.
- Despegar el molde de plástico. Usando una hoja de afeitar, cortar una caja de agarosa que contiene el tejido del oído interno. Tenga cuidado para asegurarse de que el plano de la sección es recta y paralela al lado opuesto de la manzana, que será la superficie sobre la que está pegada al bloque de agarosa hacia abajo. Desde la agarosa no infiltrarse en el tejido, no recortar demasiado agarosa de todo el tejido, por lo que el tejido esté bien apoyada.
- Utilice pegamento para unir el bloque de la superficie de corte.
- Sección con un espesor de 40 a 100 micras por vibratome. Guardar las secciones en una placa de cultivo de tejidos llenos de 1X PBS, 0,1% TritonX-100. Una sección representativa a través de la espiral coclear se muestra en la figura. 2C.
- El uso de fórceps para diseccionar la agarosa de los tejidos. Agarosa al no penetrar en el tejido, pero sólo se pegará a la superficie externa del oído interno.
- Si lo desea, piscina de agarosa-libre, el tejido seccionado con una pipeta con una abertura de gran diámetro para evitar que corte excesivo de los tejidos. Si se realiza múltiples manchas de anticuerpos en varios tejidos diferentes secciones se pueden organizar en un 16 - o 24-así placa de cultivo de tejidos.
3. Anticuerpos secciones tinción vibratome
Proceda con el anticuerpo mancha. Secciones de proceso en todo el montaje, que flotan libremente en la solución. A continuación se muestra un anticuerpo ejemplo el protocolo de tinción para el marcador S100 de las células de los pilares del órgano de Corti, pero el protocolo se puede utilizar para cualquier anticuerpo. Todos los lavados se llevan a cabo a temperatura ambiente a menos que se indique lo contrario.
- En un plato de tejido multi-así la cultura, incubar de libre flotación secciones con suave balanceo en PBT (PBS 1X, 1% de albúmina de suero bovino Triton, un 0,1% X-100) durante 30 minutos.
- Pipeta de solución de edad y el bloque de libre flotante secciones con suave balanceo de PBT + suero normal de cabra (NGS 50 l / 1 ml PBT) durante 30 minutos.
- Pipeta de solución de edad y añadir el anticuerpo primario diluido en PBT + NGS (dilución 1:200 de la S100 en PBT + NGS). Incubar toda la noche a 4 ° C con suave balanceo.
- Pipeta de solución de anticuerpo primario. Lave 3 veces, a 5 minutos. con PBT, a continuación, 4X, 30 min. con PBT.
- Bloque con PBT + NGS, de 30 minutos.
- Se incuba con el anticuerpo secundario conjugado con fluorescencia (criado en cabra) diluido en PBT + NGS. Incubar toda la noche a 4 ° C, o un par de horas, RT, suave balanceo.
- Pipeta de solución de anticuerpo secundario. Lave 3 veces, a 5 minutos., Entonces min 4X, 30. con PBT.
- Pipeta de última PBT lavar y cambiar con las correspondientes medio de montaje acuoso que contiene una contratinción nuclear.
4. Secciones de montaje de diapositivas y microscopía confocal
Para evitar el aplastamiento de las secciones de espesor con el cubreobjetos, al montar las distintas secciones, un espaciador debe insertarse entre los portaobjetos de microscopio y cubreobjetos los. A continuación se presentan dos métodos alternativos para el montaje de espesor vibratome:
- Un espaciador puede ser creado mediante la colocación de un borde de grasa de vacío en un cuadrado alrededor de la sección de tejido. Por lo tanto, al establecer el cubreobjetos, los bordes del cubreobjetos se sellan con grasa de vacío. Presione sobre los bordes del cubreobjetos con el pulgar para que se adhiera firmemente a la diapositiva. Si la grasa de vacío es de forma clara y uniforme presente en todos los bordes del cubreobjetos, la caída será sellado suficiente para su uso en un microscopio confocal invertido.
- Por otra parte, un separador se pueden crear utilizando la resina de agarosa cromatografía de malla conocidos (como Affi-Gel Gel Azul, Bio-Rad). Pipeta de 1 l de resina sobre el portaobjetos en cada una de las cuatro esquinas donde se coloca el cubreobjetos. Pipeta de un tejido de la sección de montaje y los medios de comunicación en el centro de los cuatro puntos de la resina. Cubreobjetos. Si se utiliza un microscopio confocal invertido, sellar el cubreobjetos sobre el portaobjetos de microscopio con nailpolish.
- Obtener secciones ópticas de las rebanadas de vibratome teñidas utilizando microscopía confocal. Para cuantificar los distintos tipos de células en el órgano de Corti, obtener un z-stack en un tamaño de paso definido (entre 1,5 y 3 micras). Secciones deben ser contra-teñidas con un colorante nuclear (paso 3.8). Las imágenes pueden examinarse en cualquier pantalla de la computadora después de la toma de imagen confocal. Las células pueden ser contados manualmente se observa la aparición y desaparición de núcleos como las imágenes se examinan de forma secuencial a través de la z-stack.
5. Los resultados representativos:
Un representante confocal z-stack a través de una sección vibratome, teñidas con proteína S-100, que está presente en los pilares y las células de Deiters, y contrastados con un colorante nuclear (Fig. 3A-F). Cada panel es la imagen confocal a los 3 m-pasos, con el panel A de la imagen confocal obtener más cercana a la superficie de la sección vibratome y el panel de la imagen confocal F obtenido la mayoría de los internos dentro de la sección vibratome. La morfología del órgano de Corti parece mínimamente alterada. En particular, las extensiones de citoplasma de las células de los pilares no están rotos. Observando la aparición y desaparición de núcleos de células a través de la columna z-stack (Fig. 3A a 3F), tanto en número de células pilar interior y exterior se pueden contar (ver numeración, Fig. 3A -. F). Debido al reducido número de cada tipo celular por imagen confocal, este método puede ser usado para contar la mayoría de los tipos de células en el órgano de Corti.
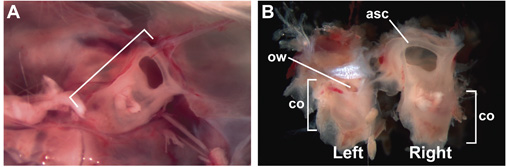
Figura 1. Intacto, 15 semanas de edad, adultos oído interno encerrado en la cápsula ótica. (A) La cápsula ótica derecha (entre paréntesis) incrustado en el cráneo, visto desde un punto de vista del interior de la cabeza, después de la extracción del cerebro. Anterior está a la derecha. (B) se mantienen intactas, de 15 semanas de edad, el oído interno después de la disección del cráneo. Superficie lateral del oído interno izquierdo es visible, la superficie medial del oído interno derecho es visible. Las etiquetas indican la ubicación de la parte anterior del canal semicircular (ASC), co (cóclea), y OW (ventana oval).
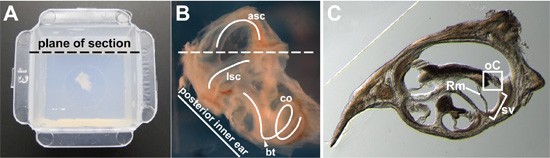
Figura 2. (A) oreja completos al interior de un adulto de 15 semanas de edad, incrustado en agarosa en el centro de un molde desprendible. Avión destinado de la sección se indica. (B) primer plano la imagen de un niño de 15 semanas de edad, el oído interno entero antes de la inclusión. Una parte del hueso que lo rodea ha sido diseccionada por lo que el laberinto membranoso podría considerarse una forma más clara. El lateral del canal semicircular (LSC), anterior semicircular canal (ASC), y la cóclea (co) se trazan (curvas de color blanco). La vuelta basal de la cóclea (cabeza de flecha) y el plano intención de la sección (línea discontinua) se indican. (C) Representante de cross de la sección a través de la cóclea. En una sección transversal a través del conducto coclear, el órgano de Corti (º C) es en caja, la estría vascular (sv) se encuentra entre corchetes, y la membrana de Reissner (Rm) se indica.
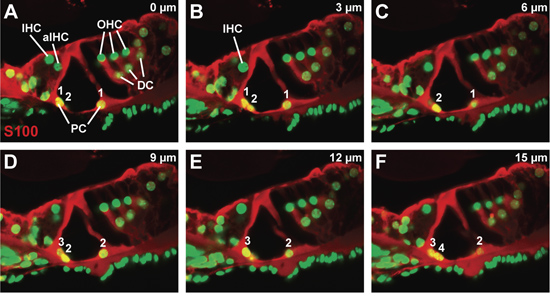
Figura 3. El órgano de Corti en un ratón de tipo salvaje en P21. (AF) serie secuencial confocal, en las células 3 micras de tamaño paso, a través de un S100 anticuerpo teñido de órgano de Corti para visualizar las células pilar y Deiters. Cuenta de células pilar interior y el exterior desde el principio hasta el final de la serie están contados. Abreviaturas: IHC (células ciliadas internas), aIHC (células ciliadas internas adyacentes), OHC (células ciliadas externas), PC (células pilar), DC (células de Deiters).
Access restricted. Please log in or start a trial to view this content.
Discusión
El procedimiento de corte vibratome, seguido de imágenes de inmunohistoquímica y confocal permite la visualización del órgano de Corti con el mínimo daño a los tejidos. Claramente, las imágenes tomadas de la región confocal interna en la sección vibratome muestran una excelente conservación de la morfología celular que sólo está limitado por artificios de fijación. Confocal de imágenes tomadas cerca de las dos superficies de corte de una sección vibratome son a menudo indistinguibles de las imágenes de ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
El autor desea reconocer el uso del núcleo de la Infancia del Instituto de Investigación de imágenes para la microscopía confocal y el Dr. Jian Zhang a la sugerencia de montar secciones usando perlas de agarosa. Este trabajo fue financiado por el NIH subvención DC010387.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Leica VT1000S vibrante hoja microtomo | Leica | ||
| Zeiss LSM510 microscopio láser confocal de barrido | Zeiss | ||
| Estudiantes Dumont # 5 Pinzas | Herramientas de Bellas Ciencia | 91150-20 | |
| UltraPure bajo punto de fusión de agarosa | Invitrogen | 16520-050 | |
| Pele-A-Way incorporación de molde | Polysciences | 18986 o 18646A | |
| albúmina de suero bovino | Jackson ImmunoResearch | 001-000-162 | |
| De suero de cabra | Invitrogen | 16210-064 | |
| S100 | Dako | Z0311 | |
| Alexa Fluor 568 cabra anti-conejo IgG | Invitrogen | A-11036 | Dilución 1:1000 |
| Vectashield | Vector de Laboratorios | H-1000 | |
| YO-PRO-1 | Invitrogen | Y3603 | |
| grasa de vacío | Pescador | S41718 | |
| Affi-Gel Gel Azul | Bio-Rad | 153-7301 |
Referencias
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados