É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Vibratome Seccionamento de Preservação melhorada da citoarquitetura do Órgão de Corti de mamíferos
Neste Artigo
Resumo
Um procedimento simples de vibratome seccionando o órgão de Corti, seguido por microscopia confocal e imuno-histoquímica é descrito. Este procedimento permite uma melhor preservação da citoarquitetura fino do órgão de Corti de mamíferos e, conseqüentemente, permite a quantificação precisa dos tipos de células.
Resumo
O órgão de mamíferos de Corti é um mosaico altamente ordenada celular de cabelo e não-sensorial mecanosensorial células de suporte
(Revisto em 1,2). Visualização deste mosaico celulares freqüentemente requer que o órgão de Corti é transversa. Em particular, o pilar não-sensorial e células Deiters ', cujos núcleos estão localizados basally com relação às células ciliadas, não pode ser visualizada sem cross-seccionando o órgão de Corti. No entanto, a citoarquitetura delicada do órgão de Corti de mamíferos, incluindo os processos de multa citoplasmática do pilar e células Deiters ', é difícil de preservar pela rotina de procedimentos histológicos, tais como parafina e crio-seccionamento, que são compatíveis com as técnicas de coloração imuno-histoquímica.
Aqui eu descrevo um procedimento simples e robusta consistindo de vibratome seccionamento da cóclea, coloração imuno-histoquímica destas seções vibratome no monte todo, seguido por microscopia confocal. Este procedimento tem sido utilizado amplamente para a análise immunhistochemical de múltiplos órgãos, incluindo o broto de membro mouse, gut zebrafish, fígado, pâncreas e coração (ver 3-6 para exemplos seleccionados). Além disso, este procedimento foi bem sucedida para ambos imagem e quantitificaton do número de células em órgãos pilar mutante e controle de Corti em ambos os embriões e camundongos adultos 7. Este método, no entanto, atualmente não é amplamente usado para examinar o órgão de mamíferos de Corti. O potencial para este procedimento para tanto proporcionar a preservação do maior bem citoarquitetura do órgão de Corti e adultos permitem a quantificação de vários tipos celulares é descrito.
Protocolo
1. Isolamento e fixação do ouvido interno
- Para análise dos padrões celulares no órgão de Corti, euthanize adequadamente encenado embriões ou adultos.
- Dissecar a cápsula ótica, contendo a orelha interna membranosa. No mouse, isso pode ser feito facilmente em embriões de embriões (E) 14,5 dias e mais velhos, em que E0.5 é o dia em que um plug vaginal foi detectada. Dissecção da cápsula ótica é realizada primeiro por decapitação e abertura do crânio, na linha média. Retire do cérebro para expor cada orelha (Fig. 1A). Ouvido interno podem ser descascados fora intacta usando uma pinça (como Dumont n º 5, fig. 1B). Se a imagem do órgão de Corti, remoção cuidadosa de todo o tecido neuronal e conjuntivo associados à cápsula ótica não é necessário.
- Fix todo ouvidos internos por imersão em paraformaldeído a 4% (PFA) com balanço delicado a 4 ° C overnight em 1,8 ml com tampa de rosca NUNC Cryo-tubo frascos, ou recipiente de tamanho adequado outros. Solução de PFA deve ser feita fresco em DDH 2 0, em seguida, armazenadas a -20 ° C até ser necessário.
- No dia seguinte, lave o fixador com três mudanças de fosfato 1X solução salina tamponada (PBS). Tecidos podem ser armazenados em 1X PBS estéril por dias até meses até que esteja pronto para processamento. Para o tecido adulto, descalcificar em EDTA 10% (0,27 M) a 4 ° C por 5 dias, seguido de lavagem e armazenamento em 1X PBS.
2. Corte de secções vibratome
- Prepare 4% baixo ponto de fusão agarose em 1X PBS. Adicionar baixo ponto de fusão de agarose a 1X PBS e microondas até agarose está na solução. Tome cuidado para que a solução não mais de bolha - tirar do microondas periodicamente e agite para misturar. Mantenha a solução em banho-maria a 55 ° C até que esteja pronto para uso.
- Utilizando uma pinça, remova ouvido interno de 1X solução PBS e posição na parte inferior de um molde de incorporação Peel-A-Way. Pipeta o excesso 1X PBS a partir do molde. Preencher o molde para cobrir o tecido com bastante líquido 4% baixo ponto de fusão agarose (Fig. 2A).
- Posição do ouvido interno para o seccionamento no plano apropriado. Eu tenho obtido bons cortes transversais do órgão de Corti, aproximando a posição da cápsula ótica como se tivesse sido deixados no local da cabeça e corte no plano transversal. Para E14.5 embriões para adultos, a posição do ouvido interno de forma que ele é visto lateralmente, com o canal semi-circular laterais visíveis (Fig. 2B). Ângulo do ouvido interno de modo que a linha formada pelo lado posterior da cápsula ótica é de aproximadamente em um ângulo de 45 graus do plano previsto para a secção (Fig. 2A, B). Quando a cápsula ótica é visto de modo que a porção dorsal da cápsula ótica está no topo, o giro basal da cóclea deve estar localizado na parte inferior (ponta de seta, fig. 2B) e do canal semi-circular anterior (asc) deve estar no topo (Fig. 2B).
- Agarose será fixado em RT dentro de 30 minutos. Transferência Peel-Away moldes contendo tecido incorporados a 4 ° C até que esteja pronto para a seção. Se o corte será adiada para o dia seguinte, adicione 1X PBS para cobrir a agarose no molde e guarde em uma caixa contendo toalhas de papel úmido embebido em 1X PBS.
- Descascar o molde de plástico. Usando uma lâmina de barbear, cortar uma caixa de agarose contendo o tecido do ouvido interno. Tomar cuidado para garantir que o plano da seção é reta e paralela ao lado oposto do bloco, que será a superfície em que o bloco de agarose é colado para baixo. Desde a agarose não se infiltrar no tecido, não aparar agarose muito de todo o tecido, de modo que o tecido vai ser bem suportada.
- Use supercola para fixar o bloco à superfície de corte.
- Seção de 4-10 mM espessura por vibratome. Salvar seções em um prato da cultura de tecidos cheios de 1X PBS, 0,1% tritonX-100. Uma seção representativa através da espiral coclear é mostrado na figura. 2C.
- Use pinças para dissecar afastado a agarose a partir do tecido. Agarose não penetram no tecido, mas só vai ser preso na superfície externa do ouvido interno.
- Se desejar, piscina agarose sem tecido, seccionadas com uma pipeta com uma abertura de grandes buracos para evitar corte excessivo de tecido. Se estiver executando várias manchas de anticorpos em vários tecidos diferentes, as seções podem ser organizados em um 16 - ou 24 bem-prato de cultura de tecidos.
3. Anticorpo seções vibratome coloração
Prosseguir com anticorpos mancha. Secções de processo em todo o monte, de livre flutuação em solução. Abaixo está um exemplo protocolo de coloração de anticorpos para o marcador S100 das células pilar do órgão de Corti, mas o protocolo pode ser usado para qualquer anticorpo. Todas as lavagens são realizadas à temperatura ambiente salvo indicação em contrário.
- Em um prato de cultura de tecido multi-bem, incubar flutuante seções com balanço delicado em PBT (1X PBS, 1% de soro bovino Triton, albumina 0,1% X-100) por 30 minutos.
- Pipeta off solução antiga e bloco livre-floating seções com balanço delicado em PBT + soro normal de cabra (50 NGS mL / 1 ml PBT) por 30 minutos.
- Pipeta off solução antiga e adicione o anticorpo primário diluído em PBT + NGS (1:200 diluição do S100 em PBT + NGS). Incubar overnight a 4 ° C com balanço delicado.
- Pipeta off solução anticorpo primário. Lavar 3X, 5 mins. com PBT, em seguida, 4X, 30 minutos. com PBT.
- Bloco com PBT + NGS, 30 mins.
- Incube com fluorescente-anticorpo secundário conjugado (criado em cabra) diluídas em PBT + NGS. Incubar overnight a 4 ° C, ou algumas horas, RT, balançando suave.
- Pipeta off solução de anticorpos secundários. Lavar 3X, 5 min., Em seguida, 4X, 30 minutos. com PBT.
- Pipeta off PBT última lavagem e substitua-o por meio aquoso apropriado de montagem contendo um contracorante nuclear.
4. Seções de montagem em lâminas e microscopia confocal
Para evitar o esmagamento de espessura com a lamínula, ao montar seções individuais, um espaçador deve ser inserido entre a lâmina de microscópio e as lamelas. Abaixo estão dois métodos alternativos de montagem seções vibratome grossa:
- Um espaçador pode ser criado por colocar um aro de graxa de vácuo em uma praça ao redor da secção de tecido. Assim, quando, que estabelece as lamelas, as bordas da lamínula serão vedados com graxa de vácuo. Pressione para baixo as bordas da lamínula com o polegar para aderir firmemente-lo para o slide. Se a graxa de vácuo está bem presente e uniforme em torno de todas as bordas da lamínula, a lâmina será selado o suficiente para uso em um microscópio invertido confocal.
- Alternativamente, um espaçador pode ser criado usando agarose resina de cromatografia de malhagem conhecidos (como Gel Azul Affi-Gel, Bio-Rad). Pipete uma de resina para a lâmina de microscópio em cada um dos quatro cantos, onde a lamela será colocado. Pipeta uma secção de tecido e meios de montagem no meio dos quatro pontos de resina. Lamela. Se estiver usando um microscópio invertido confocal, selar a lamínula sobre a lâmina de microscópio utilizando nailpolish.
- Obtenção de cortes ópticos das fatias vibratome coradas utilizando microscopia confocal. Para quantificar vários tipos celulares dentro do órgão de Corti, obtenha uma pilha z-passo em um tamanho definido (entre 1,5 e 3 mm). Seções devem ser contra-marcadas com um corante nuclear (passo 3.8). As imagens podem ser examinados em qualquer tela do computador após a coleta de imagem confocal. As células podem ser contadas manualmente ser observado o aparecimento e desaparecimento de núcleos como as imagens são examinados seqüencialmente através do z-stack.
5. Resultados representativos:
A confocal representante z pilha através de uma seção vibratome, manchado para a proteína S100, que está presente na coluna e células Deiters "e contrastado com um corante nuclear (Fig. 3A-F). Cada painel é a imagem confocal tomada em 3 m-passos, com o painel A da imagem confocal obtido mais próximo à superfície da seção vibratome e painel de F a imagem confocal obtido mais internamente dentro da seção vibratome. A morfologia do órgão de Corti parece minimamente perturbado. Em particular, as extensões citoplasmáticas das células pilar não estão quebrados. Observando o aparecimento e desaparecimento de núcleos de células pilar através do z-stack (Fig. 3A a 3F), tanto o número de células interiores e exteriores pilar podem ser contadas (ver numeração, Fig. 3A -. F). Devido ao pequeno número de cada tipo de célula por imagem confocal, esta abordagem pode ser usada para contar a maioria dos tipos celulares dentro do órgão de Corti.
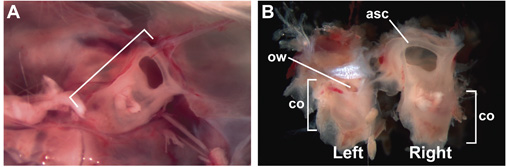
Figura 1. Intactas, 15 semanas de idade, adultos ouvidos internos encerrado na cápsula ótica. (A) A cápsula ótica direita (entre colchetes) encerrado no crânio, visto de um ponto de vista de dentro da cabeça, após a remoção do cérebro. Anterior é para a direita. (B) intactas, 15 semanas de idade ouvidos internos após a dissecção do crânio. Superfície lateral da orelha esquerda interior é visível; face medial da orelha direita interior é visível. Etiquetas indicam os locais da anterior canal semi-circular (asc), co (cóclea), e ow (janela oval).
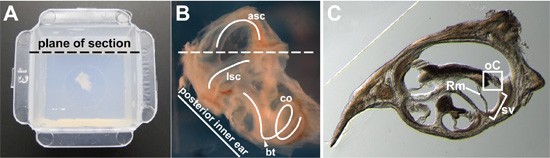
Figura 2. (A) da orelha interna inteiro de um adulto de 15 semanas de idade, embutido em agarose no centro de um molde de Peel-Away. Plano destina de seção é indicado. (B) imagem Close-up of a 15 semanas de idade, a orelha todo interior antes de incorporação. Uma parte do osso circundante foi dissecada de modo que o labirinto membranoso poderia um visto mais claramente. O canal semi-circular lateral (LSC), canal semi-circular anterior (asc), e cóclea (co) são traçados (curvas de branco). O giro basal da cóclea (seta) eo plano da seção destina (linha tracejada) são indicados. (C) Representante cross-section através da cóclea. Em uma seção transversal através do ducto coclear, o órgão de Corti (oC) é em caixa, da estria vascular (sv) está entre colchetes, e membrana de Reissner (Rm) é indicado.
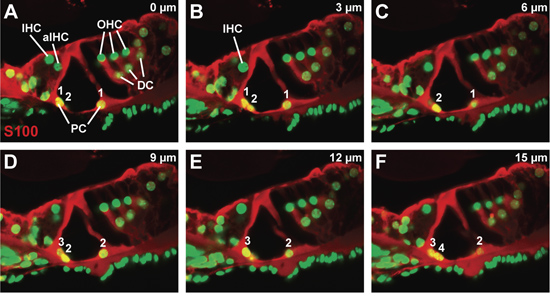
Figura 3. O órgão de Corti em um rato do tipo selvagem em P21. (AF) da série Sequential confocal, a um passo células 3 mm de tamanho, através de um órgão S100-anticorpo manchada de Corti para visualizar as células pilar e Deiters '. Contagens de células pilares internas e externas desde o início até o fim da série são contados. Abreviaturas: IHC (células ciliadas), aIHC (células ciliadas adjacentes interior), OHC (células ciliadas externas), PC (células pilar), DC (células Deiters ').
Discussão
O procedimento de corte vibratome, seguido por imagem imunohistoquímica e confocal permite a visualização do órgão de Corti com dano tecidual mínimo. Claramente, as imagens tiradas de confocal regiões do interior da seção vibratome mostram excelente preservação da morfologia celular, que é limitada apenas por artefatos de fixação. Confocal imagens tomadas perto das duas superfícies de corte de uma seção vibratome são muitas vezes indistinguíveis a partir de imagens de regiões internas, embora ocasion...
Divulgações
Agradecimentos
O autor gostaria de reconhecer o uso de Investigação de Crianças Núcleo de Imagem Instituto de microscopia confocal e Jian Zhang para a sugestão de montar seções usando pérolas de agarose. Este trabalho foi financiado pelo NIH conceder DC010387.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Leica VT1000S vibratório Lâmina micrótomo | Leica | ||
| Zeiss LSM510 laser de microscópio de varredura confocal | Zeiss | ||
| Estudante Dumont # 5 Pinça | Multa Ferramentas Ciência | 91150-20 | |
| UltraPure baixo ponto de fusão Agarose | Invitrogen | 16520-050 | |
| Peel-A-Way molde incorporação | Polysciences | 18.986 ou 18646A | |
| albumina de soro bovino | ImmunoResearch Jackson | 001-000-162 | |
| O soro de cabra | Invitrogen | 16210-064 | |
| S100 | Dako | Z0311 | |
| Alexa Fluor 568 cabra anti-IgG de coelho | Invitrogen | A-11036 | 1:1000 diluição |
| Vectashield | Vector Labs | H-1000 | |
| YO-PRO-1 | Invitrogen | Y3603 | |
| graxa de vácuo | Pescador | S41718 | |
| Affi-Gel Gel Azul | Bio-Rad | 153-7301 |
Referências
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados