È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Vibratome sezionamento per la Conservazione avanzata del citoarchitettura dell'organo di Corti dei mammiferi
In questo articolo
Riepilogo
Una semplice procedura di vibratome sezionamento dell'organo del Corti, seguito da immunoistochimica e microscopia confocale è descritto. Questa procedura consente una migliore conservazione del bene citoarchitettura dell'organo di Corti dei mammiferi, e permette di conseguenza per la quantificazione precisa dei tipi di cellule.
Abstract
L'organo di Corti dei mammiferi è un mosaico altamente ordinato cellulari di capelli mechanosensory e nonsensory cellule di supporto
(Recensione a 1,2). Visualizzazione di questo mosaico cellulare spesso richiede che l'organo del Corti è sezionato. In particolare, il pilastro nonsensory e le cellule Deiters ', i cui nuclei si trovano basale rispetto alle cellule dei capelli, non possono essere visualizzati senza cross-sezionare l'organo del Corti. Tuttavia, il delicato citoarchitettura dell'organo di Corti dei mammiferi, inclusi i processi multa citoplasmatica del pilastro e cellule Deiters ', è difficile da conservare per procedure istologiche di routine come la paraffina e crio-sezionamento, che sono compatibili con le tecniche standard di colorazione immunoistochimica.
Qui descrivere una procedura semplice e robusta costituita da vibratome sezionamento della coclea, la colorazione immunoistochimica di queste sezioni vibratome a monte tutto, seguita da microscopia confocale. Questa procedura è stata utilizzata ampiamente per l'analisi immunhistochemical di molti organi, tra cui la gemma dell'arto topo, pesce zebra intestino, fegato, pancreas e cuore (vedi 3-6 per esempi selezionati). Inoltre, questa procedura è stata sucessful sia per l'imaging e quantitificaton del numero di cellule mutanti pilastro di organi e il controllo delle Corti sia in embrioni di topi adulti e 7. Questo metodo, tuttavia, non è attualmente molto utilizzato per esaminare l'organo di Corti dei mammiferi. Il potenziale di questa procedura per garantire sia la conservazione potenziata del citoarchitettura multa dell'organo del Corti adulti e consentire la quantificazione dei vari tipi di cellule è descritto.
Protocollo
1. Isolamento e fissazione interna delle orecchie
- Per l'analisi di patterning cellulare in dell'organo del Corti, eutanasia opportunamente allestita embrioni o gli adulti.
- Sezionare la capsula otica, che contiene l'orecchio interno membranoso. Nel topo, questo può essere fatto facilmente su embrioni a embrionale (E) giorno 14.5 e anziani, in cui E0.5 è il giorno in cui è stata rilevata una spina vaginale. Dissezione della capsula otica avviene prima per decapitazione e l'apertura del cranio sulla linea mediana. Rimuovere cervello per esporre ciascun orecchio (Fig. 1A). Orecchio interno può essere sborsato intatto pinze utilizzando (come Dumont # 5, fig. 1B). Se l'imaging dell'organo del Corti, la rimozione accurata di tutto il tessuto neuronale e connettivo associata alla capsula otica non è necessario.
- Fissare tutta orecchi interiori per immersione in 4% paraformaldeide (PFA) con dondolo dolci a 4 ° C per una notte in 1,8 ml con tappo a vite NUNC Cryo-tubo fiale o altri contenitori di dimensioni appropriate. PFA soluzione dovrebbe essere fresca in DDH 2 0, poi conservati a -20 ° C fino al momento dell'uso.
- Il giorno dopo, lavare il fissativo con tre cambi di fosfato 1X soluzione salina tamponata (PBS). Tessuti possono essere memorizzati in sterili PBS 1X per giorni fino a mesi fino al momento per l'elaborazione. Per i tessuti adulti, decalcificare nel 10% EDTA (0,27 M) a 4 ° C per 5 giorni, seguito da risciacquo e conservazione in PBS 1X.
2. Il taglio delle sezioni vibratome
- Preparare il 4% di agarosio a basso punto di fusione in PBS 1X. Aggiungi a basso punto di fusione di agarosio al PBS 1X e forno a microonde fino agarosio è in soluzione. Fare attenzione che la soluzione non bolla oltre - tolga dal forno a microonde periodicamente e mescolare. Conservare la soluzione in un bagno d'acqua ° 55 C fino al momento dell'uso.
- Utilizzando pinze, rimuovere orecchio interno dalla soluzione PBS 1X e la posizione sul fondo di una Peel-A-Way stampo incorporamento. Pipettare via qualsiasi eccesso di PBS 1X dallo stampo. Riempire stampi per coprire il tessuto con abbondanza di liquido 4% agarosio a basso punto di fusione (Fig. 2A).
- Posizionare l'orecchio interno di sezionamento nel piano adeguato. Io ho ottenuto buoni sezioni dell'organo del Corti da approssimare la posizione della capsula otica come se fosse stato lasciato in situ nella testa e sezionamento nel piano trasversale. Per E14.5 embrioni agli adulti, la posizione l'orecchio interno in modo che sia visto lateralmente, con il laterale semicircolare canale visibile (Fig. 2B). Angolo dell'orecchio interno in modo che la linea formata dalla parte posteriore della capsula otica è pari a circa ad un angolo di 45 gradi rispetto al piano previsto di sezionamento (Fig. 2A, B). Quando la capsula otica è vista in modo che la parte dorsale della capsula otica è al top, il giro basale della coclea deve essere posizionato in basso (punta di freccia, fig. 2B) e l'anteriore semicircolare canale (asc) dovrebbe essere in cima (Fig. 2B).
- Agarosio sarà fissato a RT entro 30 minuti. Trasferimento Peel-Away di scarto contenenti tessuto integrato a 4 ° C fino al momento di sezione. Se sezionamento sarà rimandato al giorno dopo, aggiungere PBS 1X per coprire l'agarosio nello stampo e conservare in una scatola contenente carta assorbente umida imbevuta di PBS 1X.
- Sbucciare via lo stampo di plastica. Utilizzando una lama di rasoio, ritagliare una scatola di agarosio contenente il tessuto dell'orecchio interno. Fare attenzione per assicurare che il piano di sezione è diritta e parallela al lato opposto del blocco, che sarà la superficie su cui è incollato il blocco di agarosio in giù. Dal momento che l'agarosio non infiltrano i tessuti, non tagliare troppo agarosio provenienti da tutto il tessuto, in modo che il tessuto sarà ben supportato.
- Usa supercolla per fissare il blocco alla superficie di taglio.
- Sezione a 40-100 micron di spessore vibratome. Salva sezioni in un tessuto-cultura piatto pieno di PBS 1X, 0,1% TritonX-100. Una sezione rappresentativa attraverso la spirale cocleare è mostrato in fig. 2C.
- Utilizzare pinze a sezionare l'agarosio via dal tessuto. Agarosio non penetra nel tessuto, ma sarà solo attaccati alla superficie esterna dell'orecchio interno.
- Se lo si desidera, piscina agarosio-free, tessuto sezionato con una pipetta di un grosso foro di apertura per evitare un eccessivo taglio del tessuto. Se si esegue macchie di anticorpi multipli su più tessuti diversi, le sezioni possono essere organizzate in 16 - o 24-ben piatto coltura tissutale.
3. Anticorpi colorazione vibratome sezioni
Procedere con anticorpi macchia. Sezioni processo per intero-mount, fluttuante in soluzione. Di seguito è riportato un anticorpo protocollo di esempio per la colorazione S100 marker delle cellule pilastro dell'organo del Corti, ma il protocollo può essere utilizzato per qualsiasi anticorpi. Tutti i lavaggi sono condotte a temperatura ambiente, se non diversamente specificato.
- In un piatto multi-bene di coltura tissutale, incubare libero di fluttuare sezioni con dondolo dolce in PBT (1X PBS, 1% di sieroalbumina bovina, 0,1% Triton X-100) per 30 minuti.
- Pipettare off vecchia soluzione e bloccare free-floating sezioni con dondolo dolci capra PBT siero + normale (50 microlitri NGS / 1 ml PBT) per 30 minuti.
- Pipettare off vecchia soluzione e aggiungere l'anticorpo primario diluito in PBT + NGS (1:200 diluizione S100 in PBT + NGS). Incubare per una notte a 4 ° C con dolce dondolio.
- Pipettare off soluzione dell'anticorpo primario. Lavare 3X, 5 min. con PBT, poi 4X, minuti 30. con PBT.
- Blocco con PBT + NGS, 30 min.
- Incubare con fluorescenza anticorpo secondario coniugato (cresciuto a capra) diluito in PBT + NGS. Incubare per una notte a 4 ° C, o un paio d'ore, RT, dolce dondolio.
- Pipettare off soluzione di anticorpo secondario. Lavare 3X, 5 min., Poi 4X, minuti 30. con PBT.
- Pipettare lo scorso PBT lavare e sostituire con adeguate mezzo acquoso contenente il montaggio di contrasto nucleare.
4. Sezioni di montaggio su vetrini e microscopio confocale
Per evitare lo schiacciamento delle sezioni di spessore con il coprioggetti, durante il montaggio singole sezioni, un distanziatore deve essere inserito tra il vetrino da microscopio e il coprioggetto. Di seguito sono due metodi alternativi di montaggio sezioni vibratome spessore:
- Un distanziatore può essere creato inserendo un bordo di grasso per vuoto in una piazza intorno alla sezione di tessuto. Così, nello stabilire il coprioggetti, i bordi del coprioggetto saranno sigillati con grasso per vuoto. Premere verso il basso i bordi del coprioggetto con il pollice per aderire saldamente sulla diapositiva. Se il grasso vuoto è ordinatamente e in modo uniforme presenti tutti i bordi del vetrino, la diapositiva sarà sigillato sufficiente per l'uso su un microscopio invertito confocale.
- In alternativa, un distanziatore possono essere creati utilizzando resina agarosio cromatografia maglie di dimensioni conosciute (come Affi-Gel Blu Gel, Bio-Rad). Pipettare 1 ml di resina sul vetrino da microscopio in ciascuno dei quattro angoli dove il coprioggetti verrà posizionato. Pipettare una sezione di tessuto e mezzi di montaggio al centro dei quattro punti di resina. Coprioggetto. Se si utilizza un microscopio invertito confocale, sigillare il coprioggetto sul vetrino da microscopio utilizzando nailpolish.
- Ottenere sezioni ottiche delle fette vibratome colorati usando la microscopia confocale. Per quantificare vari tipi di cellule all'interno dell'organo del Corti, ottenere un z-stack in un passo definito (tra 1,5 e 3 micron). Sezioni devono essere controproducente da un colorante nucleare (passo 3,8). Le immagini possono essere esaminate su qualsiasi schermo del computer dopo la raccolta di immagini confocale. Le celle possono essere contati manualmente sia osservando la comparsa e la scomparsa dei nuclei come immagini vengono esaminate in modo sequenziale attraverso il z-stack.
5. Rappresentante dei risultati:
Un rappresentante confocale z-stack attraverso una sezione vibratome, colorati per le proteine S100, che è presente nel pilastro e cellule Deiters ', e di contrasto con un colorante nucleare (Fig. 3A-F). Ogni pannello è l'immagine confocale presa a 3 micron-passi, con un pannello l'immagine confocale ottenuto più vicino alla superficie della sezione vibratome e il pannello F l'immagine confocale ottenuto più internamente all'interno della sezione vibratome. La morfologia dell'organo del Corti appare minimamente disturbato. In particolare, le estensioni citoplasmatica delle cellule pilastro non sono rotte. Notando la comparsa e la scomparsa dei nuclei delle cellule pilastro attraverso il z-stack (Fig. 3A a 3F), sia interiore che esteriore numero di cellulare pilastro può essere contato (vedi numerazione, Fig. 3A -. F). A causa del piccolo numero di ciascun tipo di cellula per immagine confocale, questo approccio può essere usato per contare più tipi di cellule all'interno dell'organo del Corti.
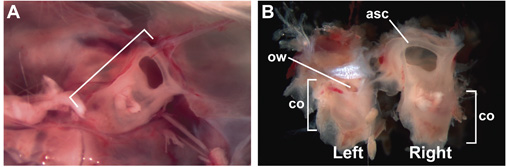
Figura 1. Intatto, 15 settimane di età, adulti orecchio interno racchiuso nella capsula otica. (A) La capsula diritto otic (tra parentesi) racchiuso nel cranio, viste da un punto di vista di dentro la testa, dopo la rimozione del cervello. Anteriore è a destra. (B) intatto, orecchie interna di 15 settimane di età dopo la dissezione dal cranio. Superficie laterale dell'orecchio interno sinistro è visibile; superficie mediale dell'orecchio interno destro è visibile. Le etichette indicano le posizioni dei anteriore semicircolare canale (ASC), co (coclea), e ow (finestra ovale).
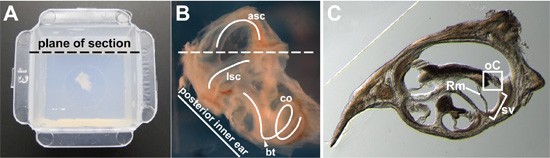
Figura 2. (A) intero orecchio interno da 15 settimane di età adulta, incorporato nel agarosio al centro di una Peel-Away stampo. Aereo prevista di sezione è indicato. (B), primo piano l'immagine di 15 settimane di età, intero orecchio interno prima di incorporamento. Una parte dell'osso circostante è stata sezionata via così il labirinto membranoso potrebbe un visto più chiaramente. Il laterale del canale semicircolare (LSC), anteriore semicircolare canale (asc), e la coclea (co) sono tracciati (curve bianco). La svolta basale della coclea (punta di freccia) e il piano previsto di sezione (linea tratteggiata) sono indicati. (C) Rappresentante cross-sezione attraverso la coclea. In una sezione trasversale attraverso il dotto cocleare, l'organo del Corti (° C) è boxed, il vascularis stria (sv) è tra parentesi, e la membrana del Reissner (Rm) è indicato.
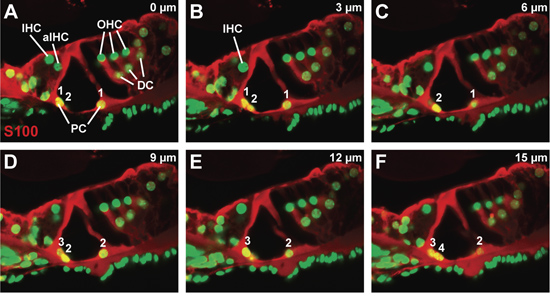
Figura 3. L'organo di Corti in una wild-type del mouse P21. (AF) serie sequenziale confocale, ad un passo cellule 3 micron di dimensioni, attraverso un anticorpo macchiato S100 organo di Corti per visualizzare le cellule pilastro e Deiters '. Conta delle cellule pilastro interiore ed esteriore dall'inizio alla fine della serie sono numerati. Abbreviazioni: IHC (cellule ciliate interne), aIHC (adiacente cellule ciliate interne), ACT (cellule ciliate esterne), PC (cella pilastro), DC (cellule Deiters ').
Access restricted. Please log in or start a trial to view this content.
Discussione
La procedura di sezionamento vibratome, seguita da immagini immunoistochimica e confocale permette la visualizzazione delle dell'organo del Corti, con minimo danno tissutale. Chiaramente, le immagini confocale preso dalle regioni interne della sezione vibratome spettacolo eccellente conservazione della morfologia cellulare che è limitata solo dalla fissazione artefatti. Immagini confocale preso vicino alle due superfici di taglio di una sezione vibratome sono spesso indistinguibili dalle immagini provenienti dalle ...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
L'autore ringrazia vivamente l'uso di Ricerca dei Bambini Nucleo Istituto Imaging per la microscopia confocale e il dottor Zhang Jian per il suggerimento di montare sezioni utilizzando perline agarosio. Questo lavoro è stato finanziato dal NIH concedere DC010387.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Leica VT1000S vibrante lama microtomo | Leica | ||
| Zeiss LSM510 microscopio confocale a scansione laser | Zeiss | ||
| Studente Dumont # 5 Pinze | Strumenti Scienza multa | 91150-20 | |
| Ultrapura Bassa Punto di fusione Agarose | Invitrogen | 16520-050 | |
| Peel-A-Way embedding stampo | Polysciences | 18986 o 18646A | |
| albumina di siero bovino | Jackson ImmunoResearch | 001-000-162 | |
| Siero di capra | Invitrogen | 16210-064 | |
| S100 | Dako | Z0311 | |
| Alexa Fluor 568 di capra anti-IgG di coniglio | Invitrogen | A-11036 | Diluizione 1:1000 |
| Vectashield | Vector Labs | H-1000 | |
| YO-PRO-1 | Invitrogen | Y3603 | |
| vuoto grasso | Pescatore | S41718 | |
| Affi-Gel Gel Blu | Bio-Rad | 153-7301 |
Riferimenti
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon