このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ビブラトームは、コルチ器の哺乳類器官の細胞構築の強化された保全のためセクショニング
要約
免疫組織化学と共焦点顕微鏡に続くコルチ器官を、切片ビブラトームの簡単な手順が説明されています。この手順では、コルチ器の哺乳類器官の微細な細胞構築の改良保全を可能にし、その結果、細胞の種類を正確に定量することができます。
要約
コルチ器の哺乳類の器官はmechanosensory髪とnonsensory支持細胞の高度に秩序化された細胞のモザイクです。
この細胞のモザイクの(1,2でレビュー)。可視化は、多くの場合、コルチ器官は横断面であることが必要です。特に、その核有毛細胞に関してbasally配置されているnonsensory柱とダイテルス"細胞は、、コルチ器官を横断切片のない視覚化できません。しかし、柱とダイテルス"細胞の微細な細胞質プロセスを含むコルチの哺乳類器官のデリケートな細胞構築は、標準的な免疫組織化学的染色技術と互換性のあるようなパラフィンおよび凍結切片のようなルーチン組織学的手続きによって維持することは困難です。
ここでは、共焦点顕微鏡に続く蝸牛、全体のマウントにこれらのビブラトーム切片の免疫組織化学染色の切片ビブラトームで構成されるシンプルかつ堅牢な手順を説明します。この手順は、マウスの肢芽、ゼブラフィッシュの腸、肝臓、膵臓、および心臓(選択された例については3-6を参照)を含む複数の臓器のimmunhistochemical解析に広く用いられている。さらに、この手順では、胚および成体マウス7の両方におけるコルチ器の変異体と制御器官における柱の細胞数のイメージングとquantitificatonの両方の判定に成功した。このメソッドは、しかし、現在広くコルチの哺乳類の器官を調べるために使用されていません。この手順の両方コルチ成人器官の微細な細胞構築の強化された保護を提供し、種々の細胞型の定量化を可能にするために可能性が説明されています。
プロトコル
1。内側の耳の単離と固定
- コルチ器官の細胞のパターニングの分析については、安楽死は、適切に胚、大人を上演した。
- 膜性内耳を含む、耳嚢をばらばらにする。マウスでは、これは簡単に(E)14.5日と古いが、これでE0.5は膣栓が検出された日である胚における胚で行うことができます。耳嚢の解剖は、正中線で断頭し、頭蓋骨の開放が最初に実行されます。それぞれの耳を(図1A)を公開するために脳を取り外します。内側の耳はそのまま使用して鉗子を(そのようなデュモン#5、図1Bのような)を砲撃することができます。イメージングコルチ器官の場合、耳嚢に関連するすべての神経と結合組織を注意深く除去する必要はありません。
- 4%4での穏やかな振盪パラホルムアルデヒド(PFA)° C一晩1.8ミリリットルのスクリューキャップNUNCクライオチューブバイアル、または他の適切なサイズの容器に浸漬することによって全体の内側の耳のを修正。 PFAのソリューションは、必要になるまでその後-20℃で保存し、DDH 2 0で新鮮なされるべきである。
- 翌日、1Xリン酸の三つの変更を固定液を洗い流す緩衝食塩水(PBS)。組織は、処理の準備が整うまで数ヶ月に数日のために滅菌1X PBSにまで保存することができます。成体組織の場合は、4で10%EDTA(0.27 M)でカルシウムが溶け出す° 1X PBSで洗浄し、ストレージに続いて5日間Cを、。
2。ビブラトームセクションカッティング
- 1X PBSで4%低融点アガロースを準備します。アガロースが溶液になるまで、1X PBSと電子レンジに低融点アガロースを追加。解決策は、オーバーバブルしないことに注意してください - 定期的に電子レンジから取り出して、渦が混在する。使用するまで55 ° Cの水浴中で解決してください。
- 鉗子を使用して、1X PBS溶液とピール- A -ウェイ埋め込み型の下部にある位置から内耳を削除します。金型から離れてピペットで余分な1X PBSを。液体4パーセント低融点アガロース(図2A)をたっぷり使って組織をカバーするために金型を埋める。
- 適切な平面でセクショニングの内耳を置きます。私はそれが頭の中でその場に残されていたかのように耳嚢の位置を近似し、横断面の切片によってコルチ器官の良い断面を取得しています。それは目に見える側面の半円形の運河(図2B)と、横方向に表示されるように大人、位置内耳をするE14.5胚のための。耳嚢の後側が作る折れ線は、切片の意図した平面(図2A、B)から45度の角度で約であるように。内耳の角度に耳嚢は(ASC)耳嚢の背側部分が最上部にある、蝸牛の基底回転が下(矢印、図2B)および前部の半円形の運河に設置されるべきであるようにしてください表示されている場合上部(図2B)になります。
- アガロースは30分以内、RTで設定されます。埋組織から4 ° Cのセクションへの準備ができるまでを含むピールアウェイ金型を転送する。 1X PBSに浸した湿ったペーパータオルを含むボックスの金型とストア内のアガロースをカバーするために1X PBSを追加、次の日まで延期されます切片場合。
- プラスチック金型離れて皮をむき。カミソリの刃を使用して、内耳の組織を含むアガロースボックスを切り取る。セクションの面ではストレートとアガロースブロックが下に接着されている面となるブロックの反対側に、平行になるように注意してください。アガロースが組織に浸潤していないので、組織がしっかりサポートされるように、組織の周りからあまりにも多くのアガロースをトリムしないでください。
- 切断面にブロックを取り付けるために瞬間接着剤を使用してください。
- ビブラトームは40〜100μmの厚さでセクション。 1X PBS、0.1%TritonX - 100を充填した組織培養皿内のセクションを保存します。蝸牛のスパイラルを通じて代表的なセクションを図に示します。 2C。
- 組織からアガロースを離れて分析する鉗子を使用してください。アガロースは、組織に浸透しませんが、単に内耳の外表面に貼着される。
- 組織の過度の剪断を防ぐために、大ホールの開口部にピペットを用いて必要に応じて、プールアガロースフリー、組織切片。または24ウェル組織培養皿 - 複数の異なる組織の複数の抗体染色を行う場合、セクションは16に整理することができます。
3。抗体染色のビブラトームのセクション
抗体染色に進みます。溶液中でのホールマウント、フリーフローティングのプロセスのセクション。下記のコルチ器官の柱細胞のS100マーカーの例の抗体染色のプロトコルですが、プロトコルは任意の抗体のために使用することができます。特に記載がない限り、すべての洗浄は室温で実施しています。
- マルチウェル組織培養皿では、30分間PBTの中で穏やかに振盪(1X PBS、1%ウシ血清アルブミン、0.1%トリトンX - 100)とフリーフローティングのセクションをインキュベートする。
- 従来のソリューションとブロック自由FLオフピペットPBTの中で穏やかに振盪+ 30分のための正常ヤギ血清(50μlのNGS / 1ミリリットルPBT)を持つセクションを浮動少数。
- 古いソリューションオフピペットとPBT + NGS(PBT + NGSのS100の1:200希釈)で希釈した一次抗体を加える。 4℃で一晩インキュベート℃で緩やかに振盪した。
- 一次抗体溶液オフピペット。 、5分3X洗う。 PBTと、その後4X、30分。 PBTと。
- PBT + NGSとブロック、30分。
- PBT + NGSで希釈した蛍光標識二次抗体(ヤギで提起された)でインキュベートする。 4℃で一晩インキュベート° C、または数時間、RT、穏やかな揺れ。
- 二次抗体溶液オフピペット。 、5分3X洗う。、その後4X、30分。 PBTと。
- 最後のPBTオフピペットは核対比を含む適切な水性封入剤で洗浄し、交換してください。
4。スライドおよび共焦点顕微鏡で取り付け部
カバーガラスと厚いセクションを粉砕しないようにするには、個々のセクションをマウントする際に、スペーサーは、顕微鏡スライドとカバースリップの間に挿入されている必要があります。下記の取付厚いビブラトームのセクションの2つの代替方法は、以下のとおりです。
- スペーサーは、組織切片の周りの広場に真空グリースのリムを配置することによって作成することができます。このように、カバースリップを敷設するときに、カバースリップの端は真空グリースで密封されます。しっかりとスライド上に付着するために親指でカバースリップの端を押し下げます。真空グリースはカバースリップのすべてのエッジの周りにきれいに、均一に存在する場合、スライドは、倒立型共焦点顕微鏡で使用するために十分に密封されます。
- また、スペーサーは、既知のメッシュサイズのアガロースクロマトグラフィー樹脂(例えば、アフィ - ゲルブルージェルとして、Bio - Rad)を使用して作成することができます。ピペットでカバースリップが配置される四隅のそれぞれの顕微鏡スライド上に樹脂を1μl。樹脂の4ドットの真ん中にピペットつの組織のセクションと取り付けメディア。カバースリップ。倒立型共焦点顕微鏡を使用している場合、nailpolishを使用して、顕微鏡のスライドにカバースリップをシール。
- 共焦点顕微鏡を用いて染色したビブラトームスライスの光学セクションを取得します。コルチ器官内のさまざまな種類の細胞を定量化するために、定義されたステップサイズ(1.5〜3μmの間)でのz -スタックを取得する。のセクションでは、核染料(ステップ3.8)で対比染色してください。画像は、共焦点画像のコレクションの後に任意のコンピュータの画面上で調べることができます。細胞は、画像はZ -スタックを順次検討しているように手動で核の出現と消失を観察することが数えることができる。
5。代表的な結果:
ビブラトームセクションを通じて代表的な共焦点Z -スタックは、柱とダイテルス"細胞内に存在するS100タンパク質、のために染色し、核染色(図3A - F)で対比。各パネルはパネルで、3μmのステップで取得された共焦点画像である共焦点画像ビブラトームセクションとパネルのFビブラトームセクション内で最も内部的に取得共焦点像の表面に最も近い得た。コルチ器官の形態は、低侵襲中断されます。特に、柱細胞の細胞質の拡張子が壊れていない。 Z -スタック(図3A 3Fへ)を介して柱の細胞核の出現と消失に注目することによって、両方の内側と外側の柱の細胞数は、(。 - F番号、図3Aを参照)をカウントすることができます。共焦点画像ごとの各細胞型の数が少ないため、このアプローチは、コルチ器官の中で最も細胞の種類をカウントするために使用することができます。
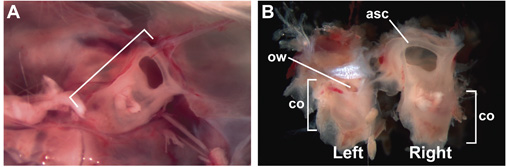
図1は、無傷の、15週齢、大人内耳は耳のカプセルに封入した。 (A)の右耳嚢は、(括弧)脳の除去後、ヘッド内部の視点から見て、頭蓋骨に収められた。前方には、右側にあります。 (B)はそのまま、15週齢の内側の耳の頭蓋骨から郭清後。左内耳の側面が見える、右内耳の内側面が見えるようになります。ラベルは前の半円形の運河(ASC)、CO(蝸牛)、およびOW(卵円窓)の位置を示している。
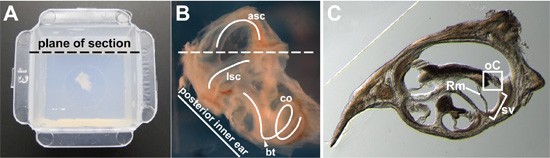
図2()ピールアウェイ型の中央にアガロースに埋め込 まれている15週齢の成体、より全体内耳。セクションの意図する面が表示されます。前の埋め込み〜15週齢、全体内耳の(B)クローズアップ画像。膜迷路がより明確に見ることができるように周囲の骨の部分が離れて解剖されています。横方向の半円形の運河(LSC)、前半円形の運河(ASC)、および蝸牛(CO)(白のカーブ)がトレースされます。蝸牛の基底回転(矢印)とセクションの意図された平面(破線)が示されている。 (C)代表CROは蝸牛を通しての断面。蝸牛管を通じて1断面では、コルチ器官(OC)がボックス化されると、血管条(SV)は、括弧で、ライスナーの膜は、(RM)が示されている。
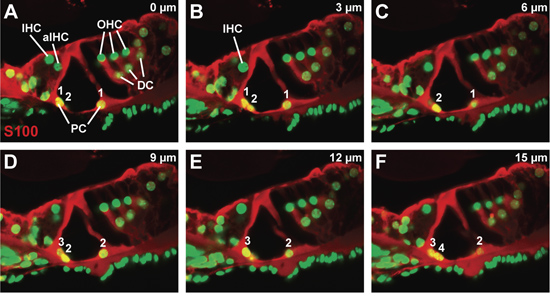
図3。P21において、野生型マウスにおけるコルチ器官。 (AF)柱細胞とダイテルス"細胞を可視化するコルチS100抗体染色臓器3〜μmのステップサイズでのシーケンシャル共焦点シリーズ、、。シリーズの開始から終了までの内側と外側の柱細胞のカウントは番号が付けられています。略語:IHC(内有毛細胞)、aIHC(隣接する内側の有毛細胞)、OHC(外有毛細胞)、PC(柱のセル)、DC(ディーターズ"セル)。
ディスカッション
免疫組織化学と共焦点イメージングが続くビブラトーム切片、の手順では、最小限の組織損傷とコルチ器官の可視化が可能になります。明らかに、ビブラトームセクションで内部の地域から採取した共焦点画像は固定のアーティファクトによって制限される細胞形態の優れた保全を示しています。このような柱細胞の細胞質の拡張子の区切りなど、時折携帯電話の中断は、(図示せず)が観?...
開示事項
謝辞
著者は、アガロースビーズを使用してセクションをマウントするために提案するための共焦点顕微鏡と博士建張のための子供の研究所イメージングコアの使用を承認したいと思います。この作品は、NIHの助成金DC010387によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| ライカは、ブレードミクロトームを振動VT1000S | ライカ | ||
| ツァイスLSM510レーザー走査型共焦点顕微鏡 | ツァイス | ||
| 学生デュモン#5鉗子 | ファイン科学ツール | 91150〜20 | |
| 超高純度低融点アガロース | インビトロジェン | 16520-050 | |
| ピールウェイ埋め込み型 | Polysciences | 18986または18646A | |
| ウシ血清アルブミン | ジャクソンイムノ | 001-000-162 | |
| ヤギ血清 | インビトロジェン | 16210-064 | |
| S100 | ダコ | Z0311 | |
| のAlexa Fluor ® 568ヤギ抗ウサギIgG | インビトロジェン | - 11036 | 1:1000希釈 |
| Vectashield | ベクトル研究所 | H - 1000 | |
| YO - PRO - 1 | インビトロジェン | Y3603 | |
| 真空グリース | フィッシャー | S41718 | |
| アッフィのジェルブルージェル | Bio - Rad社 | 153-7301 |
参考文献
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved