Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Vibratome sectionnement pour la préservation accrue de la cytoarchitecture de l'Organe de Corti des mammifères
Dans cet article
Résumé
Une procédure simple de vibratome sectionner l'organe de Corti, suivie par microscopie confocale immunohistochimie et est décrit. Cette procédure permet une meilleure conservation de l'cytoarchitecture amende de l'organe de Corti des mammifères, et permet par conséquent d'une quantification précise des types de cellules.
Résumé
L'organe de Corti des mammifères est une mosaïque très ordonné cellulaires de cheveux et de mécano nonsensory cellules de soutien
(Examiné en 1,2). Visualisation de cette mosaïque cellulaires exige souvent que l'organe de Corti est à section. En particulier, le pilier nonsensory et les cellules de Deiters, dont les noyaux sont situés basale à l'égard des cellules ciliées, ne peuvent être visualisées sans coupes transversales de l'organe de Corti. Toutefois, la cytoarchitecture délicat de l'organe de Corti des mammifères, y compris les processus cytoplasmiques fines du pilier et les cellules de Deiters, est difficile à conserver par la routine des procédures histologiques telles que la paraffine et cryo-coupe, qui sont compatibles avec les techniques standards de coloration immunohistochimique.
Je décris ici une procédure simple et robuste composé de vibratome sectionnement de la cochlée, la coloration immunohistochimique de ces sections vibratome dans la montagne entière, suivie par microscopie confocale. Cette procédure a été largement utilisée pour l'analyse immunohistochimique de multiples organes, y compris le bourgeon de membre de la souris, le poisson-zèbre intestins, le foie, le pancréas et le cœur (voir 3-6 pour des exemples choisis). En outre, cette procédure a été réussie pour les deux imagerie et quantitificaton du nombre de cellules dans les organes des piliers de mutants et de contrôle de Corti à la fois dans les embryons et des souris adultes 7. Cette méthode, cependant, n'est pas largement utilisée pour examiner l'organe de Corti des mammifères. Le potentiel de cette procédure à la fois à assurer la préservation accrue de la cytoarchitecture amende de l'organe de Corti et les adultes permettent de quantifier les différents types de cellules est décrite.
Protocole
1. L'isolement et la fixation de l'oreille interne
- Pour l'analyse de la structuration cellulaire dans l'organe de Corti, euthanasier correctement mis en scène des embryons ou des adultes.
- Disséquer la capsule otique, contenant de l'oreille interne membraneuse. Chez la souris, ce qui peut être facilement fait sur les embryons au embryonnaires (E) 14,5 jours et plus, dont E 0,5 est le jour où un bouchon vaginal a été détectée. La dissection de la capsule otique est accompli d'abord par la décapitation et l'ouverture du crâne à la ligne médiane. Retirer du cerveau afin d'exposer chaque oreille (Fig. 1A). Oreille interne peut être déboursé intacte pince à l'aide (comme Dumont # 5, Fig. 1B). Si l'imagerie de l'organe de Corti, l'enlèvement minutieux de tous les tissus conjonctifs et neuronaux associés à la capsule otique n'est pas nécessaire.
- Fixer l'ensemble oreille interne par immersion dans du paraformaldéhyde 4% (PFA) avec doux balancement à 4 ° C pendant une nuit dans 1,8 ml à bouchon à vis NUNC Cryo-tube de flacons, ou tout autre récipient de taille appropriée. Solution de PFA doivent être préparées dans le trou DDH 2 0, puis stocké à -20 ° C jusqu'à ce que nécessaire.
- Le lendemain, laver le fixateur avec trois changements de phosphate 1X saline tamponnée (PBS). Les tissus peuvent être conservés dans du PBS 1X stériles pour les jours à plusieurs mois avant d'être prêt pour la transformation. Pour des tissus adultes, détartrer dans 10% d'EDTA (0,27 M) à 4 ° C pendant 5 jours, suivis d'un rinçage et le stockage dans du PBS 1X.
2. Découpage des sections vibratome
- Préparer 4% d'agarose bas point de fusion dans du PBS 1X. Ajouter à faible point de fusion d'agarose pour PBS 1X et micro-ondes jusqu'à ce agarose est en solution. Veillez à ce que la solution ne se propage pas plus - sortir de la micro périodiquement et faire tourbillonner pour mélanger. Conserver la solution dans un bain d'eau à 55 ° C jusqu'au moment de servir.
- En utilisant une pince, retirez l'oreille interne à partir du PBS 1X solution et la position au fond d'un moule intégration Peel-A-Way. Pipet tout excès de PBS 1X à partir du moule. Remplir le moule pour couvrir le tissu avec beaucoup de liquide à 4% d'agarose bas point de fusion (figure 2A).
- Position de l'oreille interne pour la coupe dans le plan approprié. J'ai obtenu de bonnes sections de l'organe de Corti en rapprochant la position de la capsule otique, comme si elle avait été laissé en place dans la tête et de sectionnement dans le plan transversal. Pour E14.5 embryons à des adultes, la position de l'oreille interne de sorte qu'il est vu latéralement, avec les latéraux semi-circulaire du canal visible (Fig. 2B). Angle de l'oreille interne de sorte que la ligne formée par la face postérieure de la capsule otique est approximativement à un angle de 45 degrés par rapport au plan prévu de sectionnement (Fig. 2A, B). Lorsque la capsule otique est considéré sorte que la partie dorsale de la capsule otique est au sommet, la tour basal de la cochlée devrait être situé dans le bas (flèche, fig. 2B) et la partie antérieure du canal semi-circulaire (asc) devrait être au sommet (figure 2B).
- Agarose sera fixé à RT dans 30 min. Transfert Peel-Away moules contenant des tissus intégrés à 4 ° C jusqu'au moment de la section. Si la coupe sera reportée à la journée suivante, ajoutez du PBS 1X pour couvrir l'agarose dans le moule et le ranger dans une boîte contenant des essuie-tout humide trempé dans du PBS 1X.
- Peler le moule en plastique. En utilisant une lame de rasoir, découper une boîte d'agarose contenant le tissu de l'oreille interne. Prenez soin de s'assurer que le plan de coupe est droite et parallèle au côté opposé du bloc, qui sera la surface sur laquelle le bloc d'agarose est collé. Depuis l'agarose ne infiltrent le tissu, ne pas couper trop d'agarose à travers le tissu, de sorte que le tissu sera bien soutenu.
- Utilisez la superglue pour fixer le bloc à la surface de coupe.
- Section de 40 à 100 um d'épaisseur par vibratome. Enregistrer des sections dans un plat de culture de tissus remplis de PBS 1X, 0,1% TritonX-100. Une section représentant la spirale cochléaire est indiquée dans la Fig. 2C.
- Utilisez une pince à disséquer l'écart de l'agarose à partir des tissus. Agarose ne pénètre pas les tissus, mais sera simplement collé à la surface externe de l'oreille interne.
- Si désiré, une piscine d'agarose-libre, les tissus sectionnés à l'aide d'une pipette avec une grande ouverture trous à prévenir le cisaillement excessif des tissus. Si vous effectuez des taches d'anticorps multiples sur plusieurs tissus différents, les articles peuvent être organisées dans un 16 - ou 24-vaisselle ainsi la culture de tissus.
3. Anticorps sections coloration vibratome
Procéder à des anticorps tache. Sections de processus dans l'ensemble du montage, flottant dans la solution. Ci-dessous un exemple de protocole de coloration d'anticorps pour le marqueur des cellules S100 pilier de l'organe de Corti, mais le protocole peut être utilisé pour n'importe quel anticorps. Tous les lavages sont effectués à température ambiante, sauf indication contraire.
- Dans un plat à multi-puits de culture de tissu, incuber flottant sections doux balancement de PBT (PBS 1X, 1% d'albumine sérique bovine, 0,1% de Triton X-100) pendant 30 min.
- Pipet off ancienne solution et de bloc libre-flottant sections doux balancement de PBT + sérum normal de chèvre (50 END ul / 1 ml PBT) pendant 30 min.
- Pipet off ancienne solution et ajouter l'anticorps primaire dilué dans PBT + END (1:200 dilution du S100 en PBT + END). Incuber une nuit à 4 ° C avec doux balancement.
- Pipet hors solution d'anticorps primaire. Laver 3x, 5 min. avec des PBT, puis 4X, mn 30. avec des PBT.
- Bloc avec PBT + NGS, 30 min.
- Incuber avec l'anticorps secondaire conjugué fluorescent (soulevée dans de chèvre) dilué dans PBT + END. Incuber une nuit à 4 ° C, ou quelques heures, RT, doux balancement.
- Pipet hors solution d'anticorps secondaire. Laver 3x, 5 min., Puis 4X, mn 30. avec des PBT.
- Pipet off dernière PBT laver et remplacer par le milieu de montage approprié aqueuse contenant une contre-coloration nucléaire.
4. Sections de montage sur des lames et la microscopie confocale
Pour éviter l'écrasement des sections d'épaisseur avec la lamelle, lors du montage des sections individuelles, une entretoise doit être inséré entre la lame de microscope et de la lamelle. Voici deux méthodes alternatives de montage sections vibratome épaisse:
- Une entretoise peut être créé en plaçant une jante de graisse à vide dans un carré autour de la coupe de tissu. Ainsi, lorsque fixant la lamelle, les bords de la lamelle sera scellé avec de la graisse à vide. Appuyez sur les bords de la lamelle avec votre pouce fermement qu'il adhère sur la lame. Si la graisse à vide est soigneusement et uniformément présents autour de tous les bords de la lamelle, la lame sera scellé suffisante pour une utilisation sur un microscope inversé confocal.
- Alternativement, une entretoise peut être créé en utilisant la chromatographie d'agarose résine de maillage connus (tels que Affi-Gel Blue Gel, Bio-Rad). Pipeter 1 pl de résine sur la lame du microscope dans chacun des quatre coins où la lamelle sera placé. Coupe de tissu Pipet un et les médias de montage dans le milieu des quatre points de la résine. Lamelle. Si vous utilisez un microscope inversé confocal, sceller la lamelle sur la lame de microscope à l'aide nailpolish.
- Obtenir des sections optiques des tranches vibratome colorées à l'aide de microscopie confocale. Afin de quantifier divers types de cellules au sein de l'organe de Corti, obtenir un Z-stack à une taille étape définie (entre 1,5 et 3 microns). Les articles doivent être contre-colorées avec un colorant nucléaire (étape 3.8). Les images peuvent être examinées sur n'importe quel écran d'ordinateur après la collecte d'image confocale. Les cellules peuvent être comptées manuellement soit en observant l'apparition et la disparition des noyaux que les images sont examinés successivement par le z-stack.
5. Les résultats représentatifs:
Un représentant confocale z-stack à travers une section vibratome, colorées pour la protéine S100, qui est présent dans les cellules et les piliers de Deiters, et contre-colorées avec un colorant nucléaire (Fig. 3A-F). Chaque panneau est l'image confocale prise à 3 um-étapes, avec le panneau A l'image confocale obtenu le plus proche de la surface de la section vibratome et le panneau F l'image confocale obtenu la plus interne au sein de la section vibratome. La morphologie de l'organe de Corti apparaît peu perturbé. En particulier, les extensions cytoplasmiques des cellules piliers ne sont pas brisés. En notant l'apparition et la disparition des noyaux de cellules à travers le pilier z-stack (Fig. 3A à 3F), tant en nombre piliers intérieurs et extérieurs de cellules peuvent être comptés (voir la numérotation, la figure 3A -. F). En raison du petit nombre de chaque type cellulaire par image confocale, cette approche peut être utilisée pour compter la plupart des types de cellules au sein de l'organe de Corti.
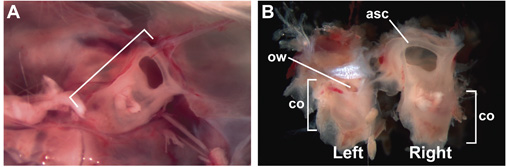
Figure 1. Intact, 15-week-vieux, adulte oreille interne enfermé dans la capsule otique. (A) La capsule otique droite (entre crochets) enfermé dans le crâne, vu d'un point de vue de l'intérieur de la tête, après le retrait du cerveau. Antérieure est à la droite. (B) Intact, 15 semaines d'âge oreille interne après dissection du crâne. Surface latérale de l'oreille interne gauche est visible; face médiale de l'oreille droite interne est visible. Les étiquettes indiquent les emplacements de la partie antérieure du canal semi-circulaire (asc), co (cochlée), et OW (fenêtre ovale).
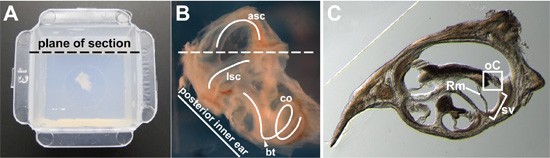
Figure 2 (A). Oreille intérieure entier d'un adulte de 15 semaines, a embarqué dans l'agarose dans le centre d'un moule de Peel-Away. Destiné avion de la section est indiquée. (B) Close-up image d'un 15-semaines-vieille, l'oreille interne entière avant l'enrobage. Une partie de l'os environnant a été disséqué de sorte que le labyrinthe membraneux pourrait une vue plus claire. Le latéraux du canal semi-circulaire (LSC), semi-circulaire antérieure du canal (ASC), et la cochlée (co) sont tracés (courbes blanches). Le tour basal de la cochlée (tête de flèche) et l'avion de la section destinée (ligne pointillée) sont indiqués. (C) représentant Cross-section à travers la cochlée. Dans une section transversale du canal cochléaire, l'organe de Corti (OC) est en boîte, la strie vasculaire (sv) est entre crochets, et la membrane de la Reissner (Rm) est indiquée.
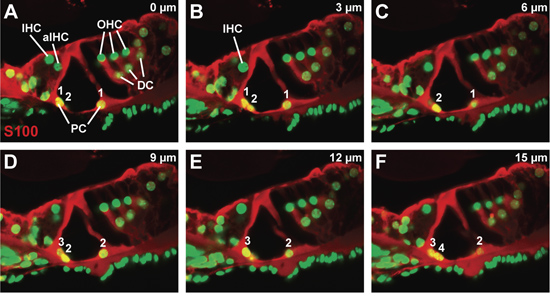
Figure 3. L'organe de Corti dans une souris de type sauvage au P21. (AF) série séquentielle confocale, lors d'une étape cellules 3 microns de taille, grâce à un anticorps S100 teinté organe de Corti de visualiser les cellules pilier et de Deiters. Comtes de cellules piliers intérieurs et extérieurs du début à la fin de la série sont numérotés. Abréviations: IHC (cellules ciliées internes), AIHC (adjacent cellules ciliées internes), ACT (cellules ciliées externes), PC (cellule pilier), DC (cellules de Deiters).
Access restricted. Please log in or start a trial to view this content.
Discussion
La procédure de sectionnement vibratome, suivi par imagerie confocale immunohistochimie et permet la visualisation de l'organe de Corti à une lésion tissulaire minime. De toute évidence, les images prises à partir confocale régions internes dans la section vibratome montrent une excellente conservation de la morphologie cellulaire qui n'est limitée que par des artefacts de fixation. Images prises confocale à proximité des deux coupe-surfaces d'une section vibratome sont souvent impossibles à distin...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
L'auteur tient à remercier l'utilisation de Core pour enfants de l'Institut de recherche pour l'imagerie de microscopie confocale et le Dr. Jian Zhang pour la suggestion de monter des sections en utilisant des billes d'agarose. Ce travail a été financé par le NIH octroi DC010387.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Leica VT1000S lame vibrante microtome | Leica | ||
| Zeiss LSM510 microscope confocal à balayage laser | Zeiss | ||
| Étudiant Dumont # 5 forceps | Outils Fine Science | 91150-20 | |
| UltraPure bas point de fusion d'agarose | Invitrogen | 16520-050 | |
| Moisissures intégration Peel-A-Way | Polysciences | 18986 ou 18646A | |
| l'albumine sérique bovine | Jackson ImmunoResearch | 001-000-162 | |
| Sérum de chèvre | Invitrogen | 16210-064 | |
| S100 | Dako | Z0311 | |
| Alexa Fluor 568 de chèvre anti-IgG de lapin | Invitrogen | A-11036 | Dilution de 1:1000 |
| Vectashield | Vector Labs | H-1000 | |
| YO-PRO-1 | Invitrogen | Y3603 | |
| graisse à vide | Fisher | S41718 | |
| Affi-Gel Blue Gel | Bio-Rad | 153-7301 |
Références
- Lim, D. J. Functional structure of the organ of Corti: a review. Hear Res. 22, 117-146 (1986).
- Raphael, Y., Altschuler, R. A. Structure and innervation of the cochlea. Brain Res Bull. 60, 397-422 (2003).
- Chung, W. S., Shin, C. H., Stainier, D. Y. Bmp2 signaling regulates the hepatic versus pancreatic fate decision. Dev Cell. 15, 738-748 (2008).
- Sun, X., Mariani, F. V., Martin, G. R. Functions of FGF signalling from the apical ectodermal ridge in limb development. Nature. 418, 501-508 (2002).
- Trinh, L. A., Stainier, D. Y. Fibronectin regulates epithelial organization during myocardial migration in zebrafish. Dev Cell. 6, 371-382 (2004).
- Yin, C., Kikuchi, K., Hochgreb, T., Poss, K. D., Stainier, D. Y. Hand2 regulates extracellular matrix remodeling essential for gut-looping morphogenesis in zebrafish. Dev Cell. 18, 973-984 (2010).
- Shim, K., Minowada, G., Coling, D. E., Martin, G. R. Sprouty2, a mouse deafness gene, regulates cell fate decisions in the auditory sensory epithelium by antagonizing FGF signaling. Dev Cell. 8, 553-564 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon