A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A أسلوب الخطوة بخطوة لإعادة تشكيل ناقلة الى جزيئات الدهون ABC Nanodisc
In This Article
Summary
Nanodiscs هي جسيمات صغيرة القرصية التي تتضمن البروتينات الغشاء في قطعة صغيرة من طبقة ثنائية فسفوليبيد. نحن نقدم بروتوكول البصرية التي تظهر إدماج خطوة بخطوة من نقل MalFGK2 إلى القرص.
Abstract
وnanodisc هو الجسيمات قريصي (~ 10-12 نانومتر الكبيرة) أن البروتينات الغشاء فخ في قطعة صغيرة من طبقة ثنائية فسفوليبيد. وnanodisc هو خيارا جذابا بشكل خاص لدراسة البروتينات الغشاء، وخاصة في سياق يجند مستقبلات التفاعلات. رائدا في الطريقة التي Sligar ويقوم الزملاء على خصائص متقابلة الزمر من المهندسة عالية A-حلزونية سقالة البروتين المستمد من A1 ئي. وجوه مسعور من البروتين سقالة التفاعل مع سلاسل جانبية أسيل الدهنية من طبقة ثنائية المادة الدهنية في حين أن المناطق القطبية تواجه البيئة المائية. تحليل البروتينات الغشاء في nanodiscs لها مزايا هامة على الحويصلية لأن جزيئات صغيرة، متجانسة وللذوبان في الماء. وبالإضافة إلى ذلك، يمكن تطبيق أساليب الكيمياء الحيوية والفيزياء الحيوية التي عادة ما تحجز للبروتينات قابلة للذوبان، ومن جانبي الغشاء. في هذا البروتوكول البصرية، فإننا نقدم إعادة خطوة بخطوة من charac جيداterized نقل ABC البكتيرية، والذكور 2 MalFGK المعقدة. تشكيل القرص هو عملية التجميع الذاتي التي تعتمد على التفاعلات التي تحدث أثناء مسعور في الإزالة التدريجية للمواد التنظيف. نحن وصف الخطوات الأساسية ونسلط الضوء على أهمية اختيار الصحيح البروتين إلى الدهون نسبة للحد تشكيل المجاميع والجسيمات الأكبر حجما polydisperse الحويصلية مثل. نوعية بسيطة مثل اللوني يتحكم الترشيح هلام، هلام الكهربائي الأصلي وديناميكية تشتت الضوء الطيفي ضمان أنه تم تشكيل الأقراص بشكل صحيح.
Protocol
وعموما عملية إعادة إعماره
عملية إعادة خلط يبدأ الغشاء سقالة البروتين (MSP) مع مجمع تنقية 2 MalFGK في وجود المنظفات الفوسفاتية-solubilized. ويتبع الخطوة عن طريق إزالة البطيء للالمنظفات من مادة البوليسترين الممتزات دعا بيو الخرز أو Amberlite (الشكل 1). عملية التجميع التلقائي يحدث على الأرجح بسبب التفاعلات بين عديم الأقطاب الفوسفورية مسعور، 2 MalFGK معقدة وسطح البروتين ومتقابلة الزمر MSP. المنتج النهائي هو الجسيمات القرصية المصنوعة من اثنين من جزيئات التفاف حول المجمع MSP 2 MalFGK. يتم فصل الجزيئات من adducts والمجاميع المتطرفة بواسطة الطرد المركزي والتحليلية اللوني الحجم الاستبعاد. وتتميز الجزيئات التي كتبها الأصلي هلام الكهربائي ودينامية تشتت الضوء الطيفي.
عنوان "> 1. إعداد الغشاء سقالة البروتين، MSP- THE-MSP له الموسومة (الإصدار MSP1D1 1) وينتج من pMSP1D1 البلازميد في E. القولونية BL21 (DE3) التي يسببها في OD 600 ~ 0،5 مع 0.5 مم الآيزوبروبيل β-D-thiogalactopyranoside-1 لمدة 3 ساعة عند 37 ° C.
- ويتم حصاد الخلايا بواسطة الطرد المركزي عند 5000 x ج لمدة 10 دقيقة في 4 درجات مئوية ومعلق في TSG10 العازلة التي تحتوي على 100 فلوريد phenylmethanesulfonyl ميكرومتر.
- والخلايا هي lysed مع الصحافة الفرنسية (3X) عند 8،000 رطل وتتم إزالة المواد غير القابلة للذوبان بواسطة الطرد المركزي عند 5000 x ج لمدة 10 دقيقة في C. ° 4 يتم عزل جزء القابلة للذوبان التي تحتوي على MSP بواسطة الطرد المركزي المتطرفة في 125،000 x ج لمدة 45 دقيقة.
- يتم تنقيته من MSP من النيكل مخلبية اللوني باستخدام ~ 1.5 مل ني sepharose و HP في TSG10 العازلة. تغسل مع الملوثات بعيدا TSG10 العازلة التي تحتوي على 50 ملي الاميدازول. ومزال في MSP مع TSG10 العازلة التي تحتوي على 600 ممالاميدازول. ومدال البروتين النقي في TSG10 العازلة وتخزينها في -70 ° C عند تركيز بروتين 10-15 ملغ من ~ / مل.
2. إعداد مجمع 2 MalFGK
- ال 2 MalFGK المعقدة، له الموسومة في محطة سي من ذالك، ويعبر عن البلازميد من pBAD22-FGK في E. القولونية BL21 (DE3) والتي يسببها في OD 600 ~ 0،5 مع 0.2٪ L-أرابينوز لمدة 3 ساعة عند 37 ° C.
- بعد تحلل الخلايا والطرد المركزي كما في الخطوة 1.3، وبيليه معلق في الغشاء TSG20 العازلة عند تركيز النهائي من 5 ملغ / مل. وsolubilized المواد مع 1٪ ث / ت ن دوديسيل-β-maltopyranoside (DDM) لمدة 3 ساعة في 4 درجات مئوية مع الهز لطيف.
- تتم إزالة المواد غير القابلة للذوبان بواسطة الطرد المركزي المتطرفة كما في الخطوة 1.3 و طاف يحتوي على solubilized يتم جمع 2 MalFGK معقدة وتنقيته كما في الخطوة 1.4، ولكن من دون غسيل الكلى.
- ابعد من ذلكويتحقق عن طريق تنقية ص الكروماتوغرافيا الترشيح في المخزن المؤقت TSGD على HR 200 Superdex 10/300 في العمود معدل تدفق 0.5 مل / دقيقة.
3. إعداد من الدهون الفوسفاتية
- وE. القولونية الليبيدات الكلية الذائبة في استخراج كلوروفورم يتم فصل إلى 1000 نانومول مأخوذة في أنابيب المسمار microfuge الغطاء. يبخر المذيب تحت تيار لطيف من النيتروجين وتجفيفها في ليلة وضحاها مزيد من فراغ مجفف.
- يذوب الدهون في الفيلم TS العازلة في تركيز نانومتر 5 انتهاء الوقت وvortexed بقوة وsonicated. سوف تظهر الدهون المذابة مبهمة قليلا بسبب الذوبان بهم في العام العازلة TS المائي، ولكنها ينبغي أن تظل في التعليق. يضاف إلى DDM تركيز النهائي من 0.5٪ (~ 10 ملم)، حيث يصبح الحل واضح.
- يتم وضع الخليط الدهون في حمام مائي والنبض sonicated لمدة 5 ثوانى مرات عن 5 ~. يتم تخزين الدهون في الخليط C ° 4 لأقصى 1 ويك.
4. إعداد الحيوية الخرز
- حوالي 10-15 مل (حجم الجافة) يتم وضع الخرز الحيوية في أنبوب 50 مل.
- تغسل حبات تباعا مع 50 مل من الميثانول بنسبة 100٪، والإيثانول 95٪، milliQ H O 2، وأخيرا TS العازلة (مرتين لكل منهما).
- يتم تخزين حبات غسلها عند 4 ° C ~ 10 في المخزن المؤقت TS مل.
5. Nanodisc إعادة إعماره
- وتضعف MSP في المخزن المؤقت TSGD في تركيز النهائي من ملغ 7 ~ / مل (~ 0.3 مم).
- يتم خلط ~ 2 نانومول مجمع تنقية 2 MalFGK في البروتين: MSP: نسبة الدهون من 1:3:60 أو 1:3:400 في المخزن المؤقت TSGD. تركيز النهائي هو 6 ميكرومتر MalFGK 2 و 18 ميكرومتر والدهون MSP ميكرومتر 360 (1:3:60) أو 2.4 ملي الدهون (1:3:400). الحجم النهائي هو 300 ميكرولتر. تركيز DDM النهائي هو 0.08٪ (~ 1.6 مم). تركيز النهائي من الجلسرين يعتمد على مقدار من الدهون المضافة ولكن لا يزال حوالي 5-10٪ V / V.
- ~ تم إضافة 50 ميكرولتر من الحيوية حبة التعليق على أنبوب وحضنت الخليط بين عشية وضحاها على طاولة هزاز في C. ° 4
- وsedimented حبات عن طريق الجاذبية وpipetted الحل من خلال معلومات سرية لتجنب ضيق بقدر الحيوية الخرز ممكن.
- يتم إزالة رواسب كبيرة بواسطة الطرد المركزي المتطرفة في 100،000 x ج لمدة 20 دقيقة. وتنقيته من الأقراص الكروماتوغرافيا الترشيح كما في الخطوة 2.4 في TSG10 العازلة. يتم تجميع الكسور التي تحتوي على أقراص وينبغي أن يكون قسامة إعادة حقن على عمود هلام نفس الترشيح لاختبار استقرار الإعداد.
- يمكن للأقراص تنقية تخزينها في -70 ° C لفترة طويلة من الزمن. بعد ذوبان الجليد على ذلك، ينبغي إخضاع أقراص لالطرد المركزي المتطرفة كما في الخطوة 5.5 إلى إزالة رواسب المحتملة. ينبغي تحليل وقسامة من الترشيح هلام اللوني لضمان تجميع كبيرة أو هطول الأمطار لم يحدث خلال الذوبانالعملية.
6. الأم جل الكهربائي
- ويتم تحليل من 1 ميكرومتر nanodiscs (حوالي 0.2 ملغ / مل) في الصفحة الأصلية 6، 7 (تريس، حمض الهيدروكلوريك درجة الحموضة 8.8، 4-12٪) لتقييم جودة إعادة (الشكل 3A).
- كما يتم تقييم الربط من الذكور (1 ميكرومتر) إلى MalFGK 2-معقدة تشكيلها في nanodiscs من قبل الناطقين PAGE (الشكل 3A).
- بعد الكهربائي، اتسخت لهلام مع الأزرق لمدة 10 دقيقة Coomassie، وdestained للساعة 1 ~.
7. ديناميكية تشتت الضوء (DLS)
- وتنقيته من Nanodiscs الكروماتوغرافيا الترشيح كما في الخطوة 2.4 في TSG10 العازلة باستخدام إلي 200 Superdex HR 10/300 في العمود معدل تدفق 0.1 مل / دقيقة. يتم تجميع الكسور التي تحتوي على nanodiscs وركزوا على 10 ملغ ~ / مل مع مرشح Amicon الطرد المركزي.
- يتم تصفية العينة مرتين (0.22 ميكرون فلتر) قبل التحليل باستخدام DLSوnanostar DynaPro صك (وايت التكنولوجيا) في (أ) 1 ميكرولتر حجم كوفيت الكوارتز الداخلية. تم تجهيز البيانات باستخدام برنامج DYNAMICS (وايت التكنولوجيا) لتقدير القطر والوزن الجزيئي للجزيئات.
8. قياسات أتباز
- يتم تحديد النشاط أتباز من MalFGK 2-المعاد nanodiscs باستخدام مقايسة اللونية 8.
- يتم خلط 1 ميكرومتر من الأقراص تنقية و 1 ملي ATP مع كميات متزايدة من C ذكر وحضنت عند 37 درجة لمدة 20 دقيقة. يتم قياس الافراج عن الفوسفات غير العضوي في 660 نيوتن متر.
- تتم مقارنة كمية الفوسفات المفرج عنهم إلى منحنى القياسية ولدت مع الفوسفور حل قياسي.
9. ممثل النتائج
وتنقيته من nanodiscs بواسطة الكروماتوغرافيا الترشيح (الشكل 2A، اليسار). وكروماتوغرام يدل على أن الغالبية العظمى من د المعادISCS (أسود التتبع) أزل باعتبارها ذروة واحدة، في حين أن الأقراص المصنوعة من الدهون الزائدة (أحمر التتبع) أزل في حجم الفراغ ونتيجة لسلسلة من القمم واسعة. ويتم تحليل مزيد من نوعية nanodiscs من الأم الكهربائي للهلام وديناميكية تشتت الضوء الطيفي (DLS). أقراص المعاد بشكل صحيح كما ترحيل فرقة حادة على هلام في حين أن أعيد تشكيلها في وجود فائض من الدهون وترحيل مسحة (2A الشكل، والحق). تحليل DLS يدل على أن السكان القرص متجانسة ذات قطر متوسط قدره 11.4 نانومتر (الشكل 2B). الأقراص المعاد يكون لها الوزن الجزيئي واضح من 215 كيلو دالتون على أساس تقريب DLS. عرض على نطاق واسع في تشكيل العينات وجود الدهون الزائدة حول كعبرة 100 نانومتر، والتي هي نموذجية لغير متجانسة العينات.
ويتم تقييم نوعية معقدة من 2 MalFGK الأصلية جل الكهربائي ونشاطها من خلال أتبازقياسات (الشكل 3). والمالتوز ذكر بروتين ملزمة يتحد مع تقارب عالية لنقل 2 MalFGK 9 و 10. استخدام غير يبدل طبيعة الكهربائي للهلام، فمن الممكن الكشف عن مجمع بين الذكر وMalFGK 2 (الشكل 3A). يظهر تحفيز النشاط أتباز ذالك 2 من الذكور في الشكل 3B.
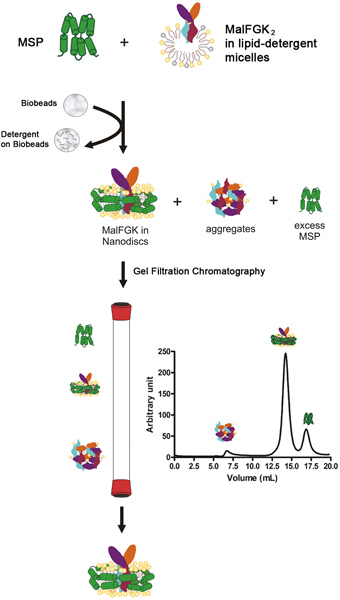
الشكل 1. مخطط نموذجي لبروتوكول إعادة.
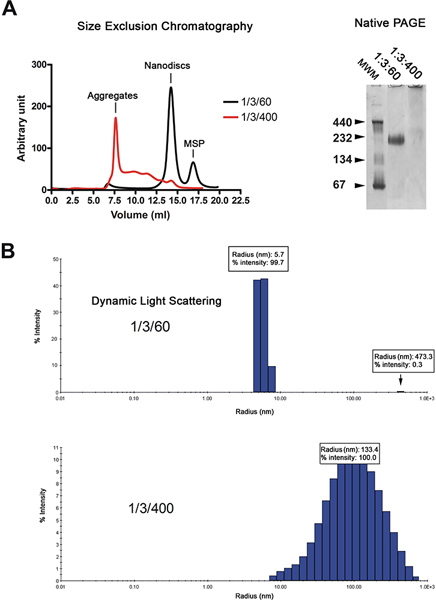
الشكل 2. مراقبة جودة إعداد nanodisc. A. تشكيل هلام تحليل الترشيح (200 Superdex HR 10 / عمود 300) من نسبة الدهون في nanodiscs منخفضة (1/3/60؛ التتبع أسود) أو ارتفاع نسبة الدهون (1/3/400؛ التتبع الحمراء). الأم الكهربائي للهلام لإعداد القرص نفسه. موليشار إلى علامات الوزن ecular في كيلو دالتون. B. تشتت الضوء الحيوي تحليل إعداد القرص نفسه. اضغط هنا لمشاهدتها بشكل اكبر شخصية .

الشكل 3. تحليل MalFGK 2-nanodisc الجسيمات. A. هلام تحليل التحول من ذكر حضنت مع كميات متزايدة من الجزيئات 2-nanodisc MalFGK. B. ATPase النشاط من MalFGK 2-nanodisc جزيئات بوصفها وظيفة من تركيز ذكر.
Discussion
وصفنا إجراء بسيط لإعادة تشكيل المالتوز في نقل nanodiscs. الناقل هو أتباز نشطة ويمكن أن يعاد التفاعل مع شريك ذكر ملزمة للذوبان (الشكل 3). إعادة تشكيل ناجحة للنقل في nanodiscs فتح الطريق لتحليل إضافية البيوفيزيائية والكيميائية الحيوية. سوف تكون ذات أهمية خاصة في التحلي?...
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل المعهد الكندي للبحوث الصحية. وقد تم تمويل CSC زمالة ما بعد الدكتوراه من من العلوم الطبيعية والهندسة مجلس البحوث كندا. FD هو المستوى الثاني للبحوث كندا الرئاسة.
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||
| اسم كاشف | شركة | كتالوج رقم | تعليقات | ||||||||||||||||||||||||||||||
| Amicon الترا-4 50K تصفية الطرد المركزي | ميليبور | UFC805008 | اتبع بروتوكول الشركة المصنعة للاستخدام السليم | ||||||||||||||||||||||||||||||
| الحيوي الخرز SM-2 الممتزات | بيو راد | 152-3920 | |||||||||||||||||||||||||||||||
| كولاي E. الدهون الكلية | افانتي الدهون القطبية | 100500C | المذاب في الكلوروفورم، والتعامل مع يتناسب مع مذيب عضوي | ||||||||||||||||||||||||||||||
| ني sepharose و HP الراتنج | GE للرعاية الصحية | 17-5268-01 | |||||||||||||||||||||||||||||||
| الفوسفور القياسية الحل | سيغما الدريخ | P3869 | |||||||||||||||||||||||||||||||
| pMSP1D1 | Addgene | 20061 | |||||||||||||||||||||||||||||||
| Superdex 200 HR 10/300 | GE للرعاية الصحية | 17-5172-01 | |||||||||||||||||||||||||||||||
| الجدول الكواشف I. محددة. | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
References
- Denisov, I. G., Ginkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed self-assembly of monodisperse phospholipid bilayer Nanodiscs with controlled size. J. Am. Chem. Soc. 126, 3477-3487 (2004).
- Boldog, T., Grimme, S., Li, M., Sligar, S. G., Hazelbauer, G. L. Nanodiscs separate chemoreceptor oligomeric states and reveal their signaling properties. Proc. Natl. Acad. Sci. USA. 103, 11509-11514 (2006).
- Bass, B. J., Denisov, I. G., Sligar, S. G. Homotropic cooperativity of monomeric cytochrome P450 3A4 in a nanoscale native bilayer environment. J. Biol. Chem. 282, 7066-7076 (2007).
- Alami, M., Dalal, K., Lelj-Garolla, B., Sligar, S. G., Duong, F. Nanodiscs unravel the interaction between the SecYEG channel and its cytosolic partner SecA. EMBO J. 26, 1995-2004 (2007).
- Mi, L. -. Z., Grey, M. J., Nishida, N., Walz, T., Lu, C., Springer, T. A. Functional and structural stability of the epidermal growth factor receptor in detergent micelles and phospholipid nanodiscs. Biochemistry. 47, 10314-10323 (2008).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217, 220-230 (1994).
- Dalal, K., Duong, F. Reconstitution of the SecY translocon in Nanodiscs. Methods Mol. Biol. 619, 145-156 (2010).
- Lanzetta, P. A., Alvarez, L. J., Reinach, P. S., Candia, O. A. An improved assay for nanomole amounts of inorganic phosphate. Anal. Biochem. 100, 95-97 (1979).
- Davidson, A. L., Dassa, E., Orelle, C., Chen, J. Structure, function and evolution of bacterial ATP-binding cassette systems. Microbiol. Mol. Biol. Rev. 72, 317-364 (2008).
- Bordignon, E., Grote, M., Schneider, E. The maltose ATP-binding cassette transporter in the 21st century-towards a structural dynamic perspective on its mode of action. Mol. Microbiol. 77, 1354-1366 (2010).
- Alvarez, F. J., Orelle, C., Davidson, A. L. Functional reconstitution of an ABC transporter for use in electron paramagnetic resonance spectroscopy. J. Am. Chem. Soc. 132, 9513-9515 (2010).
- Ritchie, T. K., Grinkova, Y. V., Bayburt, T. H., Denisov, I. G., Zolnerciks, J. K., Atkins, W. M., Sligar, S. G. Reconstitution of membrane proteins in phospholipid bilayer Nanodiscs. Methods Enzymol. 464, 211-231 (2009).
- Glück, J. M., Koenig, B. W., Willbold, D. Nanodiscs allow the use of integral membrane proteins as analytes in surface plasmon resonance studies. Anal. Biochem. 408, 46-52 (2011).
- Wan, C. -. P. L., Chiu, M. H., Wu, X., Lee, S. K., Prenner, E. J., Weers, P. M. M. Apolipoprotein-induced conversion of phosphatidylcholine bilayer vesicles into nanodisks. Biochim. Biophys. Acta (BBA). 1808, 606-613 (2011).
- Nath, A., Trexler, A. J., Koo, P. K., Miranker, A. D., Atkins, W. M., Rhoades, E. Single-molecule fluorescence spectroscopy using phospholipid bilayer Nanodiscs. Methods Enzymol. 472, 89-117 (2010).
- Denisov, I. G., Sligar, S. G. Cytochromes P450 in Nanodiscs. Biochim. Biophys. Acta. 1814, 223-229 (2011).
- Zhang, X. X., Chan, C. S., Bao, H., Fang, Y., Foster, L. J., Duong, F. Nanodiscs and SILAC-based mass spectrometry to identify a membrane protein interactome. J. Proteome Res. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved