A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטת צעד אחר צעד לכינונה מחדש של טרנספורטר ABC לחלקיקי ליפידים Nanodisc
In This Article
Summary
Nanodiscs הם חלקיקי discoid קטנים המשלבים חלבונים בממברנה לתיקון קטן של bilayer פוספוליפידים. אנו מספקים פרוטוקול חזותי המציג את שילוב צעד אחר הצעד של טרנספורטר MalFGK2 לתוך דיסק.
Abstract
Nanodisc הוא חלקיק discoidal (~ 10-12 ננומטר גדול) שחלבוני קרום מלכודת תיקון קטן של bilayer פוספוליפידים. Nanodisc היא אופציה אטרקטיבית במיוחד ללימוד חלבונים בממברנה, במיוחד בהקשר של יחסי גומלין יגנד לרצפטור. השיטה החלוצית שSligar ועמיתים מתבססים על המאפיינים של amphipathic מהונדס מאוד סליל חלבון פיגום נגזר מאפוליפופרוטאין A1. הפנים ההידרופובי של חלבון פיגום אינטראקציה עם רשתות הלוואי acyl השומן של bilayer השומנים ואילו אזורי הקוטב להתמודד בסביבה המימית. אנליזות של חלבוני קרום בnanodiscs יש יתרונות משמעותיים על פני יפוזום מפני החלקיקים קטנים, הומוגנית ומסיסים במים. בנוסף, שיטות ביוכימיות וbiophysical השמורים בדרך כלל לחלבונים מסיסים יכולות להיות מיושם, ומשני הצדדים של הקרום. בפרוטוקול החזותי הזה, אנו מציגים כינון מחדש צעד אחר צעד וגם characטרנספורטר terized חיידקי ABC, 2 המורכב גברי MalFGK. ההיווצרות של הדיסק היא תהליך הרכבה עצמית שתלוי באינטראקציות הידרופוביות המתרחשות במהלך ההסרה ההדרגתית של חומר הניקוי. אנו מתארים את הצעדים החיוניים ואנו מדגישים את החשיבות של בחירה נכון יחס חלבון לשומנים בדם, במטרה לצמצם את ההיווצרות של אגרגטים וחלקיקים גדולים יותר polydisperse יפוזום דמויים. איכות פשוט שולטת כגון כרומטוגרפיה ג'ל סינון, ג'ל אלקטרופורזה יליד וספקטרוסקופיה פיזור האור דינאמי להבטיח כי את הדיסקים כבר מחדש כראוי.
Protocol
תהליך כינונה מחדש באופן כללי
תהליך הבנייה מחדש מתחיל על ידי ערבוב קרום פיגום החלבון (MSP) עם 2 המורכבים MalFGK המטוהר בנוכחות פוספוליפידים דטרגנט-solubilized. הצעד אחריו ההסרה האיטית של חומר הניקוי על ידי חומר הנקרא פוליסטירן סופח-Bio חרוזים או Amberlite (איור 1). התהליך אוטומטי ההרכבה מתרחש ככל הנראה בשל אינטראקציות apolar בין פוספוליפידים הידרופובי, 2 המורכבים MalFGK ועל פני השטח של חלבון amphipathic MSP. המוצר הסופי הוא חלקיק discoid המורכב משתי מולקולות של עטיפת MSP סביב 2 המורכבים MalFGK. החלקיקים הם מופרדים מadducts ואגרגטים על ידי-צנטריפוגה אולטרה וכרומטוגרפיה אנליטית גודל הדרה. החלקיקים מתאפיינים אלקטרופורזה היליד ג 'וספקטרוסקופיה פיזור האור דינאמי.
כותרת "> 1. הכנת ממברנה פיגום חלבון, MSP- מתויג-MSP (גרסת MSP1D1 1) הוא מיוצר מpMSP1D1 פלסמיד בE. coli BL21 (DE3) מושרה בOD 600 ~ 0.5 עם mM β-D-1-thiogalactopyranoside איזופרופיל 0.5 עבור 3 שעות ב 37 ° C.
- התאים נקצרים על ידי צנטריפוגה XG ב 5000 עבור 10 דקות ב 4 ° C וresuspended בTSG10 חיץ המכיל פלואוריד phenylmethanesulfonyl מיקרומטר 100.
- תאי lysed עם עיתונות צרפתית (3x) בשעת 8000 psi והחומר המסיס יוסר על ידי צנטריפוגה XG ב 5000 עבור 10 דקות ב 4 ° C. החלק מסיס המכיל MSP מבודד על ידי צנטריפוגה החרדית ב125.000 XG עבור 45 דקות.
- MSP מטוהר על ידי ניקל chelating כרומטוגרפיה באמצעות ~ 1.5 המ"ל Ni Sepharose HP בTSG10 חיץ. מזהמים נשטפים עם TSG10 מאגר המכיל 50 המ"מ imidazole. MSP הוא eluted עם TSG10 חיץ המכיל 600 מ"מimidazole. החלבון המטוהר הוא דיאליזה בTSG10 חיץ ומאוחסן ב-70 ° C בריכוז חלבון של ~ 10-15 מ"ג / מ"ל.
2. הכנת 2 קומפלקס MalFGK
- 2 המורכבות MalFGK, מתויג ב- C-הסופי של MalK, בא לידי ביטוי מפלסמיד pBAD22-FGK בE. coli BL21 (DE3), ועורר בOD 600 ~ 0.5 עם 0.2 L-arabinose% עבור 3 שעות ב 37 ° C.
- בעקבות תמוגה תא וצנטריפוגה כמו בשלב 1.3, קרום הכדור הוא resuspended בTSG20 חיץ בריכוז סופי של 5 מ"ג / מ"ל. חומר solubilized עם 1% w / v-n-β-dodecyl maltopyranoside (DDM) ל3 שעות ב 4 ° C בטלטול עדין.
- החומרים מסיסים יוסרו על ידי-צנטריפוגה אולטרה כמו בשלב 1.3 ו supernatant המכיל solubilized 2 מורכבים MalFGK נאסף ומטוהר כמו בשלב 1.4, אך ללא דיאליזה.
- Furtheטיהור r מושגת על ידי כרומטוגרפיה סינון ג'ל במאגר TSGD על Superdex 200 HR 10/300 עמודה בקצב זרימה של 0.5 מ"ל / דקה.
3. הכנת פוספוליפידים
- ה שומנים כוללים coli לחלץ מומס בכלורופורם מופרדים ל1000 aliquots nmol בשפופרות microfuge מתברגות. הממס מתאדה תחת זרם עדין של חנקן והתייבש עוד לילה בתא ייבוש ואקום.
- סרט השומנים מומס בחיץ TS בריכוז 5 nM סופי וvortexed נמרץ וsonicated. השומנים המומסים יופיעו קצת אטומים בשל insolubility הכללי שלהם במאגר TS מימי, אבל הם צריכים להישאר בהשעיה. DDM מתווסף לריכוז סופי של 0.5% (~ 10 מ"מ), שבפתרון הופך ברור.
- תערובת השומנים ממוקמת באמבט מים ודופק sonicated ל5 פעמים ל~ 5 שניות. תערובת השומנים מאוחסנת ב 4 ° C למקסימום של פיפי 1יא.
4. הכנת ביו חרוזים
- כ 10-15 מ"ל (נפח יבש) Bio-חרוזים ממוקם לתוך צינור מ"ל 50.
- החרוזים נשטפים ברציפות עם 50 מ"ל של מתנול 100%, 95% אתנול, milliQ H 2 O, ולבסוף חיץ TS (פעמים כל אחת).
- חרוזי השטף הם מאוחסנים ב 4 ° C ב~ חיץ 10 מ"ל TS.
5. כינון Nanodisc
- MSP מדולל במאגר TSGD בריכוז הסופי של ~ 7 מ"ג / מ"ל (~ 0.3 מ"מ).
- ~ 2 מתוך 2 nmol מורכב MalFGK מטוהרים מעורבבים בחלבון: יחס שומנים של 1:3:60 או 1:3:400 במאגר TSGD: MSP. הריכוז הסופי הוא 6 MalFGK 2, MSP 18 מיקרומטר ושומני 360 מיקרומטר (1:3:60) או 2.4 מ"מ (שומני 1:3:400) מיקרומטר. הנפח הסופי הוא 300 μl. ריכוז DDM הסופי הוא 0.08% (~ 1.6 מ"מ). הריכוז הסופי של גליצרול תלוי בכמות השומנים הוסיפו אך נשאר סביב 5-10% v / נ
- ~ 50 μl של השעית יו חרוז מתווסף לצינור ואת התערובת הוא מודגרות הלילה על שולחן נדנדה ב 4 ° C.
- את החרוזים מכילים משקעים על ידי כוח הכביד ופתרון pipetted דרך קצה צר להימנע מחרוזי Bio ככל האפשר.
- גדול משקעים יוסרו על ידי-צנטריפוגה אולטרה ב100.000 XG במשך 20 דקות. הדסקיות מטוהרות על ידי כרומטוגרפיה סינון ג'ל כמו בשלב 2.4 בTSG10 חיץ. ברים המכילים את הדיסקים הם נקווים וaliquot צריך להיות מחדש הזריק באותה עמודת סינון ג'ל כדי לבחון את היציבות של ההכנה.
- את הדיסקים המטוהרים ניתן לאחסן ב -70 מעלות צלזיוס במשך תקופה ממושכת של זמן. בעקבות הפשרה על קרח, את הדיסקים צריכים להיות כפופים לצנטריפוגה אולטרה כמו בשלב 5.5 להסיר פוטנציאל משקעים. Aliquot צריך להיות מנותח על ידי כרומטוגרפיה סינון ג'ל על מנת להבטיח שצבירה או משקעים משמעותיים לא התרחשה במהלך ההפשרהתהליך.
6. ג'ל אלקטרופורזה יליד
- 1 מיקרומטר של nanodiscs (~ 0.2 מ"ג / מ"ל) הם נותחו על ידי ילידי 6, 7 (טריס-HCl pH 8.8, 4-12%) על מנת להעריך את איכות הכינון מחדש (איור 3 א).
- הכריכה של זכר (1 מיקרומטר) לMalFGK 2 המורכבים-לשחזר בnanodiscs גם מוערך על ידי-PAGE ילידים (איור 3 א).
- לאחר אלקטרופורזה, ג'ל מוכתם בCoomassie כחול למשך 10 דקות, וdestained ל~ 1 שעה.
7. פיזור אור דינמי (DLS)
- Nanodiscs מטוהר על ידי כרומטוגרפיה סינון ג'ל כמו בשלב 2.4 בTSG10 חיץ באמצעות Superdex 200 HR 10/300 עמודה בקצב זרימה של 0.1 מ"ל / דקה. ברים המכילים nanodiscs הם נקווים ומרוכזים ל~ 10 מ"ג / מ"ל עם מסנן צנטריפוגלי Amicon.
- המדגם מסונן פעמים (0.22 מיקרומטר לסנן) לפני הניתוח על ידי DLS באמצעותDynaPro nanostar מכשיר (וויאט טכנולוגיה) בנפח קובט פנימי μl 1 קוורץ. נתונים מותאמים באמצעות דינמיקת התוכנה (וויאט טכנולוגיה) כדי להעריך את הקוטר ומשקל מולקולרי של החלקיקים.
8. מדידות ATPase
- הפעילות של ATPase MalFGK nanodiscs 2-משוחזר נקבעה באמצעות בדיקת colorimetric 8.
- 1 מיקרומטר של דיסקים מטוהרים וmM ATP 1 מעורבב עם כמויות הולכות וגדלות של זכר וטופחו על 37 מעלות צלזיוס למשך 20 דקות. השחרור של פוספט האורגני נמדד ב660 ננומטר.
- הכמות של פוספט שוחרר בהשוואה לעקומת סטנדרט שנוצרה עם פתרון אחיד זרחן.
9. נציג תוצאות
את nanodiscs מטוהר על ידי כרומטוגרפיה סינון ג'ל (איור 2 א, משמאל). הכרומתוגרמה מראה כי הרוב המכריע של ד המשוחזרelute ISCS (עקבות שחורות) כשיא יחיד, ואילו דיסקים שנעשו עם שומנים עודפים (אדומות עקבות) elute בנפח החלל וכסדרה של פסגות רחבות. איכות nanodiscs מנותחת נוסף על ידי אלקטרופורזה ג'ל יליד וספקטרוסקופיה פיזור אור הדינמית (DLS). דיסקים כראוי משוחזרים נודדים כלהקה חדה בג'ל ואילו אלה משוחזרים בנוכחות עודפת של שומנים להעביר כלמרוח (2A איור, מימין). ניתוח על פי DLS מראה כי האוכלוסייה היא הומוגנית הדיסק עם קוטר ממוצע של 11.4 ננומטר (איור 2 ב '). הדיסקים המשוחזרים יש משקל מולקולרי לכאורה של 215 kDa מבוסס על קירוב DLS. דגימות מחדש בנוכחות של שומנים עודפים הציג מופצים באופן נרחב רדיוס סביב 100 ננומטר, שהוא אופייני לדוגמאות הלא הומוגנית.
האיכות של 2 המורכבים MalFGK מוערכת על ידי אלקטרופורזה היליד ג 'ופעילותה על ידי ATPaseמדידות (איור 3). זכר החלבון המחייב מלטוז נקשר עם זיקה גבוהה ל2 טרנספורטר MalFGK 9, 10. שימוש הלא denaturing אלקטרופורזה ג'ל, ניתן לזהות מורכב בין הזכר וMalFGK 2 (איור 3 א). הגירוי של פעילות MalK 2 ATPase ידי זכר הוא שמוצג באיור 3 ב.
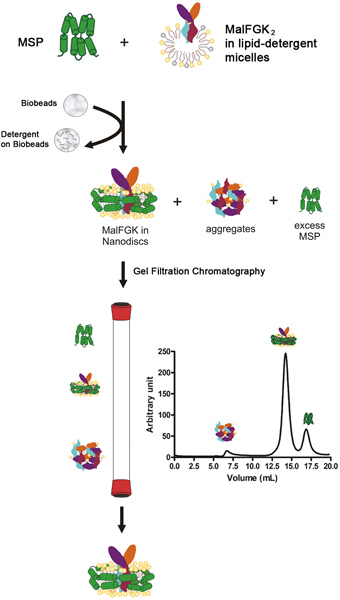
איור 1. תרשים זרימה אופייני לפרוטוקול הכינון מחדש.
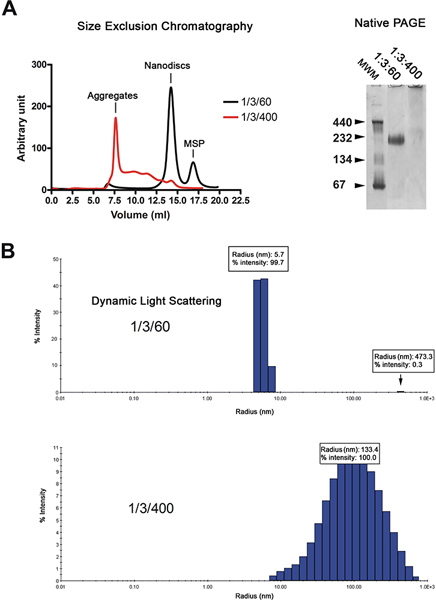
איור 2. בקרת איכות של תכשיר nanodisc. א ניתוח סינון ג'ל (Superdex 200 HR 10/300 טור) של nanodiscs מחדש בשיעור נמוך שומנים (1/3/60; עקבות שחורות) או יחס שומנים גבוה (1/3/400; עקבות אדומות). ג'ל אלקטרופורזה יליד אותה הכנת דיסק. מולסמני משקל ecular בkDa הם ציינו. ניתוח ב 'פיזור אור הדינמי של אותו תכשיר דיסק. לחץ כאן לצפייה בדמות גדולה.

איור 3. ניתוח MalFGK החלקיקים 2-nanodisc. א ניתוח שינוי ג'ל לזכר דגר עם כמויות הולכות וגדלות של חלקיקי MalFGK 2-nanodisc. פעילות ב ATPase של MalFGK 2-nanodisc חלקיקים כפונקציה של ריכוז גברי.
Discussion
אנו מתארים הליך פשוט לכינון מחדש של טרנספורטר מלטוז לnanodiscs. טרנספורטר הוא ATPase הפעיל והאינטראקציה עם זכר השותף מחייב המסיס ניתן ליצור מחדש (איור 3). הכינון מחדש המוצלח של טרנספורטר לnanodiscs לפתוח את הדרך לניתוח biophysical וביוכימיים נוספים. מעניין במיוחד יהיה הניתוח...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי המכון הקנדי לחקר בריאות. CSC מומן על ידי מלגת דוקטורט ממדעי הטבע והנדסת מועצת המחקר של קנדה. FD היא קנדה מחקר קתדרה משנית.
Materials
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||
| שם המגיב | חברה | מספר קטלוגים | תגובות | ||||||||||||||||||||||||||||||
| Amicon Ultra-4 50K מסנן צנטריפוגלי | Millipore | UFC805008 | עקוב הפרוטוקול של היצרן לשימוש נכון | ||||||||||||||||||||||||||||||
| Bio-חרוזי SM-2 כושר ספיג | Bio-Rad | 152-3920 | |||||||||||||||||||||||||||||||
| חיידק שומנים כלל | שומני פולאר AVANTI | 100500C | מומס בכלורופורם, לטפל לפי צורך ממס אורגני | ||||||||||||||||||||||||||||||
| Ni sepharose HP שרף | GE Healthcare | 17-5268-01 | |||||||||||||||||||||||||||||||
| פתרון סטנדרטי זרחן | סיגמה אולדריץ | P3869 | |||||||||||||||||||||||||||||||
| pMSP1D1 | Addgene | 20061 | |||||||||||||||||||||||||||||||
| Superdex 200 HR 10/300 | GE Healthcare | 17-5172-01 | |||||||||||||||||||||||||||||||
| ריאגנטים ספציפיים I. טבלה. | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
References
- Denisov, I. G., Ginkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed self-assembly of monodisperse phospholipid bilayer Nanodiscs with controlled size. J. Am. Chem. Soc. 126, 3477-3487 (2004).
- Boldog, T., Grimme, S., Li, M., Sligar, S. G., Hazelbauer, G. L. Nanodiscs separate chemoreceptor oligomeric states and reveal their signaling properties. Proc. Natl. Acad. Sci. USA. 103, 11509-11514 (2006).
- Bass, B. J., Denisov, I. G., Sligar, S. G. Homotropic cooperativity of monomeric cytochrome P450 3A4 in a nanoscale native bilayer environment. J. Biol. Chem. 282, 7066-7076 (2007).
- Alami, M., Dalal, K., Lelj-Garolla, B., Sligar, S. G., Duong, F. Nanodiscs unravel the interaction between the SecYEG channel and its cytosolic partner SecA. EMBO J. 26, 1995-2004 (2007).
- Mi, L. -. Z., Grey, M. J., Nishida, N., Walz, T., Lu, C., Springer, T. A. Functional and structural stability of the epidermal growth factor receptor in detergent micelles and phospholipid nanodiscs. Biochemistry. 47, 10314-10323 (2008).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217, 220-230 (1994).
- Dalal, K., Duong, F. Reconstitution of the SecY translocon in Nanodiscs. Methods Mol. Biol. 619, 145-156 (2010).
- Lanzetta, P. A., Alvarez, L. J., Reinach, P. S., Candia, O. A. An improved assay for nanomole amounts of inorganic phosphate. Anal. Biochem. 100, 95-97 (1979).
- Davidson, A. L., Dassa, E., Orelle, C., Chen, J. Structure, function and evolution of bacterial ATP-binding cassette systems. Microbiol. Mol. Biol. Rev. 72, 317-364 (2008).
- Bordignon, E., Grote, M., Schneider, E. The maltose ATP-binding cassette transporter in the 21st century-towards a structural dynamic perspective on its mode of action. Mol. Microbiol. 77, 1354-1366 (2010).
- Alvarez, F. J., Orelle, C., Davidson, A. L. Functional reconstitution of an ABC transporter for use in electron paramagnetic resonance spectroscopy. J. Am. Chem. Soc. 132, 9513-9515 (2010).
- Ritchie, T. K., Grinkova, Y. V., Bayburt, T. H., Denisov, I. G., Zolnerciks, J. K., Atkins, W. M., Sligar, S. G. Reconstitution of membrane proteins in phospholipid bilayer Nanodiscs. Methods Enzymol. 464, 211-231 (2009).
- Glück, J. M., Koenig, B. W., Willbold, D. Nanodiscs allow the use of integral membrane proteins as analytes in surface plasmon resonance studies. Anal. Biochem. 408, 46-52 (2011).
- Wan, C. -. P. L., Chiu, M. H., Wu, X., Lee, S. K., Prenner, E. J., Weers, P. M. M. Apolipoprotein-induced conversion of phosphatidylcholine bilayer vesicles into nanodisks. Biochim. Biophys. Acta (BBA). 1808, 606-613 (2011).
- Nath, A., Trexler, A. J., Koo, P. K., Miranker, A. D., Atkins, W. M., Rhoades, E. Single-molecule fluorescence spectroscopy using phospholipid bilayer Nanodiscs. Methods Enzymol. 472, 89-117 (2010).
- Denisov, I. G., Sligar, S. G. Cytochromes P450 in Nanodiscs. Biochim. Biophys. Acta. 1814, 223-229 (2011).
- Zhang, X. X., Chan, C. S., Bao, H., Fang, Y., Foster, L. J., Duong, F. Nanodiscs and SILAC-based mass spectrometry to identify a membrane protein interactome. J. Proteome Res. , (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved