需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一个循序渐进的步骤方法的到Nanodisc脂质颗粒的ABC转运蛋白的重组
摘要
奈米圆盘是小盘状颗粒结合成一小片的磷脂双分子层膜蛋白。我们提供了一个可视化的协议,一步一步注册成立的MalFGK2转运到光盘。
摘要
nanodisc是一个圆盘状的颗粒(〜10-12纳米大),成一小片的磷脂双分子层的陷阱膜蛋白。该nanodisc的研究,尤其是膜蛋白的配体 - 受体相互作用的上下文中的一个特别有吸引力的选择。该方法率先由Sligar和同事的两亲性质的基础上设计高度α-螺旋支架蛋白载脂蛋白A1来自。支架蛋白的疏水性表面的相互作用与脂肪酰基侧链的脂双层,而极性的区域面对的含水环境。奈米圆盘膜蛋白的分析有显着的优势脂质体,因为颗粒是小的,均匀的和水溶性的。此外,通常保留以可溶性蛋白的生物化学和生物物理的方法可以被应用,并从膜的任一侧。在这种可视化的协议,我们提出了一个一步一步的重组的良好特征在于细菌ABC转运,男性,MalFGK的的2复杂。在盘的形成是一个自组装过程中,依赖于疏水相互作用发生期间逐步除去洗涤剂。我们描述的基本步骤,我们强调的重要性选择正确的蛋白质 - 类脂比,以限制形成的聚集体和较大的多分散性的脂质体样颗粒。简单的质量控制,例如凝胶过滤色谱法,天然凝胶电泳和动态光散射光谱,确保光盘已正确重组。
研究方案
整体重建过程
重整过程开始用纯化的MalFGK 2复合物中的洗涤剂溶解的磷脂存在下通过混合膜支架蛋白(MSP)。该步骤之后是由吸附剂的聚苯乙烯材料称为生物珠或Amberlite( 图1),由缓慢除去洗涤剂。的自动装配过程的发生是最有可能的,因为非极性疏水磷脂,的MalFGK 2配合物和表面的两亲性的MSP蛋白之间的相互作用。最终产物是一种盘状的颗粒制成的两个分子的MSP包装周围MalFGK 2配合物 。颗粒的加合物和聚集体,通过超离心分离和分析的体积排阻色谱法分离。该颗粒的特征在于由母语的凝胶电泳和动态光散射光谱。
标题“> 1。制备的膜支架蛋白,MSP- 的his标记MSP(版本MSP1D1 1)产生从质粒pMSP1D1在大肠杆菌大肠杆菌 BL21(DE3),在OD 600〜0.5诱导与0.5mM的异丙基-β-D-1-硫代半乳糖苷3小时,在37℃下
- 以5,000 xg离心10分钟,在4℃通过离心收获细胞,并再悬浮在TSG10缓冲器含有100μM苯甲基磺酰氟。
- 细胞裂解与法国媒体(3次),在8,000 psi的,并通过离心除去不溶性物质在4℃以5,000 xg离心10分钟含可溶组分的MSP通过超离心分离,以125,000 xg离心45分钟。
- MSP是纯化通过使用镍螯合层析〜1.5毫升Ni Sepharose 4B柱HP TSG10缓冲。污染物被冲走TSG10缓冲液含有50mM咪唑。 MSP洗脱TSG10缓冲区,其中包含600毫米咪唑。纯化的蛋白质TSG10缓冲区中透析,并储存在-70℃下在〜10-15毫克/毫升的蛋白质浓度。
2。制备的MalFGK 2复杂
- 该MalFGK 2复合物,他在C-末端的MalK标签的,表示从质粒在大肠杆菌 pBAD22-FGK 大肠杆菌 BL21(DE3)中,并在OD 600诱导〜0.5,在37℃下3小时用0.2%的L-阿拉伯糖
- 之后的细胞裂解和离心步骤1.3中,该膜的颗粒再悬浮TSG20缓冲器中的最终浓度为5毫克/毫升。该材料溶解用1%w / v的正十二烷基-β-吡喃麦芽糖苷(DDM)的3小时,在4℃下轻轻摇动。
- 步骤1.3中,通过超离心除去不溶性物质和上清液含有溶解 MalFGK 2复合物的收集和纯化的步骤1.4中,但没有透析。
- Furtheŕ纯化通过凝胶过滤色谱法在TSGD缓冲器实现的Superdex 200 HR 10/300柱的流速为0.5毫升/分钟。
3。磷脂制备
- 一个E.大肠杆菌总脂质提取物溶解在氯仿中1000纳摩尔的等分试样,在螺旋盖的微量离心管中被分离成。蒸去溶剂,在温和的氮气流中,并在真空干燥器中进一步干燥过夜。
- 脂质膜溶解在TS缓冲液5 nM的最终浓度和涡旋大力和超声处理。溶解脂肪,由于其不溶于水TS缓冲会出现轻微的不透明,但他们应该保持悬浮状态。 DDM被添加至终浓度为0.5%(〜10毫摩尔),在该溶液变得清晰。
- 的脂类混合物被放置在水浴中和脉冲超声处理5倍〜5秒。脂质混合物在4℃下的最大的1凌晨存储K。
4。下游的生物珠
- 大约为10-15毫升(干体积)生物珠放入50毫升的试管。
- 的珠子依次用50ml 100%的甲醇,95%乙醇中的MilliQ H 2 O,和最后TS缓冲器(两次,每次)。
- 洗过的小珠被存储在4℃下在〜10毫升TS缓冲器。
5。 Nanodisc重建
- 在TSGD缓冲液稀释的MSP〜7毫克/毫升(〜0.3毫摩尔)在终浓度为。
- 〜2 nmol的纯化MalFGK 2配合物进行混合的蛋白质:MSP:类脂比1:3:60或1:3:400 TSGD缓冲区。最终浓度为6的μMMalFGK 2,18μM的MSP和360μM的脂质(1:3:60)或2.4mM脂质(1:3:400)。的最终体积为300微升。 DDM的最终浓度为0.08%(〜1.6毫摩尔)。甘油的最终浓度取决于脂质的量添加,但仍然大约5-10%V / V。
- 〜50微升生物珠子悬架被添加到所述管,将混合物摇椅表上在4℃下孵育过夜
- 珠粒沉淀通过重力和该溶液用移液管通过一个狭窄的尖端尽可能多的生物珠尽可能避免。
- 大的析出物以100,000 xg离心20分钟超离心除去。光盘TSG10缓冲区在步骤2.4中,通过凝胶过滤层析纯化。包含光盘的馏分被汇集,并使用其等分应重新注入相同的凝胶过滤柱,来测试该制剂的稳定性。
- 将纯化的光盘可以存储在-70℃下在较长的一段时间。在冰上解冻,光盘应进行超离心在步骤5.5去除潜在的沉淀物。的等分试样应通过凝胶过滤色谱法进行分析,以确保,解冻期间未发生显着的聚集或沉淀的过程。
6。变性凝胶电泳
- 奈米圆盘(1μM〜0.2毫克/毫升),以英语为母语的第6,第7页的Tris-HCl pH值为8.8,(4-12%)的重组( 图3A)的质量进行评估分析。
- 奈米圆盘的结合男性(1μM)的MalFGK 2复杂的重组,也进行了评估以英语为母语-PAGE( 图3A)。
- 电泳后,将凝胶染色10分钟,用考马斯亮蓝,和脱色〜1小时。
7。动态光散射(DLS)
- 奈米圆盘TSG10缓冲区使用的Superdex 200 HR 10/300柱的流速为0.1毫升/分钟,在步骤2.4中,通过凝胶过滤色谱法进行纯化。含有奈米圆盘的馏分被汇集,并浓缩至约10毫克/毫升的Amicon离心过滤。
- 将样品过滤两次(0.22μm过滤器)进行分析之前通过DLS使用一个DynaPro NANOSTAR仪器(悦科技)在1微升内卷石英比色皿。数据使用动力学软件(Wyatt技术)来估计重量的颗粒的直径和分子嵌合。
8。 ATP酶活性测量
- ATPase活性的重组MalFGK 2奈米圆盘确定用比色法检测8。
- 1μM的纯化的光盘和1mM ATP的混合在一起,与递增量的MalE和孵育在37℃下20分钟。无机磷酸盐的释放在660nm处测量。
- 释放的磷酸盐的量进行比较磷标准溶液与产生的标准曲线。
9。代表性的成果
奈米圆盘被纯化,通过凝胶过滤色谱法( 图2A,左 )。的色谱图显示,大多数的重组ðISCS(黑色线)洗脱作为一个单一的峰,而用过量的脂质(红色迹线)的空隙体积中洗脱,并作为一个系列的宽峰的光盘。进一步分析非变性凝胶电泳和动态光散射光谱(DLS)的奈米圆盘的质量。正确重组的光盘作为一个尖锐的能带在凝胶上迁移而那些重组脂质过量的存在下在作为涂抹( 图2A,右 )迁移。利用动态光散射(DLS)分析显示该光盘的人口是均匀的,其平均粒径为11.4纳米( 图2B)。重组后的光盘具有的表观分子量215 kDa的基于上的DLS近似。过剩的脂质的存在下,在重组的样片显示器广泛分布半径约100 nm,这是典型的非均质样本。
母语的凝胶电泳和其活性由ATP酶的MalFGK 2配合物的质量的评估是通过测量( 图3)。麦芽糖结合蛋白的男性结合的高亲和性的MalFGK 2转运9,10。使用非变性凝胶电泳,它能够检测2 MALE和MalFGK的( 图3A)之间的复合物。刺激的MalK ATP酶活性的男性在图3(b)所示。
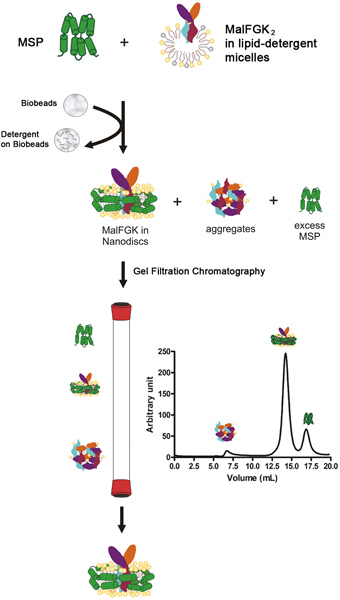
图1。典型的流程重组协议。
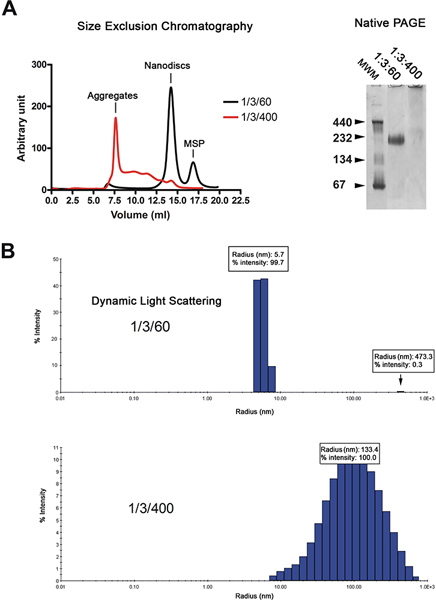
图2。质量控制的nanodisc准备。凝胶过滤分析(Superdex 200 HR 10/300柱)的奈米圆盘重组,低脂肪比率(60年1月3日,黑色迹线)或高血脂比率(1/3/400的红色曲线)。非变性凝胶电泳同一张光盘的准备。摩尔以kDa表示ecular重量标记。 B.动态光散射分析同一张光盘的准备。 点击此处查看大图 。

图3。的MalFGK的2 - nanodisc颗粒分析A.。培养的男性越来越多的MalFGK 2-nanodisc的颗粒凝胶移位分析。 B. ATPase活性的MalFGK 2 nanodisc颗粒作为功能的MalE浓度。
讨论
我们描述了一个简单的程序,重组的麦芽糖转运到奈米圆盘。转运体ATPase活性和与可溶性的结合配偶体的男性的相互作用( 图3)可以重新创建。成功重组的转运到奈米圆盘开启方式为更多的生物物理和生物化学分析。特别令人感兴趣的是系统的分析MalK ATP酶和麦芽糖运输活动的清洁剂,脂质体和奈米圆盘。 ABC转运过程中改变构象的运输周期,但脂质,这些构象变化的贡献仍有待探讨...
披露声明
没有利益冲突的声明。
致谢
这项工作是由加拿大健康研究学会的支持。 CSC是由一个从自然科学和工程研究理事会,加拿大博士后奖学金。 FD是Tier II加拿大研究主席。
材料
| Name | Company | Catalog Number | Comments | ||||||||||||||||||||||||||||||
| 的试剂的名称 | 公司 | 目录编号 | 评论 | ||||||||||||||||||||||||||||||
| 的Amicon Ultra-50K离心式过滤器 | 密理博 | UFC805008 | 按照制造商的协议,为正确使用 | ||||||||||||||||||||||||||||||
| 生物珠SM-2吸附剂 | Bio-Rad公司 | 152-3920 | |||||||||||||||||||||||||||||||
| 大肠杆菌总脂质 | 阿凡提极性脂质 | 100500C | 溶解在氯仿中,处理以适合的有机溶剂的 | ||||||||||||||||||||||||||||||
| Ni Sepharose 4B柱HP树脂 | GE医疗集团 | 17-5268-01 | |||||||||||||||||||||||||||||||
| 磷标准溶液 | Sigma-Aldrich公司 | P3869 | |||||||||||||||||||||||||||||||
| pMSP1D1 | Addgene | 20061 | |||||||||||||||||||||||||||||||
| Superdex 200 HR 10/300 | GE医疗集团 | 17-5172-01 | |||||||||||||||||||||||||||||||
| 表一特定的试剂。 | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
参考文献
- Denisov, I. G., Ginkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed self-assembly of monodisperse phospholipid bilayer Nanodiscs with controlled size. J. Am. Chem. Soc. 126, 3477-3487 (2004).
- Boldog, T., Grimme, S., Li, M., Sligar, S. G., Hazelbauer, G. L. Nanodiscs separate chemoreceptor oligomeric states and reveal their signaling properties. Proc. Natl. Acad. Sci. USA. 103, 11509-11514 (2006).
- Bass, B. J., Denisov, I. G., Sligar, S. G. Homotropic cooperativity of monomeric cytochrome P450 3A4 in a nanoscale native bilayer environment. J. Biol. Chem. 282, 7066-7076 (2007).
- Alami, M., Dalal, K., Lelj-Garolla, B., Sligar, S. G., Duong, F. Nanodiscs unravel the interaction between the SecYEG channel and its cytosolic partner SecA. EMBO J. 26, 1995-2004 (2007).
- Mi, L. -. Z., Grey, M. J., Nishida, N., Walz, T., Lu, C., Springer, T. A. Functional and structural stability of the epidermal growth factor receptor in detergent micelles and phospholipid nanodiscs. Biochemistry. 47, 10314-10323 (2008).
- Schägger, H., Cramer, W. A., von Jagow, G. Analysis of molecular masses and oligomeric states of protein complexes by blue native electrophoresis and isolation of membrane protein complexes by two-dimensional native electrophoresis. Anal. Biochem. 217, 220-230 (1994).
- Dalal, K., Duong, F. Reconstitution of the SecY translocon in Nanodiscs. Methods Mol. Biol. 619, 145-156 (2010).
- Lanzetta, P. A., Alvarez, L. J., Reinach, P. S., Candia, O. A. An improved assay for nanomole amounts of inorganic phosphate. Anal. Biochem. 100, 95-97 (1979).
- Davidson, A. L., Dassa, E., Orelle, C., Chen, J. Structure, function and evolution of bacterial ATP-binding cassette systems. Microbiol. Mol. Biol. Rev. 72, 317-364 (2008).
- Bordignon, E., Grote, M., Schneider, E. The maltose ATP-binding cassette transporter in the 21st century-towards a structural dynamic perspective on its mode of action. Mol. Microbiol. 77, 1354-1366 (2010).
- Alvarez, F. J., Orelle, C., Davidson, A. L. Functional reconstitution of an ABC transporter for use in electron paramagnetic resonance spectroscopy. J. Am. Chem. Soc. 132, 9513-9515 (2010).
- Ritchie, T. K., Grinkova, Y. V., Bayburt, T. H., Denisov, I. G., Zolnerciks, J. K., Atkins, W. M., Sligar, S. G. Reconstitution of membrane proteins in phospholipid bilayer Nanodiscs. Methods Enzymol. 464, 211-231 (2009).
- Glück, J. M., Koenig, B. W., Willbold, D. Nanodiscs allow the use of integral membrane proteins as analytes in surface plasmon resonance studies. Anal. Biochem. 408, 46-52 (2011).
- Wan, C. -. P. L., Chiu, M. H., Wu, X., Lee, S. K., Prenner, E. J., Weers, P. M. M. Apolipoprotein-induced conversion of phosphatidylcholine bilayer vesicles into nanodisks. Biochim. Biophys. Acta (BBA). 1808, 606-613 (2011).
- Nath, A., Trexler, A. J., Koo, P. K., Miranker, A. D., Atkins, W. M., Rhoades, E. Single-molecule fluorescence spectroscopy using phospholipid bilayer Nanodiscs. Methods Enzymol. 472, 89-117 (2010).
- Denisov, I. G., Sligar, S. G. Cytochromes P450 in Nanodiscs. Biochim. Biophys. Acta. 1814, 223-229 (2011).
- Zhang, X. X., Chan, C. S., Bao, H., Fang, Y., Foster, L. J., Duong, F. Nanodiscs and SILAC-based mass spectrometry to identify a membrane protein interactome. J. Proteome Res. , (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。