Method Article
جيل من الفئران المستمدة من الخلايا الجذعية المحفزة المستحثة
In This Article
Summary
توليد الخلايا الجذعية المحفزة التي يسببها (اللجنة التوجيهية) تنتج خطوط خطوط مختلفة المحتملة التنموية حتى عندما تمر الاختبارات القياسية لتعدد القدرات. نحن هنا وصف بروتوكول لإنتاج الفئران المستمدة كليا من iPSCs، الذي يحدد الخطوط التوجيهية وتعدد القدرات الكاملة امتلاك 1.
Abstract
إنتاج الخلايا الجذعية المحفزة التي يسببها (iPSCs) من الخلايا الجسدية يوفر وسيلة لخلق أدوات قيمة للبحوث الأساسية ويمكن أن تنتج أيضا مصدرا للخلايا المريض لعلاجات التجدد المتطابقة. قد يتم إنشاء iPSCs باستخدام بروتوكولات متعددة ومستمدة من مصادر متعددة الخلايا. ولدت مرة واحدة، ويتم اختبار iPSCs باستخدام مجموعة متنوعة من المقايسات المناعية بما في ذلك لتعدد القدرات علامات، وتوليد طبقات الجرثومية الثلاث في الهيئات مضغي الشكل ومسخي المبيض، مقارنات بين التعبير الجيني مع الخلايا الجذعية الجنينية (المجالس الاقتصادية والاجتماعية) وإنتاج الفئران خيالية مع أو بدون مساهمة سلالة الجرثومية 2 . الأهم من ذلك، خطوط التوجيهية التي تمر هذه الاختبارات تختلف تزال في قدرتها على إنتاج مختلف أنواع الخلايا المتمايزة 2. وهذا جعل من الصعب تحديد البروتوكولات التي الاشتقاق اللجنة التوجيهية، ومصادر الخلية المانحة أو أساليب اختيار هي الأكثر فائدة لمختلف التطبيقات.
الاختبار الأكثر صرامةما إذا كان خط الخلايا الجذعية لديها امكانات تنموية كافية لتوليد كل الأنسجة اللازمة لبقاء الكائن الحي (تعدد القدرات الكاملة يسمى) هو رباعي الصيغة الصبغية تكامل الجنين (TEC) 3-5. من الناحية الفنية، TEC ينطوي الكهربائي اثنين من خلايا الأجنة لتوليد رباعي الصيغة الصبغية (4N) واحد خلايا الأجنة التي يمكن زرعها في المختبر لمرحلة الكيسة الأريمية 6. ثم يتم حقن مضاعفا الجذعية المحفزة (2N) الخلايا (مثل المجالس الاقتصادية والاجتماعية أو iPSCs) في تجويف blastocoel من الكيسة رباعي الصيغة الصبغية ونقل إلى الإناث المتلقية للحمل (انظر الشكل 1). المكون رباعي الصيغة الصبغية للجنين تستكمل يساهم بشكل حصري تقريبا إلى الأنسجة خارج الجنين (المشيمة، الكيس المحي)، في حين أن الخلايا مضاعفا تشكل الجنين السليم، مما أدى إلى الجنين مشتق تماما من خط الخلايا الجذعية حقن.
مؤخرا، أفاد نحن اشتقاق خطوط التوجيهية التي تولد بتكاثر الفئران البالغةعبر TEC 1. هذه الخطوط التوجيهية أن تؤدي إلى الجراء قابلة للحياة مع الكفاءات من 5-13٪، وهو مشابه لالمجالس الاقتصادية والاجتماعية و3،4،7 النسبة التي أبلغت عن معظم خطوط التوجيهية الأخرى 8-12. هذه التقارير تظهر أن إعادة برمجة المباشر يمكن أن تنتج iPSCs المحفزة التي تطابق تماما المجالس الاقتصادية والاجتماعية في إمكاناتها التنموية وكفاءة توليد الجراء في اختبارات TEC. في الوقت الحاضر، فإنه ليس من الواضح ما يميز بين iPSCs المحفزة بالكامل وخطوط أقل قوة 13-15. وليس من الواضح أي الطرق سوف تنتج إعادة برمجة هذه الخطوط وفقا لأعلى كفاءة. نحن هنا وصف أسلوب واحد التي تنتج iPSCs بالكامل والمحفزة "اللجنة التوجيهية للجميع" الفئران، والتي قد تكون مفيدة للمحققين الذين يرغبون في تعدد القدرات مقارنة خطوط التوجيهية أو إنشاء معادلة مختلفة أساليب إعادة برمجة.
Protocol
وقد استخدم هذا الأسلوب في البحث عنها في الطبيعة وآخرون بولاند. آل. 461، 91-96 (2009) 1
1. إعداد الفيروسة البطيئة
هذا البروتوكول يعمل الدوكسيسيكلين-محرض ناقلات lentiviral المكوك التي تكود لOct4، Sox2، Klf4، وج Myc على-تحت سيطرة عنصر استجابة تيتو. يتم تنشيط الجينات المحورة من البروتين عكس عبر تفعيل التتراسيكلين، rtTAM2.2 16، الذي يدفع إعادة برمجة التعبير عاملا في وجود الدوكسيسيكلين. هذا النظام يسمح للتعبير، التي تسيطر عليها بإحكام عالية من عوامل إعادة البرمجة. وناقلات lentiviral المستخدمة هنا هي تعطيل الذاتي، وبالتالي لا يمكن نسخ التكامل الجينومية التالية. ومع ذلك، يجب الانتباه عند العمل مع lentiviruses ويجب أن يتم تنفيذ مختبرات متوافقة مع في BSL2 (USA) والمعايير S2 (أوروبا).
- ذوبان الجليد الخلايا HEK293T والمرور على الأقل مرة واحدة قبل هيئة تنظيم الاتصالاتnsfection. ينبغي الحفاظ على كثافة خلايا في subconfluent في المتوسط HEK في 37 درجة مئوية، 5٪ CO 2 في بيئة مرطب. الخلايا بشكل روتيني مرور كل يوم 2 مع نسبة انقسام 1:06 حتي 01:10.
- البذور ~ 8 × 10 6 HEK293T cells/T150 مع 25 مل المتوسطة HEK. استخدام واحد لكل T150 إعداد الفيروسة البطيئة.
- ما يلي الخلايا HEK293T يوم بالنقل عن طريق الترسيب فوسفات الكالسيوم. (ملاحظة: في أيدينا الكالسيوم فوسفات يؤدي هطول الأمطار بشكل روتيني في كفاءة ترنسفكأيشن 80-90٪، ولكن قد يستخدم أيضا الموجبة الكواشف ترنسفكأيشن الدهون مثل Lipofectamine 2000 أن). إعداد كل منهما من 15 مل المخروطية أنابيب لكل فيروس أن نكون مستعدين. تسمية أنابيب "A" و "B". أنبوب A، 10 ميكروغرام لكل من: الناقل العوامل المكوك ترميز lentiviral إعادة برمجة (أو rtTAM2.2)، وناقلات التعبئة والتغليف الفيروسية، وترميز البلازميد البروتين المغلف الفيروسية، VSVg. إضافة ميكرولتر 186 2 M CaCl 2 إلى أنبوب، وتحقيق وحدة التخزين إلى 1.5 مل العقيمة مع O 2 H. أنبوب B: 1.5 مل 2X HBS (قبل تحسنت إلى درجة حرارة الغرفة).
- ماصة الخليط في أنبوب حتى يتم حل متجانسة. إضافة إلى حل A B حل نقطه نقطه واسمحوا الوقوف في درجة حرارة الغرفة لمدة 2-3 دقيقة.
- نضح المتوسطة نمو الخلايا HEK293T واستبدالها مع 22 مل المتوسطة HEK قبل تحسنت دون البنسلين والستربتوميسين.
- ماصة مجتمعة حلول AB (راسب الفوسفات الكالسيوم) مباشرة إلى الخلايا HEK293T وتوزيع بالتساوي بواسطة هزاز لطيف.
- 24 ساعة بعد ترنسفكأيشن من HEK-293T مع الفيروسة البطيئة الخلايا، وإزالة المتوسطة النمو واستبدالها 25 مل من الطازجة والمتوسطة HEK قبل تحسنت. العودة إلى HEKs بالنقل الحاضنة.
- 48 ساعة بعد ترنسفكأيشن من HEK-293T مع الخلايا الفيروسة البطيئة، وجمع وسائل الإعلام التي تحتوي على جزيئات النمو lentiviral من HEKs بالنقل. إزالة الحطام من الجسيمات الفيروسية الحل تحصد بواسطة الطرد المركزي عند 3،000 x ج لمدة 5 دقائق في 4 درجات مئوية.
- تركز الفيروس عن طريق يلاقي تنبيذ فائقهتاف اشمئزاز وسادة السكروز 20٪ (2 مل مل طاف sucrose/25 الفيروسية) لمدة 2 ساعة في 112،000 XG في 4 درجات مئوية تعليق بيليه الفيروسية في 0.4 مل في المتوسط MEF C ° 4 ل15-30 دقيقة مع هزاز لطيف. تخزين الجسيمات الفيروسية في استخدام مرة واحدة مأخوذة (أي 50 ميكرولتر) في -80 ° C.
2. إعداد الخلايا الليفية الجنينية الماوس (MEF) لإعادة برمجة
ملاحظة: بروتوكول المذكورة هنا يتعلق اشتقاق الخلايا الليفية من iPSCs E الماوس 13،5 الجنينية لاستخدامها في فحوصات TEC. بينما مجموعات أخرى قد ولدت كل من اللجنة التوجيهية الفئران الكبار مصادر الخلية المانحة، ونحن لم نجرب هذه الطريقة على أنواع الخلايا الأخرى، ويمكن أن لا تكون على يقين من نوع من الخلايا المانحة ليست عاملا.
- إعداد الماوس التزاوج التوقيت. في يوم الجنينية 13.5 (E13.5)، الموت ببطء الأنثى الحامل وتشريح الأجنة من الرحم قرون. مكان والأجنة في برنامج تلفزيوني 1X متجر (ما قبل المبردة إلى C ° 4) على الجليد.
- إزالة الأنسجة خارج الجنين (أيالمشيماء، والمشيمة السلى). قطع رأس الجنين وإزالة الذيل (اختياري - إذا لزم الأمر لالتنميط الجيني) والأطراف. يستخرج الأعضاء الداخلية، أو باستخدام ملقط ملعقة مغرفة على شكل اللحم المفروم والذبيحة المتبقية مع شفرة لمقص مشرط أو حادة.
- غسل الذبيحة المفروم في 5 مل PBS 1X قبل مبردة. أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق.
- نضح طاف. تعليق بيليه في 5 مل 0.25٪ التربسين EDTA واحتضان-في 37 ° C مع قوي يهز لمدة 20-30 دقيقة.
- إضافة 5 مل من المتوسط MEF (قبل تحسنت إلى 37 ° C)، ومزيج أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق.
- نضح طاف بيليه وresuspend في المتوسط MEF قبل تحسنت.
- MEFs وحة فصل في 2-3 آبار لوحة 6 جيدا قبل المغلفة مع الجيلاتين 0.1٪. ويعتبر هذا المقطع 1.
- مرور MEFs في التخفيف من 1:04 حتي 01:05 كل 48 ساعة. MEFs في مرور 3 هي على استعداد لتنبيغ lentiviral.
3. اشتقاق خطوط التوجيهية
- قبل يوم واحد تنبيغ lentiviral؛ البذور ~ 3 × 10 5 MEFs الأولية في واحدة جيدا من لوحة 6 جيدا قبل المغلفة مع الجيلاتين 0.1٪.
- يوم 1: يجب أن يكون الابتدائية MEFS متموجة 80-90٪ لتنبيغ lentiviral. إضافة جزيئات lentiviral مباشرة إلى وسائل الإعلام MEF واحتضان بين عشية وضحاها مع MEFs في 37 ° C، 5٪ CO 2 في بيئة مرطب.
- في اليوم التالي (يوم 2) نضح على المديين المتوسط ويغسل مرتين مع 3 مل من 1X PBS لإزالة الجسيمات الفيروسية.
- إضافة 0.5 مل قبل تحسنت 0.25٪ التربسين EDTA-إلى الخلايا واحتضان عند 37 درجة مئوية لمدة 3-5 دقائق مع هزاز في بعض الأحيان.
- يسحن لتحقيق تعليق وحيد الخلية. مراقبة الخلايا عن طريق المجهر الضوئي لضمان تعليق خلية واحدة.
- نقل MEFs في أنبوب مخروطي 15 مل تحتوي على 5 مل سائل الإعلام MEF. أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق. نضح طاف الخلايا و resuspend بلطف في المتوسط MEF.
- موزعة بالتساوي بين الخلايا تعليق بئرين من ص 6 جيدفي وقت متأخر قبل المغلفة مع الجيلاتين 0.1٪.
- لوحة صخرة ذهابا وإيابا، جنبا إلى جنب، ومرة واحدة في حركة دائرية لتحقيق توزيع عادل للخلايا في جميع أنحاء البئر. احتضان بين عشية وضحاها في 37 درجة مئوية، 5٪ CO 2 في بيئة مرطب.
- يوم 3: كرر الخطوات من 4-9 باستثناء تقسيم الخلايا بالتساوي من بئر واحد إلى 3 آبار من قبل المغلفة لوحة 6 جيدا مع الجيلاتين 0.1٪. وهذا العائد من 6 آبار transduced الخلايا الليفية الأولية.
- اليوم 4: إضافة الدوكسيسيكلين (دوكس) في تركيز 10 ميكروغرام / مل إلى 5/6 آبار. ينبغي للمرء أن يبقى كذلك دون علاج لتكون بمثابة السيطرة.
- إضافة VPA بنحو 1.9 مم إلى 3 من الآبار 5 تعامل مع دوكس. VPA يقلل من معدل انتشار MEFs. الثقافات كثيفة من MEFs تحمل التعرض لفترات طويلة لحين VPA الثقافات تميل إلى subconfluent senesce داخل 2-5 أيام. ولذلك، ينبغي أن تكون متموجة MEFS 100٪ عند إضافة VPA. ملاحظة: نحن نستخدم VPA في تجاربنا إعادة برمجة لأنها معروفة معدل جينية، وكان SHالخاصة لزيادة كفاءة توليد التوجيهية 17 على الرغم من أننا لا نعرف الآثار وآليات العمل فيما يتعلق VPA توليد خطوط التوجيهية المحفزة بشكل كامل.
- يوم 5: نضح والمتوسطة، وغسل ويعرض للتريبسين الخلايا كما كان من قبل. مرور الخلايا تعامل مع دوكس / VPA لمدة 15 سم 2 الأنسجة طبق ثقافة ما قبل المغلفة مع الجيلاتين و0.1٪ من كل الشروط الأخرى ل10 سم قبل المغلفة أطباق 2 في الخلية المتوسطة ES تستكمل مع دوكس الطازجة وVPA.
- تجديد الخلايا كل يوم مع المتوسط ESC تستكمل مع دوكس الطازجة وVPA. يجب ESC مثل المستعمرات تبدأ في الظهور بعد 7 ايام ~ في علاج دوكس / VPA وبعد 10 يوما في العلاج ~ وحدها دوكس. لا ينبغي لمستعمرات تظهر في غياب المعالجة دوكس.
- مرة واحدة المستعمرات امتلاك الانكسار مشرق، والحدود واضحة المعالم وتحتوي على 30-50 الخلايا، عزل المستعمرات يدويا مع تلميح ماصة هلام التحميل والنقل إلى لوحة U-96 أسفل جيدا تحتوي على 20 ميكرولتر من 0.25٪ التربسين EDTA-. يعرض للتريبسين إلى الخلايا واحدة ونقلها إلى مغذيات في 96 لوحة مسطحة القاع جيدا في 150 ميكرولتر المتوسطة ESC تحتوي على دوكس / VPA أو دوكس وحدها.
- الاستمرار في توسيع نطاق clonally خطوط التوجيهية معزولة على مغذيات في المتوسط ESC. إزالة دوكس وVPA في يوم 19 بعد إضافة بهم (بعد يوم تنبيغ 23). تجاهل الخطوط التوجيهية التي لا الحفاظ على احترامهم لتجديد أو معدلات انتشار مماثلة لضوابط ESC.
قد يكون من المفيد لوصف خطوط التوجيهية الخاصة بك فيما يتعلق المجالس الاقتصادية والاجتماعية قبل محاولة تنفيذ TEC. اتسمت نحن لدينا خطوط من 1) التعبير عن علامات تعدد القدرات الذاتية (SSEA-1، Oct4، Sox2، NANOG) من كيمياء سيتولوجية مناعية، 2) تحليل النمط النووي الصبغي وعن طريق عد 3) تشكيل هيئة مضغي الشكل. يمكن للمرء أيضا تنفيذ lentiviral محددة RT-qPCR للتأكد من أن لا يتم التعبير عن الجينات المحورة proviral في iPSCs. ومع ذلك، فقد حددنا iPSCs المحفزة بشكل كامل باستخدام التشكل فقط، والمناعية karyotypجي. في تجاربنا، واختيار خطوط التوجيهية بناء على ESC مثل التشكل والنمو النتائج الخصائص في معظم خطوط التعبير عن علامات تعدد القدرات في حين أننا عادة تحديد عدة خطوط غير طبيعية مع كروتب] يحتمل.
4. إعداد iPSCs لحقن الكيسة
وقد تبين عدد مرور خط PSC أن تؤثر ال 18 على الرغم من تعدد القدرات هذا قد تعتمد إلى 19 خط. وقد استخدمنا iPSCs من 8-14 من الممرات لإنتاج الكبار كل التوجيهية الفئران.
- iPSCs ذوبان الجليد وعلى مغذيات لوحة في وسط ESC. مرور الخلايا على الأقل مرة واحدة على مغذيات قبل الاستخدام للحقن.
- واحدة من جانب لوحة 6 جيدا تحتوي على 70-80٪ متموجة iPSCs توفير أكثر من عدد كاف من الخلايا للحقن. نضح المتوسطة النمو وغسل الخلايا مع 1X PBS 3 ~ مل (بدون كا 2 + / المغنيسيوم 2 +).
- إضافة 0.5 مل قبل تحسنت 0.05٪ التربسين EDTA-إلىالخلايا واحتضان عند 37 درجة مئوية لمدة 10 دقيقة مع هزاز في بعض الأحيان.
- يسحن لتحقيق تعليق وحيد الخلية. مراقبة الخلايا عن طريق المجهر الضوئي لضمان تعليق خلية واحدة. وiPSCs يجب أن تكون في خلية واحدة والتعليق المستعمرات / المجاميع خلية لن تسد ماصة الحقن.
- مرة واحدة في خلية واحدة والتعليق بن المحرز، إضافة 1.0 مل سائل الإعلام ESC إلى البئر والعودة إلى الحاضنة لوحة 37 درجة مئوية. احتضان لدقيقة 15 ~ أو حتى غالبية مغذيات بدأت الالتزام.
- إزالة بلطف المتوسطة التي تحتوي على iPSCs مع الحرص على عدم طرد مغذيات تمسكا ضعيفة.
- وضع iPSCs في أنبوب مخروطي 15 مل تحتوي على 5 مل المتوسطة ESC. أجهزة الطرد المركزي في 200 x ج لمدة 5 دقائق. نضح طاف وإزالة ما تبقى من خلايا ES المتوسطة مع micropipette. الاستفادة من أنبوب لإخراج بيليه والخلايا برفق في إعادة تعليق 0،2-0،5 مل المتوسطة FHM قبل مبردة. الخلايا متجر على الجليد حتى وأثناء الحقن في ب رباعي الصيغة الصبغيةlastocysts.
5. جيل من مثانات بلاستولية رباعي الصيغة الصبغية
وقد وصفت الإجراءات التي تؤدى في هذا القسم بالتفصيل في مكان آخر 5،6،20. نحن هنا الخطوط العريضة أسلوبنا الأمثل لمناور الخلية الكهربائية BTX ECM 2001.
- انشاء الفئران المانحة الجنين من 23-28 فتيلة الفئران الإناث اليوم القديمة (C-2J C57BL/6J-Tyr / BALB / cByJ F1) مع PMS وHCG. إدارة وحدة دولية من 5 PMS في 2pm و 5 وحدة دولية من 47 ساعة في وقت لاحق HCG. بعد حقن HCG، التي أنشئت إناث الفئران مع C57BL/6J-Tyr C-2J / BALB / cByJ الذكور مسمار F1. تحقق من اليوم التالي لالمقابس المهبلية.
- توصيل الموت ببطء إناث الفئران وجمع ناقلة البيضات. جمع الخلايا 1-الأجنة عن طريق وضع ناقلة البيضات في FHM مع هيالورونيداز وتمزيق بلطف ampulae. السماح للجماهير الركامية على الجلوس في FHM / هيالورونيداز للدقيقة 5-7.
- جمع الأجنة 1-الخلية باستخدام ماصة الفم وغسل وسائل الإعلام من خلال قطرات من FHM قبل وضعها في KSOMثقافة-AA. الثقافة في 37 درجة مئوية، 5٪ CO 2 تحت الزيوت المعدنية بين عشية وضحاها وحدد 2-الخلية الأجنة يوم الكهربائي، ونبذ جميع الأجنة الأخرى.
- وضع شريحة مجهرية BTX في طبق بتري الطول 10. صب سائل الإعلام بما فيه الكفاية الكهربائي درجة حرارة الغرفة لغمر الشريحة في الحل، ولكن ليس لدرجة أن يتم مغمورة تماما أقطاب القطب.
- تشغيل ECM 2001 وBTX محسن 400. توصيل الكابلات وECM لشريحة مجهرية القطب وإصلاح الكابلات إلى جانب طبق بتري لمنع حركة غير مقصودة من الشريحة.
- تشغيل نبضة واحدة للحصول على دليل على القراءة محسن BTX ولاحظ الجهد من التيارات AC / DC يتم تطبيقها. AC الحالية سوف تحكم في السرعة التي سوف محاذاة الأجنة بين الأقطاب، سوف DC الحالي صهر blastomeres، والوقت سيتم تعيين نبض طول النبض DC. A نقطة انطلاق جيدة هو 3V AC، DC 100V، والوقت ميللي ثانية 0.05. ويختلف DC الأمثل في حدود 90-150 فولت.
- باستخدام ماصة الفم، يستغرق حوالي الأجنة لمدة 30-40 خلية من KSOM-AA الثقافة وغسلها من خلال عدة قطرات من المتوسط الكهربائي. رسم وسائل الإعلام الكهربائي الطازجة من صحن شريحة مجهرية في الفم ماصة واتخاذ الأجنة من الغسيل. وضعها في الفجوة بين 1 مم الأقطاب على شريحة مجهرية. أن نكون حذرين المناصرة لها في منتصف أسفل الفجوة، وأنها ليست على اتصال مع بعضها البعض.
- تطبيق AC الحالية عن طريق الضغط على زر نبض اليدوي. سوف الأجنة في مجال تدوير AC، حتى الطائرة الاتصال قسيم أرومي موازية للالأقطاب الكهربائية. إذا لم يتم محاذاة الأجنة في بضع ثوان، وزيادة AC الإعداد.
- وانضمت بعد الأجنة، اضغط على الزر مرة أخرى لنبض دليل تطبيق نبض DC.
- مع الكهربائي المتوسط في ماصة، وجمع الأجنة من شريحة مجهرية. غسل الأجنة من خلال عدة قطرات من KSOM-AA ووضعها في KSOM-AA الثقافة في 37 درجة مئوية، 5٪ CO 2. اندماج قسيم أرومي SHOULD أن تكتمل في أقل من 30 دقيقة في الثقافة.
- كرر الخطوات من 7-11 للبقاء الخلية 2-الأجنة. بعد مجموعات الانصهار اللاحقة ورصد وتحديد الأجنة مع blastomeres تنصهر. سوف تنصهر الأجنة بنجاح تبدو في 1-الخلية المرحلة. تجاهل الأجنة هي lysed و 2 خلية بعد 30 دقيقة في الثقافة. إذا كان معدل الانصهار هو أقل من 80٪، وزيادة الجهد و / أو الوقت في الزيادات من 5V وميللي ثانية 0.01. إذا تحلل فوق 20٪، وانخفاض الجهد DC و / أو الوقت وفقا لذلك. كانت الإعدادات المثلى في تجاربنا AC 4V، DC 146V، وميللي ثانية 0،07. أسفرت هذه الإعدادات باستمرار 90٪ أو أعلى معدلات الاندماج مع تحلل قليلة أو معدومة.
- تواصل ثقافة الأجنة تنصهر في microdrops من KSOM-AA تحت الزيوت المعدنية عند 37 درجة مئوية، 5٪ CO 2. يجب أن تتوقع 85-95٪ من الأجنة تنصهر لتشكل رباعي الصيغة الصبغية (4N) مثانات بلاستولية بعد 48 ساعة من الحضانة.
6. حقن مكروي من iPSCs في مثانات بلاستولية رباعي الصيغة الصبغية
نستخدم نيكون TE-2000Uالمجهر المقلوب مجهزة البصريات DIC وmicromanipulators Narishige للحقن الكيسة. يتم حقن كل الكيسة رباعي الصيغة الصبغية مع 10-12 iPSCs باستخدام بروتوكول قياسي للحقن ESC في مثانات بلاستولية الماوس أنه قد ثبت في منشور إن الرب السابق 5،20،21
- ضع بنسبة 20 ميكرولتر من FHM في وسط شريحة المجهر المقعرة وتغطية ذلك مع 150 ميكرولتر من الزيوت المعدنية.
- تخفيض ماصة القابضة وإبرة حقن مكروي في انخفاض FHM. السماح 2-3 دقائق لكل من الإبر لملء جزئيا مع FHM.
- يغسل 20-30 مثانات بلاستولية رباعي الصيغة الصبغية من خلال قطرات من FHM ونقل إلى انخفاض FHM على الشريحة المجهر.
- خليط الفم ماصة اللجنة التوجيهية في الهبوط. قد يكون من الضروري لتخفيف الخليط خلية في قطرة من FHM إذا مسبقا تتركز أيضا الخلايا أو تجميعها.
- التقاط 100-200 الخلايا التي تحتوي على إبرة الحقن.
- عقد الكيسة مع الكتلة الخلوية الداخلية في يفترض الساعة 9أيون. حقن الخلايا في blastocoel عن طريق اختراق الشفافة زونا والأرومة الغاذية في موقف الساعة 3. حقن الخلايا في الكيسة 16-18.
- العودة إلى اللجنة التوجيهية مثانات بلاستولية تستكمل KSOM-AA الثقافة.
7. ونقل مثانات بلاستولية رباعي الصيغة الصبغية تستكمل في القرون الرحم من الفئران المتلقية
يتم نقل جراحيا مثانات بلاستولية رباعي الصيغة الصبغية تكملة لقرون الرحم لدى الفئران الإناث المستفيدة وفقا للمبادئ التوجيهية للمعهد الباحث، وذلك باستخدام تقنية القياسية 20 التي سنقوم بإيجاز. حدد أنثى الفئران CD-1 في المرحلة الموالية للشبق وإقامتها للالتزاوج مع الذكور مستأصل الأسهر. تحقق من وجود المقابس المهبل في صباح اليوم التالي. الإناث على استعداد لنقل الأجنة في الرحم بعد يومين من الكشف عن المكونات (2.5 DPC).
يوم واحد قبل أن يتم تزاوج الذكور الإناث المتلقي مع مستأصل الأسهر، وإنشاء إضافية CD-1 الإناث مع الذكور غير مستأصل الأسهرلاستخدامها كأمهات تعزيز للجميع الفئران التي تم استردادها بواسطة اللجنة التوجيهية عملية قيصرية.
8. ولادة قيصرية القسم وتشجيع من اللجنة التوجيهية المستمدة من الجراء
نقل الأجنة TC النتائج عادة في resorptions متعددة بعد زرع، حتى لو كانت اللجنة التوجيهية أو خط ESC لديها امكانات عالية التنموية. ونتيجة لذلك، يمكن للمرء أن يتوقع أكثر من 4 لا الجراء قابلة للحياة (1-2 عادة) في المتلقي. عادة ما تهمل هذه الفضلات صغيرة من المتلقين. لزيادة مستوى رعاية الأطفال حديثي الولادة ومعدل البقاء على قيد الحياة، ونحن أداء العمليات القيصرية وتعزيز فقا للبروتوكولات القياسية 20. لأداء عملية قيصرية، الموت ببطء الفئران المتلقية 16 يوما بعد نقل الأجنة في 20:00-7 (18،5 المتلقي DPC) وتشريح الجراء من قرون الرحم. تعزيز الجراء قابلة للحياة للأمهات CD-1 أن الفضلات تسليمها في نفس اليوم.
النتائج
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
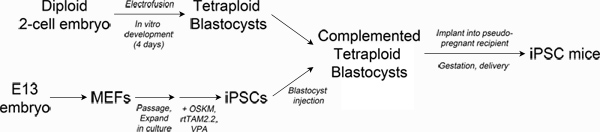
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
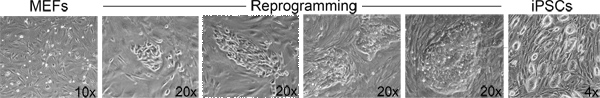
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
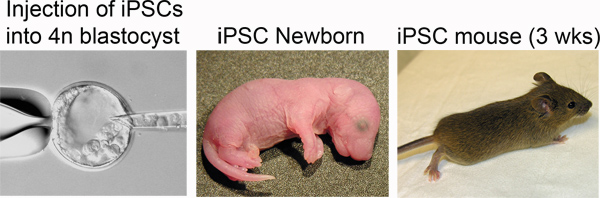
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discussion
الفئران توليد خطوط التوجيهية من استخدام المقايسات TEC يوفر اختبار صارمة لتعدد القدرات الوظيفية وجود خط التوجيهية. وهذا قد يكون من المفيد اختبار لتقييم الكفاءة النسبية لمختلف أساليب إعادة برمجة أو لتحديد خطوط التوجيهية التي قد تكون مفيدة للغاية لتوليد بعض أنواع الخلايا في المختبر. ويمكن استخدام الفئران المولدة من iPSCs لاختبار صارم الاستقرار طويل الأجل وtumorigenicity من اللجنة التوجيهية المستمدة من الأنسجة. وسوف يكون من المفيد هذا البروتوكول للمحققين الراغبين في توليد خطوط التوجيهية المحفزة بشكل كامل أو الفئران أو اللجنة التوجيهية للمقارنة بين الفائدة النسبية لمختلف أساليب إعادة برمجة.
لا تزال غير مفهومة تماما الآليات التي تتحكم في توليد وتحديد iPSCs المحفزة بشكل كامل وأنه من الممكن أن بعض خطوط التوجيهية المنتجة باستخدام هذه الطريقة لن اجتياز اختبار TEC. هناك عوامل عديدة قد تختلف بين التجارب بما في ذلك الخلفيات الوراثية، عيار lentiviral، وأنماط أنا lentiviralnsertion، المعلمات دورة الخلية من السكان المانحة، الاختلافات بين المختبرات في مختلف خطوات الإجراء TEC والنزعات متغير من iPSCs إلى المرفأ الانحرافات الجينية أو جينية. لضمان نجاح أفضل، ونحن نحرص على إقامة مستويات مناسبة من التعبير الجيني في التجارب lentiviral الاشتقاق اللجنة التوجيهية عن طريق اختبار التخفيفات الفيروسية على MEFs الرقابة لضمان أن يتركز كل بما فيه الكفاية لإنتاج فيروس يمكن اكتشافها التعبير الجيني لا يقل عن 80٪ ومثالي 100٪ من MEFs. وهذا يسمح لنا لتحديد خطوط مع نسخ متعددة من lentiviruses مختلفة مع الحد سمية للMEFs المستعمرات وانتاج الآبار دون الاكتظاظ. تجدر الإشارة إلى أن ثبت متعددة البروتوكولات الأخرى لإنتاج iPSCs مع إمكانات النمو الكامل، وذلك باستخدام أساليب متعددة ومصادر الخلية المانحة تشير إلى أن مسارات متعددة لتعدد القدرات الكاملة قد تكون موجودة 1،8-13،15. في الوقت الحاضر، اللجنة التوجيهية ومع ذلك، لا نهائية العلامات البيولوجية المحفزة بالكاملتم التعرف وبالتالي فإن الفحص لا يزال اختبار TEC الذهب القياسية ما إذا كان خط التوجيهية يمكن أن تولد كل خلية في الأنساب كائن حي.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
ودعم لKKB، شريطة MJB، وJLH KLN من معهد كاليفورنيا للطب التجديدي، وصناديق بيو الخيرية برنامج علماء الطب الحيوي والأسرة استير أوكيفي مؤسسة B. ومؤسسة أسرة شابيرو. KKB هو E. دونالد ودليا B. باكستر مؤسسة الباحث كلية.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
References
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. . Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -. Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -. y., et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved