Method Article
Geração de camundongos derivadas de células-tronco pluripotentes induzidas
Neste Artigo
Resumo
Gerando pluripotentes induzidas de células-tronco (IPSC) produz linhas de linhas de diferentes potencial de desenvolvimento, mesmo quando eles passam por testes padrão pluripotência. Aqui nós descrevemos um protocolo para produzir ratos derivadas inteiramente de iPSCs, que define as linhas iPSC como possuindo pluripotência completa 1.
Resumo
A produção de células-tronco pluripotentes induzidas (iPSCs) a partir de células somáticas, proporciona um meio para criar ferramentas valiosas para a investigação básica e também pode produzir uma fonte de células-paciente combinados para terapias regenerativas. iPSCs pode ser gerada utilizando vários protocolos e derivado de fontes de células múltiplas. Uma vez gerados, iPSCs são testados usando uma variedade de ensaios, incluindo os marcadores de imunocoloração para pluripotência, geração de três camadas germinais em corpos embrióides e teratomas, comparações de expressão de genes em células estaminais embrionárias (ESC) e na produção de ratinhos quiméricos, com ou sem contribuição da linha germinativa 2 . É importante notar que as linhas iPSC que passam estes testes ainda variam na sua capacidade para produzir diferentes tipos de células diferenciadas 2. Isso tornou difícil estabelecer quais protocolos de derivação IPSC, fontes de células doadoras ou métodos de selecção são mais úteis para diferentes aplicações.
O teste mais rigorosose uma linha de células-tronco tem o potencial de desenvolvimento suficiente para gerar todos os tecidos necessários para a sobrevivência de um organismo (denominado pluripotência cheio) é a complementação de embriões tetraplóides (TEC) 3-5. Tecnicamente, TEC envolve electrofusão de duas células de embriões para gerar tetraplóides (4n) uma célula de embriões que podem ser cultivados in vitro para a fase de blastocisto 6. Diplóides (2n), as células estaminais pluripotentes (por exemplo, ESCs ou iPSCs) são então injectado na cavidade do blastocele blastocistos tetraplóides e transferido para uma fêmea receptora de gestação (ver Figura 1). O componente do embrião tetraplóide complementado contribui quase exclusivamente aos tecidos extra-embrionário (placenta, saco vitelino), enquanto que as células diplóides constituem o embrião propriamente dito, o que resulta em um feto derivado totalmente a partir da linha de células estaminais injetadas.
Recentemente, relatou a derivação de linhas de iPSC que reproduzível gerar ratos adultosatravés de uma TEC. Estas linhas iPSC dar origem a filhotes viáveis com eficiências de 5-13%, que é comparável com os CES 3,4,7 e maior do que o relatado para a maioria das outras linhas iPSC 8-12. Estes relatórios mostram que a reprogramação direta pode produzir iPSCs totalmente pluripotentes que correspondem CES no seu potencial de desenvolvimento e eficiência de gerar filhotes em testes TEC. No momento, não está claro o que distingue entre iPSCs totalmente pluripotentes e linhas menos potentes 13-15. Também não é claro que os métodos de reprogramação irá produzir essas linhas com a maior eficiência. Aqui nós descrevemos um método que produz iPSCs totalmente pluripotentes e "todo-iPSC" ratos, que podem ser úteis para pesquisadores que desejam comparar a pluripotência das linhas iPSC ou estabelecer a equivalência de diferentes métodos de reprogramação.
Protocolo
Este método foi utilizado na pesquisa relatada em Boland et al Nature.. 461, 91-96 (2009) 1.
1. Preparação de Lentivirus
Este protocolo utiliza doxiciclina induzíveis por vectores vaivém lentivirais que codificam para Oct4, Sox2, Klf4, e c-Myc sob o controlo de um elemento de resposta de tetO. Os transgenes são activados pela tetraciclina reversa proteína trans-activação, rtTAM2.2 16, que induz a expressão do factor de reprogramação na presença de doxiciclina. Este sistema permite a expressão controlada rigidamente, elevada de factores de reprogramação. Os lentivirais usados aqui são auto-inativadora e, portanto, não pode replicar integração genômica seguinte. No entanto, é necessária precaução quando se trabalha com lentivírus e deve ser realizado em conformidade com laboratórios BSL2 (EUA) e S2 (Europa) padrões.
- Descongele as células HEK293T e passagem pelo menos uma vez antes de transfection. As células devem ser mantidas a densidade confluentes em meio de HEK a 37 ° C, 5% de CO 2 num ambiente humidificado. Células de passagem rotineiramente a cada 2 dias, com uma razão de divisão de 1:06 - 01:10.
- Semente ~ 8 x 10 6 HEK293T cells/T150 meio com 25 ml de HEK. Usar um T150 para cada preparação lentivirus.
- No dia seguinte, transfectar células HEK293T por precipitação com fosfato de cálcio. (Nota: nas nossas mãos de precipitação com fosfato de cálcio resulta rotineiramente em eficiência de transfecção de 80-90%, no entanto, reagentes lipídicos catiónicos de transfecção, tais como Lipofectamina 2000 também pode ser utilizado). Preparar dois tubos cónicos de 15 ml para cada virus a ser preparada. Rotular os tubos "A" e "B". Tubo A, 10 ug de cada um: os lentivirais shuttle vector codificando factores de reprogramação (ou rtTAM2.2), os vectores virais de empacotamento, e plasmídeo que codifica a proteína do envelope viral, VSVg. Adicionar 186 ul de 2 M de CaCl2 para tubo A, e levar o volume até 1,5 ml com H2O estéril. Tubo B: 1,5 ml de 2x HBS (pré-aquecido até à temperatura ambiente).
- Pipetar a mistura no tubo A, até que uma solução homogénea. Adicione-se uma solução de solução B, gota a gota e deixar em repouso à temperatura ambiente durante 2-3 min.
- Aspirar meio de crescimento de células HEK293T e substituir por 22 ml de meio de HEK pré-aquecido, sem penicilina e estreptomicina.
- Pipeta combinado soluções AB (fosfato de cálcio precipitado) diretamente para HEK293T células e distribuir uniformemente pelo suave balanço.
- 24 horas após a transfecção de células HEK-293T células com lentivírus, remover meio de crescimento e substituí-la com 25 ml de fresco, médio HEK pré-aquecido. Retornar HEKS transfectadas para a incubadora.
- 48 h após a transfecção de células HEK-293T células com lentivírus, recolher o meio de crescimento contendo partículas lentivirais das HEKS transfectadas. Remover os restos em partículas a partir da solução viral colhidas por centrifugação a 3000 xg durante 5 min a 4 ° C.
- Concentrar vírus por ultracentrifugação through uma almofada de sacarose a 20% (2 ml sucrose/25 sobrenadante viral ml) durante 2 horas a 112.000 xg a 4 ° C. Suspender pellet viral em 0,4 ml MEF meio a 4 ° C durante 15-30 minutos com agitação suave. Armazenar as partículas virais em alíquotas de uso único (isto é, 50 ul) a -80 ° C.
2. Preparação de fibroblastos de rato embrionárias (MEF) para a reprogramação
Nota: O protocolo apresentado aqui refere-se à derivação de iPSCs de E 13,5 fibroblastos de rato embrionárias para uso em ensaios de TEC. Enquanto outros grupos têm gerado todo-iPSC ratos de fontes de células adultas de doadores, nós não testei este método em outros tipos de células e não pode ter certeza de que tipo de célula doadora não é um fator.
- Configure acasalamentos rato cronometrados. No dia embrionário 13,5 (E13.5), eutanásia a mulher grávida e dissecar os embriões dos cornos uterinos. Lugar e embriões de loja em 1x PBS (pré-refrigerada a 4 ° C) em gelo.
- Remover os tecidos extra-embrionário (iecórion, âmnio e placenta). Decapitar o embrião e remova a cauda (opcional - se necessário para genotipagem) e membros. Retire os órgãos internos, utilizando fórceps ou uma espátula colher em forma e pique o restante da carcaça com a lâmina de uma tesoura ou bisturi afiado.
- Lava-se a carcaça de picada em 5 ml pré-refrigerada 1x PBS. Centrifugar a 200 xg durante 5 min.
- Aspirar o sobrenadante. Suspender o pellet em 5 ml de 0,25% de tripsina-EDTA e incubado a 37 ° C com agitação vigorosa durante 20-30 min.
- Adicionar 5 ml de meio de MEF (pré-aquecido a 37 ° C), misturar e centrifugar a 200 xg durante 5 min.
- Aspirar o sobrenadante e ressuspender o pellet em pré-aquecido médio MEF.
- Placa MEFs dissociado em 2-3 cavidades de uma placa de 6 poços pré-revestidas com gelatina a 0,1%. Isto é considerado uma passagem.
- MEFs passagem a uma diluição de 1:04 - 01:05 hr cada 48. MEFs na passagem 3 está pronto para a transdução lentiviral.
3. Derivação das linhas iPSC
- Um dia antes de transdução lentiviral; semente ~ 3 x 10 5 MEFs primário para um poço de uma placa de 6 poços pré-revestidas com gelatina a 0,1%.
- Dia 1: Primário MEFs deve ser de 80-90% confluentes para a transdução lentiviral. Adicionar lentivirais partículas directamente para MEF media e incubar com MEFs a noite a 37 ° C, 5% de CO 2 num ambiente humidificado.
- No dia seguinte (dia 2) aspirar o meio e lava-se duas vezes com 3 ml de 1x PBS para remover as partículas virais.
- Adicionar 0,5 ml pré-aquecida de 0,25% de tripsina-EDTA para as células e incubar a 37 ° C durante 3-5 min com agitação ocasional.
- Tritura-se para obter uma suspensão de célula única. Observar as células por microscopia de luz para garantir uma suspensão de célula única.
- Transferência MEFs para um tubo cónico de 15 ml contendo 5 ml de meio MEF. Centrifugar a 200 xg durante 5 min. Aspirar o sobrenadante as células e ressuspender em meio levemente MEF.
- Divididos igualmente a suspensão de células entre dois poços de uma p 6 bemfinal pré-revestidas com gelatina a 0,1%.
- Agitar a placa para trás e para frente, de lado a lado, e uma vez com um movimento circular para alcançar uma distribuição uniforme de células ao longo do poço. Incubar durante a noite a 37 ° C, 5% de CO 2 num ambiente humidificado.
- Dia 3: Repita os passos 4-9, excepto dividir as células uniformemente a partir de um poço de 3 poços de uma placa de 6 bem pré-revestidas com gelatina a 0,1%. O resultado será de 6 poços transduzidos fibroblastos primários.
- Dia 4: Adicionar doxiciclina (dox), a uma concentração de 10 ug / ml a 5/6 poços. Um poço deve permanecer sem tratamento para servir de controlo.
- Adicionar VPA, 1,9 mM para 3 dos 5 poços tratados com dox. VPA reduz a taxa de proliferação de MEFs. Culturas densas de MEFs tolerar a exposição prolongada ao VPA enquanto que as culturas tendem a subconfluência senesce dentro de 2-5 dias. Por conseguinte, deve ser MEFs confluente de 100% quando o VPA é adicionado. Nota: Usamos VPA nas nossas experiências de reprogramação, porque é um modificador epigenética conhecida, e tem sido shprópria para aumentar a eficiência da geração iPSC 17, embora os efeitos e os mecanismos de acção de VPA com respeito à geração de linhas iPSC totalmente pluripotentes não são conhecidos.
- Dia 5: Aspirar o meio, lave e Tripsinizar as células como antes. Passagem das células tratadas com dox / VPA a uma placa de cultura de 15 centímetros 2 tecido pré-revestido com gelatina a 0,1% e cada uma das outras condições de pré-revestidas com 10 cm 2 em meio de pratos de células ES suplementadas com dox fresco e VPA.
- Repor células a cada dia com ESC meio suplementado com dox fresco e VPA. ESC-como colónias devem começar a aparecer após ~ 7 dias no tratamento dox / VPA e ~ 10 dias após o tratamento em dox sozinho. Sem colónias devem aparecer na ausência de tratamento dox.
- Uma vez que as colónias possuir uma refracção brilhante, borda bem definido e contém 30-50 células, manualmente isolar as colónias com uma ponta de pipeta de gel de carregamento e transferência para um fundo em U placa de 96 poços contendo 20 ul de 00,25% de tripsina-EDTA. Tripsinizar as células individuais e transferir para alimentadores de uma placa plana 96 poços de fundo em 150 ul de meio contendo ESC dox / VPA ou dox sozinho.
- Continuar a expandir as linhas clonalmente isoladas iPSC nos alimentadores em meio ESC. Remover dox VPA e no dia 19, após a sua adição (pós-transdução no dia 23). Descarte linhas iPSC que não mantêm auto-renovação ou taxa de proliferação semelhantes aos controles ESC.
Pode ser útil para caracterizar suas linhas iPSC em relação a CES antes de tentar executar TEC. Temos caracterizado nossas linhas por 1) expressão de marcadores de pluripotência endógenos (SSEA-1, Oct4, Sox2, Nanog) por imunocitoquímica, 2) a análise do cariótipo por contagem de cromossomos e 3) formação de corpo embryoid. Pode-se também realizar lentiviral específica de RT-qPCR para confirmar que os transgenes provirais não são expressos nos iPSCs. No entanto, identificamos iPSCs totalmente pluripotentes usando apenas morfologia imunomarcação, e karyotyping. Nas nossas experiências, a selecção das linhas de base iPSC ESC-como morfologia e características de crescimento resulta em que a maioria das linhas que expressam marcadores de pluripotência enquanto que tipicamente identificar várias linhas de cariótipo potencialmente anormais.
4. Preparação de iPSCs para injeção Blastocisto
Número de passagens de uma linha de PSC tem sido demonstrado que afecta a sua pluripotencialidade 18, embora isto possa ser a linha 19 dependente. Temos usado iPSCs de passagens a partir de 8-14 para a produção de adultos de todos os iPSC ratos.
- IPSCs descongelamento e placa em alimentadores em meio ESC. Passagem das células pelo menos uma vez nos alimentadores antes da utilização de injeção.
- Um poço de uma placa de 6 poços contendo 70-80% confluentes iPSCs irá fornecer mais do que um número suficiente de células para a injecção. Aspirar meio de crescimento e de lavar as células com ~ 3 ml de PBS 1x (sem + / Mg 2 + Ca 2).
- Adicionar 0,5 ml pré-aquecida de 0,05% de tripsina-EDTA paraas células e incubar a 37 ° C durante 10 minutos com agitação ocasional.
- Tritura-se para obter uma suspensão de célula única. Observar as células por microscopia de luz para garantir uma suspensão de célula única. Os iPSCs precisam de estar em suspensão de célula única como colónias / agregados de células vão entupir a pipeta de injecção.
- Uma vez que uma única suspensão celular obtida foi ben, adicionar 1,0 ml ESC meios para o bem e devolver a placa à incubadora a 37 ° C. Incubar durante ~ 15 min, ou até a maior parte dos alimentadores de ter começado a aderir.
- Remover suavemente o meio contendo as iPSCs tendo cuidado para não deslocar os alimentadores fracamente aderentes.
- Coloque as iPSCs num tubo cónico de 15 ml contendo 5 ml de meio de ESC. Centrifugar a 200 xg durante 5 min. Aspirar o sobrenadante e remover o restante meio de células ES com uma micropipeta. Toque no tubo para retirar o sedimento de células e ressuspender em 0,2-0,5 suavemente meio FHM ml pré-arrefecida. Loja de células no gelo e até durante a injecção tetraplóide blastocysts.
5. Geração de blastocistos tetraploides
Os procedimentos realizados nesta secção foram descritas em detalhe noutro local 5,6,20. Aqui destacamos a nossa técnica, otimizada para o celular Manipulator BTX Electro ECM 2001.
- Configure camundongos doadores de embrião por priming 23-28 dias de idade camundongos fêmeas (C57BL/6J-Tyr c-2J / BALB / cByJ F1) com TPM e HCG. Administrar 5 UI de PMS em 14:00 e 5 UI de HCG 47 horas mais tarde. Após a injeção de HCG, criado camundongos fêmeas com C57BL/6J-Tyr c-2J / BALB / cByJ acasaladas F1. Verifique o dia seguinte para plugues vaginais.
- Euthanize conectado camundongos fêmeas e recolher ovidutos. Colete 1 de células de embriões oviductos colocando em FHM com hialuronidase e gentilmente rasgar a ampulae. Permitir que as massas cumulus de se sentar em FHM / Hialuronidase para 5-7 min.
- Colete 1 de células de embriões utilizando uma pipeta de boca e lavar através de gotas de mídia FHM antes de colocá-los em KSOMCultura-AA. Cultura a 37 ° C, CO2 a 5% em óleo mineral durante a noite e seleccione 2 células de embriões no dia de electrofusão, eliminar todos os embriões outros.
- Coloque um MICROSLIDE BTX em uma placa de 10 cm de Petri. Despeje espaço suficiente mídia eletrofusão temperatura para submergir a lâmina na solução, mas não tanto que os pólos do eletrodo são completamente submerso.
- Ligue ECM 2001 e Enhancer BTX 400. Conectar cabos a ECM para o eléctrodo MICROSLIDE e fixar os cabos para o lado da placa de Petri para impedir o movimento não intencional do slide.
- Executar um pulso manual para obter uma leitura sobre o potenciador BTX e observe a tensão das correntes AC / DC a ser aplicadas. Corrente AC irá controlar a velocidade a que os embriões se alinhar entre os eléctrodos, a corrente CC irá fundir os blastómeros, e tempo de pulso irá definir o comprimento do impulso de DC. Um bom ponto de partida é o AC 3V, CC 100V, e tempo de 0,05 ms. A DC óptima varia na gama de 90-150 volts.
- Usando uma pipeta, tomar cerca de 30-40 duas células de embriões de KSOM-AA cultura e lavá-los através de algumas gotas de meio de eletrofusão. Desenhe mídia eletrofusão frescos do prato MICROSLIDE em pipeta e tomar embriões a partir da lavagem. Colocá-los no intervalo de 1 mm entre os eletrodos sobre a MICROSLIDE. Ter o cuidado de que estão alinhados no meio da fenda e que eles não estão em contacto uns com os outros.
- Aplicar AC atual pressionando o botão de pulso manual. Os embriões rodará no campo AC, até que o plano de contacto blastômero é paralela aos eléctrodos. Se os embriões não estão alinhados em poucos segundos, aumente a configuração de CA.
- Depois de ter alinhado embriões, pressione o botão de pulso manual novamente para aplicar o pulso DC.
- Com meio eletrofusão na pipeta, recolher os embriões do MICROSLIDE. Lavar os embriões através de várias gotas de KSOM-AA e colocá-los em KSOM-AA cultura a 37 ° C CO, 5% 2. O blastômero fusão should ser completado em menos de 30 min em cultura.
- Repita os passos 7-11 para permanecer duas células de embriões. Após os grupos de fusão subseqüentes, monitorar e selecionar embriões com blastômeros fundidos. Embriões fundidas com sucesso irão parecer ser de uma célula de fase. Descartar embriões lisadas e 2-célula após 30 min em cultura. Se a taxa de fusão é inferior a 80%, o aumento de tensão e / ou de tempo, em incrementos de 5 V e 0,01 mseg. Se a lise for superior a 20%, diminuir a tensão de CC e / ou de tempo em conformidade. Os melhores ajustes em nossos experimentos foram AC 4V, DC 146V, e 0,07 ms. Estas definições consistentemente produziu taxas de 90% ou mais elevadas de fusão com pouca ou nenhuma lise.
- Continuar a cultura de embriões fundidos em microgotas de KSOM-AA em óleo mineral a 37 ° C, 5% CO 2. Deve esperar 85-95% de embriões fundidos para formar tetraplóides (4n) blastocistos após 48 h de incubação.
6. Microinjeção de iPSCs em blastocistos tetraploides
Nós usamos uma Nikon TE-2000Umicroscópio invertido equipado com óptica de DIC e micromanipuladores Narishige para injecção de blastocistos. Cada blastocistos tetraplóides é injectado com 10-12 iPSCs utilizando um protocolo padrão para injecção ESC em blastocistos de ratinho que tem sido demonstrada em uma publicação anterior JoVE 5,20,21
- Colocar uma gota de 20 ul de FHM no centro de uma lâmina de microscópio côncava e cobri-lo com 150 uL de óleo mineral.
- Abaixe a pipeta holding e agulha microinjeção na gota FHM. 2-3 min para permitir que ambas as agulhas para encher parcialmente com FHM.
- Lavar 20-30 blastocistos tetraplóides através gotas de FHM e transferência para a queda FHM na lâmina de microscópio.
- Boca pipeta mistura iPSC na gota. Pode ser necessário diluir a mistura de células numa gota de FHM antecipadamente se as células são muito concentradas, ou agregados.
- Pegue 100-200 células com a agulha de injeção.
- Segurar o blastocisto com a massa celular interna no posit horas 9íon. Injectar células em blastocélica penetrando a zona pelúcida e trofoblasto na posição de 3 horas. Injectar 16-18 células por blastocisto.
- Retornar iPSC blastocistos complementadas para KSOM-AA cultura.
7. Transferência de complementada Blastocistos tetraploides nos cornos uterinos de camundongos destinatário
Complementadas blastocistos tetraplóides são cirurgicamente transferidos para os cornos uterinos de camundongos fêmeas receptoras de acordo com as diretrizes do instituto do pesquisador, utilizando a técnica padrão de 20 que vamos resumir. Selecione femininos ratinhos CD-1 na fase pró-estro e configurá-los para o acasalamento com machos vasectomizados. Verifique para plugues vaginais na manhã seguinte. As fêmeas estão prontas para a transferência de embriões uterinos, dois dias após o bujão foi detectada (2,5 dpc).
Um dia antes de fêmeas receptoras são acasaladas com machos vasectomizados, configurar adicionais CD-1 fêmeas com machos vasectomizados nãopara ser usado como mães adotivas para todo-iPSC ratos recuperados por cesariana.
8. Cesariana e Fomento da iPSC derivados Pups
A transferência de embriões TC normalmente resulta em múltiplas reabsorções após o implante, mesmo se o iPSC ou ESC linha tem um alto potencial de desenvolvimento. Como resultado, pode-se esperar que não mais de 4 crias viáveis (geralmente 1-2) por recipiente. Estas ninhadas pequenas são normalmente negligenciados pelos destinatários. Para aumentar o nível de cuidado neonatal ea taxa de sobrevivência, nós realizar cesarianas e fomento de acordo com os protocolos padrão de 20. Para realizar a cesariana, eutanásia ratos receptores 16 dias após a transferência de embriões em 7 20:00 (destinatário 18,5 dpc) e dissecar os filhotes dos cornos uterinos. Promover filhotes viáveis para um CD-mães que ninhadas entregues no mesmo dia.
Resultados
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
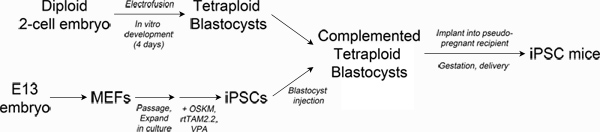
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
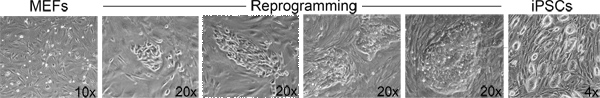
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
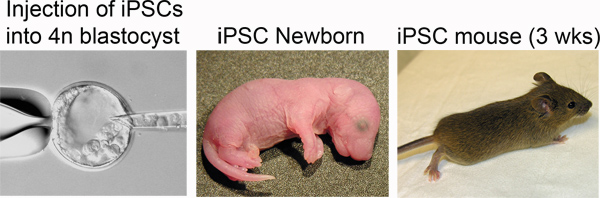
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discussão
Camundongos de geração de linhas iPSC usando ensaios TEC fornece um teste rigoroso funcional para a pluripotência de uma linha de IPSC. Este teste pode ser útil para avaliar a eficácia relativa dos diferentes métodos de reprogramação ou para identificar linhas iPSC que podem ser mais úteis para a geração de certos tipos celulares in vitro. Gerados a partir de ratinhos iPSCs pode ser usado para testar rigorosamente a estabilidade a longo prazo e de tumorigenicidade iPSC derivados de tecidos. Este protocolo irá ser útil para investigadores que desejam gerar totalmente pluripotentes linhas iPSC ou ratinhos iPSC ou para comparar a utilidade relativa dos diferentes métodos de reprogramação.
Os mecanismos que controlam a geração e identificação de iPSCs totalmente pluripotentes permanecem pouco compreendidos e é possível que algumas linhas iPSC produzida usando este método não vai passar no teste de TEC. Muitos fatores podem variar entre ensaios, incluindo fundos genéticos, título lentiviral, padrões de i lentiviralnsertion, os parâmetros do ciclo celular da população de dadores, inter-laboratoriais diferenças nas várias etapas do procedimento de TEC e inclinações variáveis de iPSCs abrigar aberrações genéticas ou epigenético. Para melhor garantir o sucesso, ter o cuidado de estabelecer níveis apropriados de expressão do gene lentiviral em experiências de derivação iPSC testando diluições virais de controlo MEFs para garantir que cada vírus seja suficientemente concentrada para produzir a expressão do gene detectável pelo menos 80% e, de preferência 100% do MEFs. Isso nos permite identificar linhas com várias cópias de lentivírus diferentes, limitando a toxicidade para o MEFs e produzindo colônias sem superlotação dos poços. Deve notar-se que vários outros protocolos têm sido mostrados para produzir iPSCs com potencial de desenvolvimento total, utilizando diversos métodos e fontes de células doadoras, sugerindo que múltiplos caminhos para pluripotência completo pode existir 1,8-13,15. Actualmente, iPSC no entanto, nenhum biomarcador definitiva totalmente pluripotentefoi identificado e, portanto, o ensaio do TCE é o teste padrão ouro de saber se uma linha de iPSC pode gerar todas as linhagens de células de um organismo.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Apoio a KKB, MJB, JLH e KLN foi fornecido pelo California Institute for Regenerative Medicine, a Pew Charitable Trusts Scholars Program Biomédica, a Esther B. Família O'Keeffe ea Fundação Família Shapiro. KKB é um E. Donald e Delia B. Baxter Fundação Faculdade Acadêmico.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Referências
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados