Method Article
Generation der Mäuse aus induzierten pluripotenten Stammzellen
In diesem Artikel
Zusammenfassung
Erzeugung induzierten pluripotenten Stammzellen (iPS) Linien produziert Linien unterschiedlicher Entwicklungspotenzial, auch wenn sie Standard-Tests für Pluripotenz passieren. Hier beschreiben wir ein Protokoll, um Mäuse vollständig aus iPS, die die iPSC Linien definiert als die über volle Pluripotenz abgeleitet produzieren 1.
Zusammenfassung
Die Herstellung von induzierten pluripotenten Stammzellen (IPSCs) aus somatischen Zellen liefert ein Mittel, um wertvolle Werkzeuge für Grundlagenforschung erstellen und kann zusätzlich auch eine Quelle von auf den Patienten abgestimmte Zellen für regenerative Therapien. iPSCs können unter Verwendung mehrerer Protokolle und abgeleitet aus mehreren Quellen gefahndet. Einmal erzeugt werden IPSCs getestet unter Verwendung einer Vielzahl von Assays, einschließlich Immunfärbung für Pluripotenz Markern Generation drei Keimblätter in embryoid bodies und Teratome, Vergleichen der Genexpression mit embryonalen Stammzellen (WSR) und Produktion von chimären Mäusen mit oder ohne Beteiligung Keimbahn 2 . Wichtig ist, dass iPSC Linien, die diese Tests bestehen noch variieren in ihrer Fähigkeit, produzieren verschiedene differenzierte Zelltypen 2. Dadurch wurde es schwierig, festzustellen, welche iPSC Ableitung Protokolle Donorzelle Quellen oder Auswahlmethoden am nützlichsten sind für verschiedene Anwendungen.
Die strengste Testob eine Stammzell-Linie hat genügend Entwicklungspotenzial, alle Gewebe für das Überleben eines Organismus benötigt generieren (sog. volle Pluripotenz) ist tetraploide Embryos Ergänzung (TEC) 3-5. Technisch beinhaltet TEC Elektrofusion von Zwei-Zell-Embryonen tetraploiden (4n) ein-Zell-Embryonen, die in vitro in das Blastozystenstadium 6 kultiviert werden können erzeugen. Diploiden (2n) pluripotente Stammzellen (zB WSR bzw. iPSCs) werden dann in die blastocoel Hohlraum der tetraploide Blastozysten injiziert und an einen Empfänger Buchse für Schwangerschaft (siehe Abbildung 1). Die Komponente der tetraploiden Embryo ergänzt trägt fast ausschließlich den extraembryonale Gewebe (Plazenta, Dottersack), während die diploiden Zellen der Embryo ordnungsgemäße bilden, was zu einem Fötus vollständig aus dem injizierten Stammzelllinie abgeleitet.
Kürzlich berichteten wir über die Ableitung von iPSC Linien, die reproduzierbar erzeugen erwachsenen Mäusenüber TEC 1. Diese iPS-Linien ergeben sich lebensfähige Jungtiere mit Wirkungsgraden von 5-13%, vergleichbar mit WSR 3,4,7 und höher als das für die meisten anderen iPSC Zeilen 8-12 gemeldet wird. Diese Berichte zeigen, dass die direkte Reprogrammierung voll pluripotente iPS, die WSR entsprechen in ihrem Entwicklungspotential und die Effizienz der Erzeugung von Welpen in TEC Tests produzieren. Derzeit ist nicht klar, was unterscheidet zwischen vollständig pluripotenten iPS und weniger potent Zeilen 13-15. Auch ist es nicht klar, welche durch Verfahren der Reprogrammierung wird diese Zeilen mit dem höchsten Wirkungsgrad zu produzieren. Hier beschreiben wir eine Methode, die vollständig pluripotente iPS und "all-iPSC" Mäuse, die hilfreich sein für die Ermittler wollen die Pluripotenz von iPS-Linien zu vergleichen oder zu etablieren, die Gleichwertigkeit der verschiedenen Verfahren der Reprogrammierung kann produziert.
Protokoll
Diese Methode wurde in der Forschung in Boland et al. Nature berichtet werden. 461, 91-96 (2009). 1
Ein. Herstellung von Lentivirus
Dieses Protokoll arbeitet Doxycyclin-induzierbaren lentiviralen Shuttle-Vektoren, die für Oct4 codieren, Sox2, Klf4, und c-Myc unter Steuerung eines tetO Antwortelement. Transgene werden durch die umgekehrte Tetracyclin trans-aktivierendes Protein, rtTAM2.2 16, die Umprogrammierung Faktor-Expression in Gegenwart von Doxycyclin induziert aktiviert. Dieses System ermöglicht streng kontrollierten, hohe Expression von Umprogrammierung Faktoren. Die lentiviralen Vektoren werden dabei selbst inaktivierende und kann somit nicht replizieren folgenden genomische Integration. Allerdings ist Vorsicht geboten beim Umgang mit Lentiviren und sollten in Labors kompatibel mit BSL2 (USA) und S2 (Europe) Standards durchgeführt werden.
- HEK293T-Zellen aufgetaut und Passage mindestens einmal vor transfection. Zellen sollten subkonfluente HEK Dichte im Medium bei 37 ° C gehalten werden, 5% CO 2 in einer feuchten Umgebung. Routinemäßig Durchlaßzellen alle 2 Tage mit einem Split-Verhältnis von 1.06 bis 01.10 Uhr.
- Saatgut ~ 8 x 10 6 HEK293T cells/T150 mit 25 ml HEK Medium. Verwenden Sie ein T150 für jeden Lentivirus Vorbereitung.
- Die folgenden Tag transfizieren HEK293T-Zellen durch Calciumphosphat-Präzipitation. (Anmerkung: in unseren Händen Calciumphosphatpräzipitation routinemäßig 80-90% ergibt Transfektionseffizienz, doch, kationische Lipid Transfektionsreagenzien wie Lipofectamin 2000 ebenfalls verwendet werden können). Bereiten Sie zwei 15 ml konischen Röhrchen für jeden Virus vorbereitet werden. Beschriften Sie die Röhrchen "A" und "B". Röhre A, 10 ug von jeder der: die lentivirale Shuttlevektor Codierung Reprogrammierungsfaktoren (oder rtTAM2.2), die virale Verpackungssignal Vektoren und Plasmid kodierend das Virushüllprotein, VSVG. Fügen Sie 186 ul 2 M CaCl 2 bis Rohr A, und bringe das Volumen auf 1,5 ml mit sterilem H 2 O. Tube B: 1,5 ml 2x HBS (auf Raumtemperatur vorgewärmt).
- Pipettieren der Mischung im Rohr A, bis es eine homogene Lösung ist. Fügen Lösung A zu Lösung B tropfenweise und stehen lassen bei Raumtemperatur für 2-3 min.
- Absaugen Wachstumsmedium HEK293T Zellen und ersetzen mit 22 ml vorgewärmten HEK-Medium ohne Penicillin und Streptomycin.
- Pipette kombinierten Lösungen AB (Calciumphosphat-Niederschlag) direkt an HEK293T Zellen und gleichmäßig verteilen durch sanftes Schaukeln.
- 24 Stunden nach Transfektion von HEK-293T-Zellen mit Lentivirus, entfernen Wachstumsmedium und ersetzen Sie es mit 25 ml frisch, vorgewärmten HEK Medium. Zurück transfizierten HEKS in den Inkubator.
- 48 Stunden nach Transfektion von HEK-293T-Zellen mit Lentivirus, sammeln Nährmedien mit lentivirale Partikel aus den transfizierten HEKS. Entfernen Partikelteilchen aus der geernteten viralen Lösung durch Zentrifugieren bei 3000 × g für 5 min bei 4 ° C.
- Konzentrieren Virus durch Ultrazentrifugation through eine 20% Saccharose-Kissen (2 ml sucrose/25 ml viralen Überstand) für 2 Stunden bei 112.000 × g bei 4 ° C. Suspend virale Pellet in 0,4 ml MEF Medium bei 4 ° C für 15-30 min unter leichtem Schütteln. Bewahren Viruspartikel im einzelnen Aliquots (dh 50 ul) bei -80 ° C.
2. Vorbereitung der embryonale Maus-Fibroblasten (MEF) für Reprogrammierung
Hinweis: Das Protokoll hier skizzierten bezieht sich auf die Ableitung von iPS von E 13,5 embryonale Maus-Fibroblasten für den Einsatz in TEC-Assays. Während andere Gruppen all-iPSC Mäuse von erwachsenen Spenders Zellquellen generiert haben, haben wir nicht diese Methode auf andere Zelltypen nicht getestet und kann sicher sein, dass Spender Zelltyp nicht ein Faktor.
- Richten Sie mit der Maus timed Paarungen. An embryonalen Tag 13,5 (E13.5), einschläfern die schwangere Frau und sezieren die Embryonen aus den Uterushörner. Ort und Shop Embryonen in 1x PBS (vorgekühlt auf 4 ° C) auf Eis.
- Entfernen Sie die extraembryonalen Gewebe (dhChorion, Amnion und Plazenta). Enthaupten den Embryo und entfernen Sie den Schwanz (optional - wenn für die Genotypisierung erforderlich) und Gliedmaßen. Scoop aus der inneren Organe, mit einer Pinzette oder einer Schaufel geformten Spachtel und zerkleinern die restlichen Karkasse mit der Klinge eines Skalpells oder einer scharfen Schere.
- Waschen Sie das Hackfleisch Karkasse in 5 ml vorgekühlte 1x PBS. Zentrifuge bei 200 × g für 5 min.
- Überstand. Suspend Pellet in 5 ml 0,25% Trypsin-EDTA und Inkubation bei 37 ° C unter kräftigem Schütteln für 20-30 min.
- 5 ml MEF Medium (vorgewärmt auf 37 ° C), mischen und Zentrifuge bei 200 xg für 5 min.
- Überstand entfernen und Pellet in vorgewärmten MEF Medium.
- Platte dissoziierten MEFs in 2-3 Wells einer 6-Well-Platte vorbeschichtet mit 0,1% Gelatine. Dies wird als ein Durchgang.
- Passage MEFs bei einer Verdünnung von 1.04 Uhr bis 01.05 Uhr alle 48 Stunden. MEFs in Passage 3 sind bereit für lentivirale Transduktion.
3. Ableitung von iPSC Linien
- Am Tag vor lentivirale Transduktion; seed ~ 3 x 10 5 primäre MEFs in eine Vertiefung einer 6-Well-Platte vorbeschichtet mit 0,1% Gelatine.
- Tag 1: Primäre MEFs sollte 80-90% konfluent für lentivirale Transduktion sein. Fügen lentivirale Partikel direkt an MEF Medien und inkubieren mit MEFs über Nacht bei 37 ° C, 5% CO 2 in einer feuchten Umgebung.
- Am folgenden Tag (Tag 2) Saugen Sie das Medium und waschen zweimal mit 3 ml 1x PBS, um virale Partikel zu entfernen.
- 0,5 ml vorgewärmtes 0,25% Trypsin-EDTA zu den Zellen und bei 37 ° C für 3-5 min mit gelegentlichen rocking.
- Verreiben eine Einzelzell-Suspension zu erzielen. Beobachten Zellen lichtmikroskopisch um eine Einzelzellen-Suspension zu gewährleisten.
- Übertragen MEFs in einem 15 ml konischen Röhrchen, das 5 ml MEF Medien. Zentrifuge bei 200 × g für 5 min. Überstand und sanft resuspendieren Zellen in MEF Medium.
- Gleichmäßig aufgeteilt die Zellsuspension zwischen zwei Vertiefungen einer 6-Loch-pspäten vorbeschichtet mit 0,1% Gelatine.
- Rocken die Platte hin und her, hin und her, und einmal in einer kreisförmigen Bewegung um eine gleichmäßige Verteilung der Zellen im ganzen gut zu erreichen. Inkubieren über Nacht bei 37 ° C, 5% CO 2 in einer feuchten Umgebung.
- Tag 3: Wiederholen Sie die Schritte 4-9, außer spalten die Zellen gleichmäßig von einem gut 3 Vertiefungen einer 6-Well-Platte vorbeschichtet mit 0,1% Gelatine. Das ergibt 6 Vertiefungen von primären Fibroblasten transduziert.
- Tag 4: Add Doxycyclin (Dox) bei einer Konzentration von 10 ug / ml bis 5/6 Brunnen. Ein gut sollte unbehandelt bleiben, um als Kontrolle dienen.
- Hinzufügen VPA bei 1,9 mM bis 3 der 5 Vertiefungen mit dox behandelt. VPA reduziert die Proliferationsrate von MEFs. Dense Kulturen MEFs tolerieren längerer VPA während subkonfluenten Kulturen innerhalb von 2-5 Tagen senesce neigen. Daher sollte MEFs 100% konfluent wenn VPA hinzugefügt wird. Hinweis: Wir verwenden VPA in unserem Reprogrammierung Versuche, weil es eine bekannte epigenetische Modifikator, und wurde shEigene, die Effizienz der Erzeugung iPSC 17 obwohl die Wirkungen und Mechanismen von VPA Wirkung gegenüber Herstellung vollständig pluripotenten iPSC Linien sind nicht bekannt erhöhen.
- Tag 5: Saugen Sie das Medium, waschen und trypsinieren die Zellen wie zuvor. Passage die Zellen mit dox / VPA zu einer 15 cm 2 Gewebekulturschale vorbeschichtet mit 0,1% Gelatine und jeder der anderen Bedingungen vor, beschichtete 10 cm 2 Gerichte in ES-Zell-Medium mit frischem dox und VPA ergänzt behandelt.
- Tanken Zellen jeden Tag mit ESC Medium mit frischem dox und VPA ergänzt. ESC-ähnliche Kolonien beginnt nach ca. 7 Tagen in der dox / VPA-Behandlung und nach ~ 10 Tage in der dox eigenständige Behandlung erscheinen. Keine Kolonien in Abwesenheit von dox Behandlung erscheinen.
- Sobald Kolonien ein helles refraktiven besitzen, gut definierte Grenze und enthalten 30-50 Zellen manuell isolieren die Kolonien mit einem Gelbeladung Pipettenspitze und Transfer zu einem U-Boden 96 Well-Platte mit 20 ul von 00,25% Trypsin-EDTA. Trypsinieren, um einzelne Zellen und Transfer zum Abzweigen in einem flachen Boden 96 Well-Platte in 150 ul ESC-Medium mit dox / VPA oder dox allein.
- Weiter zu klonal expandieren die isolierten iPSC Linien auf Feeder ESC Medium. Entfernen dox und VPA am Tag 19 nach Zugabe (post-Transduktion Tag 23). Entsorgen iPSC Linien, die nicht pflegen Selbst-Erneuerung oder Proliferation ähnlich ESC Kontrollen.
Es kann hilfreich sein, um Ihre iPSC Linien in Bezug auf ESCs charakterisieren bevor TEC durchzuführen. Wir haben unsere Linien durch 1) die Expression von endogenen Pluripotenz Marker (SSEA-1, Oct4, Sox2, Nanog) Immunzytochemie, 2) Karyotypanalyse durch Chromosomenzählung und 3) Embryoidkörper Bildung. Man kann auch durchführen lentiviralen-spezifische RT-qPCR, um zu bestätigen, dass die provirale Transgene nicht in den iPSCs ausgedrückt. Allerdings haben wir voll pluripotente iPS identifiziert mit nur Morphologie, Immunfärbung und karyotyping. In unseren Experimenten Auswahl iPSC Linien auf ESC-artige Morphologie und Wachstumseigenschaften Ergebnisse in der Mehrzahl der Linien exprimieren Pluripotenz Marker basiert, während wir typischerweise identifizieren mehrere Linien mit potentiell anormale Karyotypen.
4. Vorbereitung der iPS in Blastozysten injiziert
Passage Nummer eines PSC Linie hat sich gezeigt, ihre Pluripotenz 18 beeinträchtigen, obwohl dies abhängig Linie 19 sein kann. Wir haben iPSCs von Passagen 8-14 zur Behandlung von erwachsenen all-iPSC Mäuse produzieren.
- Thaw iPSCs und Platte auf Feeder ESC Medium. Passage der Zellen mindestens einmal auf Zubringer vor dem Einsatz zur Injektion.
- Einem Well einer 6-Well-Platte, enthaltend 70-80% konfluenten IPSCs wird mehr als eine ausreichende Anzahl von Zellen für die Injektion. Absaugen Wachstumsmedium und waschen Sie die Zellen mit ~ 3 ml 1x PBS (ohne Ca 2 + / Mg 2 +).
- 0,5 ml vorgewärmten 0,05% Trypsin-EDTAdie Zellen und bei 37 ° C für 10 min mit gelegentlichen rocking.
- Verreiben eine Einzelzell-Suspension zu erzielen. Beobachten Zellen lichtmikroskopisch um eine Einzelzellen-Suspension zu gewährleisten. Die iPSCs müssen in einzelne Zellsuspension so Kolonien / Zellaggregate die Injektionspipette verstopfen.
- Sobald eine Einzelzellsuspension ben erreicht hat, 1,0 ml ESC Medien zum Brunnen und gibt die Platte an dem 37 ° C Inkubator. Inkubieren ~ 15 min oder bis die Mehrheit der Anleger haben damit begonnen, haften.
- Entfernen Sie vorsichtig das Medium mit den iPS dabei nicht die schwach haftende Anleger zu vertreiben.
- Legen Sie die iPS in einem 15 ml konischen Röhrchen mit 5 ml ESC Medium. Zentrifuge bei 200 × g für 5 min. Überstand und entfernen Sie den Rest der ES-Zell-Medium mit einer Mikropipette. Tippen Sie auf das Rohr, um das Pellet und sanft resuspendieren Zellen in 0,2-0,5 ml vorgekühlte FHM Medium zu vertreiben. Shop-Zellen auf Eis, bis und während der Injektion in tetraploide blastocysts.
5. Generation tetraploide Blastozysten
Verfahren in diesem Abschnitt ausgeführt haben an anderer Stelle ausführlich 5,6,20 beschrieben worden. Hier beschreiben wir unsere Technik für die BTX Electro Zellmanipulators ECM 2001 optimiert.
- Richten Sie Embryos Spender Mäusen durch Grundierung 23-28 Tage alte weibliche Mäuse (C57BL/6J-Tyr c-2J / BALB / cByJ F1) mit PMS und HCG. Verwalten 5 IU von PMS am 02.00 und 5 IU HCG 47 Stunden später. Nach HCG Injektion einzurichten weibliche Mäuse mit C57BL/6J-Tyr c-2J / BALB / cByJ F1 Deckrüden. Überprüfen Sie die folgenden Tage für vaginale Stecker.
- Euthanize eingesteckt weiblichen Mäusen und sammeln Eileiter. Sammle 1-Zell-Embryonen, indem Eileiter in FHM mit Hyaluronidase und sanft reißen die ampulae. Lassen Sie die cumulus Massen in FHM / Hyaluronidase für 5-7 min sitzen.
- Sammle 1-Zell-Embryonen mit dem Mund ansaugen und waschen durch Tropfen FHM Medien, bevor sie in KSOM-AA Kultur. Kultur bei 37 ° C, 5% CO 2 unter Mineralöl Nacht, und wählen Sie 2-Zell-Embryonen am Tag der Elektrofusion, verwirft alle anderen Embryonen.
- Legen Sie eine BTX MicroSlide in einer 10 cm Petrischale. Gießen Sie genug Raumtemperatur Elektrofusion Medien tauchen die Folie in der Lösung, aber nicht so viel, dass die Pole der Elektrode vollständig untergetaucht.
- Schalten Sie ECM 2001 und BTX Enhancer 400. Verbinden Sie den ECM-Kabel an den MicroSlide der Elektrode und fixieren Sie die Kabel an der Seite der Petrischale zu unbeabsichtigten Bewegung des Schlittens zu verhindern.
- Führen Sie einen manuellen Impuls an eine Lesung auf dem BTX-Enhancer erhalten und beachten Sie die Spannung der AC / DC-Ströme angewandt werden. Wechselstrom wird die Geschwindigkeit, mit welcher die Embryonen zwischen den Elektroden ausgerichtet werden wird, wird die Gleichstrom verschmelzen Blastomeren und Pulszeit wird die Länge des DC-Impuls eingestellt. Ein guter Ausgangspunkt ist AC 3V, DC 100V und Zeit 0,05 ms. Die optimale DC variiert im Bereich von 90-150 Volt.
- Mit einem Mund Pipette ca. 30-40 Zwei-Zell-Embryonen entnehmen KSOM-AA Kultur und waschen Sie sie durch mehrere Tropfen Elektrofusion Medium. Zeichnen frischen Elektrofusion Medien aus dem MicroSlide Teller in den Mund Pipette und nehmen Embryonen aus der Wäsche. Sie in den 1 mm Spalt zwischen den Elektroden auf dem MicroSlide. Vorsichtig sein, dass sie in der Mitte des Spaltes, und dass sie nicht in Kontakt miteinander ausgerichtet sind.
- Mit Wechselstrom durch Drücken des manuellen Impuls-Taste. Die Embryonen werden in der Wechselstromfeld drehen, bis die Ebene der Blastomere Kontakt ist parallel zu den Elektroden. Wenn Embryonen nicht in ein paar Sekunden ausgerichtet sind, erhöhen AC Einstellung.
- Nach Embryonen ausgerichtet haben, drücken Sie die Handrad-Taste erneut, um die DC Impuls anzulegen.
- Mit Elektrofusion Medium in der Pipette, sammeln die Embryonen aus dem MicroSlide. Waschen Embryonen durch einige Tropfen KSOM-AA und legen Sie sie in KSOM-AA Kultur bei 37 ° C, 5% CO 2. Die Blastomeren Fusion shoULD in weniger als 30 min in Kultur abgeschlossen sein.
- Wiederholen Sie die Schritte 7-11 für die verbleibenden 2-Zell-Embryonen. Nach anschließender Fusion Gruppen, zu überwachen und wählen Embryonen mit geschmolzenem Blastomeren. Erfolgreich fusionierten Embryonen erscheint, um in 1-Zell-Stadium sein. Entsorgen lysiert und 2-Zell-Embryonen nach 30 min in der Kultur. Wenn Fusion liegt unter 80%, Erhöhung von Spannung und / oder die Zeit in Schritten von 5V und 0,01 msec. Wenn Lyse über 20%, verringern Gleichspannung und / oder der Zeit entsprechend. Die optimalen Einstellungen in unseren Experimenten wurden AC 4V DC 146v und 0,07 msec. Diese Einstellungen konsequent ergab 90% oder höher Fusionsraten mit wenig oder keiner Lyse.
- Weiterhin Kultur kondensierten Embryonen in Mikrotropfen KSOM-AA unter Mineralöl bei 37 ° C, 5% CO 2. Sie sollten erwarten, 85-95% des fusionierten Embryonen tetraploiden (4n) Blastozysten nach 48 Std. Inkubation bilden.
6. Mikroinjektion von iPS in tetraploide Blastozysten
Wir verwenden eine Nikon TE-2000Uinverse Mikroskop mit DIC Optik und Narishige Mikromanipulatoren in Blastozysten injiziert ausgestattet. Jeder tetraploide Blastozysten mit 10-12 iPSCs mit einem Standard-Protokoll für die ESC-Injektion in Maus-Blastozysten, die in einer früheren JoVE Veröffentlichung 5,20,21 nachgewiesen wurde injiziert
- Legen Sie eine 20 ul Tropfen FHM in der Mitte eines konkaven Objektträger und bedecken Sie es mit 150 ul Mineralöl.
- Senken Sie die Haltepipette und Mikroinjektion Nadel in die FHM Tropfen. Lassen Sie 2-3 min für beide Nadeln teilweise mit FHM füllen.
- Waschen 20-30 tetraploide Blastozysten durch Tropfen FHM und Transfer zum FHM Tropfen auf dem Objektträger.
- Mouth Pipette iPSC Mischung in den Tropfen. Es kann notwendig sein, um die Zellmischung in einem Tropfen FHM vorher, wenn Zellen zu konzentrieren oder aggregiert verdünnen.
- Pick-up 100-200 Zellen mit der Injektionsnadel.
- Halten Sie die Blastozyste mit der inneren Zellmasse in der 9-Uhr postulierenIon. Inject Zellen in blastocoel durch Durchdringen der Zona pellucida und Trophoblasten in der 3-Uhr-Position. Inject 16-18 Zellen pro Blastozyste.
- Zurück iPSC ergänzt Blastozysten zu KSOM-AA Kultur.
7. Transfer von Ergänzt tetraploide Blastozysten in die Gebärmutter Horns des Empfängers Mäuse
Ergänzt tetraploide Blastozysten werden chirurgisch zu den Uterushörner der weiblichen Empfängermäuse nach den Richtlinien des Forschers Instituts übertragen, mit der Standard-Technik 20, die wir kurz zusammenfassen soll. Wählen weiblichen CD-1-Mäuse an der pro-Östrus Bühne und stellte sie zur Paarung mit vasektomierten Männchen. Überprüfen Sie für die vaginale Stecker am nächsten Morgen. Frauen sind bereit für uterine Embryotransfer zwei Tage nach dem Plug erkannt wurde (2,5 dpc).
Einen Tag vor Empfänger Weibchen mit vasektomierten Männchen verpaart, Einrichten zusätzlicher CD-1 Weibchen mit nicht-vasektomierten Männchenals Ammen für die all-iPSC Mäusen durch Kaiserschnitt abgerufen werden.
8. Kaiserschnitt und Förderung der iPSC-derived Pups
Der Transfer der Embryonen TC resultiert typischerweise in mehreren Resorptionen nach der Implantation, auch wenn der iPSC oder ESC-Linie hat eine hohe Entwicklungsfähigkeit. Als Ergebnis kann man erwarten, nicht mehr als 4 lebensfähige Jungtiere (in der Regel 1-2) pro Empfänger. Diese kleinen Würfe sind in der Regel von den Empfängern vernachlässigt. Um das Niveau der Neonatologie und die Überlebensrate zu erhöhen, führen wir C-Profile und die Förderung nach dem Standard-Protokolle 20. Um den Kaiserschnitt durchzuführen, einschläfern Empfängermäuse 16 Tage nach dem Embryotransfer bei 7-08.00 (Empfänger 18,5 dpc) und sezieren Welpen aus den Uterushörner. Foster lebensfähige Jungtiere zur CD-1 Müttern, dass die gelieferten Würfe am selben Tag.
Ergebnisse
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
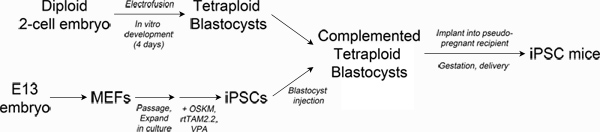
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
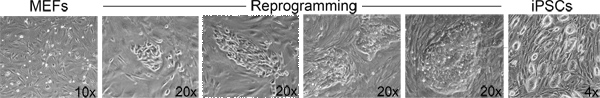
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
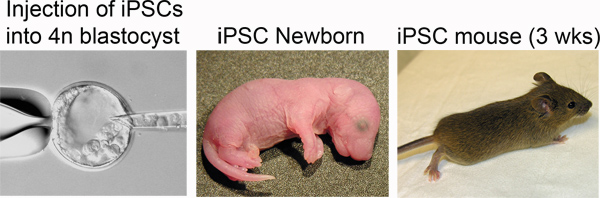
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Diskussion
Generieren Mäuse aus iPS-Linien mit TEC-Assays stellt eine strenge funktionale Test für die Pluripotenz einer iPSC Linie. Dieser Test kann nützlich sein, um die relative Wirksamkeit der verschiedenen Verfahren der Reprogrammierung beurteilen oder iPSC Linien, die am nützlichsten sein kann zum Erzeugen bestimmter Zelltypen in vitro zu identifizieren. Mäuse aus iPS erzeugt werden, können verwendet werden, um stringent testen die langfristige Stabilität und Tumorigenität von iPSC abgeleiteten Geweben werden. Dieses Protokoll wird nützlich sein, um Ermittler wollen voll pluripotente iPS Linien oder iPSC Mäuse zu generieren oder die relative Nutzen der verschiedenen Verfahren der Reprogrammierung zu vergleichen.
Die Mechanismen, die Erzeugung und Identifizierung von vollständig pluripotente iPS Kontrolle bleiben schlecht verstanden und es ist möglich, dass einige iPSC Linien unter Verwendung dieser Methode wird nicht durch den TEC-Test. Viele Faktoren können zwischen Experimenten einschließlich der genetischen Hintergründe, lentiviralen Titer, Muster von lentiviralen i variierennsertion, Zell-Zyklus-Parameter des Spenders Bevölkerung, Inter-Labor-Unterschiede in den verschiedenen Stufen des TEC Verfahren und variable Neigungen iPSCs beherbergen genetischer oder epigenetischer Aberrationen. Die besten Voraussetzungen dafür Erfolg, wir kümmern uns um angemessenen Niveaus des lentiviralen Genexpression in iPSC Ableitung Experimenten testen viralen Verdünnungen zur Kontrolle MEFs um sicherzustellen, dass jeder Virus ausreichend konzentriert zu nachweisbaren Genexpression mindestens 80% und idealerweise 100% der Erzeugung zu etablieren MEFs. Dies ermöglicht es uns, um Linien mit mehreren Kopien verschiedener Lentiviren zu identifizieren, während limitierenden Toxizität der MEFs und produziert Kolonien ohne Überbelegung der Brunnen. Es sollte beachtet werden, dass mehrere andere Protokolle erwiesen haben IPSCs mit voller Entwicklungspotential erzeugen, unter Verwendung mehrerer Verfahren und Donorzelle Quellen nahe legt, dass mehrere Pfade zu allen Pluripotenz kann 1,8-13,15 existieren. Derzeit jedoch keine definitive Biomarker voll pluripotent iPSCidentifiziert wurde und daher die TEC Assay bleibt der Goldstandard Test, ob eine Linie iPSC können alle Zelllinien in einem Organismus zu erzeugen.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Unterstützung für KKB wurde MJB, JLH und KLN vom California Institute for Regenerative Medicine, der Pew Charitable Trusts Biomedical Scholars Program, das Esther B. O'Keeffe Family Foundation und der Shapiro Family Foundation zur Verfügung gestellt. KKB ist ein Donald E. und Delia B. Baxter Foundation Faculty Scholar.
Materialien
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Referenzen
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten