Method Article
Génération de souris dérivées de cellules souches pluripotentes induites
Dans cet article
Résumé
Génération induites pluripotentes (cellules souches iPSC) lignes produit des lignes de différentes potentiel de développement, même quand ils passent des tests standard pour la pluripotence. Nous décrivons ici un protocole de produire des souris provenant entièrement de iPSCs, qui définit les lignes iPSC comme possédant la pluripotence complète 1.
Résumé
La production de cellules souches pluripotentes induites (CSPi) à partir de cellules somatiques fournit un moyen de créer des outils précieux pour la recherche fondamentale et peut également produire une source de cellules patients appariés pour les thérapies régénératives. CSPi peuvent être générées en utilisant des protocoles multiples et provenant de sources multiples de cellules. Une fois généré, iPSCs sont testées en utilisant une variété de tests, y compris immunomarquage pour les marqueurs de pluripotence, la production de trois couches germinales dans des corps embryoïdes et les tératomes, des comparaisons de l'expression des gènes des cellules souches embryonnaires (CSE) et la production de souris chimériques avec ou sans lignée germinale contribution de 2 . Fait important, les lignes iPSC qui réussissent ces tests varient encore dans leur capacité à produire différents types de cellules différenciées 2. Cela a rendu difficile d'établir les protocoles de dérivation iPSC, sources de cellules bailleurs de fonds ou des méthodes de sélection sont très utiles pour différentes applications.
Le test le plus rigoureuxde savoir si une lignée de cellules souches a suffisamment de potentiel de développement pour générer tous les tissus nécessaires à la survie d'un organisme (appelé pluripotence complet) est complémentation embryon tétraploïde (TEC) 3-5. Techniquement, le TEC implique électrofusion de deux cellules d'embryons de générer des tétraploïdes (4n) d'une cellule embryons qui peuvent être cultivés in vitro jusqu'au stade blastocyste 6. Diploïdes (2n) Les cellules souches pluripotentes (CES par exemple ou CISP) sont ensuite injectés dans la cavité du blastocyste blastocoel tétraploïde et transféré dans une femelle receveuse pour la gestation (voir Figure 1). La composante de l'embryon tétraploïde complété contribue presque exclusivement vers les tissus extra-embryonnaires (placenta, le sac vitellin), alors que les cellules diploïdes constituer l'embryon proprement dite, résultant en un fœtus issu entièrement de la lignée de cellules souches injectées.
Récemment, nous avons rapporté des lignées iPSC que reproductible générer des souris adultesvia TEC 1. Ces lignes iPSC donner lieu à des chiots viables avec des rendements de 5-13%, ce qui est comparable aux CES 3,4,7 et supérieure à celle observée pour la plupart des autres lignes iPSC 8-12. Ces rapports montrent que la reprogrammation directe peut produire des CSPi pluripotentes qui répondent pleinement CES dans leur potentiel de développement et l'efficacité de la génération chiots dans les tests de TEC. À l'heure actuelle, on ne sait pas ce que fait la distinction entre iPSCs pleinement pluripotentes et des lignes moins puissants 13-15. Il n'est pas clairement quelles méthodes de reprogrammation va produire ces lignes avec la plus grande efficacité. Nous décrivons ici une méthode qui produit iPSCs pleinement pluripotentes et "tout" iPSC souris, qui peuvent être utiles pour les chercheurs qui souhaitent comparer la pluripotence des lignes iPSC ou d'établir l'équivalence des différentes méthodes de reprogrammation.
Protocole
Cette méthode a été utilisée dans la recherche présentée dans Boland et al. Nature. 461, 91-96 (2009) 1.
1. Préparation d'Lentivirus
Ce protocole utilise la doxycycline inductibles par des vecteurs navettes lentiviraux codant pour Oct4, Sox2, Klf4, et c-Myc sous le contrôle d'un élément de réponse tetO. Transgènes sont activés par la tétracycline inverse protéine trans-activatrice, rtTAM2.2 16, ce qui induit l'expression du facteur de reprogrammation en présence de doxycycline. Ce système permet de bien contrôlé, une expression élevée de facteurs de reprogrammation. Les vecteurs lentiviraux utilisés ici sont auto-inactivant et donc ne peut pas répliquer suivante intégration génomique. Toutefois, la prudence s'impose lorsque l'on travaille avec des lentivirus et doit être effectuée dans des laboratoires conformes aux BSL2 (USA) et S2 (Europe) normes.
- Décongeler les cellules HEK293T et le passage au moins une fois avant de transfection. Les cellules doivent être maintenus à une densité subconfluente en milieu HEK à 37 ° C, 5% de CO 2 dans un environnement humidifié. Les cellules de passage systématiquement tous les 2 jours avec un rapport de division de 01 heures 06-01:10.
- Semences ~ 8 x 10 6 HEK293T cells/T150 avec 25 ml HEK milieu. Utilisez une T150 pour chaque préparation lentivirus.
- Les cellules jour suivant, HEK293T transfecter par précipitation au phosphate de calcium. (Remarque: dans nos mains précipitation au phosphate de calcium entraîne systématiquement l'efficacité de transfection 80-90%, mais réactifs de transfection cationiques lipidiques tels que la lipofectamine 2000 peut également être utilisé). Préparer deux tubes coniques de 15 ml pour chaque virus d'être préparé. Etiqueter les tubes "A" et "B". Un tube d', 10 pg de chacun: les facteurs lentiviraux vecteur navette de codage de reprogrammation (ou rtTAM2.2), les vecteurs d'encapsidation virale, et plasmide codant pour la protéine d'enveloppe virale, VSVG. Ajouter 186 ul 2 M CaCl 2 à tube A, et porter le volume à 1,5 ml avec H 2 O stérile. Tube B: 1,5 ml 2x HBS (pré-chauffé à la température ambiante).
- Introduire à la pipette le mélange dans un tube jusqu'à ce qu'il soit une solution homogène. Ajouter la solution A à la solution B goutte à goutte et laisser reposer à température ambiante pendant 2-3 min.
- Aspirer le milieu de croissance des cellules HEK293T et les remplacer par 22 ml préchauffé à moyen HEK sans pénicilline et de la streptomycine.
- Pipette solutions combinées AB (précipité de phosphate de calcium) directement à HEK293T cellules et répartir uniformément en le berçant doucement.
- 24 heures après transfection de cellules HEK-293T avec lentivirus, éliminer le milieu de croissance et de la remplacer par 25 ml de frais, préchauffé à moyen HEK. Retour EPER transfectées à l'incubateur.
- 48 heures après transfection de cellules HEK-293T avec lentivirus, collecter des milieux de culture contenant des particules lentivirales des EPER transfectées. Enlever les débris de particules de la solution virale récoltée par centrifugation à 3000 xg pendant 5 min à 4 ° C.
- Concentrez-virus par ultracentrifugation through un coussin de saccharose à 20% (2 ml sucrose/25 ml de surnageant viral) pendant 2 h à 112 000 xg à 4 ° C. Suspendre culot viral dans 0,4 ml MEF moyenne à 4 ° C pendant 15-30 min avec doux balancement. Stocker des particules virales dans des aliquotes à usage unique (soit 50 pi) à -80 ° C.
2. Préparation des fibroblastes embryonnaires de souris (MEF) pour reprogrammation
Remarque: Le protocole décrit ici concerne la dérivation de iPSCs à partir de fibroblastes embryonnaires 13,5 E souris pour utilisation dans des essais TEC. Alors que d'autres groupes ont généré tout iPSC souris de sources de cellules adultes donateurs, nous n'avons pas testé cette méthode sur d'autres types cellulaires et ne peut pas être certain de ce type de cellule donneuse n'est pas un facteur.
- Mise en place de la souris accouplements chronométrés. Le jour embryonnaire 13,5 (E13.5), euthanasier la femme enceinte et de disséquer les embryons des cornes utérines. Lieu et embryons de magasins dans PBS 1x (pré-réfrigérés à 4 ° C) sur la glace.
- Retirez les tissus extra-embryonnaires (c.-à-chorion, l'amnios et le placenta). Décapiter l'embryon et enlever la queue (facultatif - si nécessaire pour le génotypage) et les membres. Scoop sur les organes internes, des pinces ou une spatule à l'aide cuillère en forme et émincer la carcasse restante avec la lame d'un ciseau ou scalpel pointu.
- Laver la carcasse hachée dans 5 ml de PBS pré-réfrigérés 1x. Centrifuger à 200 xg pendant 5 min.
- Aspirer le surnageant. Suspendre le culot dans 5 ml 0,25% de trypsine-EDTA et incuber à 37 ° C avec une agitation vigoureuse pendant 20-30 min.
- Ajouter 5 ml de milieu de MEF (pré-chauffé à 37 ° C), mélanger et centrifuger à 200 xg pendant 5 min.
- Aspirer le surnageant et remettre en suspension le culot dans préchauffé à moyen MEF.
- Plaque dissocié FAE en 2-3 puits d'une plaque à 6 puits pré-enduites de gélatine à 0,1%. Ceci est considéré comme le passage 1.
- Passage MEF à une dilution de 01 heures 04-1h05 toutes les 48 h. FAE au passage 3 sont prêts pour la transduction lentivirale.
3. Dérivation des lignes iPSC
- La veille de transduction lentivirale; graines ~ 3 x 10 5 primaire MEF dans un puits d'une plaque à 6 puits pré-enduites de gélatine à 0,1%.
- Jour 1: primaire MEFS devrait être confluentes à 80-90% pour la transduction lentivirale. Ajouter particules lentivirales directement au MEF médias et incuber avec une nuit à 37 ° C MEF, 5% de CO 2 dans un environnement humidifié.
- Le lendemain (jour 2) aspirer le milieu et laver deux fois avec 3 ml de PBS 1x pour éliminer les particules virales.
- Ajouter 0,5 ml préchauffé 0,25% de trypsine-EDTA pour les cellules et incuber à 37 ° C pendant 3-5 min à bascule occasionnelle.
- Triturer pour obtenir une suspension à cellule unique. Observer des cellules par microscopie optique afin d'assurer une suspension de cellules isolées.
- Transfert MEF dans un tube conique de 15 ml contenant 5 ml de milieu MEF. Centrifuger à 200 xg pendant 5 min. Aspirer le surnageant et les cellules doucement remis en suspension dans un milieu MEF.
- Répartie également la suspension de cellules entre deux puits d'une p 6 puitsfin pré-enduit avec 0,1% de gélatine.
- Basculer la plaque avant et en arrière, de côté à côté, et une fois dans un mouvement circulaire pour obtenir une distribution uniforme de cellules dans le puits. Incuber une nuit à 37 ° C, 5% de CO 2 dans un environnement humidifié.
- Jour 3: Répétez les étapes 4-9, sauf diviser les cellules uniformément d'un puits à 3 puits d'une plaque de 6 puits pré-enduites de gélatine à 0,1%. Cela donnera 6 puits de transduites fibroblastes primaires.
- Jour 4: Ajouter la doxycycline (Dox) à une concentration de 10 pg / ml à 5/6 puits. Un puits doit rester non traitée pour servir de contrôle.
- Ajouter VPA à 1,9 mM à 3 des 5 puits traités avec dox. APV réduit le taux de prolifération de MEF. Cultures denses de MEFs tolérer une exposition prolongée à l'APV alors que les cultures sous-confluentes ont tendance à vieillir dans les 2-5 jours. Par conséquent, MEFS doivent être confluentes 100% lorsque l'APV est ajouté. Remarque: Nous utilisons l'APV dans nos expériences de reprogrammation, car il est un modificateur connu épigénétique, et a été shpropres à accroître l'efficacité de la production iPSC 17 Bien que les effets et les mécanismes d'action APV en ce qui concerne la génération entièrement pluripotentes iPSC lignes ne sont pas connus.
- Jour 5: Aspirer le milieu, laver et trypsiniser les cellules comme avant. Passage des cellules traitées avec dox / VPA à un 15 cm 2 boîte de culture tissulaire pré-enduites de gélatine à 0,1% et chacune des autres conditions pré-enduits 10 cm 2 plats au milieu de cellules ES complétés avec des produits frais et dox APV.
- Reconstituer les cellules chaque jour avec support ESC complétée avec des produits frais et dox APV. ESC-comme les colonies devraient commencer à apparaître après environ 7 jours dans le traitement dox / VPA et après ~ 10 jours dans le traitement dox seul. Aucune colonie devrait apparaître en l'absence de traitement dox.
- Une fois que les colonies possèdent une réfraction lumineuse, frontière bien définie et contiennent 30-50 cellules, manuellement isoler les colonies avec une pointe de pipette gel de chargement et de transfert à un fond en U 96 puits contenant 20 pl de 0.25% De trypsine-EDTA. Trypsiniser à des cellules individuelles et de transférer aux mangeoires dans une plaque plane inférieure 96 et dans 150 pl de milieu contenant ESC dox / VPA ou dox seul.
- Continuer à développer les clonale lignes isolées sur iPSC mangeoires en milieu ESC. Retirer dox et l'APV au jour 19 après l'adjonction (post-transduction jour 23). Jeter lignes iPSC qui ne maintiennent pas l'auto-renouvellement ou de taux de prolifération semblables à des contrôles ESC.
Il peut être utile pour caractériser vos lignes iPSC par rapport au CES avant de procéder à TEC. Nous avons caractérisé nos lignes par 1) l'expression de marqueurs endogènes pluripotence (AESS-1, Oct4, Sox2, Nanog) par immunocytochimie, 2) l'analyse du caryotype par comptage des chromosomes et 3) formation de corps embryoïdes. On peut également effectuer lentiviral spécifique RT-qPCR pour confirmer que les transgènes provirales ne sont pas exprimés dans les iPSCs. Toutefois, nous avons identifié iPSCs pleinement pluripotentes en utilisant uniquement la morphologie, immunomarquage et karyotyption. Dans nos expériences, la sélection de lignées iPSC basé sur ESC-morphologie et des caractéristiques de croissance des résultats dans la majorité des lignées exprimant des marqueurs de pluripotence pendant que nous identifient généralement plusieurs lignes avec des caryotypes potentiellement anormaux.
4. Préparation de iPSCs pour injection de blastocystes
Numéro de passage d'une ligne CFP a été démontré qu'elle affecte ses 18 pluripotence bien que cela puisse être la ligne 19 dépendante. Nous avons utilisé des passages de iPSCs 8-14 pour produire des adultes tout-iPSC souris.
- IPSCs dégel et de la plaque sur les départs en milieu ESC. Passage des cellules au moins une fois avant l'utilisation de dispositifs d'alimentation pour l'injection.
- Un puits d'une plaque à 6 puits contenant 70-80% de confluence iPSCs fournira plus d'un nombre suffisant de cellules pour l'injection. Aspirer le milieu de croissance et laver les cellules avec ~ 3 ml de PBS 1x (sans Ca 2 + / Mg 2 +).
- Ajouter 0,5 ml préchauffé 0,05% de trypsine-EDTA àles cellules et incuber à 37 ° C pendant 10 min avec bascule occasionnelle.
- Triturer pour obtenir une suspension à cellule unique. Observer des cellules par microscopie optique afin d'assurer une suspension de cellules isolées. Les iPSCs doivent être mises en suspension cellulaire unique en tant que colonies / agrégats cellulaires se bouchent la pipette d'injection.
- Une fois une suspension cellulaire unique a atteint ben, ajoutez 1,0 ml ESC médias pour le bien et retourner la plaque à l'étuve à 37 ° C. Incuber pendant ~ 15 min ou jusqu'à ce que la majorité des départs ont commencé à adhérer.
- Retirez délicatement le milieu contenant les iPSCs en prenant soin de ne pas déloger les mangeoires faiblement adhérentes.
- Placez les iPSCs dans un tube conique de 15 ml contenant 5 ml ESC moyenne. Centrifuger à 200 xg pendant 5 min. Aspirer le surnageant et enlever le reste de milieu de cellules ES avec une micropipette. Appuyez sur le tube pour déloger le culot et remettre les cellules en douceur dans FHM 0.2 à 0,5 ml de milieu de pré-réfrigérés. Stocker les piles sur la glace jusqu'à et pendant l'injection dans tétraploïde blastocysts.
5. Génération de blastocystes tétraploïdes
Les interventions pratiquées dans cette section ont été décrits en détail ailleurs 5,6,20. Ici, nous décrivons notre technique, optimisé pour le Manipulateur de cellules électro BTX ECM 2001.
- Mettre en place des souris donneuses d'embryons par amorçage 23-28 jours d'âge chez les souris femelles (c C57BL/6J-Tyr-2J / souris BALB / cByJ F1) présentant un syndrome prémenstruel et HCG. Administrer 5 UI de PMS à 14 heures et de 5 UI de HCG 47 h plus tard. Après injection de HCG, mettre en place les souris femelles avec C57BL/6J-Tyr c-2J / BALB / cByJ mâles F1 haras. Vérifiez le lendemain pour bouchon vaginal.
- Euthanasier les souris femelles branché et recueillir oviductes. Récupérer le 1-cellules d'embryons en plaçant oviductes dans FHM avec hyaluronidase et la détachant délicatement la ampulae. Permettre aux masses de cumulus de s'asseoir dans FHM / hyaluronidase pendant 5-7 min.
- Récupérer le 1-cellules d'embryons aide d'une pipette et laver la bouche au travers des gouttes de médias FHM avant de les placer dans KSOMAA-culture. Culture à 37 ° C, 5% de CO 2 dans l'huile minérale nuit et sélectionnez 2-cellules d'embryons jour de électrofusion, jetez tous les autres embryons.
- Placez un Microslide BTX dans un plat de Pétri de 10 cm. Verser suffisamment de médias température ambiante électrofusion de plonger la lame dans la solution, mais pas autant que les pôles de l'électrode sont complètement submergées.
- Mettez ECM 2001 et BTX Enhancer 400. Branchez les câbles du ECM à l'électrode de la microlame et fixer les câbles sur le côté de la boîte de Pétri pour empêcher tout mouvement involontaire de la diapositive.
- Exécuter une impulsion manuelle afin d'obtenir une lecture sur l'amplificateur BTX et noter la tension des courants AC / DC appliquées. Courant alternatif va contrôler la vitesse à laquelle les embryons aligner entre les électrodes, le courant continu se fondre les blastomères, et le temps d'impulsion règle la durée de l'impulsion de courant continu. Un bon point de départ est AC 3V DC 100V, et l'heure 0,05 ms. Le CC optimale varie dans la plage de 90-150 volts.
- En utilisant une pipette bouche, prendre environ 30-40 à deux cellules d'embryons de KSOM-AA culture et lavez-les à travers quelques gouttes de milieu d'électrofusion. Dessinez des médias électrofusion frais de l'antenne microlame en pipeter à la bouche et de prendre embryons provenant du lavage. Placez-les dans l'espace de 1 mm entre les électrodes sur le microlame. Veiller à ce qu'ils soient alignés vers le bas au milieu de la fente et qui ne sont pas en contact les uns avec les autres.
- Appliquer le courant alternatif en appuyant sur le bouton d'impulsions manuel. Les embryons tourne dans le champ alternatif, jusqu'à ce que le plan de contact blastomère est parallèle aux électrodes. Si les embryons ne sont pas alignés en quelques secondes, augmenter le réglage AC.
- Après embryons ont aligné, appuyez sur le bouton d'impulsions manuel à nouveau pour appliquer l'impulsion continue.
- Avec le milieu d'électrofusion en pipette, recueillir les embryons de la microlame. Laver embryons par quelques gouttes de KSOM-AA et les placer dans KSOM-AA culture à 37 ° C, 5% de CO 2. Le blastomère fusion shoULD être complété en moins de 30 min en culture.
- Répétez les étapes 7-11 pour rester 2-cellules d'embryons. Après la fusion des groupes suivants, surveiller et sélectionner des embryons avec des blastomères fusionnés. Embryons fusionnés avec succès apparaîtra comme dans l'étape 1-cellule. Jeter embryons lysées et 2-cellule après 30 min dans la culture. Si le taux de fusion est inférieur à 80%, d'augmenter la tension et / ou de temps par paliers de 5 V et 0,01 ms. Si la lyse est supérieur à 20%, de diminuer une tension continue et / ou le temps en conséquence. Les paramètres optimaux de nos expériences étaient 4V AC, DC 146V, et de 0,07 ms. Ces paramètres toujours donné 90% ou taux de fusion plus élevés avec peu ou pas de lyse.
- Continuer à la culture des embryons fusionnés dans des microgouttes de KSOM-AA sous huile minérale à 37 ° C, 5% de CO 2. Vous devez vous attendre 85-95% des embryons fusionnés pour former tétraploïdes (4n) blastocystes après 48 heures d'incubation.
6. Microinjection de iPSCs dans des blastocystes tétraploïdes
Nous utilisons un Nikon TE-2000Umicroscope inversé équipé d'une optique DIC et micromanipulateurs Narishige pour injection blastocyste. Chaque blastocyste tétraploïde est injecté avec 10-12 iPSCs utilisant un protocole standard pour l'injection dans des blastocystes de souris ESC qui a été démontré dans une publication précédente JoVE 5,20,21
- Placez une baisse de 20 ul de FHM dans le centre d'une lame de microscope concave et couvrez avec 150 pi d'huile minérale.
- Abaissez la pipette de maintien et une aiguille micro-injection dans la chute de FHM. Laisser 2-3 min pour les deux aiguilles pour remplir partiellement avec FHM.
- Laver 20-30 blastocystes tétraploïdes par des gouttes de FHM et le transfert à la baisse FHM sur la lame de microscope.
- Bouche pipette iPSC mélange dans la goutte. Il peut être nécessaire de diluer le mélange de cellules dans une goutte de FHM à l'avance si les cellules sont trop concentrées ou regroupées.
- Ramassez 100-200 cellules avec l'aiguille d'injection.
- Tenez le blastocyste avec la masse cellulaire interne dans la poser 09 heuresion. Injecter des cellules dans blastocoel en pénétrant dans la zone pellucide et du trophoblaste à la position 3 heures. Injecter 16-18 cellules par blastocyste.
- Retour iPSC blastocystes complétés à KSOM-AA culture.
7. Le transfert de blastocystes tétraploïdes complétée dans les cornes utérines des souris receveuses
Complétés blastocystes tétraploïdes sont chirurgicalement transféré aux cornes utérines de souris receveuses femelles selon les directives de l'institut du chercheur, en utilisant la technique standard de 20 que nous allons résumer brièvement. Sélectionnez femelles souris CD-1 au stade de la pro-oestrus et de les mettre en place pour accouplement avec des mâles ayant subi une vasectomie. Vérifiez bouchon vaginal le lendemain matin. Les femelles sont prêtes pour le transfert d'embryons utérine deux jours après la prise a été détecté (2,5 dpc).
Un jour avant femelles receveuses sont accouplées avec des mâles ayant subi une vasectomie, configurer des CD-1 femelles avec des mâles ayant subi une vasectomiepour être utilisé en tant que mères de famille d'accueil pour tous les iPSC-souris récupérées par césarienne.
8. Césarienne et favoriser des iPSC dérivés Pups
Le transfert d'embryons TC se traduit généralement par de multiples résorptions après l'implantation, même si le iPSC ou ESC ligne a un fort potentiel de développement. En conséquence, on peut s'attendre à pas plus de 4 chiots viables (en général 1-2) par bénéficiaire. Ces petites portées sont généralement négligés par les bénéficiaires. Pour augmenter le niveau de soins néonatale et le taux de survie, nous effectuons des césariennes et la promotion selon la norme protocoles 20. Pour effectuer la césarienne, euthanasier les souris receveuses 16 jours après le transfert d'embryon à 7-8PM (récipiendaire 18,5 dpc) et de disséquer les petits d'entre les cornes utérines. Favoriser chiots viables pour CD-1 mères qui jonchent livrés le même jour.
Résultats
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
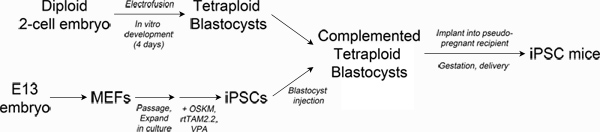
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
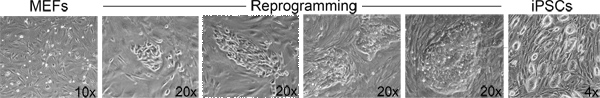
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
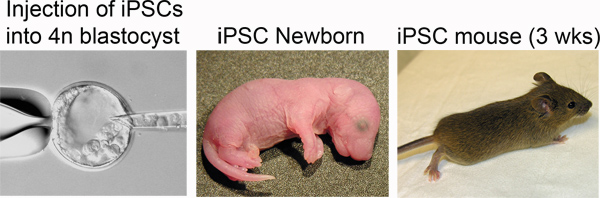
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discussion
Génération de souris lignes iPSC en utilisant des essais TEC fournit un test rigoureux fonctionnelle pour la pluripotence d'une ligne iPSC. Ce test peut être utile pour évaluer l'efficacité relative des différentes méthodes de reprogrammation ou pour identifier les lignes iPSC qui peuvent être les plus utiles pour générer certains types de cellules in vitro. Souris générés par iPSCs peut être utilisé pour tester rigoureusement la stabilité à long terme et tumorigénicité des iPSC dérivées des tissus. Ce protocole sera utile aux chercheurs souhaitant générer des lignes entièrement pluripotentes iPSC ou des souris iPSC ou de comparer l'utilité relative des différentes méthodes de reprogrammation.
Les mécanismes qui contrôlent la génération et l'identification des iPSCs pleinement pluripotentes restent mal connus et il est possible que certaines lignes iPSC produites en utilisant cette méthode ne passera pas le test TEC. De nombreux facteurs peuvent varier entre les expériences, y compris des fonds génétiques, le titre lentiviral, les modes de lentiviral insertion, les paramètres du cycle cellulaire de la population de donneurs, les différences inter-laboratoires dans les différentes étapes de la procédure TEC et les propensions variables de iPSCs pour héberger des aberrations génétiques ou épigénétiques. Pour mieux assurer le succès, nous prenons soin d'établir des niveaux appropriés de l'expression des gènes lentiviraux dans des expériences de dérivation iPSC en testant des dilutions virales sur le contrôle FAE afin de s'assurer que chaque virus est suffisamment concentrée pour produire l'expression du gène détectable au moins 80% et idéalement 100% de la MEF. Cela nous permet d'identifier les lignes avec de multiples copies de lentivirus différents tout en limitant la toxicité pour le MEF et la production de colonies sans surpopulation dans les puits. Il convient de noter que plusieurs autres protocoles ont été montré pour produire des CSPi avec plein potentiel de développement, en utilisant plusieurs méthodes et sources de cellules donateurs suggérant que plusieurs chemins vers la pluripotence complète peut exister 1,8-13,15. À l'heure actuelle, cependant, aucun biomarqueur définitive de tout pluripotentes iPSCa été identifié et donc le dosage du traité demeure le test de référence pour déterminer si une ligne iPSC peut générer tous les lignées cellulaires d'un organisme.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Soutien à KKB, MJB, JLH et KLN a été fourni par le California Institute for Regenerative Medicine, le Pew Charitable Trusts Programme biomédicale chercheurs, la Esther B. O'Keeffe famille et de la Fondation de la famille Shapiro. KKB est un E. Donald et Delia B. Baxter Foundation Scholar Faculté.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Références
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon