Method Article
유도 만능의 줄기 세포에서 파생 마우스의 생성
요약
그들은 pluripotency에 대한 표준 테스트를 통과 때도 생성 유도 만능 줄기 세포 (iPSC) 라인이 발달 가능성을 서로 다른 행을 생산하고 있습니다. 여기 가진 전체 pluripotency로 iPSC 라인을 정의 iPSCs에서 완전히 파생 쥐를 생산하기 위해 프로토콜을 설명 1.
초록
체세포의 세포에서 유도 만능 줄기 세포 (iPSCs)의 생산은 기초 연구를위한 유용한 도구를 만들 수있는 방법을 제공하며 재생 치료에 대한 환자와 일치하는 세포의 소스를 생성 할 수 있습니다. iPSCs는 여러 프로토콜을 사용하여 생성하고 여러 셀 소스에서 파생 될 수 있습니다. 일단 생성, iPSCs는 pluripotency 마커에 대한 immunostaining, embryoid 기관 및 기형 종, 배아 줄기 세포 (ESCs) 및 germline 기여 2 나없이 키메라 마우스의 생산과 유전자 표현의 비교에서 세 배아 층의 생성 등의 assays 다양한을 사용하여 테스트 . 중요한 것은,이 테스트를 통과 iPSC 라인은 여전히 다른 차별화 된 세포 유형 2를 생산하기 위해 자신의 능력에 따라 다릅니다. 이것은 어려운 iPSC 파생 프로토콜, 기증자 세포 소스 또는 선택 방법이 다른 응용 프로그램에 가장 유용 할 수립 만들었습니다.
가장 엄격한 시험줄기 세포 라인 유기체의 생존에 필요한 모든 조직을 생성 할 수있는 발달 가능성이 있는지 여부를의 (칭했다 전체 pluripotency) tetraploid 배아 complementation (TEC) 3-5입니다. 기술적으로는, TEC는 blastocyst 무대 6 체외에서 배양 할 수 tetraploid (4N) 한 세포 배아를 생성하는 두 세포 배아의 electrofusion을 포함한다. Diploid (2N) 만능의 줄기 세포 (예 ESCs 또는 iPSCs) 다음 tetraploid blastocyst의 blastocoel 캐비티에 주입하고 (그림 1 참조) 형성에 대한받는 여성으로 전송됩니다. diploid 세포가 주입 줄기 세포 라인에서 완전히 파생 된 태아의 결과로, 배아는 적절한 구성하는 반면 보완 배의 tetraploid 구성 요소 extraembryonic 조직 (태반, 난황 주머니)에 거의 독점적으로 기여하고있다.
최근, 우리는 reproducibly 성인 쥐를 생성하는 iPSC 라인의 유도를보고TEC 하나를 통해. 이 iPSC 줄이 ESCs 3,4,7 비교하고 가장 다른 iPSC 라인 8-12 대해보고보다 높을 5-13%의 효율성을 가능한 새끼로 상승을 제공합니다. 이 보고서는 직접 재활는 TEC 테스트에서 새끼를 생성하는 자신의 발달 가능성과 효율성에 ESCs 일치 완전히 만능 iPSCs를 생성 할 수 있습니다 것으로 나타났습니다. 현재 완전히 만능 iPSCs의 정확성과 강력한 라인 13-15 구분을 명확하게하지 않습니다. 또한이 재활 방법이 가장 효율이 줄을 생산됩니다 삭제합니다. 여기 iPSC 라인의 pluripotency을 비교하거나 다른 재 프로그래밍 방법의 동등한을 수립하고자하는 조사에 도움이 될 수 있습니다 완전히 만능 iPSCs와 "모든 iPSC"마우스를 생산하는 한 가지 방법을 설명합니다.
프로토콜
이 방법은 Boland 외. 자연에보고 된 연구에 사용되었다. 461, 91-96 (2009) 1.
1. Lentivirus의 작성
이 프로토콜은 tetO 응답 요소의 통제하에, Oct4에 Sox2, Klf4, 그리고 C-Myc를 인코딩 doxycycline-inducible lentiviral 셔틀 벡터를 사용하고 있습니다. Transgenes은 doxycycline의 존재의 재 프로그래밍 요소 식을 유도 역 테트라 사이클린 횡단 활성화 단백질, rtTAM2.2 16,에 의해 활성화됩니다. 이 시스템은 재 프로그래밍 요소를 강력히 제어, 높은 표현을 할 수 있습니다. 여기에 사용 된 lentiviral 벡터는 자체 운영을 중지시키지이고 따라서 다음과 같은 게놈 통합을 복제 할 수 없습니다. lentiviruses 작업 및 BSL2 (미국)과 S2 (유럽) 표준 실험실 준수에 수행해야 할 때 그러나,주의가 필요합니다.
- 적어도 한 번 이상 tra 전에 HEK293T 세포와 통로를 해동nsfection. 세포가 37 HEK 매체에 subconfluent 밀도에서 유지되어야합니다 ° C, 5 % humidified 환경에서 CO 2. 1시 6분에서 1시 10분까지의 분할 비율 정기적으로 통로 세포는 매 2 일.
- 종자 ~ 8 X 10 6 25 ML HEK 매체와 HEK293T cells/T150. 각 lentivirus 준비에 대해 하나의 T150을 사용합니다.
- 인산 칼슘 침전에 의한 다음 날 transfect의 HEK293T 세포. (참고 : 우리 손에 인산 칼슘 침전은 정기적으로 80~90%의 transfection 효율에 결과 있지만, 이러한 Lipofectamine 2000과 같은 양이온 지질 transfection의 시약도 사용할 수 있습니다.) 준비 할 각 바이러스위한 두 15 ML 원뿔 튜브를 준비합니다. "A"와 "B"튜브 라벨을 지정합니다. 튜브 A, 각 10 μg : lentiviral 셔틀 벡터 인코딩 재 프로그래밍 요소 (또는 rtTAM2.2), 바이러스 성 포장 벡터, 그리고 플라스미드 인코딩 바이러스 봉투 단백질, VSVg. 튜브에 186 μl 2 M CaCl 2를 추가하고 살균 H 2 O와 1.5 ML에 볼륨을 가져. 튜브 B : 1.5 ML 배 HBS (객실 온도에 미리 따뜻하게).
- 이 동질적인 솔루션입니다 때까지 튜브의 혼합물을 피펫. 에 대한 솔루션 B dropwise 솔루션을 추가 한 후 2-3 분 동안 실온에서 서 보자.
- HEK293T 세포의 성장 매체를 대기음, 22 ML 미리 예열 HEK의 페니실린이없는 매체와 스트렙토 마이신과 교체하십시오.
- 피펫 통합 솔루션 AB (인산 칼슘의 침전물)은 직접 세포를 HEK293T하고 부드러운 락 음악으로 균일하게 배포 할 수 있습니다.
- lentivirus와 HEK-293T 세포의 transfection 후 24 시간이, 성장 매체를 제거하고 신선한, 사전 예열 HEK 매체의 25 ML로 교체. 보육에 transfected HEKs을 반환합니다.
- 48 시간 lentivirus와 HEK-293T 세포의 transfection 후, transfected HEKs에서 lentiviral 입자를 포함하는 성장 미디어를 수집합니다. 4에 5 분 ° C. 3,000 XG에서 원심 분리하여 수확 바이러스 솔루션에서 미립자 오염 물질을 제거
- ultracentrifugation 동안 줄곧으로 바이러스를 집중우 4에 112,000 XG에서 2 시간에 20 %의 자당 쿠션 (2 ML sucrose/25 ML 바이러스 표면에 뜨는) ° C. 부드러운 요동과 15-30 분에 대해 4 ° C에서 0.4 ML의 MEF 매체에 바이러스 펠릿을 일시 중지합니다. -80에서 단일 사용 aliquots (즉, 50 μl)에 바이러스 입자를 저장 ° C.
2. 재 프로그램에 대한 마우스 배아 섬유 아세포의의 준비 (MEF)
참고 : 여기에 설명 된 프로토콜 TEC의 assays에 사용하기 위해 E 13.5 마우스 배아 섬유 아세포에서 iPSCs의 유도에 관한 것이다. 다른 그룹 성인 기증자 세포의 소스에서 모든 iPSC 쥐를 생성하고 있지만, 우리는 다른 세포 유형에이 방법을 테스트하지 않은 기증자 세포 유형은 반영되지 않습니다 확신 할 수 없습니다.
- 마우스를 특정 시간에 matings을 설정합니다. 배아 일 13.5 (E13.5)에서 임신 여성을 안락사시켜야하고 자궁 뿔에서 배아를 해부. 얼음에 1X PBS의 장소 및 매장 배아 (4 ° C로 사전에 차가운).
- extraembryonic 조직 (예 : 제거융모막, 양막과 태반). 배아 목을 벨과 꼬리를 제거 (선택 사항 - genotyping을 위해 필요한 경우)와 팔다리. 내부 장기 사용 포셉 또는 특종 모양의 주걱을 꺼내서 메스 나 날카로운 가위 블레이드와 나머지 시체를 이기다.
- 5 ML 미리 차가운 1X PBS에 다진 시체를 씻으십시오. 5 분에 대해 200 XG에 원심 분리기.
- 표면에 뜨는을 대기음. 37에서 5 ML 0.25 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산)와 배양에서 펠렛을 일시 중지 ° C 활발한는 20-30 분 동안 흔들림과 함께.
- MEF 중간 (37 ° C에 사전 예열), 5 분 200 XG의 믹스와 원심 분리기의 5 ML을 추가합니다.
- 사전 예열 MEF 매체에 표면에 뜨는 및 resuspend 펠렛을 대기음.
- 0.1 % 젤라틴으로 미리 코팅 6 잘 플레이트로부터 2-3 우물의 플레이트 dissociated MEFs. 이것은 통과 한 것으로 간주됩니다.
- 1시 4분부터 1시 5분까지 모든 48 시간의 희석에 통로 MEFs. 통로 3 MEFs는 lentiviral 도입을위한 준비가되어 있습니다.
3. iPSC 라인의 유도
- lentiviral 도입 전날, 씨앗 ~ 3 × 10 0.1 % 젤라틴으로 미리 코팅 6 잘 접시의 잘 하나에 5 차 MEFs.
- 1 일 : 주 MEFS는 lentiviral 도입을위한 80~90%의 합류해야합니다. 37 번 밤새 MEFs와 직접 MEF 미디어 및 배양에 lentiviral 입자를 추가 ° C, humidified 환경 5 % CO 2.
- 다음 날 (제 2 일)는 매체를 기음과 바이러스 입자를 제거하는 1X PBS의 3 ML로 두 번 씻어.
- 0.5 ML 미리 예열 가끔 흔들와 3-5 분 동안 37 번 세포와 배양 ° C로 0.25 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산)입니다.을 추가
- 단일 셀 정지를 달성 할 수 씹다. 하나의 세포 현탁액을 보장하기 위해 빛을 현미경으로 세포를 관찰.
- 5 ML MEF 미디어를 포함하는 15 ML 원뿔 튜브로 전송 MEFs. 5 분에 대해 200 XG에 원심 분리기. MEF 매체의 표면에 뜨는 조심스럽게 resuspend 세포를 대기음.
- 균등 6도 P의 두 우물 사이에 세포 현탁액을 분할0.1 % 젤라틴으로 미리 코팅 늦었 어.
- 앞뒤로 판을 락, 좌우로, 한 번 잘 전역 세포도 분포를 달성 할 수있는 원형 모션 인치 37 박 품다 ° C, humidified 환경 5 % CO 2.
- 3 일 : 반복 0.1 % 젤라틴있는 6 잘 플레이트 사전 코팅 3 우물에 잘 하나 균등하게 세포를 분리 제외하고 4-9 단계를 반복합니다. 이 차 섬유 아세포를 transduced의 6 우물를 얻을 수 있습니다.
- 4 일 : 10 μg / ML 육분의 오 우물까지의 농도에서 추가 doxycycline (dox). 하나는 잘 제어 역할을 할 치료 유지됩니다.
- dox로 치료 5 우물의 1.9 MM 3에서 VPA를 추가합니다. VPA는 MEFs의 확산 속도를 낮 춥니 다. subconfluent 문화가 2-5 일 이내에 senesce하는 경향이 반면 MEFs의 조밀 한 문화는 VPA에 장시간 노출을 용납. 따라서 MEFS는 VPA를 추가 100 % 합류해야합니다. 참고 : 알려진 epigenetic 변형이며, 쉬되었습니다 때문에 우리는 재 프로그래밍 실험에서 VPA를 사용완전 만능 iPSC 라인을 생성에 대해 효과와 VPA의 행동의 메커니즘은 알려져 있지 않습니다 있지만 iPSC 생성 17 효율성을 증가 자신의.
- 5 일 : 매체를 대기음 이전과 세포를 씻고 trypsinize. 신선한 dox과 VPA와 보충 ES 세포 매체에 미리 코팅 10cm이 요리를에 0.1 % 젤라틴과 다른 조건의 각으로 미리 코팅 15cm 두 조직 배양 접시에 dox / VPA로 치료 통로 세포.
- 신선한 dox과 VPA와 보충 ESC 매체로 매일 세포를 보충. ESC 같은 식민지는 dox / VPA 치료 ~ 7 일 후에와 dox 혼자 치료 ~ 10 일 후에 나타나기 시작합니다. 더 콜로니는 dox 치료의 부재에 나타나지 않습니다.
- 일단 식민지가 잘 정의 국경을 밝은 굴절을 가지고 있으며 30-50 세포를 포함 수동으로 공의 20 μl를 포함하는 U-하단에 96도 플레이트에 젤을로드하는 피펫 팁 및 전송과 식민지를 분리0.25 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산). 하나의 셀에 Trypsinize 혼자 dox / VPA 또는 dox를 포함하는 150 μl ESC 매체에 평면 바닥 96 잘 플레이트에 피더로 전송할 수 있습니다.
- clonally ESC 매체의 피더에 격리 된 iPSC 라인을 확장하고 있습니다. 자신뿐만 아니라 (후 전달 일 23) 이후 일 19 dox과 VPA를 제거합니다. 자기 갱신 또는 ESC 컨트롤과 유사 확산 속도를 유지하지 iPSC 라인을 폐기하십시오.
이 TEC를 수행하기 전에 ESCs과 관련하여 iPSC 라인을 특징하는 데 도움이 될 수 있습니다. 우리는 1)에 의해 내생 pluripotency immunocytochemistry, 2의 마커 (SSEA-1, Oct4, Sox2, Nanog)) 염색체 계산에 의한 핵형 분석 및 3) embryoid 바디 형성의 표현을 우리의 라인을 특징으로하고 있습니다. 하나는 lentiviral 특정 RT-qPCR은 proviral transgenes이 iPSCs으로 표현되지 않습니다 확인하기 위해 수행 할 수 있습니다. 그러나, 우리는 형태, immunostaining 및 karyotyp를 사용하여 완전히 만능 iPSCs를 확인했습니다ING. 우리의 실험에서, 우리는 일반적으로 잠재적 인 이상 karyotypes으로 여러 줄을 pluripotency 마커를 표현 라인의 대부분의 ESC와 같은 형태와 성장 특성 결과에 따라 iPSC 라인의 선택을 확인하면서.
4. Blastocyst 사출에 대한 iPSCs의 작성
PSC 라인의 항로 번호는이 라인에 의존 할 수 있지만 19의 pluripotency 18에 영향을 보여왔다. 우리는 성인 모든 iPSC 쥐를 생산하는 통로 8-14의 iPSCs를 사용하고 있습니다.
- 해동 iPSCs와 ESC 매체의 피더에 판. 항로 분사에 대한 사용하기 전에 피더에 한 번 이상 세포.
- 70-80% 합류 iPSCs를 포함하는 6 잘 접시의 잘 하나 분사에 대한 세포의 충분한 수의 이상을 제공 할 것입니다. 성장 매체를 기음과 ~ 3 ML 1X PBS (CA 2 + / MG 2 + 제외)으로 세포를 씻어.
- 에 0.5 ML 미리 예열 0.05 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산)을 추가가끔 흔들와 10 분에 대한 ° C 37 번 세포와 품다.
- 단일 셀 정지를 달성 할 수 씹다. 하나의 세포 현탁액을 보장하기 위해 빛을 현미경으로 세포를 관찰. iPSCs는 식민지 / 셀 집계가 주입 피펫을 방해하므로 단일 세포 현탁액에 있어야합니다.
- 하나의 세포 현탁액이 벤 달성되면, 잘에 1.0 ML ESC 미디어를 추가하고 37 ° C 배양기에 플레이트를 반환합니다. ~ 15 분 동안 배양이나 피더의 대부분을 부착하기 시작했다 때까지.
- 부드럽게 약하게 자기편 피더를 제거하지 돌봐 iPSCs를 포함하는 매체를 제거합니다.
- 5 ML ESC 매체를 포함하는 15 ML 원뿔 튜브에 iPSCs를 놓습니다. 5 분에 대해 200 XG에 원심 분리기. 표면에 뜨는을 기음과 micropipette으로 ES 세포 매체의 나머지를 제거합니다. 0.2-0.5 ML 사전 차가운 FHM 매체에 펠렛 조심스럽게 resuspend 세포를 제거하기 위해 튜브를 누르세요. 때까지 tetraploid B에 분사 동안 얼음에 저장 셀lastocysts.
5. Tetraploid Blastocysts의 생성
이 섹션에서 수행 절차는 다른 5,6,20 자세히 설명되어 있습니다. 여기 BTX 전기 셀 속이는 ECM 2001에 최적화 된 우리의 기술을 설명합니다.
- PMS와 HCG와 프라이밍 23-28일 세 여성 마우스 (C57BL/6J-Tyr C-2J / BALB / cByJ F1)에 의해 배아 기증자 마우스를 설정합니다. 나중에 HCG 47 시간의 오후 2시 5 IU의 PMS의 5 IU를 관리 할 수 있습니다. HCG 주사 후, C57BL/6J-Tyr C-2J / BALB / cByJ F1의 스터드 남성 여성 쥐를 설정합니다. 질 플러그에 대한 다음 일을 확인합니다.
- 안락사시켜야은 여성 쥐를 연결하고 oviducts를 수집합니다. Hyaluronidase과 FHM에 oviducts을 배치하고 부드럽게 ampulae을 찢어하여 1-세포 배아를 수집합니다. 적운 질량은 5-7 분 동안 FHM / Hyaluronidase에 앉아 할 수 있습니다.
- 입 피펫을 사용하여 1-세포 배아를 수집하고 KSOM에서 그들을 배치하기 전에 FHM 미디어의 물방울을 통해 씻어- AA 문화. 37 번 문화 ° C, 5 %의 박 미네랄 오일에 따라 CO 2, 2 세포 배아에게 electrofusion의 날을 선택합니다 다른 모든 배아를 폐기하십시오.
- 10cm 배양 접시에있는 BTX Microslide를 놓습니다. 솔루션 슬라이드가 있지만, 많은 전극의 극은 완전히 침수는 안 잠수함에 충분한 공간 온도 electrofusion 미디어를 넣어.
- ECM 2001 BTX 증폭기 400도에 전환합니다. microslide의 전극에 ECM의 케이블을 연결하고 슬라이드의 의도 움직임을 방지하기 위해 페트리 접시의 측면에 케이블을 해결할 수 있습니다.
- BTX 증강에 독서를 얻고 적용되는 AC / DC 전류의 전압을 참고 한 수동 펄스를 실행합니다. AC 전류가 배아는 전극 사이에 정렬되는 속도를 제어합니다, 현재 DC는 blastomeres을 융합되며, 펄스 시간은 DC 펄스의 길이를 설정합니다. 좋은 출발점은 AC 3V, DC 100V, 시간 0.05 밀리 초입니다. 최적의 DC는 90-150 볼트의 범위에 따라 다릅니다.
- 입 피펫 사용 KSOM-AA 문화 30-40 두 세포 배아에 대해 가지고 electrofusion 매체의 여러 물방울을 통해 그들을 씻어. 입 피펫에 microslide 요리에서 신선한 electrofusion 미디어를 이끌어 빨래에서 배아를. microslide에있는 전극 사이의 1mm 간격으로 배치합니다. 그들이 갭의 중간에서 내려하고 서로 접촉하지 그 정렬되어 있는지주의해야합니다.
- 수동 펄스 버튼을 눌러 AC 전류를 적용 할 수 있습니다. blastomere 접촉의 비행기가 전극에 평행 할 때까지 배아는 AC 필드에 회전합니다. 배아는 몇 초 내에 정렬되지 않은 경우, AC 설정을 늘리십시오.
- 배아는 정렬 한 후, DC 펄스를 적용하기 위해 다시 수동 펄스 버튼을 누르십시오.
- 피펫의 electrofusion 매체를 통해 microslide에서 배아를 수집합니다. KSOM-AA의 여러 물방울을 통해 배아를 깨끗이 씻어 37 KSOM-AA 문화에 넣어 ° C, 5 % CO 2. blastomere 융합 우문화 미만 30 분에 완료 될 uld.
- 반복은 2 셀 배아를 나머지에 대한 7-11 단계를 반복합니다. 이후 퓨전 그룹 후, 모니터링 및 융합 blastomeres으로 배아를 선택합니다. 성공적으로 융합 배아은 1 셀 단계에 있어야 나타납니다. 문화의 30 분 후 lysed 및 2 셀 배아를 폐기하십시오. 퓨전 비율은 아래 80 % 경우, 5V 및 0.01 밀리 초 단위로 전압 및 / 또는 시간을 향상시킬 수 있습니다. 용해 20 % 이상이면, DC 전압 및 / 또는 시간을 적절하게 감소. 우리 실험의 최적의 설정은 AC의 4V, DC 146V 및 0.07 밀리 초했다. 이러한 설정은 지속적으로 90% 또는 거의 또는 전혀 용해와 높은 퓨전 속도를 나왔고.
- 37 번 미네랄 오일에 따라 KSOM-AA의 microdrops의 문화 융합 배아를 ° C, 5 % CO 2로 진행합니다. 당신은 부화 48 시간 후 tetraploid (4N) blastocysts를 형성하기 위해 융합 배아의 85-95%을 기대해야합니다.
6. Tetraploid Blastocysts에 iPSCs의 Microinjection
우리는 니콘 TE-2000U를 사용하여역 현미경 blastocyst 분사에 대한 DIC 광학 및 Narishige의 마이크로을 갖추고 있습니다. 각 tetraploid blastocyst은 이전 주피터 간행물 5,20,21에서 입증 된 마우스 blastocysts에 ESC 주입을위한 표준 프로토콜을 사용하여 10-12 iPSCs를 주입
- 오목 현미경 슬라이드의 중앙에 FHM의 20 μl 방울을 넣고 미네랄 오일의 150 μl로 다룹니다.
- FHM 드롭에 개최 피펫 및 microinjection의 바늘을 낮 춥니 다. 두 바늘까지 2-3 분 부분적으로 FHM로 입력 할 수 있습니다.
- FHM과 현미경 슬라이드의 FHM 드롭으로 전송 물방울을 통해 20-30 tetraploid blastocysts을 씻는다.
- 드롭에 입 피펫 iPSC 혼합물. 그것은 세포가 너무 집중하거나 집계됩니다 사전에 경우 FHM 한 방울의 세포 혼합물을 희석해야 할 수도 있습니다.
- 주입 바늘로 100-200 셀을 선택합니다.
- 9시 멋 부리다에 내부 세포 질량과 blastocyst 잡아이온. 3시 위치에 조나 pellucida 및 trophoblast를 관통하여 blastocoel에 세포를 주입. blastocyst 당 16-18 세포를 주입.
- KSOM-AA 문화에 iPSC 보완 blastocysts을 반환합니다.
7. 받는 마우스의 자궁 뿔에 보완 Tetraploid Blastocysts의 양도
보완 tetraploid blastocysts는 수술 우리가 간략하게 요약한다 표준 기술 20를 사용하여 연구자의 기관의 지침에 따라 여성받는 마우스의 자궁 뿔으로 전송됩니다. 프로 발정 단계에서 여성의 CD-1 마우스를 선택하고 vasectomized 남성과 결합 사람들을 설정합니다. 다음날 아침 질 플러그가 있는지 확인합니다. 암컷은 플러그가 (2.5 dpc) 발견 지 2 일 후에 자궁 배아 전송을위한 준비가되어 있습니다.
받는 사람 여자는 vasectomized 남성 정합되기 전에 어느 날, 비 vasectomized 남성 추가 CD-1 여성을 설정카이사르의 섹션에서 검색 모든 iPSC 마우스의 위탁 어머니로 사용할 수 있습니다.
8. iPSC 파생 새끼의 제왕 섹션 및 육성
주입 후 여러 resorptions에서 TC의 배아의 전송은 일반적으로 결과 iPSC 또는 ESC 줄은 높은 발달 가능성이있는 경우에도. 그 결과, 하나는 수신자 당 더하지 4보다 가능한 새끼를 (보통 1-2) 기대할 수 있습니다. 이 작은 litters는 일반적으로 수신자에 의해 무시됩니다. 신생아 치료의 수준과 생존의 속도를 증가하기 위해, 우리는 C-섹션을 수행하고 표준 프로토콜 20에 따라 육성. 제왕 섹션을 수행하려면 7 오후 8시 (받는 18.5 dpc)에 16일 배아 전송 후받는 쥐를 안락사시켜야하고 자궁 뿔에서 새끼를 해부. CD-1 엄마 전달 litters 그 같은 날에 가능한 새끼를 육성.
결과
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
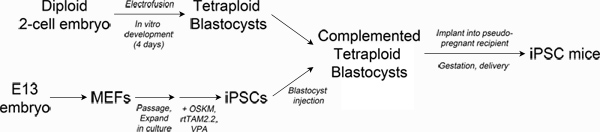
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
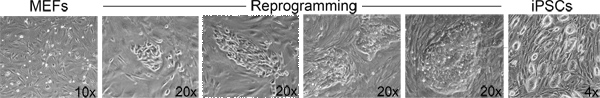
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
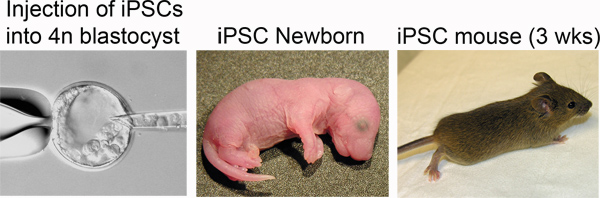
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
토론
TEC의 assays를 사용하여 iPSC 라인에서 생성 마우스는 iPSC 라인의 pluripotency에 대한 엄격한 기능 테스트를 제공합니다. 이 테스트는 다른 재 프로그래밍 방법의 상대적 효능을 평가하거나 체외에서 특정 세포 유형을 생성하기 위해 가장 유용 할 수 있습니다 iPSC 라인을 식별 할 유용 할 수 있습니다. iPSCs에서 생성 된 쥐들이 stringently 장기적인 안정성과 iPSC 파생 조직의 tumorigenicity을 테스트하는 데 사용할 수 있습니다. 이 프로토콜은 완전히 만능 iPSC 선 또는 iPSC 쥐를 생성하거나 다른 재 프로그래밍 방법의 상대적 유틸리티를 비교하고자 조사에 도움이 될 것입니다.
완전 만능 iPSCs의 생성 및 식별을 통제 메커니즘은 제대로 이해하고 일부 iPSC 라인이이 방법을 사용하면 TEC 테스트를 통과하지 않습니다 생산 가능성이 있습니다 유지합니다. 많은 요인은 유전 적 배경, lentiviral titer, lentiviral 전의 패턴 등을 포함하여 실험을 사이에 다를 수 있습니다nsertion, 기증자 인구의 세포주기 매개 변수는 TEC 절차의 여러 단계와 iPSCs의 변수 경향에 간 실험실 차이는 유전자 또는 epigenetic aberrations을 품다합니다. 최고의 성공을 보장하기 위해, 우리는 각각의 바이러스가 충분히 감지 유전자 발현 적어도 80 %의 이상적인 100 % 생산 집중되도록 제어 MEFs에 바이러스 dilutions를 테스트하여 iPSC 유도 실험에서 lentiviral 유전자 발현의 적절한 수준을 설정하는데주의를 기울여야 MEFs. 이 MEFs에 독성을 제한하고 우물 인구 과잉없이 식민지를 생산하는 동안 우리는 서로 다른 lentiviruses의 여러 사본 라인을 확인할 수 있습니다. 그것은 여러 다른 프로토콜은 전체 pluripotency에 대해 여러 경로가 1,8-13,15가 존재하고 있다는 것을 암시 여러 방법과 공여 세포 소스를 사용하여 전체 개발 잠재력을 지닌 iPSCs를 생성하기 위해 표시되었음을 주목해야한다. 현재, 그러나,의 확실한 biomarker가 완전히 만능 iPSC식별 및 따라서 TEC 분석은 iPSC 줄은 유기체의 모든 세포 lineages을 생성 할 수 있는지 여부의 금을 표준 시험 남아있다.
공개
관심 없음 충돌이 선언 없습니다.
감사의 말
KKB에 지원, MJB, JLH 및 KLN는 재생 의료에 대한 캘리포니아 연구소, 퓨 자선 신탁 바이오 메디컬 학자 프로그램, 에스더 B. O'Keeffe 가족 재단과 샤피로 가족 재단에 의해 제공되었다. KKB는 도널드 E.와 델리아 B. 박스터 재단 학부 학술 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
참고문헌
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유