Method Article
İsteyerek Pluripotent Kök Hücrelerinin Elde Edilen Fare Üretimi
Bu Makalede
Özet
Onlar pluripotency için standart testleri geçmek bile oluşturuluyor indüklenen pluripotent kök hücre (IPSC) hatları gelişim potansiyeli birbirinden farklı çizgiler üretir. Burada sahip tam olarak pluripotency IPSC hattı tanımlayan iPSCs, tamamen edilen fareler üretmek için bir protokol tanımlamak 1.
Özet
Somatik hücrelerden indüklenmiş pluripotent kök hücreler (iPSCs) üretimi temel araştırma için değerli araçlar oluşturmak için bir araç sağlar ve aynı zamanda rejeneratif tedaviler için hasta eşleşen hücreleri kaynağı üretebilir. iPSCs çoklu protokolleri kullanılarak oluşturulan ve birden çok hücre kaynaklardan elde edilebilir. Bir kere üretilen iPSCs pluripotency belirteçleri için immun, embriyoid organları ve teratomlar, embriyonik kök hücreler (EKH) ve germline katkısı 2 olan veya olmayan kimerik fare üretimi ile gen ekspresyon karşılaştırmalar üç germ yaprağının üretimi de dahil olmak üzere testler çeşitli kullanılarak test edilmiştir . Önemlisi, bu testleri geçmek IPSC hatları hala farklı farklılaşmış hücre tipleri 2 üretme kapasitesi değişir. Bu zor IPSC derivasyon protokolleri, donör hücre kaynakları veya seçimi yöntemleri farklı uygulamalar için en yararlı olan kurmak için yaptı.
En sıkı testBir kök hücre hattı, bir organizmanın yaşamını sürdürmesi için gerekli tüm dokularda oluşturmak için yeterli gelişim potansiyeline sahip olup olmadığı (adlandırılır tam pluripotency) tetraploid embriyo tamamlayamamakta (TEC) 3-5 olduğunu. Teknik olarak, TEC blastosit 6, in vitro olarak yetiştirilebilir tetraploid (4n) tek-hücreli embriyo oluşturmak için iki hücreli embriyoların elektrofüzyon içerir. Diploid (2n) pluripotent kök hücreler (örn EKH veya iPSCs) ardından tetraploid blastokist blastocoel boşluğuna enjekte ve (bkz. Şekil 1) gebelik için bir alıcı kadın aktarılır. Diploid hücreler enjekte kök hücre hattı tamamen türetilmiş bir fetüs sonuçlanan, embriyonun düzgün teşkil ise tamamlanmaktadır embriyonun tetraploid bileşeni, extraembryonic dokular (plasenta, yolk kesesi) neredeyse sadece katkıda bulunur.
Son zamanlarda, biz tekrarlanabilir erişkin farelerde üreten IPSC hatlarının türetme bildirdiTEC 1 ile. Bu IPSC hatları EKH 3,4,7 karşılaştırılabilir ve çoğu diğer IPSC hatları 8-12 rapor daha yüksektir 5-13%, verimlilikleri ile canlı yavru doğurur. Bu raporlar doğrudan reprogramming TEC testlerinde yavrular üretme gelişim potansiyeli ve verimliliği EKH neticesinde tamamen pluripotent iPSCs üretebilir olduğunu göstermektedir. Şu anda, tam pluripotent iPSCs ve daha az güçlü hatları 13-15 arasında ayıran ne olduğu açık değildir. Ne de yeniden programlama yöntemleri yüksek verimlilik ile bu satırları üretecek ortadadır. Burada IPSC hatları pluripotency karşılaştırmak veya farklı reprogramming yöntemleri denklik kurmak isteyen araştırmacılar için yararlı olabilir tam pluripotent iPSCs ve "all-IPSC" fareler, üreten bir metot tanımlamıştır.
Protokol
Bu yöntem, Boland ve ark. Nature bildirilen araştırmada kullanılmıştır. 461, 91-96 (2009). 1
1. Lentivirus hazırlanması
Bu protokol bir Teto yanıt elemanı kontrolü altında Oct4 için Sox2, Klf4, ve c-myc encode doksisiklin-indüklenebilir lentiviral mekik vektörleri kullanmaktadır. Transgenlerin doksisiklin varlığında yeniden programlanması faktör ekspresyonuna sebep olur ters tetrasiklin trans aktive edici protein, rtTAM2.2 16 ile aktive edilir. Bu sistem, yeniden programlanması faktörlere sıkı kontrol, yüksek ifade için olanak sağlar. Burada kullanılan lentiviral vektörleri kendini etkisiz olduğu ve bu nedenle aşağıdaki genomik entegrasyon çoğaltamıyor. Lentiviruses ile çalışan ve BSL-2 (ABD) ve S2 (Avrupa) standartlarına uyumlu laboratuvarlarda yapılmalıdır Ancak, dikkatli olunmalıdır.
- En az bir kez tra önce HEK293T hücreleri ve geçit çözülmensfection. Hücreler 37 HEK orta yoğunlukta subconfluent tutulmalıdır ° C,% 5 nemlendirilmiş bir ortam içinde CO2. 1:06-01:10 bir split oranı ile rutin pasaj hücreler 2 günde.
- Tohum ~ 8 x 10 6 25 ml HEK orta HEK293T cells/T150. Her bir lentivirüs hazırlanması için bir T150 kullanın.
- Kalsiyum fosfat çökeltme ile ertesi gün hücrelerin transfekte HEK293T. (Not: Elimizdeki kalsiyum fosfat çökeltme rutin olarak% 80-90 transfeksiyon verimi ile sonuçlanır, ancak bu tür lipofektamin 2.000 katyonik lipid transfeksiyon reaktifler de kullanılabilir). Hazırlanması için her bir virüs için iki adet 15 ml'lik konik bir tüp hazırlanır. "A" ve "B" tüpleri etiketleyin. Tüp A, her biri 10 ug: lentiviral mekik vektörünün kodlama yeniden programlanması faktörleri (ya da rtTAM2.2), viral paketleme vektörler, ve plasmid kodlama viral zarf proteini VSVg. Tüp A 186 ul 2 M CaCl2 ekleyin ve steril H 2 O ile 1.5 ml hacimleri getirir. Tüp B: 1.5 mL 2x HBS (oda sıcaklığına kadar önceden ısıtılır.)
- Bir homojen çözelti kadar Tüp A içinde karışım pipet. A B çözeltisi damla damla çözeltisi ekleyin ve 2-3 dakika oda sıcaklığında bekletin.
- HEK293T hücrelerinin büyümesini orta aspire ve 22 ml önceden ısıtılmış HEK penisilin olmadan orta ve streptomisin ile değiştirin.
- Pipet kombine çözümler AB (kalsiyum fosfat çökelti) doğrudan hücre HEK293T ve hafif sallanan tarafından eşit şekilde dağıtmak.
- Lentivirüs ile HEK-293T hücrelerin transfeksiyon sonra 24 saat, büyüme orta kaldırmak ve taze, önceden ısıtılmış HEK orta 25 ml ile değiştirin. Inkübatör transfekte Heks dönün.
- 48 saat lentivirüs ile HEK-293T hücreleri transfeksiyondan sonra, transfekte edilmiş heks dan lentiviral parçacıkları içeren büyüme ortam toplamak. 5 dakika 4 ° C'de 3.000 x g'da santrifüjleme ile hasat çözelti viral partikül artıkları kaldırma
- Ultrasantrifügasyon uçtan bir uca tarafından virüs Konsantreöf 4'te 112,000 x g'de 2 saat için bir% 20 sakroz yastığı (2 mi sucrose/25 ml viral süpernatant) ° C. Nazik sallama ile 15-30 dakika boyunca 4 ° C'de 0.4 ml EMB orta viral pelet süspanse edin. -80 Tek kullanımlık alikotları (yani 50 ul) viral parçacıkların saklayın ° C
2. Yeniden programlanması için Fare Embriyonik Fibroblast hazırlanması (MEF)
Not: Burada açıklanan protokol TEC tahlillerde kullanılmak için E 13.5 fare embriyonik fibroblastlardan iPSCs bir türetme ile ilgilidir. Diğer gruplar yetişkin donör hücre kaynaklarından tüm IPSC farelerde oluşturulan olmasına rağmen, biz diğer hücre türleri üzerinde bu yöntemi test değil ve donör hücre tipi bir faktör değildir emin olamaz.
- Fare zamanlamalı çiftleşmelerin ayarlayın. Embriyonik gün 13.5 (E13.5) üzerinde, hamile kadın ötenazi ve rahim boynuzları gelen embriyolar teşrih. Buz üzerinde 1x PBS içinde yer ve mağaza embriyolar (4 ° C kadar önceden soğutulmuş).
- Extraembryonic dokular (yani kaldırkoryon, amniyon ve plasenta). Embriyo başını kesmek ve kuyruk kaldırmak (opsiyonel - genotipleme için gerekirse) ve bacaklarda. Iç organları, kullanarak forseps veya bir kepçe biçimli bir mala boaltınız ve bir neşter veya keskin makas bıçağı ile kalan karkas kıyma.
- 5 ml önceden soğutulmuş 1x PBS kıyılmış karkas yıkayın. 5 dakika boyunca 200 x g'de santrifüjleyin.
- Süpernatant aspire. 37 5 ml% 0.25 tripsin-EDTA ve inkübe pelet Askıya ° C dinç 20-30 dk sallayarak.
- EMB ortam (37 ° C'de ön-ısıtılmış), 5 dakika boyunca 200 x g ile santrifüj karışımı 5 ml ilave edilir.
- Önceden ısıtılmış MEF ortamda süpernatant ve tekrar süspansiyon pelet aspire.
- % 0.1 jelatin ile önceden kaplanmış bir 6-kuyulu plakanın kuyularının 2-3 Plak ayrışmış MEFS. Bu pasaj 1 olarak kabul edilir.
- 1:04-01:05 her 48 saat dilusyondaki Passage MEFS. Geçit 3'te MEFS lentiviral transdüksiyon için hazırız.
3. IPSC Hatları türetilmesi
- Lentiviral transdüksiyon önceki gün; tohum ~ 3 x 10% 0,1 jelatin ile önceden kaplanmış bir 6-plaka çok iyi birine 5 ilköğretim MEFS.
- 1. Gün: Birincil MEFS lentiviral transdüksiyon için 80-90% konfluent olmalıdır. 37 gece boyunca MEFS ile doğrudan MEF ortam ve inkübe lentiviral parçacıklar ekleme ° C'de nemlendirilmiş bir ortam içinde% 5 CO2.
- Ertesi gün (2 gün) orta aspirat ve viral parçacıkların kaldırılması için 1x PBS 3 ml ile iki kez yıkayın.
- 0.5 ml önceden ısıtılmış ara sıra sallama ile 3-5 dakika için 37 hücreleri ile inkübe ° C ila% 0.25 tripsin-EDTA ekleyin.
- Tek bir hücre süspansiyonu elde etmek için öğütmek. Tek bir hücre süspansiyonu sağlamak için ışık mikroskobu ile hücrelerin gözlemleyin.
- 5 ml MEF medya içeren 15 ml konik tüp içine Transferi MEFS. 5 dakika boyunca 200 x g'de santrifüjleyin. MEF orta süpernatant ve tekrar süspansiyon hücreleri hafifçe aspire.
- Eşit bir 6 kuyu p iki kuyu arasındaki hücre süspansiyonu bölünmüş% 0.1 jelatin ile önceden kaplanmış geç.
- Ileri ve geri plakası Kaya, yan yana, ve bir kez iyi boyunca hücrelerin eşit dağılımını sağlamak için dairesel bir hareket. 37 ° C'de gece boyunca inkübe, nemlendirilmiş bir ortam içinde% 5 CO2.
- 3. Gün: Tekrar% 0.1 jelatin ile 6 plaka önceden kaplanmış 3 kuyu iyi birinden eşit hücreleri bölme hariç 4-9 adımları yineleyin. Bu birincil fibroblastlar transduced 6 kuyu verecektir.
- Gün 4: 10 ug / ml 5/6 kuyu için bir konsantrasyonda Ekleme doksisiklin (DOX). Bir iyi bir kontrol olarak hizmet için arıtılmamış kalmalıdır.
- Dox ile tedavi 5 kuyu 1.9 mM 3'te VPA ekleyin. VPA MEFS proliferasyon hızını azaltır. Subconfluent kültürleri 2-5 gün içinde senesce eğilimindedir, oysa MEFS yoğun kültürleri VPA uzun süreli maruz tolere. Bu nedenle, MEFS VPA ilave edilir% 100 birbirine karışan olmalıdır. Not: Bu bilinen bir epigenetik değiştirici, ve sh olmuştur çünkü bizim reprogramming deneylerde VPA kullanımıtam pluripotent IPSC hatları oluşturmak bakımından etkileri ve VPA etki mekanizması bilinmemekle birlikte, IPSC kuşak 17 etkinliğini arttırmak için kendi.
- 5. Gün:, orta aspire önce olduğu gibi hücrelerin yıkayın ve Trypsinize. Taze dox ve VPA ile takviye ES hücre ortamında önceden kaplanmış 10 cm tabaklar 2 ile% 0.1 jelatin ve diğer koşulların her biri ile önceden kaplanmış 15 cm2 doku kültürü çanağı dox / VPA ile tedavi edilen geçiş hücreleri.
- Taze Ortodoks ve VPA ile takviye ESC orta her gün hücrelerin yenileyin. ESC benzeri koloniler dox / VPA tedavisi ~ 7 gün sonra ve dox yalnız tedavisinde ~ 10 gün sonra ortaya çıkmaya başlar gerekir. Resim koloniler dox tedavi yokluğunda yer almalıdır.
- Sonra koloniler, iyi tanımlanmış sınır parlak bir refraktif sahip ve 30-50 hücreler içeren, elle 0 20 ul içeren bir U-alt 96 plaka bir jel yükleme pipet ve transferi ile koloniler izole.25% Tripsin-EDTA. Tek hücrelere Trypsinize ve yalnız dox / VPA veya dox içeren 150 ul ESC ortamda düz dipli 96 plaka besleyiciler aktarmak.
- Klonal ESC ortamda besleyiciler üzerinde izole IPSC hatları genişletmeye devam edin. Bunların yanı sıra (post-transdüksiyon gün 23) gün sonra 19 Ortodoks ve VPA çıkarın. Kendini yenileme veya ESC denetimleri benzer proliferasyon oranlarını korumak yok IPSC çizgiler atın.
Bu TEC gerçekleştirmeye çalışmadan önce EKH ilişkili olarak IPSC çizgiler karakterize etmek için yararlı olabilir. Biz 1) endojen pluripotency immünsitokimya, 2 belirteçleri (SSEA-1, Oct4, Sox2, Nanog)) kromozom sayımı ile karyotip analizi ve 3) embriyoid vücudun oluşumu ifadesi bizim çizgiler karakterize etmiş. Bir de lentiviral özgü RT-qPCR proviral transgenlerin iPSCs ifade olmadığını teyit etmek için yapabilir. Ancak, biz sadece morfoloji, immun ve karyotyp kullanarak tam pluripotent iPSCs belirlediking. Deneylerde, biz genellikle potansiyel anormal karyotip ile birkaç satır pluripotency belirteçler eksprese hatlarının çoğunda ESC benzeri morfolojisi ve büyüme özellikleri sonuçlarına göre IPSC hatları seçimi tespit ederken.
4. Blastosist Enjeksiyon için iPSCs hazırlanması
PSC hattı kanal adedi ile bu hat 19 bağlı olabilir, ancak onun pluripotency 18 etkilediği gösterilmiştir. Biz yetişkin tüm IPSC fareler üretmek için pasajlardan 8-14 iPSCs kullandık.
- Çözülme iPSCs ve ESC orta besleyiciler üzerinde plaka. Passage enjeksiyon kullanmadan önce besleyiciler ile ilgili en az bir kez hücreler.
- % 70-80 oranında konfluent iPSCs ihtiva eden bir 6-plaka arasında iyi bir enjeksiyon için hücrelerin yeterli sayıda daha fazla sağlayacaktır. Büyüme ortamı aspire ve ~ 3 ml 1 x PBS (Ca2 + / Mg2 + içermeyen) her hücreleri yıkayın.
- 0.5 ml önceden ısıtılmış% 0.05 tripsin-EDTA ekleyinAra sıra sallanan ile 10 dakika süreyle 37 ° C de ve hücreler inkübe.
- Tek bir hücre süspansiyonu elde etmek için öğütmek. Tek bir hücre süspansiyonu sağlamak için ışık mikroskobu ile hücrelerin gözlemleyin. IPSCs koloniler / hücre agrega enjeksiyon pipeti yapışmasına neden olacak gibi tek bir hücre süspansiyonu olması gerekiyor.
- Tek bir hücre süspansiyonu ben elde sonra, kuyu için 1.0 ml ESC medya ekleyin ve 37 ° C inkübatör için plaka döner. ~ 15 dakika inkübe veya besleyiciler çoğunluğu uymak başladı kadar.
- Yavaşça zayıf yapışık besleyiciler çıkarmak için özen iPSCs içeren orta kaldırmak.
- 5 ml ESC ortam ihtiva eden bir 15 ml'lik konik bir tüp içinde iPSCs yerleştirin. 5 dakika boyunca 200 x g'de santrifüjleyin. Süpernatan aspire ve bir mikropipet ile ES hücre orta kalan çıkarın. 0.2-0.5 ml önceden soğutulmuş FHM ortam içinde pelet ve nazikçe tekrar süspansiyon hücreleri çıkarmak için tüp dokunun. Kadar ve tetraploid b içine enjeksiyon sırasında buz üzerinde saklayın hücrelerilastocysts.
5. Tetraploid Blastosistler Üretimi
Bu bölümde yapılan işlemler başka 5,6,20 ayrıntılı olarak tarif edilmiştir. Burada BTX Elektro Hücre Manipülatörü ECM 2001 için optimize bizim teknik, anahat.
- PMS ve HCG emişli 23-28 gün yaşlı dişi farelerde (C57BL/6J-Tyr c-2J / BALB / cByJ F1) embriyo donör fare ayarlayın. Daha sonra HCG 47 saat arasında 02:00 ve 5 IU PMS 5 IU Yönet. HCG enjeksiyonundan sonra, C57BL/6J-Tyr c-2J / BALB / cByJ F1 damızlık erkek ile dişi fareler kurdu. Vajinal fişleri için ertesi gün kontrol edin.
- Ötenazi dişi farelerde takılı ve yumurta kanalları toplamak. Hyaluronidaz ile FHM Fallop borularının yerleştirilmesi ve yavaşça ampulae yırtarak 1 hücreli embriyolar toplayın. Kümülüs kitleler 5-7 dk için FHM / Hyaluronidaz içinde bekletin.
- Bir ağız pipet kullanarak 1-hücreli embriyo toplayın ve KSOM koymadan önce FHM medya damla yoluyla yıkayın-AA kültürü. Kültür 37 ° C'de,% 5 lik bir gecede mineral yağ altında CO 2 ve 2 hücreli embriyolar elektrofüzyon gününde embriyolar seçmek tüm diğer atın.
- 10 cm Petri kabındaki BTX Microslide yerleştirin. Çözüm slayt, ama çok elektrot direkleri tamamen batık değil o batığın kadar oda sıcaklığında elektrofüzyon medya dökün.
- ECM 2001 ve BTX Artırıcı 400 açın. Microslide en elektroduna ECM'nin kabloları bağlayın ve slayt istenmeyen hareketi önlemek için Petri kabı tarafına kabloları sabitleyin.
- BTX arttırıcı bir okuma almak ve uygulanan AC / DC akım gerilim Unutulmaması gereken bir el çarkı çalıştırın. AC akım embriyoların elektrotlar arasında hizalamak hızını kontrol edecek, DC akım blastomer kaynaştırmak, ve darbe zamanı DC darbe uzunluğu ayarlanır. İyi bir başlangıç noktası AC 3V DC 100V, ve zaman 0.05 msn olduğunu. Optimal DC 90-150 volt aralığı içinde değişmektedir.
- Bir ağız pipet kullanarak, KSOM-AA kültürü 30-40 iki hücreli embriyo sürer ve elektrofüzyon orta birkaç damla ile yıkayın. Ağız pipet içine microslide yemeğin taze elektrofüzyon medya çizin ve yıkama embriyolar alır. Microslide üzerindeki elektrotlar arasında 1 mm boşluk koyun. Onlar boşluğun ortasında aşağı ve birbirleri ile temas halinde olmadığını hizalanmış olduğunu dikkatli olun.
- Manüel darbe düğmesine basarak AC akım uygulayın. Blastomer temas düzlemi elektrotlar paralel olana kadar embriyo, AC alanına dönecektir. Embriyolar birkaç saniye içinde hizalı değilse, AC ayarını artırın.
- Embriyolar hizalı sonra, DC darbe uygulamak için tekrar manuel darbe düğmesine basın.
- Pipet içinde elektrofüzyon orta ile microslide gelen embriyolar toplamak. KSOM-AA birkaç damla yoluyla embriyolar yıkayın ve 37 KSOM-AA kültür koyun ° C,% 5 CO2. Blastomer füzyon shokültür içinde en az 30 dakika içinde tamamlanır uLd.
- Tekrar 2-hücreli embriyo kalan için 7-11 adımları yineleyin. Sonraki füzyon grupların ardından, izlemek ve erimiş blastomer ile embriyolar seçin. Başarıyla erimiş embriyolar 1-hücreli aşamasında olduğu görünecektir. Kültür içinde 30 dakika sonra lize ve 2 hücreli embriyolar atın. Füzyon oranının altında% 80 ise, 5V ve 0.01 msn artışlarla gerilimi ve / veya süresini artırın. Lizis% 20 üstünde ise, DC gerilim ve / veya zaman buna göre azalır. Bizim deneylerde optimum ayarları AC 4V, DC 146V ve 0.07 msn idi. Bu ayarlar sürekli% 90 veya az veya hiç lizis ile yüksek füzyon oranı vermiştir.
- 37 mineral yağ altında KSOM-AA microdrops kültür sigortalı embriyolar ° C,% 5 CO 2 ile devam edin. Sen inkübasyondan 48 saat sonra tetraploid (4n) blastokist oluşturmak için erimiş embriyoların% 85-95 beklemesin.
6. Tetraploid Blastosistler içine iPSCs Mikroenjeksiyon
Biz Nikon TE-2000U kullanımıinverted mikroskop blastosist enjeksiyon için DIC optik ve Narishige mikromanipülatörler ile donatılmıştır. Her tetraploid blastosist önceki vallahi yayında 5,20,21 ortaya konmuştur fare blastokist içine ESC enjeksiyon için bir standart protokolü kullanarak 10-12 iPSCs ile enjekte edilir
- Konkav bir mikroskop slaydı merkezinde FHM bir 20 ul düşüş yerleştirin ve mineral yağ, 150 ul ile kapağı.
- FHM damla içine tutarak pipet ve mikroenjeksiyon iğne indirin. Hem iğneler için 2-3 dk kısmen FHM ile dolmasını sağlayın.
- FHM ve mikroskop lamı üzerine FHM damla transfer damla yoluyla 20-30 tetraploid blastokist yıkayın.
- Damla içine Ağız pipet IPSC karışımı. Bu, hücre ya da çok konsantre toplanır önceden eğer FHM bir damla hücre karışımı seyreltik için gerekli olabilir.
- Enjeksiyon iğnesi ile 100-200 hücre seçin.
- Saat 9 varsaymak içinde iç hücre kütlesi ile blastosist tutuniyon. Saat 3 hizasında zona pellucida ve trofoblast nüfuz ederek blastocoel içine hücreleri enjekte. Blastosist başına 16-18 hücreleri enjekte edilir.
- KSOM-AA kültürüne IPSC tamamlanmaktadır blastokist dönün.
7. Alıcı Mice Uterus Kornalar içine tamamlanmaktadır Tetraploid blastokist transferi
Tamamlanmaktadır tetraploid blastokist cerrahi kısaca özetlemek olacaktır standart tekniği 20 kullanılarak, araştırmacının enstitü kurallarına göre dişi alıcı farelerin rahim boynuzları aktarılır. Pro-östrus aşamada dişi CD-1 fare seçin ve Vasektomi erkek ile çiftleşme için onları kurmak. Ertesi sabah vajinal fişleri kontrol edin. Dişiler fişi (2.5 DPC) tespit edildikten iki gün sonra uterin embriyo transferi için hazırız.
Alıcının kadın Vasektomi erkek ile evlendirilen önce bir gün, olmayan Vasektomi erkek ile ek CD-1 kadın kurmaksezaryen tarafından alınan tüm-IPSC fareler için koruyucu anne olarak kullanılır.
8. IPSC türetilmiş Pups arasında Sezaryen ve Hızlandırılması
Implantasyon sonrası birden rezorpsiyonlarının TC embriyo transferi genellikle sonuçları, IPSC veya ESC hattı yüksek gelişim potansiyeline sahip olsa bile. Sonuç olarak, bir alıcı için fazla 4 uygun yavrusu (genellikle 1-2) beklenebilir. Bu küçük yavrular genellikle alıcılar tarafından ihmal edilir. Yenidoğan bakım düzeyi ve hayatta kalma oranını arttırmak için, sezaryen gerçekleştirmek ve standart protokoller 20 göre teşvik. Sezeryan gerçekleştirmek için, 7-08:00 (alıcı 18.5 DPC), 16 gün embriyo transferi sonrası alıcı fareler ötenazi ve rahim boynuzları gelen yavrular teşrih. CD-1 annelere teslim ibrelerin aynı gün canlı yavrular Foster.
Sonuçlar
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
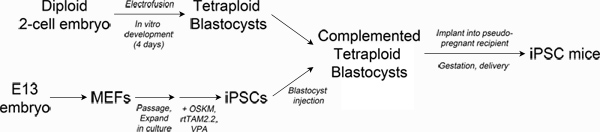
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
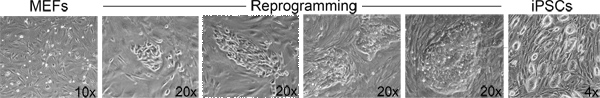
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
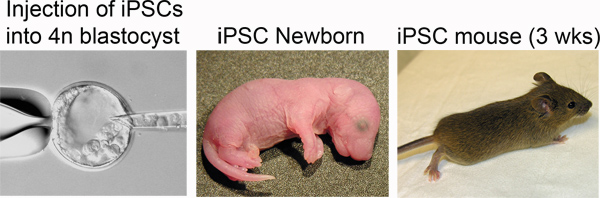
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Tartışmalar
TEC yöntemleri kullanılarak IPSC hatları oluşturma farelerin bir IPSC hattının pluripotency için sıkı bir fonksiyonel test sağlar. Bu deney yöntemleri farklı yeniden programlama göreli etkinliğini değerlendirmek için in vitro olarak belirli hücre tipleri üretmek için en yararlı olabilir IPSC hatları belirlemek için yararlı olabilir. IPSCs elde edilen Fareler sıkı bir şekilde uzun süreli kararlılık ve IPSC-türevi dokuların tümör gelişimini test etmek için de kullanılabilir. Bu protokol, tam pluripotent IPSC çizgileri veya IPSC fareler oluşturmak için ya da yeniden programlama farklı yöntemler göreceli yarar karşılaştırmak isteyen araştırmacı için yararlı olacaktır.
Tam pluripotent iPSCs üretimi ve kimlik kontrol mekanizmaları tam olarak anlaşılamamıştır ve bazı IPSC hatları bu yöntemi kullanarak TEC test geçmek olmaz üretilen mümkündür kalır. Birçok faktör genetik kökenden, lentiviral titresi, lentiviral i modellerini içeren deneyler arasında değişebilirnsertion, donör nüfusun hücre döngüsü parametreleri, TEC prosedürün çeşitli adımlar ve iPSCs değişken eğilimleri de laboratuvarlar arası farklılıklar genetik veya epigenetik sapmaları beslememiz. Iyi başarı sağlamak için, her virüs yeterince saptanabilen gen ekspresyonu en az% 80 ve ideal olarak% 100 üretmek için konsantre olmasını sağlamak için kontrol MEFS viral dilüsyonları sınayarak IPSC derivasyon deneylerde lentiviral gen ifadesinin uygun düzeylerde kurmaya özen MEFS. Bu MEFS toksisite sınırlayıcı ve kuyular kalabalık olmadan kolonileri üretirken bize farklı lentiviruses birden fazla kopyası olan satırları tanımlamak için izin verir. Birden diğer protokolleri tam pluripotency giden çoklu yolların 1,8-13,15 var olabileceğini düşündüren birden çok yöntem ve donör hücre kaynakları kullanılarak, gelişim potansiyeli olan iPSCs üretmek için gösterilmiştir unutulmamalıdır. Şu anda, ancak, herhangi bir kesin biyolojik tam pluripotent IPSCtanımlanan ve bu nedenle TEC analizinin IPSC doğrultusunda bir organizmadaki tüm hücre soylarının üretebilir olsun altın standart test kalır.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
KKB Destek, MJB, JLH ve KLN Rejeneratif Tıp California Institute, Pew Charitable Ortaklıklarına Biyomedikal Scholars Program, Esther B. O'Keeffe Aile Vakfı ve Shapiro Aile Vakfı tarafından sağlanmıştır. KKB bir Donald E. ve Delia B. Baxter Vakfı Fakülte Akademik olduğunu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Referanslar
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır