Method Article
诱导多能干细胞来源于小鼠的生成
摘要
生成诱导多能干细胞(IPSC)线生产线,不同的发展潜力,即使当他们通过标准测试的多能性。在这里,我们描述了一个协议,全部来自iPS细胞拥有完整的多能性,它定义了IPSC的小鼠 1。
摘要
生产的体细胞诱导多能干细胞(iPSCs)创造有价值的工具,为基础研究提供了一种手段,也可能产生源细胞再生疗法的患者相匹配的。 iPSCs的使用,可能会产生多种协议和来自多个来源的细胞。一旦生成,iPSCs的使用各种包括为多能性标记物的免疫染色,产生三种胚层,中胚状体和畸胎瘤,胚胎干细胞(ESC)和生产的嵌合体小鼠种系带或不带贡献2的基因表达与比较的试验测试。更重要的是,通过这些测试的IPSC的线,在自己的能力,还是有所不同,产生不同的分化的细胞类型2。这很难建立IPSC的推导协议,供体细胞的来源或不同的应用选择的方法是最有用的。
最严格的测试(全称为多能性)是一个干细胞系是否有足够的发展潜力,生成的所有组织需要一个有机体的生存四倍体胚胎互补(TEC)3-5。从技术上讲,TEC涉及电熔两细胞胚胎产生四倍体(4n)的单细胞胚胎,可以在体外培养到胚泡阶段6。二倍体(2n)的多能干细胞( 例如胚胎干细胞或iPS细胞),然后注入四倍体囊胚的囊胚腔中,(参见图1)传送给收件人妊娠女性的。补胚胎四倍体分量几乎完全的胚外组织(胎盘,卵黄囊),而二倍体细胞构成的胚胎,导致完全从注入的干细胞系衍生的胎儿。
最近,我们报道了推导iPSC的线,可重复生成成年小鼠通过TEC 1。这些IPSC的线产生可行的幼崽与5-13%,这是媲美胚胎干细胞3,4,7和高于大多数其他IPSC的线8-12报告的效率。这些报告显示,直接重新编程,可以产生完全匹配的胚胎干细胞的多能性iPS细胞,在其发展的潜力和效率的产生TEC试验的幼崽。目前,尚不清楚是什么区别完全多能性的iPS细胞和少强有力的线13-15。也不清楚重新编程的方法将这些行以最高的效率。在这里,我们介绍一个方法,完全多能性的iPS细胞,“所有iPSC的”老鼠,这可能有助于研究人员希望比较的多能性的IPSC的线或建立不同的重新编程方法的等价性。
研究方案
采用这种方法在研究报告中博兰等,自然 ,461,91-96(2009)。
1。制备慢病毒
该协议采用多西环素诱导的慢病毒穿梭质粒编码OCT4,SOX2,Klf4和c-Myc基因的控制下的一个TETO的反应元件。转基因被激活反向四环素反式激活蛋白,rtTAM2.2 16,诱导重新编程因子的表达在存在强力霉素。该系统可严格控制的,这些重编程因子的表达。这里所用的慢病毒载体是自我失活,因此不能复制下面的基因组整合。然而,谨慎是必需的工作时,与慢病毒BSL2(美国)和S2(欧洲)标准,并应在实验室标准的执行。
- HEK293T细胞,并通过解冻之前至少一次TRAnsfection。细胞应保持在亚汇合在HEK介质中的密度,在37℃,5%CO 2的加湿环境中。常规传代细胞,每2天,分流比为1:6-1:10。
- 种子〜8×10 6个用25毫升的HEK介质HEK293T cells/T150。每个慢病毒准备使用一个T150。
- 次日转染HEK293T细胞的磷酸钙沉淀。 (注:在我们的手中常规磷酸钙沉淀导致在80%至90%的转染效率,然而,阳离子脂质体转染试剂,如脂质体2000也可以使用)。准备两个15毫升锥形管,每个病毒的准备。的“A”和“B”标记的管子。管A,10微克的每一个:慢病毒穿梭载体编码,重新编程因子(或rtTAM2.2),病毒的包装载体,和质粒编码的病毒包膜蛋白,VSVG。加入186微升2 M 氯化钙管A,并把量为1.5毫升无菌H 2 O。管B:1.5毫升2×HBS(预温热至室温)。
- 用移液管的管A中的混合物,直到它是一个均匀的溶液。加入溶液A至溶液B的溶液,在室温下静置2-3分钟。
- 吸干HEK293T细胞的生长培养基中,并替换22毫升预先温热的HEK介质无青霉素和链霉素。
- 用移液管结合的解决方案直接向AB(磷酸钙沉淀物)HEK293T细胞,分布均匀,温和的摇摆。
- 用慢病毒转染的HEK-293T细胞24小时后,移除生长培养基中,并用25毫升新鲜,预先温热的HEK介质替换它。将转染HEKs的孵化。
- 用慢病毒转染的HEK-293T细胞48小时后,收集含有慢病毒颗粒从转染HEKs的生长介质。取出颗粒碎屑从收获的病毒溶液通过离心分离器以3,000 xg离心5分钟,在4℃下
- 通过超速离心浓缩病毒穿过唉20%蔗糖坐垫(2毫升sucrose/25毫升病毒上清)在112,000 xg离心2小时,在4℃下暂停病毒颗粒在0.4毫升MEF介质,在4°C为15-30分钟,温和的摇摆。病毒颗粒储存在单次使用的等分试样( 即 50微升),在-80℃下
2。准备重编程小鼠胚胎成纤维细胞(MEF)
注:这里列出的协议涉及的从E 13.5小鼠胚胎成纤维细胞在TEC检测中使用的iPSCs的推导。其他团体产生的所有iPSC的小鼠从成年供体细胞的来源,我们还没有测试这个方法对其他类型的细胞和供体细胞类型是不是一个因素不能确定。
- 设置鼠标定时交配。在胚胎13.5天(E13.5),安乐死怀孕的女性和解剖的胚胎从子宫角。地点和存储胚胎在1x PBS(预冷至4℃),在冰上。
- 删除的胚外组织( 即绒毛膜羊膜和胎盘)。杀头的胚胎,并拆下尾(可选 - 如果需要的基因分型)和四肢。挖出内脏,使用产钳或瓢形锅铲和剁碎的剩余胴体与刀片的手术刀或锋利的剪刀。
- 洗净剁碎胎体在5ml预冷的1×PBS。 200×g离心5分钟离心。
- 吸取上清液。挂起颗粒在5毫升0.25%胰蛋白酶-EDTA和孵育在37℃下在剧烈摇动20-30分钟。
- 加入5毫升的MEF培养基(预加热至37°C),混合并在200×g离心5分钟离心。
- 在预温MEF介质的吸出上清液,重悬沉淀。
- 板解离的MEF 2-3井预涂覆有0.1%明胶的6孔板中。这被认为是通道(1)。
- 在1:4-1:5的稀释每48小时的通道MEF中。 MEF中第3代慢病毒转导的准备。
3。推导的iPSC的行
- 慢病毒转导的前一天;种子〜3×10 5个初级的MEF成一个预先涂有0.1%明胶的6孔板中。
- 第1天:小学MEFS应该是慢病毒转导的80-90%汇合。直接添加慢病毒颗粒到MEF媒体并孵育与MEF中过夜,在37℃,5%CO 2的加湿环境中。
- 翌日(第2天)的吸液培养基中,并用3毫升的1x PBS洗两次,以除去病毒颗粒。
- 加入0.5ml已预热3-5分钟,偶尔摇摆0.25%胰蛋白酶-EDTA的细胞,置于37°C。
- 捣碎,以实现一个单细胞悬液。用光学显微镜观察细胞,以确保单细胞悬浮液。
- 入15ml的锥形管中含有5毫升MEF媒体传输的MEF。 200×g离心5分钟离心。在MEF培养基吸出上清液,轻轻重悬细胞。
- 两口井之间的6孔p平分的细胞悬液后期预涂覆有0.1%明胶。
- 来回摇动板,从一侧到另一侧,一旦在细胞均匀分布在整个以及一个圆形的运动来实现的。孵育过夜,在37℃,5%CO 2的加湿环境中。
- 第3天:重复步骤4-9除了均匀分裂细胞从一个井3口井的6孔板预先涂有0.1%明胶。这将产生6口井的转导的主要成纤维细胞。
- 第4天:添加强力霉素(DOX)的浓度为10微克/毫升到5/6井。一,应保持未经处理的作为对照。
- 添加VPA在1.9毫米至3阿霉素治疗的5口井。 VPA减少MEFs细胞的增殖率。的MEFs细胞的高密度培养容忍长时间暴露在VPA,而会合文化往往在2-5天内衰老。因此,MEFS应该是100%汇合时,VPA被添加。注意:我们使用VPA在我们的重新编程实验,因为它是已知的表观遗传修饰词,并已SH。自己,提高工作效率的影响及其机制的VPA行动,就完全多能性的iPSC的线虽然不知道IPSC的一代17。
- 第5天:吸取介质,清洗,和trypsinize细胞作为前。流路的的细胞与氧化还原/ VPA处理一个15厘米2组织培养皿预先涂有0.1%明胶和其他条件的每个预包被的10cm 2的菜在ES细胞培养基中补充有新鲜的氧化还原和VPA。
- 补充细胞每天新鲜的DOX和VPA ESC培养基。 ESC样集落〜7天的DOX / VPA治疗后〜10日在阿霉素单独治疗后开始出现。不的殖民地应该出现在阿霉素治疗的情况下。
- 一旦殖民地拥有一个光明的折射,以及自定义的边界,并包含30-50细胞,手动隔离的殖民地,与凝胶装载移液器吸头和转移到一个U型底的96孔板中含有20微升00.25%胰蛋白酶-EDTA。 Trypsinize单细胞转移到饲养者在平底96孔板150μLESC培养基中阿霉素/ VPA单独或阿霉素。
- 继续克隆扩大ESC介质隔离iPSC的馈线线。删除DOX和VPA后第19天加(转导后第23天)。丢弃iPSC的行不保持自我更新或类似ESC控制的增殖率。
这可能是有帮助的iPSC的线,然后再尝试执行TEC关系到胚胎干细胞的特点。我们我们的生产线的特点:1)表达的内源性细胞多能性标志物(SSEA-1,OCT4,SOX2,NANOG)的免疫细胞化学,2)染色体核型分析,染色体计数和3)胚体形成。此外,也可以执行慢病毒特异性RT-的qPCR确认原病毒的外源基因的iPS细胞中不表达的。然而,我们已经确定了完全多能性iPS细胞的形态学,免疫组化及核型ING。在我们的实验中,选择的iPSC的ESC般的形态和生长特征的结果在大多数的多能性标志物的表达上线,而我们通常确定了几个潜在的异常染色体核型。
4。制备iPS细胞囊胚注射
已被证明的PSC线的传代次数,以影响其多能性的18,虽然这可能是线路依赖19。我们从通道8-14产生成人ALL-iPSC的小鼠的iPS细胞。
- 解冻iPSCs和馈线ESC介质板。流路的的细胞至少一次注射使用前馈线。
- 一个阱的6孔板中,含有70%至80%汇合的iPS细胞,将提供多注射足够数量的细胞。吸干〜3毫升1×PBS(不含Ca 2 + / Mg 2 +的 )的生长培养基中,并洗涤细胞。
- 加入0.5ml预热的0.05%胰蛋白酶-EDTA的细胞和在37℃下孵育10分钟,偶尔摆动。
- 捣碎,以实现一个单细胞悬液。用光学显微镜观察细胞,以确保单细胞悬浮液。 iPSCs的需要是单细胞悬液,菌落/细胞聚集会堵塞注射针。
- 单细胞悬液后,本实现中,加入1.0毫升ESC媒体以及返回板块的37℃培养箱中培养。孵育〜15分钟或直到大部分馈线开始附着。
- 轻轻地取出培养基中的iPSCs的照顾,不打跑了弱附着的馈线。
- 在15毫升锥形管中含有5毫升ESC介质,将iPS细胞。 200×g离心5分钟离心。吸取上清,用微量吸移管除去剩余的ES细胞培养基中。点选管撞出颗粒,轻轻悬浮细胞在0.2-0.5毫升预冷FHM介质中。商店并在冰上,直到细胞注射进四倍体blastocysts。
5。四倍体囊胚的产生
本节中执行的程序已经描述了详细其他地方5,6,20。在这里,我们列出了我们的技术,优化BTX电电池机器人的ECM 2001年。
- 吸23-28日龄雌性小鼠(C57BL/6J-Tyr C-2J / BALB / cByJ的F1)与PMS和HCG的胚胎供体小鼠。在下午2点,5 IU的HCG 47小时后管理5 IU的PMS。注射HCG后,将雌性小鼠与C-2J C57BL/6J-Tyr / BALB / cByJ的F1螺柱男性。检查翌日阴道塞。
- 安乐死插入雌性小鼠,收集输卵管。收集1 - 细胞胚胎,,通过将输卵管FHM与透明质酸酶,轻轻地撕裂ampulae。允许积云群众坐在FHM /透明质酸酶5-7分钟。
- 收集1 - 细胞胚胎,用口吸液管和冲洗通过滴FHM媒体之前将它们放置在KSOM-AA的文化。文化在37°C,5%CO 2在矿物油通宵和选择2 -细胞胚胎电融合,放弃所有其他的胚胎。
- 放置在一个10厘米的陪替氏培养皿中的BTX的MicroSlide。倒入足够的空间,温度的电熔媒体到淹没在溶液中的幻灯片,但没有那么多极的电极被完全淹没。
- 切换ECM 2001年和的BTX增强400。 ECM的连接的线缆到的的MicroSlide的电极和固定电缆在一旁的培养皿中,以防止意外运动的幻灯片。
- 运行一个手动脉冲,以得到的BTX增强剂上的读数,并注意的电压被施加的AC / DC电流。交流电流控制时的速度的胚胎将电极之间的对齐,直流电流将融合卵裂球,和脉冲时间设置的直流脉冲的长度。一个很好的出发点是:3V AC,DC 100V,时间0.05毫秒。的最佳的DC在90-150伏的范围内变化。
- 用口吸管,以30-40的2 - 细胞胚胎从KSOM-AA文化,并把它们洗干净的电液数滴。绘制新鲜的的电熔媒体的MicroSlide菜放入口中吸液管和胚胎洗。将它们放置在电极上的MicroSlide 1毫米之间的差距。要小心,它们对齐下来的中间的空隙中,并且它们不彼此接触。
- 应用交流电流通过按下手动脉冲按钮。胚胎将在交流电场中的旋转,直到卵裂球接触的平面是平行于电极。如果没有对准在几秒钟,胚胎被,增加交流设置。
- 胚胎对齐后,按手动脉冲按钮,再次申请的直流脉冲。
- 电熔介质中的吸液管,收集的胚胎的的MicroSlide的。 KSOM-AA数滴洗净胚胎,并将其置于KSOM-AA文化在37°C,5%CO 2。卵裂球融合翔的ULD完成,在不到30分钟的文化。
- 重复步骤7-11,剩余的2 - 细胞胚胎。融合后,监视和选择融合卵裂球的胚胎。成功融合胚胎会出现在1 - 细胞阶段。 30分钟后,在文化,丢弃裂解和2 - 细胞胚胎。如果融合率是80%以下,增加电压和/或时间的增量5V和0.01毫秒。如果裂解是在20%以上,降低直流电压和/或时间。在我们的实验中的最佳设置为直流146V,AC 4V,和0.07毫秒。这些设置始终得到90%或更高的融合率很少或根本没有裂解。
- 继续文化KSOM-AA在微滴根据矿物油中的稠合的胚胎在37℃下,5%CO 2。您应该期望的融合胚胎的85%-95%,,形成四倍体(4N)囊胚培养48小时后。
6。到四倍体囊胚显微注射iPS细胞
我们使用尼康TE-2000U倒置显微镜配备了DIC的光学和成茂显微操作囊胚注射。每个四倍体囊胚注射10-12 iPSCs的使用标准的协议为ESC注入到小鼠囊胚已被证明在以前的朱庇特出版5,20,21
- 放置在中心的凹显微镜载玻片20微升FHM的下降,并用150微升矿物油覆盖。
- 降低拿着吸管及显微注射针进入FHM下降。允许部分填充FHM 2-3分钟为针。
- 20-30四倍体囊胚洗净滴FHM和转让的显微镜载玻片上的的FHM下降的。
- 口吸管的IPSC的混合成的下降。这可能是必要的,以稀释在下拉FHM的预先如果细胞过于集中或聚集的细胞混合物。
- 拿起100-200细胞与注射针。
- 在9点钟断定,保持囊胚的内细胞团离子。注入到囊胚细胞穿透透明带和滋养层细胞在3点钟的位置。注入16-18每囊胚细胞。
- 回到iPSC的补充囊胚的KSOM-AA文化。
7。补四倍体囊胚转移到受体小鼠的子宫角
雌性受体小鼠转移到子宫角手术补四倍体囊胚根据研究员的研究所的指导原则,使用标准的技术,我们将简要地总结。选择在发情期的雌性CD-1小鼠,并将它们设置为与输精管结扎的男性的交配。检查阴道塞第二天早晨。女性子宫胚胎移植后的两天插头(2.5 DPC)的准备。
前一天与输精管结扎的男性交配的雌性受体,建立额外的CD-1与非输精管结扎男性女性要用作养母IPSC的所有小鼠剖腹产检索。
8。剖腹产手术的培养和iPSC的衍生小狗
的TC胚胎的转移通常的查询结果在多个植入后的再吸收,即使IPSC的或ESC线具有高的发展潜力。因此,可以预计不超过4个可行的幼崽(一般为1-2)每个收件人。这些小的窝通常是被忽略的收件人。为了提高新生儿护理水平和成活率,我们进行剖腹产,促进根据标准协议20。要进行剖腹产,安乐死受体小鼠胚胎移植后第16天,在下午8时(收件人18.5 DPC)和解剖幼崽从子宫角。 CD-1,交付窝的母亲在同一天培育可行的幼崽。
结果
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
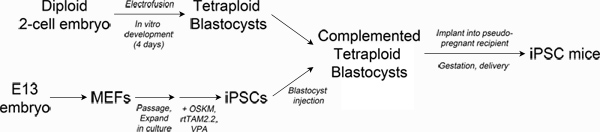
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
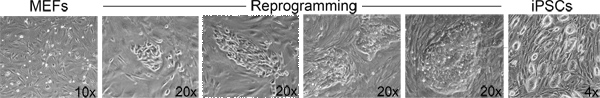
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
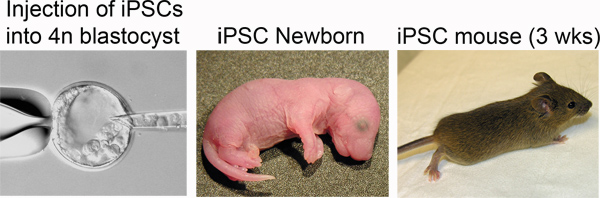
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
讨论
生成小鼠iPSC的使用TEC检测线的多能性的iPSC的行提供了一个严格的功能测试。此测试可能是有用的,以评估不同的重编程方法的相对功效或识别IPSC的线,可能是最有用的,用于产生某些类型的细胞在体外 。可使用产生的iPS细胞的小鼠的长期稳定性和IPSC的衍生的组织中的致瘤性的严格的测试。向调查人员希望完全多能性的iPSC的线或iPSC的小鼠或比较不同的重新编程方法的相对效用,此协议将是有益的。
完全多能性的iPS细胞的产生和识别的机制,控制仍然知之甚少,它是可能的一些的IPSC的线产生使用此方法,将无法通过TEC测试。许多因素可能会有所不同实验包括遗传背景,模式慢我慢病毒滴度,nsertion,细胞周期的供体人群的参数,实验室间差异的TEC程序的各个步骤和可变iPSCs的倾向怀有遗传或后生像差。为了更好地确保成功,我们照顾到建立适当的慢病毒基因的表达水平在IPSC的推导实验通过测试的控制MEFs中的病毒稀释,以确保充分集中,每个病毒检测基因的表达至少80%,而理想的100%的MEF中。这使我们能够识别不同的慢病毒的多个副本,同时限制线的MEF中的毒性和过度拥挤的情况下水井的殖民地。应当指出,已被示出,以产生多个其他协议iPSCs的充分发展潜力,用多种方法和供体细胞的来源,这表明可能存在的所有的多能性的多个路径1,8-13,15。然而,目前没有明确的生物标志物的完全多能性的IPSC的已被确定,,因此TEC检测iPSC的线是否可以生成所有的细胞系在生物仍然是黄金标准测试。
披露声明
没有利益冲突的声明。
致谢
支持KKB,MJB,JLH和九龙提供了由美国加州再生医学研究所,皮尤慈善信托基金会生物医学学者奖励计划“,”以斯帖B.奥基夫家庭基金会和夏皮罗家庭基金会。 KKB是一个Donald E.和德丽雅二巴克斯特基金会的学院学者。
材料
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
参考文献
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。