Method Article
דור של עכברים שמקורם בתאי גזע pluripotent מושרים
In This Article
Summary
תאי גזע pluripotent מושרה קווים מניבים (iPSC) מייצרים שורות של פוטנציאל ההתפתחותי שונים גם כאשר הם עוברים בדיקות תקן לpluripotency. כאן אנו מתארים פרוטוקול לייצר עכברים נגזרים לחלוטין מiPSCs, המגדיר את קווי iPSC כבעל pluripotency המלא 1.
Abstract
ייצור תאי גזע pluripotent מושרים (iPSCs) מתאים הסומטיים מספק אמצעי ליצירת כלים רבי ערך למחקר בסיסי ויכול גם לייצר מקור של תאי חולו מותאם לטיפולי התחדשות. iPSCs יכול להיות שנוצר תוך שימוש בפרוטוקולים מרובים ונובע ממקורות סלולריים מרובים. נוצר רגע, iPSCs נבדק תוך שימוש במגוון של מבחנים כוללים immunostaining לסמני pluripotency, דור משלוש שכבות ניבטות בגופי embryoid וteratomas, השוואות של ביטוי גנים בתאי גזע עובריים (ESCs) וייצור של עכברי chimeric עם או בלי תרומת germline 2 . חשוב לציין, קווי iPSC שעוברים בדיקות אלה עדיין משתנים וביכולת שלהם לייצר סוגי תאים מובחנים שונים 2. זה עשה את זה קשה לקבוע שפרוטוקולי iPSC גזירה, מקורות תא תורם או שיטות בחירה הם שימושיים ביותר ליישומים שונים.
המבחן המחמיר ביותרלשאלה אם קו תאי גזע יש פוטנציאל ההתפתחותי מספיק כדי לייצר את כל הרקמות דרושות להישרדותו של אורגניזם (מכונה pluripotency המלא) הוא complementation העובר tetraploid (TEC) 3-5. מבחינה טכנית, TEC כרוך electrofusion של עוברי שני תאים לייצר (4n) עוברי 1 תאי tetraploid שניתן בתרבית במבחנה לשלב הבלסטוציסט 6. (2n) תאי גזע pluripotent (דיפלואידי ESCs או iPSCs למשל) לאחר מכן, מוזרקים לתוך חלל blastocoel של הבלסטוציסט tetraploid והועברו לנקבת נמען להריון (ראה תרשים 1). מרכיב tetraploid של העובר השלים תורם באופן כמעט בלעדי לרקמות extraembryonic (שליה, צק חלמון), ואילו תאים דיפלואידיים מהווים את העובר תקין, וכתוצאה מכך עובר נגזר לחלוטין משורת תאי הגזע מוזרקת.
לאחרונה, דיווח הגזירה של קווי iPSC שreproducibly לייצר עכברים בוגריםדרך 1 TEC. קווי iPSC אלו מעוררים גורי קיימא עם יעילות של 5-13%, אשר ניתן להשוות ESCs 3,4,7 וגבוה מזה שדווח עבור רוב קווי iPSC אחרים 8-12. דיווחים אלו מראים כי תכנות מחדש ישיר יכול לייצר iPSCs pluripotent שתואם באופן מלא את הפוטנציאל שלהם בESCs התפתחותית והיעילות של יצירת גורים בבדיקות TEC. נכון לעכשיו, לא ברור מה מבדיל בין iPSCs pluripotent מלא וקווים פחות עוצמתיות 13-15. זה גם לא ברור אילו שיטות תכנות מחדש תהיינה לייצר שורות אלה עם היעילות הגבוהה ביותר. כאן אנו מתארים שיטה אחת שמייצרת iPSCs pluripotent מלא ועכברים "כל iPSC", שעשוי להיות מועילים עבור חוקרים המבקשים להשוות pluripotency של קווי iPSC או להקים את השקילות של שיטות שונות תכנות מחדש.
Protocol
שיטה זו הייתה בשימוש במחקר דיווח בולנד et al. טבע. 461, 91-96 (2009). 1
1. הכנת lentivirus
פרוטוקול זה מעסיק וקטורי הסעות lentiviral דוקסיציקלין-מושרה שמקודדים לOct4, Sox2, Klf4, ו-c-Myc תחת שליטה של אלמנט תגובת TETO. Transgenes מופעלים על ידי החלבון ההפוך טטרציקלין טרנס המפעיל, rtTAM2.2 16, שגורם לביטוי גורם תכנות מחדש בנוכחות דוקסיציקלין. מערכת זו מאפשרת לביטוי פיקוח הדוק, גבוה של גורמי תכנות מחדש. וקטורי lentiviral משמשים כאן הם עצמיים inactivating ולכן לא ניתן לשכפל אינטגרציה הגנומי הבאה. עם זאת, זהירות נדרשת בעת עבודה עם lentiviruses ויש לבצעו במעבדות תואמות עם BSL2 (ארה"ב) וסטנדרטי S2 (אירופה).
- הפשר תאי HEK293T ומעבר לפחות פעם אחת לפני transfection. תאים צריכים להישמר בצפיפות subconfluent במדיום HEK על 37 מעלות צלזיוס, 5% CO 2 בסביבת humidified. באופן שגרתי תאי מעבר כל 2 ימים עם יחס פיצול של 1:06-01:10.
- זרעים ~ 8 x 10 6 HEK293T cells/T150 עם מדיום 25 מ"ל HEK. השתמש באחת T150 עבור כל הכנת lentivirus.
- התאים הבאים יום transfect HEK293T ידי משקעי סידן פוספט. (הערה: בידות שלנו משקעי סידן פוספט שגרתי תוצאת 80-90% יעילות transfection, אולם ריאגנטים transfection שומני קטיוני כגון Lipofectamine 2000 עשויים לשמש גם). להכין שני צינורות חרוטים 15 מ"ל לכל וירוס כדי להיות מוכנים. תייג את הצינורות "A" ו "B". צינור, 10 מיקרוגרם של כל אחד: גורמי lentiviral הסעות וקטור קידוד תכנות מחדש (או rtTAM2.2), וקטורים הנגיפיים אריזה, וקידוד פלסמיד חלבון המעטפת הנגיפי, VSVg. הוסף 186 μl ז 2 CaCl 2 ל Tube, ולהביא את הנפח ל -1.5 מ"ל עם H 2 O סטרילי. הצינור B: 1.5 המ"ל 2x HBS (טרום חמם לטמפרטורת חדר).
- פיפטה את התערובת בצינור עד שהוא פתרון הומוגני. הוסף פתרון לפתרון B dropwise ולתת לעמוד בטמפרטורת חדר במשך 2-3 דקות.
- לשאוב מדיום גידול של תאי HEK293T ולהחליף עם מדיום 22 מ"ל מראש התחמם HEK בלי פניצילין וסטרפטומיצין.
- פיפטה המשולבת א.ב. הפתרונים (משקע סידן פוספט) ישירות לHEK293T תאים ולהפיץ באופן שווה על ידי נענוע.
- 24 שעות לאחר transfection של תאי HEK-293T עם lentivirus, להסיר מדיום גידול ולהחליף אותו עם 25 מ"ל של מדיום HEK טרי, מראש התחמם. תשואת HEKs transfected לחממה.
- 48 שעות לאחר transfection של תאי HEK-293T עם lentivirus, לאסוף תקשורת צמיחה המכילה חלקיקי lentiviral מHEKs transfected. להסיר שאריות חלקיקים מהתמיסה הנגיפית נקטפה על ידי צנטריפוגה XG ב 3000 למשך 5 דקות ב 4 ° C.
- להתרכז וירוס על ידי ultracentrifugation throאיכס 20% כרית סוכרוז (2 מ"ל sucrose/25 supernatant הנגיפי מ"ל) עבור 2 שעות ב112.000 XG ב 4 ° C. להשעות גלולה נגיפית במדיום 0.4 מ"ל MEF ב 4 מעלות צלזיוס במשך 15-30 דקות עם נדנדה עדינה. אחסן חלקיקים נגיפיים בaliquots שימוש היחיד (50 μl כלומר) ב-80 ° C.
2. הכנת פיברובלסטים עכבר עוברי (MEF) לתכנות מחדש
הערה: הפרוטוקול המתואר כאן מתייחס לגזירה של iPSCs מ13.5 פיברובלסטים עובריים של עכבר E לשימוש במבחני TEC. בעוד קבוצות אחרות יצרו עכברים כל iPSC ממקורות תא תורם למבוגרים, אנחנו עדיין לא נבחנו בשיטה זו בתאים מסוגים אחרים, ולא יכולות להיות בטוח שסוג תא תורם אינו גורם.
- הגדרת הזדווגויות מתוזמנים עכבר. ביום עוברי 13.5 (E13.5), להרדים את הנקבה בהריון ולנתח את העוברים מקרני הרחם. מקום ועוברים בחנות 1x PBS (טרום צונן עד 4 ° C) על קרח.
- הסר את רקמות extraembryonic (כלומרהסיסי, amnion ושליה). לערוף את העובר ולהסיר את הזנב (אופציונלי - אם יש צורך לgenotyping) וגפיים. מרוקן מהאיברים הפנימיים, מלקחיים או באמצעות מרית הסקופ צורה ולרכך את הפגר שנותר עם הלהב של מספרי אזמל או חדה.
- שטוף את הפגר הטחון ב5 המ"ל 1x PBS מראש מצונן. צנטריפוגה XG ב 200 למשך 5 דקות.
- לשאוב supernatant. להשעות גלולה ב 5 המ"ל 0.25% טריפסין-EDTA ולדגור על 37 מעלות צלזיוס עם הרעד נמרץ למשך 20-30 דקות.
- הוסף 5 מ"ל של מדיום MEF (מראש חמם עד 37 מעלות צלזיוס), לערבב וצנטריפוגה XG ב 200 למשך 5 דקות.
- לשאוב supernatant ו resuspend גלולה במדיום MEF מראש מחומם.
- הצלחת MEFs ניתק ב 2-3 בארות של צלחת מראש מצופית עם 0.1% ג'לטין 6-כן. זה נחשב קטע 1.
- המעבר MEFs בדילול 1:04-01:05 כל 48 שעות. MEFs בחלוף 3 מוכן לתמרת lentiviral.
3. גזירה של קווי iPSC
- היום לפני תמרת lentiviral; זרע ~ 3 x 10 5 MEFs העיקרי לטיפוס אחד מוכר היטב של צלחת מראש מצופית עם 0.1% ג'לטין 6-כן.
- יום 1: היסודי MEFs צריכה להיות confluent 80-90% לתמרת lentiviral. הוסף חלקיקי lentiviral ישירות לMEF תקשורת ולדגור עם MEFs לילה על 37 מעלות צלזיוס, 5% CO 2 בסביבת humidified.
- למחרת (יום 2) לשאוב הבינוני ולשטוף פעמים עם 3 מ"ל של 1x PBS להסיר חלקיקים נגיפיים.
- הוסף 0.5 מ"ל מראש חמם 0.25% טריפסין-EDTA לתאים ולדגור על 37 ° C במשך 3-5 דקות עם נדנדה מזדמנת.
- Triturate להשיג השעית תא בודד. ציית לתאים על ידי מיקרוסקופ אור כדי להבטיח השעית תא בודדה.
- העברת MEFs לתוך צינור חרוטים 15 מ"ל המכיל 5 מ"ל MEF תקשורת. צנטריפוגה XG ב 200 למשך 5 דקות. לשאוב את תאי supernatant ועדינות resuspend במדיום MEF.
- באופן שווה לפצל את השעית התא בין שתי בארות של 6 עמ היטבמאוחר מראש מצופה עם 0.1% ג'לטין.
- Rock הצלחת קדימה ואחורה, מצד לצד, ופעם בתנועה סיבובית כדי להשיג חלוקה שווה של תאים לאורך הבאר. דגירת הלילה על 37 מעלות צלזיוס, 5% CO 2 בסביבת humidified.
- יום 3: חזור על שלבי 4-9 אלא לפצל את התאים באופן שווה מטיפוס אחד המוכר היטב ל3 בארות מראש מצופית 6 צלחת היטב עם 0.1% ג'לטין. זה יניב 6 בארות של transduced fibroblasts הראשוני.
- יום 4: הוסף דוקסיציקלין (DOX) בריכוז של 10 מיקרוגרם / מ"ל לבארות 5/6. אחד גם צריך להישאר מטופל לשמש כשליטה.
- הוסף VPA ב1.9 מ"מ עד 3 מתוך 5 הבארות שטופלו בDOX. VPA מפחית את שיעור ההתפשטות של MEFs. תרבויות הצפופות של MEFs לסבול חשיפה ממושכת לVPA אילו תרבויות subconfluent נוטות להזדקן תוך 2-5 ימים. לכן, צריך להיות MEFs confluent 100% כאשר VPA הוא הוסיף. הערה: אנו משתמשים בניסויי VPA reprogramming כי זה צירוף epigenetic ידוע, וכבר shכדי להגדיל את היעילות של דור iPSC 17 למרות ההשפעות ומנגנוני פעולה של VPA ביחס ליצירת קווי iPSC pluripotent מלא אינן ידועות.
- יום 5: לשאוב את המדיום, לשטוף וtrypsinize התאים כמו בעבר. מעבר התאים שטופלו בDOX / VPA לצלחת 15 סנטימטר 2 רקמות תרבות מראש מצופית עם 0.1% ג'לטין וכל אחד מהמצבים האחרים ל10 סנטימטרים מראש מצופים 2 מנות במדיום תאי גזע עוברי בתוספת DOX הטרי וVPA.
- לחדש את התאים כל יום עם מדיום ESC השלים עם DOX הטרי וVPA. מושבות ESC דמויים תתחלנה להופיע לאחר ~ 7 ימים בטיפול DOX / VPA ואחרי ~ 10 ימים בטיפול לבד DOX. אין מושבות אמורות להופיע בהיעדר טיפול DOX.
- ברגע שיש מושבות שבירה בהירה, גבול מוגדר היטב ומכילות 30-50 תאים, באופן ידני לבודד את המושבות בקצה ג'ל טעינת פיפטה ומעבירה לצלחת U-96 תחתונה היטב המכילה 20 μl של 0.25% טריפסין-EDTA. Trypsinize לתאים בודדים ולהעביר למתקני האכלה בצלחת שטוחה תחתונה 96 גם במדיום ESC μl 150 המכיל DOX / VPA או DOX לבד.
- המשך clonally להרחיב את קווי iPSC המבודדים על מתקני האכלה במדיום ESC. הסר DOX וVPA ביום 19 אחרי בנוסף (יום לאחר התמר 23). השלך קווי iPSC שאינו מקיימים התחדשות עצמית או שיעורי הפצה דומים לפקדי ESC.
זה עשוי להיות מועיל כדי לאפיין קווי iPSC, ביחס לESCs לפני שאנסה לבצע TEC. יש לנו הקווים שלנו מאופיינים על ידי 1) ביטוי של סמנים אנדוגניים pluripotency (SSEA-1, Oct4, Sox2, Nanog) על ידי immunocytochemistry, 2) ניתוח קריוטיפ ידי ספירה וכרומוזום 3) היווצרות הגוף embryoid. אפשר גם לבצע lentiviral הספציפי RT-qPCR כדי לוודא שtransgenes proviral אינו באות לידי הביטוי בiPSCs. עם זאת, זיהיתי iPSCs pluripotent מלא רק באמצעות מורפולוגיה, immunostaining וkaryotyping. בניסויים שלנו, בחירה של קווי iPSC מבוססים על ESC-כמו מורפולוגיה ותוצאות מאפייני צמיחה ברוב הקווים המבטאים סמני pluripotency בזמן שאנחנו בדרך כלל לזהות כמה קווים עם karyotypes פוטנציאל חריג.
4. הכנה להזרקת iPSCs הבלסטוציסט
מספר המעבר של קו PSC הוכח להשפיע 18 pluripotency אם כי זה עשוי להיות תלוי 19 קו. יש לנו להשתמש iPSCs של קטעים מ8-14 לייצר עכברים בוגרים כל iPSC.
- iPSCs הפשרה ועל מתקני האכלה בצלחת בינונית ESC. מעבר התאים לפחות פעם אחת על מתקני האכלה לפני השימוש להזרקה.
- אחד טוב של צלחת 6-גם מכילה iPSCs confluent 70-80% יספק יותר מכמות מספקת של תאים להזרקה. לשאוב מדיום גידול ולשטוף את התאים עם ~ 3 המ"ל 1x PBS (ללא Ca 2 + / Mg 2 +).
- הוסף 0.5 0.05% מראש התחממו מיליליטר טריפסין-EDTA לאת התאים ולדגור על 37 מעלות צלזיוס למשך 10 דקות עם נדנדה מזדמנת.
- Triturate להשיג השעית תא בודד. ציית לתאים על ידי מיקרוסקופ אור כדי להבטיח השעית תא בודדה. את iPSCs צריך להיות בהשעית תא בודדה כמושבות / אגרגטים תא תסתומנה פיפטה ההזרקה.
- לאחר השעית תא בודדה שבן הושגה, הוסף 1.0 מיליליטר ESC התקשורת לטובה ולהחזיר את הצלחת ל37 מעלות צלזיוס החממה. דגירה במשך ~ 15 דקות או עד שרוב מתקני ההאכלה החלו לדבוק.
- בעדינות להסיר את המדיום המכיל את iPSCs מקפיד לא כדי לסלק את מתקני האכלת חולשת החסיד.
- הנח את iPSCs בצינור חרוטים 15 מ"ל המכיל 5 מ"ל בינוני ESC. צנטריפוגה XG ב 200 למשך 5 דקות. לשאוב supernatant ולהסיר את השארית בינונית תאי גזע עוברי עם micropipette. קש הצינור כדי לסלק את הגלולה ותאי עדינות resuspend במדיום FHM 0.2-0.5 מ"ל מראש מצונן. תאי חנות על קרח עד ובמהלך ההזרקה לתוך tetraploid בlastocysts.
5. דור של בלסטוציטים Tetraploid
פרוצדורות שבוצעו בסעיף זה תוארו בפירוט במקום אחר 5,6,20. כאן אנו מתארים הטכניקה שלנו, המותאמת למניפולטור התא אלקטרו BTX ECM 2001.
- הגדרת עכברים תורמים עובר על ידי 23-28 עכברי עירור יום ישנים נשיים (C57BL/6J-Tyr c-י 2 / BALB / cByJ F1) עם PMS וHCG. לנהל 5 IU של PMS ביחב"ל 02:00 ו5 של 47 שעתי HCG מאוחר יותר. לאחר הזרקת HCG, להגדיר נקבות עכברים עם זכרי הרבעת F1 C57BL/6J-Tyr c-י 2 / BALB / cByJ. בדקו למחרת היום לתקעי נרתיק.
- להרדים פקוק נקבות עכברים ולאסוף oviducts. לאסוף עוברים 1-סלולריים על ידי נחת oviducts בFHM עם Hyaluronidase ועדינות לקרוע ampulae. לאפשר להמוני קומולוס לשבת בFHM / Hyaluronidase לדקות 5-7.
- לאסוף עוברים 1-סלולרי באמצעות פיפטה פה ולשטוף באמצעות טיפין של תקשורת FHM לפני הכניס KSOMהתרבות-AA. תרבות על 37 מעלות צלזיוס, 5% CO 2 תחת שמן מינרלי לילה ובחר עוברים 2-תא יום electrofusion, למחוק את כל העוברים האחרים.
- הנח Microslide BTX בצלחת פטרי 10 סנטימטרים. יוצק תקשורת electrofusion טמפרטורת חדר מספיק כדי להטביע את השקופית בפתרון, אבל לא עד כדי כך שהקטבים של האלקטרודה הם שקועים לחלוטין.
- הפעל ECM 2001 וBTX Enhancer 400. לחבר את הכבלים של ECM לאלקטרודה של microslide ולתקן את הכבלים לצד של צלחת פטרי כדי למנוע תנועה לא מכוונת של השקופית.
- הפעל דופק ידני אחד כדי לקבל את קריאה על BTX משפר ורשום את המתח של זרמי AC / DC מיושמים. AC הנוכחי יהיה לשלוט על המהירות שבה העוברים יהיו ליישר בין האלקטרודות, DC הנוכחי יתיך את לסטומרים, וזמן דופק יהיה להגדיר את משך דופק DC. נקודת התחלה טובה היא AC 3V, DC 100V, ושעת 0.05 אלפיות שני. DC האופטימלי משתנה בטווח של 90-150 וולט.
- באמצעות פיפטה פה, לקחת על עוברי 30-40 שני תאים מתרבות KSOM-AA ולשטוף אותם באמצעות מספר טיפין של מדיום electrofusion. צייר תקשורת electrofusion הטריה מצלחת microslide לתוך פיפטה פה ולקחת עוברים מן הכביסה. למקם אותם בפער 1 המ"מ בין האלקטרודות על microslide. היזהר שהם מיושרים למטה באמצע את הפער ושהם אינם נמצאים בקשר אחד עם השני.
- החל AC נוכחי על ידי לחיצה על כפתור הדופק הידני. העוברים יסתובבו בתחום החשמל, עד שהמטוס של מגע blastomere מקביל לאלקטרודות. אם עוברים לא מיושרים בכמה שניות, להגדיל את הגדרת ה-AC.
- לאחר שהעוברים מיושרים, לחץ על כפתור הדופק הידני שוב כדי להחיל את דופק DC.
- עם מדיום electrofusion בפיפטה, לאסוף את העוברים מmicroslide. שטוף את העוברים באמצעות מספר טיפין של KSOM-AA ולמקם אותם בתרבות KSOM-AA על 37 מעלות צלזיוס, 5% CO 2. Blastomere ההיתוך should יושלם בפחות מ 30 דקות בתרבות.
- חזור על שלבים 7-11 להישארות עוברים 2-סלולריים. אחרי קבוצות ההיתוך הבאות, לפקח ובחר עוברים עם לסטומרים התמזגו. עוברים התמזגו בהצלחה יופיעו להיות בשלב 1-תא. השלך עוברי lysed ו2-תא לאחר 30 דקות בתרבות. אם שיעור ההיתוך הוא מתחת 80%, להגדיל את המתח ו / או זמן במרווחים של 5 וולט ו0.01 אלפיות שניות. אם תמוגה היא מעל 20%, תפחית את מתח DC ו / או זמן בהתאם. את ההגדרות האופטימליות בניסויים שלנו היו 4V AC, DC 146V, ו0.07 אלפיות שניים. הגדרות אלה עקביות הניבו 90% או שיעורי היתוך גבוהים יותר עם מעט או ללא תמוגה.
- המשך לתרבות עוברים התמזגו בmicrodrops של KSOM-AA תחת שמן מינרלים על 37 מעלות צלזיוס, 5% CO 2. אתה צריך לצפות 85-95% מעוברים התמזגו ליצירת tetraploid בלסטוציטים (4n) לאחר 48 שעות של דגירה.
6. Microinjection של iPSCs לבלסטוציטים Tetraploid
אנו משתמשים בניקון TE-2000Uמיקרוסקופ ההפוך מצויד באופטיקה DIC וmicromanipulators Narishige להזרקת הבלסטוציסט. כל הבלסטוציסט tetraploid מוזרק עם 10-12 iPSCs באמצעות פרוטוקול סטנדרטי להזרקה לתוך ESC בלסטוציטים עכבר שכבר הפגין בפרסום קודם יופיטר 5,20,21
- הנח טיפת μl 20 של FHM במרכז שקופית מיקרוסקופ קעורה ולכסות אותו עם 150 μl של שמן מינרלים.
- מנמיך את פיפטה מחזיקה ומחט microinjection לירידת FHM. כעבור 2-3 דקות עבור שתי המחטים לאופן חלקי למלא עם FHM.
- שטוף 20-30 בלסטוציטים tetraploid דרך טיפין של FHM והעברה לירידת FHM בשקופית מיקרוסקופ.
- תערובת פי פיפטה iPSC לירידה. ייתכן שיהיה צורך לדלל את התערובת בתא ירידה של FHM מראש אם תאים מרוכזים מדי או מצטברים.
- להרים 100-200 תאים עם מחט הזריקה.
- החזק את הבלסטוציסט עם מסת התאים הפנימיות במניח השעה 9יון. הזרק תאים לתוך blastocoel על ידי חדירת המעטפת השקופה וtrophoblast בכיוון השעה 3. להזריק 16-18 תאים להבלסטוציסט.
- תשואת בלסטוציטים השלים iPSC לתרבות KSOM-AA.
7. העברת בלסטוציטים Tetraploid משלים לקרני הרחם של עכברי נמען
בלסטוציטים tetraploid השלים מועבר בניתוח לקרני הרחם של עכברי נמען נשיים על פי ההנחיות של המכון של החוקר, תוך שימוש בטכניקה 20 הסטנדרטית שאנחנו צריכים לסכם בקצרה. בחר נקבות עכברי CD-1 בשלב פרו הייחום ובונה אותם להזדווגות עם זכרים עוקרו. בדקו לתקעי נרתיק למחרת בבוקר. נקבות מוכנות להשתלת עוברים ברחם ימים אחרי התקע זוהה (2.5 DPC).
יום אחד לפני נקבות נמען הזדווגו עם זכרים עוקרו, להגדיר נקבות נוספות תקליטור-1 עם זכרים שאינם עוקרוכדי לשמש כאמהות אומנות לעכברים כל iPSC נשלפו בניתוח קיסרי.
8. ניתוח קיסרי וטיפוח של Pups iPSC-derived
ההעברה של עוברי TC בדרך כלל תוצאות בresorptions המרובה לאחר ההשתלה, גם אם iPSC או ESC הקו יש פוטנציאל התפתחות גבוהה. כתוצאה מכך, ניתן לצפות שלא יותר מ 4 גורי קיימא (בדרך כלל 1-2) לנמען. המלטות קטנות אלה בדרך כלל מוזנחות על ידי נמענים. כדי להגדיל את רמת הטיפול בילוד ואת שיעור ההישרדות, אנחנו מבצעים ניתוחים קיסריים וטיפוח על פי 20 הפרוטוקולים הסטנדרטיים. כדי לבצע ניתוח הקיסרי, להרדים עכברי נמען 16 ימים לאחר חזרת עוברים ב7-08:00 (הנמען 18.5 DPC) ולנתח את גורים מקרני הרחם. פוסטר גורי קיימא ל- 1 CD אמהות שהמלטות נמסרו באותו היום.
תוצאות
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
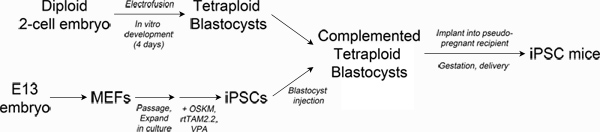
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
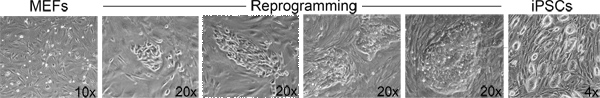
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
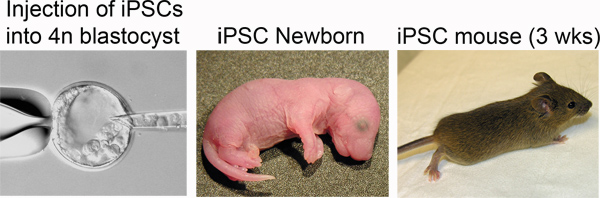
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discussion
עכברים שהניבו מקווי iPSC באמצעות מבחני TEC מספקים מבחן פונקציונלי מחמיר לpluripotency של קו iPSC. בדיקה זו עשויה להיות שימושית כדי להעריך את היעילות היחסית של שיטות שונות תכנות מחדש או לזהות קווי iPSC שעשויה להיות שימושיים ביותר ליצירת תאים מסוגים מסוימים במבחנה. עכברים שנוצרו מiPSCs ניתן להשתמש בקפדנות על מנת לבחון את היציבות לטווח ארוך וtumorigenicity של רקמות iPSC נגזרות. פרוטוקול זה יהיה שימושי לחוקרים המעוניינים לייצר קווי iPSC pluripotent מלא או עכברי iPSC או להשוות את התועלת היחסית של שיטות שונות תכנות מחדש.
את המנגנונים ששולטים הדור וזיהוי של iPSCs pluripotent מלא יישארו הבין היטב וזה אפשרי כי כמה שורות iPSC הופקו באמצעות שיטה זו לא עוברת את מבחן TEC. גורמים רבים עשויים להשתנות בין ניסויים, כולל רקע גנטי, כייל lentiviral, דפוסים של i lentiviralnsertion, פרמטרי מחזור התא של האוכלוסייה התורמת, הבדלים בין מעבדה בשלבים שונים של הליך TEC ונטיות משתנות של iPSCs לנמל סטיות גנטיות או epigenetic. הטוב ביותר כדי להבטיח הצלחה, אנו דואגים להקמת רמות המתאימות של ביטוי גנים בניסויי lentiviral גזירת iPSC ידי בדיקת דילולים נגיפיים על השליטה MEFs כדי להבטיח שכל נגיף מרוכז מספיק כדי לייצר ביטוי לגילוי גן לפחות 80% ואידיאליים של 100% MEFs. זה מאפשר לנו לזהות את הקווים עם מספר עותקים של lentiviruses השונה תוך הגבלת הרעילות לMEFs ולייצר מושבות בלי בארות הצפיפות. יצוין כי פרוטוקולים מרובים אחרים הוכחו לייצר iPSCs עם פוטנציאל ההתפתחותי מלא, תוך שימוש במספר שיטות ומקורות של תאים תורמים טוענות כי נתיבים מרובים לpluripotency מלא עשויים להתקיים 1,8-13,15. בשלב הנוכחי, iPSC עם זאת, אין סמן ביולוגי סופי של pluripotent מלאזוהה ולכן בדיקת TEC נותרת מבחן תקן הזהב של אם קו iPSC יכול לייצר את כל שושלות תאים באורגניזם.
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
תמיכה לKKB, MJB, JLH וKln סופק על ידי המכון בקליפורניה הרגנרציה רפואה, נאמנויות תכנית חוקרי ביו צדקת Pew, אסתר ב 'קרן המשפחה או' קיף וקרן משפחת שפירא. KKB הוא דונלד א 'והדלייה ב קסטר קרן הפקולטה Scholar.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
References
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved