Method Article
Generazione di topi derivati da cellule staminali pluripotenti indotte
In questo articolo
Riepilogo
Generazione indotte pluripotenti cellule staminali (IPSC) linee produce linee di diverso potenziale di sviluppo, anche quando passano i test standard per la pluripotenza. Qui si descrive un protocollo per la produzione di topi ottenute interamente da iPSCs, che definisce le linee IPSC come in possesso di pluripotenza pieno 1.
Abstract
La produzione di cellule staminali pluripotenti indotte (iPSCs) da cellule somatiche fornisce un mezzo per creare strumenti utili per la ricerca di base e può anche produrre una fonte di cellule paziente-trovati per terapie rigenerative. iPSCs possono essere generati utilizzando protocolli multipli e derivati da fonti cellulari multipli. Una volta generato, iPSCs sono testati utilizzando una varietà di saggi tra cui immunocolorazione per i marcatori pluripotenza, generazione di tre strati germinali in corpi embrionali e teratomi, confronti di espressione genica con cellule staminali embrionali (ESC) e la produzione di topi chimerici con o senza linea germinale contributo 2 . È importante sottolineare che le linee IPSC che superano questi test ancora variano nella loro capacità di produrre diversi tipi di cellule differenziate 2. Ciò ha reso difficile stabilire quali protocolli di derivazione IPSC, fonti di cellule del donatore o dei metodi di selezione sono molto utili per diverse applicazioni.
Il test più severise una linea di cellule staminali ha sufficiente potenziale di sviluppo per generare tutti i tessuti necessari per la sopravvivenza di un organismo (chiamato pluripotenza completo) è complementazione tetraploide embrione (TEC) 3-5. Tecnicamente, TEC comporta elettrofusione di due embrioni per generare cellule tetraploidi (4n) unicellulari embrioni che possono essere coltivate in vitro allo stadio di blastocisti 6. Diploidi (2n) cellule staminali pluripotenti (CES es o iPSCs) vengono iniettati nella cavità blastocele della blastocisti tetraploide e trasferito in una femmina ricevente di gestazione (vedere Figura 1). Il componente tetraploide dell'embrione completato contribuisce quasi esclusivamente ai tessuti extraembrionali (placenta, sacco vitellino), mentre le cellule diploidi costituiscono l'embrione corretta, risultando in un feto derivata interamente dalla linea di cellule staminali iniettato.
Recentemente, abbiamo riportato la derivazione di linee IPSC che riproducibile generare topi adultivia TEC 1. Queste linee IPSC dar luogo a cuccioli vitali con efficienze del 5-13%, che è paragonabile al CES 3,4,7 e superiore a quello riportato per la maggior parte delle altre linee IPSC 8-12. Dalle relazioni emerge che la riprogrammazione diretta in grado di produrre iPSCs completamente pluripotenti che corrispondono CES nel loro potenziale di sviluppo e l'efficienza della generazione di cuccioli nei test TEC. Allo stato attuale, non è chiaro ciò che distingue tra iPSCs completamente pluripotenti e delle linee meno potenti 13-15. Non è neppure chiaro quali metodi di riprogrammazione produrrà queste righe con la massima efficienza. Qui si descrive un metodo che produce iPSCs completamente pluripotenti e "all-IPSC" topi, che possono essere utili per gli investigatori che desiderano confrontare la pluripotenza delle linee IPSC o stabilire l'equivalenza dei diversi metodi di riprogrammazione.
Protocollo
Questo metodo è stato utilizzato nella ricerca riportata in Boland et al. Nature. 461, 91-96 (2009). 1
1. Preparazione di Lentivirus
Questo protocollo impiega doxiciclina inducibili vettori shuttle lentivirali che codificano per Oct4, Sox2, Klf4, e c-Myc sotto il controllo di un elemento di risposta tetO. Transgeni vengono attivati dal inverso tetraciclina trans-proteina attivante, rtTAM2.2 16, che induce l'espressione fattore riprogrammazione in presenza di doxiciclina. Questo sistema permette strettamente controllata, alta espressione di fattori di riprogrammazione. I vettori lentivirali qui utilizzati sono auto-inattivanti e quindi non può replicare seguente integrazione genomica. Tuttavia, è necessaria cautela quando si lavora con lentivirus e devono essere eseguite in laboratori conformi con BSL2 (USA) e S2 (Europa) standard.
- Scongelare HEK293T cellule e il passaggio almeno una volta prima tradinsfection. Cellule deve essere mantenuta a densità media subconfluente in HEK a 37 ° C, 5% di CO 2 in un ambiente umidificato. Di routine delle cellule di passaggio ogni 2 giorni con un rapporto di divisione di 1:06-01:10.
- Seed ~ 8 x 10 6 HEK293T cells/T150 con 25 ml di terreno HEK. Utilizzare una T150 per ciascun preparato lentivirus.
- Il giorno dopo HEK293T cellule trasfezione di precipitazione di fosfato di calcio. (Nota: nelle nostre mani precipitazione di fosfato di calcio provoca abitualmente in efficienza di trasfezione 80-90%, tuttavia, lipidi cationici reagenti di trasfezione come Lipofectamine 2000 può anche essere utilizzato). Preparare due provette da 15 ml coniche per ogni virus di essere preparati. Etichettare le provette "A" e "B". Un tubo, 10 ug di ciascuno di: i lentivirali navetta fattori vettore codificante riprogrammazione (o rtTAM2.2), i vettori virali confezionamento, e plasmide codificante la proteina di rivestimento virale, VSVG. Aggiungere 186 microlitri 2 M CaCl 2 al tubo A, e portare il volume a 1,5 ml sterile con H 2 O. Tubo B: 1,5 ml 2x HBS (pre-riscaldato a temperatura ambiente).
- Pipettare la miscela nella provetta A finché è una soluzione omogenea. Aggiungere la soluzione A alla soluzione B goccia a goccia e lasciare riposare a temperatura ambiente per 2-3 minuti.
- Aspirare il terreno di crescita delle cellule HEK293T e sostituire con 22 ml di pre-riscaldato a medio HEK senza penicillina e streptomicina.
- Pipettare combinato soluzioni AB (fosfato di calcio precipitato) direttamente HEK293T cellule e distribuire in modo uniforme da dolce dondolio.
- 24 ore dopo la trasfezione di cellule HEK-293T con lentivirus, rimuovere mezzo di crescita e sostituirla con 25 ml di fresco, pre-riscaldata medio HEK. Ritorno Heks transfettate per l'incubatrice.
- 48 ore dopo la trasfezione di cellule HEK-293T con lentivirus, raccogliere mezzi di crescita contenenti particelle lentivirali dalle Heks transfettate. Rimuovere residui di particolato dalla soluzione virale raccolte mediante centrifugazione a 3000 xg per 5 minuti a 4 ° C.
- Concentrato virus mediante ultracentrifugazione through un cuscino di saccarosio al 20% (2 ml sucrose/25 surnatante virale ml) per 2 ore a 112.000 xg a 4 ° C. Sospendere virale pellet in 0,4 ml di mezzo MEF a 4 ° C per 15-30 min con il dolce dondolio. Conservare particelle virali in varie porzioni monouso (ad esempio 50 ml) a -80 ° C.
2. Preparazione del mouse fibroblasti embrionali (MEF) per la riprogrammazione
Nota: il protocollo descritto qui riguarda la derivazione di iPSCs da E 13,5 fibroblasti embrionali di topo per l'uso in test TEC. Mentre altri gruppi hanno generato tutto IPSC topi da fonti adulti cellula donatrice, non abbiamo testato questo metodo su altri tipi di cellule e non può essere certo che tipo di cellula del donatore non è un fattore.
- Impostazione del mouse accoppiamenti a tempo. Il giorno embrionale 13.5 (E13.5), l'eutanasia la femmina incinta e sezionare gli embrioni dalle corna uterine. Luogo e conservare embrioni in 1x PBS (pre-refrigerato a 4 ° C) su ghiaccio.
- Rimuovere i tessuti extraembrionali (vale a direcorion, amnios e placenta). Decapitare l'embrione e togliere la coda (opzionale - se necessario per la genotipizzazione) e degli arti. Scoop fuori gli organi interni, pinze utilizzando o una spatola a forma di cucchiaio e tritare la carcassa rimanente con la lama di un bisturi o taglienti forbici.
- Lavare la carcassa tritata in 5 ml di pre-refrigerata 1x PBS. Centrifugare a 200 xg per 5 min.
- Aspirare il surnatante. Sospendere pellet in 5 ml 0,25% tripsina-EDTA e incubare a 37 ° C con agitazione vigorosa per 20-30 min.
- Aggiungere 5 ml di MEF medie (pre-riscaldato a 37 ° C), mescolare e centrifugare a 200 xg per 5 min.
- Aspirare il surnatante e risospendere pellet in pre-riscaldato media MEF.
- Piastra MEFs dissociato in 2-3 pozzetti di una piastra da 6 pozzetti pre-rivestiti con 0,1% di gelatina. Questo è considerato passaggio 1.
- MEFs passaggio ad una diluizione di 1:04-01:05 ogni 48 ore. MEF al passaggio 3 sono pronti per la trasduzione lentivirali.
3. Derivazione di linee IPSC
- Il giorno prima trasduzione lentivirale; seme ~ 3 x 10 5 MEFs primario in un pozzetto di una piastra da 6 pozzetti pre-rivestiti con 0,1% di gelatina.
- 1 ° giorno: MEF primaria dovrebbe essere 80-90% confluenti per la trasduzione lentivirali. Aggiungi particelle lentivirali direttamente al MEF media e incubare con una notte a 37 MEF ° C, 5% di CO 2 in un ambiente umidificato.
- Il giorno successivo (giorno 2) aspirare il terreno e lavare due volte con 3 ml di PBS 1x per rimuovere particelle virali.
- Aggiungere 0,5 ml di pre-riscaldato 0,25% tripsina-EDTA alle cellule e incubare a 37 ° C per 3-5 min con dondolo occasionale.
- Triturate per ottenere una cella singola sospensione. Osservare le cellule al microscopio ottico per garantire una sospensione singola cella.
- Trasferimento MEF in una provetta da 15 ml conica contenente 5 ml supporti MEF. Centrifugare a 200 xg per 5 min. Aspirare le cellule surnatante e risospendere delicatamente in mezzo MEF.
- Uniformemente dividere la sospensione cellulare tra due pozzetti di un 6 e pritardo pre-rivestito con 0,1% di gelatina.
- Oscillare la piastra avanti e indietro, lato a lato, e una volta in un movimento circolare per ottenere una distribuzione uniforme delle cellule in tutto il pozzetto. Incubare per una notte a 37 ° C, 5% di CO 2 in un ambiente umidificato.
- Giorno 3: ripetere i passaggi 4-9, tranne dividere le celle in modo uniforme da un pozzetto a 3 pozzetti di una piastra ben 6 pre-rivestite con 0,1% di gelatina. Questo produrrà 6 pozzi di trasdotte fibroblasti primari.
- Giorno 4: Add doxiciclina (DOX) ad una concentrazione di 10 ug / ml a 5/6 pozzetti. Un pozzetto deve rimanere non trattato per servire come controllo.
- Aggiungere VPA a 1,9 mM a 3 dei 5 pozzi trattati con DOX. VPA riduce il tasso di proliferazione delle MEF. Culture dense di MEF tollerare l'esposizione prolungata a VPA mentre subconfluenti culture tendono a senesce entro 2-5 giorni. Pertanto, MEF dovrebbe essere 100% confluenti VPA quando viene aggiunto. Nota: Usiamo VPA nei nostri esperimenti di riprogrammazione perché è un modificatore epigenetica noto, ed è stato shproprio per aumentare l'efficienza di generazione iPSC 17 anche se gli effetti e meccanismi di azione VPA rispetto alle generatrici IPSC completamente pluripotenti non sono noti.
- 5 ° giorno: Aspirare il mezzo, lavare e Tripsinizzare le celle come prima. Passaggio delle cellule trattate con DOX / VPA a un centimetro 15 2 piatto di coltura di tessuti pre-rivestito con 0,1% di gelatina e ciascuna delle altre condizioni di pre-rivestite 10 cm 2 piatti in mezzo ES cellule integrati con DOX fresca e VPA.
- Rifornire cellule ogni giorno con media ESC integrato con fresca DOX e VPA. ESC-come colonie dovrebbe iniziare a comparire dopo ~ 7 giorni nel DOX / VPA trattamento e dopo ~ 10 giorni nel trattamento sola DOX. Non ci sono colonie dovrebbe apparire in assenza di trattamento DOX.
- Una volta che le colonie in possesso di una rifrazione luminosa, confine ben definito e contengono 30-50 cellule, manualmente isolare le colonie con una pipetta gel carico e trasferimento ad un fondo a U 96 pozzetti contenente 20 pl di 00,25% tripsina-EDTA. Tripsinizzare di singole cellule e trasferimento alimentatori in un appartamento inferiore piastra a 96 pozzetti in 150 microlitri medio ESC contenente dox / VPA o DOX solo.
- Continuare a espandere clonale delle linee isolate IPSC sulla alimentatori in mezzo ESC. Rimuovere dox e VPA il giorno 19 dopo l'aggiunta (post-trasduzione del giorno 23). Eliminare le linee IPSC che non mantengono auto-rinnovamento o tassi di proliferazione simile a controlli ESC.
Può essere utile per caratterizzare le linee IPSC in relazione al CES prima di tentare di eseguire TEC. Abbiamo caratterizzato le nostre linee da 1) l'espressione di marcatori di pluripotenza endogeni (SSE-1, Oct4, Sox2, Nanog) mediante immunocitochimica, 2) analisi del cariotipo mediante conteggio cromosoma e 3) la formazione del corpo embryoid. Si può anche eseguire lentivirali specifico RT-qPCR per confermare che i transgeni provirali non sono espressi nei iPSCs. Tuttavia, abbiamo identificato iPSCs completamente pluripotenti utilizzando solo la morfologia, immunostaining e karyotyping. Nei nostri esperimenti, la selezione di linee IPSC basato su ESC-come morfologia e caratteristiche di crescita dei risultati nella maggior parte delle linee che esprimono marcatori di pluripotenza, mentre noi si identificano diverse linee con cariotipo potenzialmente anomali.
4. Preparazione di iPSCs iniettabile blastocisti
Passaggio numero di una linea PSC ha mostrato di influenzare i suoi 18 pluripotenza anche se questo può essere la linea dipendente 19. Abbiamo usato iPSCs di passaggi da 8-14 per la produzione di adulto all-IPSC topi.
- IPSCs Scongelare e piastra su linee in mezzo ESC. Passaggio delle cellule almeno una volta su alimentatori prima dell'uso per l'iniezione.
- Un pozzetto di una piastra da 6 pozzetti contenente 70-80% iPSCs confluenti fornirà più di un numero sufficiente di cellule per l'iniezione. Aspirare mezzo di crescita e lavare le cellule con ~ 3 ml di PBS 1x (senza Ca 2 + / Mg 2 +).
- Aggiungere 0,5 ml di pre-riscaldato 0,05% tripsina-EDTA perle cellule e incubare a 37 ° C per 10 min con dondolo occasionale.
- Triturate per ottenere una cella singola sospensione. Osservare le cellule al microscopio ottico per garantire una sospensione singola cella. Le iPSCs devono essere in sospensione singola cella come colonie / aggregati cellulari saranno intasare la pipetta di iniezione.
- Dopo una sospensione singola cella è ben realizzato, aggiungere 1,0 ml ESC supporto al pozzo e restituire la piastra al 37 ° C incubatore. Incubare per ~ 15 minuti o fino a quando la maggior parte degli alimentatori hanno iniziato ad aderire.
- Rimuovere delicatamente il supporto contenente i iPSCs facendo attenzione a non rimuovere gli alimentatori debolmente aderenti.
- Mettere le iPSCs in un tubo da 15 ml conica contenente 5 ml di mezzo di ESC. Centrifugare a 200 xg per 5 min. Aspirare il supernatante e rimuovere il resto del mezzo ES cella con una micropipetta. Toccare il tubo per rimuovere il pellet e le cellule Risospendere delicatamente in 0,2-0,5 ml di pre-refrigerata medio FHM. Conservare le cellule in ghiaccio fino e durante l'iniezione in tetraploide blastocysts.
5. Generazione di blastocisti tetraploidi
Procedure eseguite in questa sezione sono stati descritti in dettaglio altrove 5,6,20. Qui delineare la nostra tecnica, ottimizzato per il cellulare Electro Manipolatore BTX ECM 2001.
- Impostare topi donatori di embrioni da innesco 23-28 giorni topi vecchi femminili (C57BL/6J-Tyr c-2J / BALB / cByJ F1) con PMS e HCG. Somministrare 5 UI di PMS a 14:00 e 5 UI di HCG 47 ore più tardi. Dopo l'iniezione di HCG, istituito topi di sesso femminile con C57BL/6J-Tyr c-2J / BALB / cByJ stalloni F1. Controllare il giorno seguente per tappi vaginali.
- Eutanasia collegato topi femmina e raccogliere ovidotti. Raccogliere 1-cellule embrioni ponendo ovidotti in FHM con ialuronidasi e delicatamente strappare la ampulae. Lasciare le masse cumuliformi a sedere in FHM / ialuronidasi per 5-7 min.
- Raccogli 1 cellule embrioni utilizzando una pipetta a bocca e lavare con gocce di mezzi FHM prima di introdurla nel KSOMCultura-AA. Coltura a 37 ° C, 5% di CO 2 sotto olio minerale durante la notte e selezionare 2 cellule embrioni il giorno di elettrofusione, scarta tutti gli embrioni altri.
- Inserire un MicroSlide BTX in una capsula di Petri cm 10. Versare abbastanza spazio multimediale elettrosaldabili di temperatura per immergere il vetrino nella soluzione, ma non così tanto che i poli dell'elettrodo sono completamente sommerse.
- Accendere ECM 2001 e BTX Enhancer 400. Collegare i cavi del ECM per elettrodo del MicroSlide e fissare i cavi al lato della scatola di Petri per evitare il movimento accidentale della slitta.
- Eseguire un impulso manuale per ottenere una lettura sul potenziatore BTX e rispettare la tensione degli AC / DC correnti oggetto di applicazione. AC corrente controllare la velocità alla quale gli embrioni saranno allineati tra gli elettrodi, corrente DC si fondono blastomeri, e tempo di impulso imposterà la lunghezza dell'impulso DC. Un buon punto di partenza è 3V AC, DC 100V, e ora 0,05 msec. Il DC ottimale varia nell'intervallo 90-150 volt.
- Utilizzando una pipetta a bocca, prendere circa 30-40 a due cellule da embrioni KSOM-AA cultura e lavarli con qualche goccia di media elettrofusione. Disegna i media elettrosaldabili fresche dal piatto MicroSlide in pipetta a bocca e prendere gli embrioni dal lavaggio. Metterli nello spazio 1 mm tra gli elettrodi sulla MicroSlide. Fare attenzione che siano allineate nel mezzo del gap e che non sono in contatto tra loro.
- Applicare corrente alternata premendo il pulsante manuale di impulsi. Gli embrioni ruoterà in campo AC, fino al piano di contatto blastomero è parallelo agli elettrodi. Se embrioni non sono allineati in pochi secondi, aumentare l'impostazione AC.
- Dopo gli embrioni si sono allineati, premere il pulsante manuale di impulso nuovo per applicare l'impulso DC.
- Con mezzo elettrofusione nella pipetta, raccogliere gli embrioni dal MicroSlide. Lavare gli embrioni attraverso alcune gocce di KSOM-AA e metterli in KSOM-AA cultura a 37 ° C, 5% di CO 2. Il blastomero fusione shoULD essere completato in meno di 30 minuti di cultura.
- Ripetere i passaggi 7-11 per restante 2 cellule embrioni. Dopo i gruppi fusion successive, monitorare e selezionare embrioni con blastomeri fuse. Embrioni fuso con successo apparirà come in 1-cella stadio. Eliminare embrioni lisati e 2-cella dopo 30 minuti nella cultura. Se il tasso di fusione è inferiore all'80%, aumentare la tensione e / o il tempo con incrementi di 5 V e 0,01 msec. Se lisi è superiore al 20%, ridurre tensione continua e / o il tempo di conseguenza. Le impostazioni ottimali nei nostri esperimenti sono stati 4V AC, DC 146V, e 0,07 msec. Queste impostazioni costantemente ceduto il 90% o più elevati tassi di fusione con lisi poca o nessuna.
- Continua alla cultura embrioni fusi in microgocce di KSOM-AA in olio minerale a 37 ° C, 5% di CO 2. Si deve aspettare 85-95% degli embrioni fusi per formare tetraploidi (4n) blastocisti dopo 48 ore di incubazione.
6. Microiniezione di iPSCs in blastocisti tetraploide
Usiamo una Nikon TE-2000Umicroscopio invertito dotato di ottica DIC e micromanipolatori Narishige per l'iniezione blastocisti. Ogni blastocisti tetraploide viene iniettato con 10-12 iPSCs usando un protocollo standard per l'iniezione ESC in blastocisti di topo che è stato dimostrato in una pubblicazione precedente JoVE 5,20,21
- Posizionare una goccia 20 ml di FHM nel centro di un vetrino da microscopio concava e coprire con 150 pl di olio minerale.
- Abbassare la pipetta tenuta e l'ago microiniezione nella goccia FHM. Lasciare 2-3 minuti per entrambi gli aghi per riempire parzialmente con FHM.
- Lavare 20-30 blastocisti tetraploide attraverso gocce di FHM e trasferimento al calo FHM sul vetrino da microscopio.
- Pipetta miscela Bocca iPSC nella goccia. Può essere necessario diluire la miscela cellulare in una goccia di FHM anticipo se le cellule sono troppo concentrate o aggregati.
- Raccogliere 100-200 cellule con l'ago di iniezione.
- Tenere la blastocisti con la massa cellulare interna nel pongono 09:00ione. Iniettare cellule in blastocele penetrando la zona pellucida e trofoblasto nella posizione ore 3. Iniettare cellule per 16-18 blastocisti.
- Ritorno IPSC blastocisti integrati per KSOM-AA cultura.
7. Trasferimento di blastocisti tetraploidi completato nei Corni uterini di topi riceventi
Completato blastocisti tetraploide sono chirurgicamente trasferiti alle corna uterine di topi riceventi femminili secondo le linee guida di istituto del ricercatore, con la tecnica standard di 20 che abbiamo brevemente riassumere. Selezionare femmina CD-1 in topi pro-estro palco e configurarli per l'accoppiamento con i maschi vasectomized. Verificare la presenza di tappi vaginali la mattina successiva. Le femmine sono pronti per il trasferimento degli embrioni uterina due giorni dopo il tappo è stato rilevato (2,5 DPC).
Un giorno prima del destinatario femmine si accoppiano con i maschi vasectomized, impostare ulteriori CD-1 femmine con i maschi vasectomizedda utilizzare come madri adottive per tutti-IPSC topi recuperati con taglio cesareo.
8. Taglio cesareo e la promozione di iPSC derivati Pups
Il trasferimento di embrioni TC in genere si traduce in riassorbimento più dopo l'impianto, anche se l'IPSC o ESC linea ha un elevato potenziale di sviluppo. Di conseguenza, ci si può aspettare non più di 4 cuccioli vitali (di solito 1-2) per beneficiario. Le cucciolate sono in genere di piccole dimensioni trascurate dai destinatari. Per aumentare il livello di assistenza neonatale e il tasso di sopravvivenza, eseguiamo C-sezioni e promuovere secondo lo standard dei protocolli 20. Per eseguire il taglio cesareo, l'eutanasia topi riceventi 16 giorni dopo il trasferimento degli embrioni a 7-8PM (destinatario 18,5 DPC) e sezionare cuccioli dalle corna uterine. Foster cuccioli vitali per CD-1 madri che cucciolate consegnati lo stesso giorno.
Risultati
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
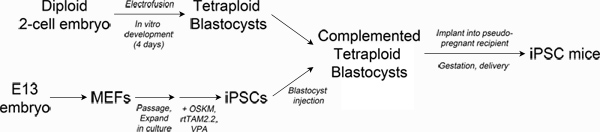
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
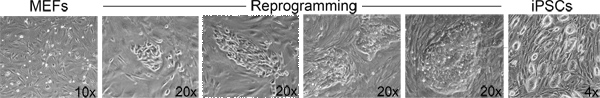
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
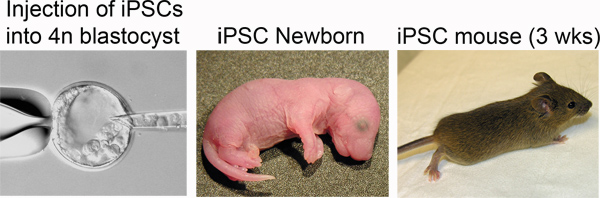
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Discussione
Generazione di topi da linee IPSC usando saggi TEC fornisce un test rigoroso funzionale per la pluripotenza di una linea IPSC. Questo test può essere utile per valutare l'efficacia relativa di diversi metodi di riprogrammazione o per identificare linee IPSC che possono essere più utili per generare certi tipi di cellule in vitro. Generata topo da iPSCs può essere usato per testare rigorosamente la stabilità a lungo termine e di tumorigenicità iPSC derivati tessuti. Questo protocollo sarà utile agli investigatori che desiderano generare linee IPSC completamente pluripotenti o topi IPSC o per confrontare l'utilità relativa di diversi metodi di riprogrammazione.
I meccanismi che controllano la generazione e l'identificazione di iPSCs completamente pluripotenti sono ancora limitate ed è possibile che alcune linee IPSC prodotte con questo metodo non superare la prova TEC. Molti fattori possono variare tra esperimenti genetici tra cui sfondi, titolo lentivirale, modelli di lentivirale insertion, i parametri del ciclo cellulare della popolazione dei donatori, tra diversi laboratori differenze nelle varie fasi della procedura TEC e propensioni variabili di iPSCs a nutrire aberrazioni genetiche o epigenetiche. Per garantire la migliore riuscita, curiamo stabilire livelli adeguati di espressione genica lentivirale in esperimenti derivazione IPSC testando diluizioni virale su MEFs controllo per garantire che ogni virus è sufficientemente concentrata per produrre rilevabile espressione genica di almeno 80% e preferibilmente il 100% del MEF. Questo ci permette di identificare le linee con più copie di lentivirus diverse limitando tossicità per il MEF e la produzione di colonie senza sovraffollamento dei pozzetti. Va notato che altri protocolli multipli hanno dimostrato di produrre iPSCs con pieno potenziale di sviluppo, con metodi e fonti di cellule donatrici che suggeriscono che più percorsi per pluripotenza pieno possono esistere 1,8-13,15. Al momento, però, non biomarcatore definitivo completamente pluripotenti iPSCè stato identificato e quindi il saggio TEC rimane il test gold standard se una linea iPSC può generare tutti linee cellulari in un organismo.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Sostegno alla KKB, MJB, JLH e KLN sono state fornite dal California Institute per la medicina rigenerativa, la Pew Charitable Trusts Programma biomedica studiosi, il Esther B. O'Keeffe Family Foundation e la Fondazione Famiglia Shapiro. KKB è un E. Donald e Delia B. Baxter Foundation Facoltà Scholar.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Riferimenti
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. . Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -. Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -. y., et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon