Method Article
Генерация Мыши, полученные из индуцированных плюрипотентных стволовых клеток
В этой статье
Резюме
Создание индуцированных плюрипотентных стволовых клеток (ИПСК) линий производит линии различной потенциал развития даже тогда, когда они проходят стандартные тесты для плюрипотентности. Здесь мы опишем протокол для получения мышей полностью проистекает из ИПСК, которое определяет ИПСК линий, обладающих полным плюрипотентности 1.
Аннотация
The production of induced pluripotent stem cells (iPSCs) from somatic cells provides a means to create valuable tools for basic research and may also produce a source of patient-matched cells for regenerative therapies. iPSCs may be generated using multiple protocols and derived from multiple cell sources. Once generated, iPSCs are tested using a variety of assays including immunostaining for pluripotency markers, generation of three germ layers in embryoid bodies and teratomas, comparisons of gene expression with embryonic stem cells (ESCs) and production of chimeric mice with or without germline contribution2. Importantly, iPSC lines that pass these tests still vary in their capacity to produce different differentiated cell types2. This has made it difficult to establish which iPSC derivation protocols, donor cell sources or selection methods are most useful for different applications.
The most stringent test of whether a stem cell line has sufficient developmental potential to generate all tissues required for survival of an organism (termed full pluripotency) is tetraploid embryo complementation (TEC)3-5. Technically, TEC involves electrofusion of two-cell embryos to generate tetraploid (4n) one-cell embryos that can be cultured in vitro to the blastocyst stage6. Diploid (2n) pluripotent stem cells (e.g. ESCs or iPSCs) are then injected into the blastocoel cavity of the tetraploid blastocyst and transferred to a recipient female for gestation (see Figure 1). The tetraploid component of the complemented embryo contributes almost exclusively to the extraembryonic tissues (placenta, yolk sac), whereas the diploid cells constitute the embryo proper, resulting in a fetus derived entirely from the injected stem cell line.
Recently, we reported the derivation of iPSC lines that reproducibly generate adult mice via TEC1. These iPSC lines give rise to viable pups with efficiencies of 5-13%, which is comparable to ESCs3,4,7 and higher than that reported for most other iPSC lines8-12. These reports show that direct reprogramming can produce fully pluripotent iPSCs that match ESCs in their developmental potential and efficiency of generating pups in TEC tests. At present, it is not clear what distinguishes between fully pluripotent iPSCs and less potent lines13-15. Nor is it clear which reprogramming methods will produce these lines with the highest efficiency. Here we describe one method that produces fully pluripotent iPSCs and "all- iPSC" mice, which may be helpful for investigators wishing to compare the pluripotency of iPSC lines or establish the equivalence of different reprogramming methods.
протокол
Этот метод был использован в исследованиях сообщается в Боланд и соавт. Природы. 461, 91-96 (2009) 1.
1. Подготовка лентивирус
Этот протокол используется доксициклин индуцируемых лентивирусов векторов трансфер которые кодируют Oct4, Sox2, Klf4 и C-Myc под контролем элемент ответа Teto. Трансгенов активируются обратном тетрациклин транс-активирующих белков, rtTAM2.2 16, который индуцирует перепрограммирования фактор выражения в присутствии доксициклина. Эта система позволяет жестко контролируется, высокая экспрессия перепрограммирования факторов. Лентивирусов векторов, используемые здесь, само инактивирующий и, следовательно, не может воспроизвести следующие геномной интеграции. Тем не менее, осторожность требуется при работе с лентивирусов и должна быть выполнена в лаборатории совместимый с BSL2 (США) и S2 (Европа) стандартов.
- Оттепель HEK293T клеток и прохождение по крайней мере, один раз перед траnsfection. Клетки должна поддерживаться на уровне субконфлюентные плотность в средней НЕК при 37 ° C, 5% CO 2 во влажной среде. Регулярно клетки проход каждые 2 дня с разделением отношение 1:6-1:10.
- Семенной ~ 8 × 10 6 HEK293T cells/T150 с 25 мл среды НЕК. Используйте один T150 для каждого лентивирус подготовки.
- На следующий день трансфекции клетки HEK293T кальция фосфата осадков. (Примечание: в наших руках осадков фосфата кальция обычно приводит к 80-90% эффективности трансфекции, однако, катионных липидов трансфекции реагентов, таких как Lipofectamine 2000 также может быть использован). Приготовьте два 15 мл конические пробирки для каждого вируса, чтобы быть готовым. Этикетка трубы "A" и "B". Труба, 10 мкг каждого из: лентивирусные челночный вектор кодировки перепрограммирования факторов (или rtTAM2.2), вирусные векторы упаковки и плазмиды, кодирующей вирусный белок оболочки, VSVg. Добавить 186 мкл 2 М CaCl 2 до трубы, и довести объем до 1,5 мл стерильной H 2 O. Труба B: 2x 1,5 мл HBS (предварительно нагревают до комнатной температуры).
- Внесите смеси в трубе, пока она не гомогенного раствора. Добавить решение к решению B каплям и дать постоять при комнатной температуре в течение 2-3 мин.
- Аспирируйте роста среды HEK293T клетки и замените 22 мл подогретого НЕК среде без пенициллина и стрептомицина.
- Внесите комбинированных решений AB (осадок фосфата кальция) непосредственно на HEK293T клетки и равномерно распределить по нежным качалки.
- Через 24 часа после трансфекции НЕК-293T клеток с лентивирусов, удалить питательную среду и заменить его 25 мл свежего, предварительно нагретой среде НЕК. Вернуться трансфицированных HEKS в инкубатор.
- 48 ч после трансфекции НЕК-293T клеток с лентивирусов, собирать роста средах, содержащих лентивирусные частиц из трансфицированных Хекс. Удалите частицы мусора из собранных вирусных решения путем центрифугирования при 3000 х г в течение 5 мин при 4 ° C.
- Концентрат вируса ультрацентрифугированием беспересадочныйтьфу 20% сахарозы подушке (2 мл sucrose/25 мл вирусного супернатанта) в течение 2 ч при 112000 х г при 4 ° C. Приостановка вирусных гранул в 0,4 средний MEF мл при 4 ° С в течение 15-30 мин с нежным качалки. Хранить вирусных частиц в одной порции использования (например, 50 мкл) при температуре -80 ° C.
2. Получение эмбриональных фибробластов мыши (MEF) для перепрограммирования
Примечание: Протокол изложенные здесь относится к выводу ИПСК из E 13,5 мышиных эмбриональных фибробластов для использования в анализах TEC. В то время как другие группы сформировали все ИПСК мышей от взрослого источников донорских клеток, мы не тестировали этот метод на других типах клеток и не может быть уверен, что тип клетки-донора не является решающим фактором.
- Настройка мыши своевременной вязки. В эмбриональный день 13,5 (E13.5), усыпить беременных женщин и анализировать эмбрионы из рога матки. Место и хранить эмбрионы в 1x PBS (предварительно охлажденный до 4 ° C) на льду.
- Снимите внеэмбриональной тканей (т.е.хориона, амниона и плаценты). Обезглавьте эмбриона и удалить хвост (по желанию - если это необходимо для генотипирования) и конечностях. Совок из внутренних органов, с помощью щипцов или совка форме лопаточки и пропустить через мясорубку оставшиеся тушки с лезвием скальпеля или острыми ножницами.
- Вымойте фарш каркаса в 5 мл предварительно охлажденного 1x PBS. Центрифуга при 200 мкг в течение 5 мин.
- Аспирируйте супернатант. Приостановить гранул в 5 мл 0,25% трипсина-EDTA и инкубировать при 37 ° С при интенсивном встряхивании в течение 20-30 мин.
- Добавить 5 мл MEF среды (предварительно нагревают до 37 ° C), перемешать и центрифуги при 200 мкг в течение 5 мин.
- Супернатант и ресуспендируют осадок в предварительно нагретой среде MEF.
- Плита диссоциированных MEFs в 2-3 скважинах 6-луночный планшет предварительно покрытых 0,1% желатином. Это считается прохода 1.
- Прохождение MEFs в разведении 1:4-1:5 каждые 48 часа. MEFs при прохождении 3 готовы к лентивирусные трансдукции.
3. Вывод линий ИПСК
- За день до лентивирусные трансдукции; семени ~ 3 х 10 5 первичном МЭФ в одну лунку 6-луночный планшет предварительно покрытых 0,1% желатином.
- День 1: Первичные MEFs должна быть 80-90% вырожденная для лентивирусные трансдукции. Добавить лентивирусные частиц непосредственно в MEF средств массовой информации и инкубировать с MEFs течение ночи при 37 ° C, 5% CO 2 во влажной среде.
- На следующий день (день 2) аспирацию среды и мыть два раза с 3 мл 1x PBS для удаления вирусных частиц.
- Добавить 0,5 мл подогретого 0,25% трипсина-EDTA в клетки и инкубировать при 37 ° С в течение 3-5 мин с редкими качалке.
- Растирают для достижения одной клеточной суспензии. Соблюдайте клеток с помощью световой микроскопии в целях обеспечения единой клеточной суспензии.
- Передача MEFs в 15 мл коническую трубку, содержащую 5 мл MEF средств массовой информации. Центрифуга при 200 мкг в течение 5 мин. Аспирируйте супернатант и аккуратно ресуспендирования клеток в среде, MEF.
- Равномерно разделить клеточной суспензии между двумя скважин 6 хорошо рпоздно предварительно покрытых 0,1% желатином.
- Рок пластину вперед и назад, из стороны в сторону, и один раз в круговом движении для достижения равномерного распределения клеток по всему хорошо. Выдержите в течение ночи при 37 ° C, 5% CO 2 во влажной среде.
- День 3: Повторите шаги 4-9, за исключением разделить клетки равномерно с одной скважины на 3 скважины из 6-луночный планшет предварительно покрытых 0,1% желатином. Это даст 6 скважин, из трансдуцированных первичных фибробластов.
- День 4: Добавить доксициклин (DOX) в концентрации 10 мкг / мл до 5/6 скважин. Одна скважина должна оставаться необработанными, чтобы служить в качестве контроля.
- Добавить VPA на 1,9 мм до 3 из 5 скважин обрабатывают парадокс. VPA уменьшает скорость пролиферации MEFs. Плотные культур MEFs переносят длительное воздействие VPA в то время как субконфлюентные культур, как правило, стареть в течение 2-5 дней. Таким образом, MEFs должна быть 100% вырожденная, когда VPA добавлен. Примечание: Мы используем в нашей VPA перепрограммирования экспериментов, потому что это известный эпигенетические модификаторы, и был Ш.самостоятельно, чтобы повысить эффективность ИПСК поколения 17, хотя эффекты и механизмы действия VPA по отношению к генерирующим полностью плюрипотентных ИПСК линии не известно.
- День 5: Аспирируйте среду, вымыть и trypsinize клетки, как раньше. Прохождение клетки, обработанные DOX / VPA до 15 см 2 культуре ткани блюдо предварительно покрытых 0,1% желатином и каждая из других условиях предварительного покрытия 10 см 2 блюд в ЭС клеточной среде дополнена свежими DOX и VPA.
- Пополнение клеток каждый день с ESC среде с добавлением свежих DOX и VPA. ESC-подобных колоний должны начать появляться после ~ 7 дней в DOX / VPA лечения и после ~ 10 дней в DOX только лечение. Нет колонии должны появиться в отсутствие парадокс лечения.
- После колоний обладают ярко преломления, четко определенные границы и содержат 30-50 клеток, вручную изолировать колонии с помощью пипетки гель чаевые загрузки и передачи U-96 и нижней пластины, содержащей 20 мкл 00,25% трипсина-EDTA. Trypsinize в одиночных камерах и передать фидеров в плоским дном 96-луночный планшет в 150 мкл среды ESC содержащих DOX / VPA или парадокс в одиночку.
- Продолжайте клонально расширить изолированные ИПСК линии на фидеры в среде ESC. Удалить DOX и VPA на 19-й день после их добавления (после трансдукции день 23). Откажитесь ИПСК линий, которые не поддерживают самообновления или распространению цены похожи на ESC управления.
Это может быть полезно, чтобы охарактеризовать ваши ИПСК линии по отношению к ЭСК перед выполнением TEC. Мы охарактеризовали наших линий на 1) экспрессия эндогенных маркеров плюрипотентности (SSEA-1, Oct4, Sox2, Nanog) по иммуноцитохимия, 2) кариотип анализ хромосом подсчета и 3) эмбриоидных формирования тела. Можно также выполнять лентивирусные конкретных RT-КПЦР чтобы подтвердить, что провирусной трансгены не выражается в ИПСК. Тем не менее, мы определили полностью плюрипотентных ИПСК, используя только морфологии, иммунным и karyotypIng. В наших экспериментах, выбор ИПСК линий на основе ESC-как морфология и особенности роста результатов в большинстве линий, экспрессирующих маркеры плюрипотентности в то время как мы обычно выделяют несколько линий с потенциально аномальный кариотип.
4. Подготовка ИПСК для инъекций бластоцисты
Прохождение номер строки PSC было показано, влияют на его плюрипотентности 18, хотя это может быть зависимой линии 19. Мы использовали ИПСК от 8-14 проходов для производства взрослой все ИПСК мыши.
- Оттепель ИПСК и пластины на фидеры в среде ESC. Прохождение клетки по крайней мере, один раз на фидеры перед использованием для инъекций.
- Один из хорошо 6-луночный планшет содержащие 70-80% вырожденная ИПСК будут обеспечивать более достаточное количество клеток для инъекций. Аспирируйте роста среднего и мыть клетки с ~ 3 мл 1x PBS (без Ca 2 + / Mg 2 +).
- Добавить 0,5 мл подогретого 0,05% трипсина-EDTA вклетки и инкубировать при 37 ° С в течение 10 мин при периодическом качалке.
- Растирают для достижения одной клеточной суспензии. Соблюдайте клеток с помощью световой микроскопии в целях обеспечения единой клеточной суспензии. ИПСК должны быть в одной клеточной суспензии в колонии / клеточных агрегатов будет забивать введения пипетки.
- После одной клеточной суспензии была достигнута Бен, добавить 1,0 мл ESC средств массовой информации к колодцу и вернуть пластину на 37 ° C инкубатора. Инкубируйте в течение ~ 15 мин или до тех пор пока большинство фидеров начали придерживаться.
- Аккуратно удалите среде, содержащей ИПСК стараясь не выбить слабо приверженцем фидеров.
- Поместите ИПСК в 15 мл коническую трубку, содержащую 5 мл ESC среды. Центрифуга при 200 мкг в течение 5 мин. Аспирируйте супернатант и удалите оставшуюся часть ES клеточной среде с микропипетки. Нажмите на трубу, чтобы выбить гранул и аккуратно ресуспендирования клеток в 0,2-0,5 мл предварительно охлажденного FHM среды. Магазин клетки на льду до и во время введения в тетраплоидных бlastocysts.
5. Генерация Тетраплоидные бластоцисты
Процедуры выполняются в этом разделе были подробно описаны в других 5,6,20. Здесь мы приводим нашу технику, оптимизированные для BTX Electro Манипулятор сотовых ECM 2001 года.
- Настройка мышей-доноров эмбрионов на 23-28 день грунтования старых самок мышей (C57BL/6J-Tyr С-2J / BALB / cByJ F1) с ПМС и HCG. Администрирование 5 МЕ ПМС в 2PM и 5 МЕ ХГЧ 47 часов спустя. После инъекции HCG, созданная самок мышей с C57BL/6J-Tyr С-2J / BALB / cByJ мужчин F1 студ. Проверьте на следующий день для вагинальных пробок.
- Усыпить подключен самок мышей и собирать яйцеводы. Сбор 1-клетки эмбрионов путем размещения яйцеводов в FHM с гиалуронидазы и осторожно срывая ampulae. Разрешить кучевые масс сидеть в FHM / гиалуронидазы в течение 5-7 мин.
- Сбор 1-клетки эмбрионов с использованием рот пипетку и промыть через капли СМИ FHM до размещения их на KSOM-AA культуры. Культура при 37 ° C, 5% CO 2 в минеральном масле в течение ночи и выберите 2-клетки эмбрионов в день электромуфтовой, отбросить все остальные эмбрионы.
- Поместите BTX предметное стекло в 10 см блюдо Петри. Налейте достаточно средств массовой информации комнатной температуре электромуфтовой погружаться слайд решение, но не настолько, чтобы полюса электрода они полностью погружены.
- Включите ECM 2001 года и BTX Enhancer 400. Подключите кабели ECM к электроду предметное стекло и зафиксировать кабели на стороне чашки Петри, чтобы предотвратить непреднамеренное движение слайда.
- Выполните одно руководство импульс, чтобы получить показания на BTX усилитель и обратите внимание на напряжение AC / DC токи применяются. Переменный ток будет контролировать скорость, при которой эмбрионы будет согласовывать между электродами, постоянного тока сольются бластомеров, а пульс времени будет установить длительность импульса тока. Хорошей отправной точкой является 3V AC, DC 100V, и времени 0,05 мс. Оптимальным DC варьируется в диапазоне 90-150 вольт.
- Использование рот пипеткой, займет около 30-40 двух клеток эмбриона от KSOM-AA культуры и мыть их через несколько капель электромуфтовой среды. Ничья свежей среды электромуфтовой от предметное стекло блюдо в рот пипеткой и принять эмбрионы от стирки. Поместите их в 1 мм зазор между электродами на предметное стекло. Будьте осторожны, что они выравниваются по центру щели, и что они не находятся в контакте друг с другом.
- Применение переменного тока, нажав на кнопку ручного пульса. Эмбрионы будут вращаться в поле переменного тока, пока плоскости контакта бластомеров параллельно электродам. Если эмбрионы не согласованы в течение нескольких секунд, увеличить AC настройки.
- После эмбрионов выровнены, нажмите кнопку ручного импульс снова применить импульс постоянного тока.
- С электромуфтовой среды в пипетку, собирать эмбрионы из предметное стекло. Промойте эмбрионы через несколько капель KSOM-AA и поместить их в KSOM-AA культуры при 37 ° C, 5% CO 2. Бластомеров слияния шоУльд быть завершена менее чем за 30 мин в культуре.
- Повторите шаги 7-11 для остальных 2-клетки эмбрионов. После последующего слияния групп, мониторинг и выбрать эмбрионы с расплавленным бластомеров. Успешно слиты эмбрионов окажется в 1-клеточной стадии. Откажитесь лизируют и 2-клетки эмбрионов после 30 мин в культуре. Если слияние скорости ниже 80%, увеличение напряжения и / или время с шагом в 5 В и 0,01 мс. Если лизис выше 20%, снижение напряжения постоянного тока и / или времени соответственно. Оптимальные настройки в наших экспериментах было 4V AC, DC 146V и 0,07 мс. Эти параметры последовательно дали 90% или выше цены слияние с небольшим или без лизиса.
- Продолжайте культуры плавленого эмбрионов в микрокапель KSOM-AA под минеральным маслом при температуре 37 ° C, 5% CO 2. Вы должны ожидать, 85-95% из плавленого эмбрионов для формирования тетраплоидных (4л) бластоцисты после 48 ч инкубации.
6. Микроинъекции ИПСК в Тетраплоидные бластоцисты
Мы используем Nikon TE-2000Uинвертированный микроскоп оснащен оптикой DIC и Narishige микроманипуляторы для бластоцисты инъекций. Каждый тетраплоидных бластоцисты вводят 10-12 ИПСК с использованием стандартного протокола для инъекций ESC в бластоцисты мыши, которая была продемонстрирована в предыдущей публикации Юпитера 5,20,21
- Поместите 20 мкл капли FHM в центре вогнутой стекло микроскопа и покрыть ее 150 мкл минерального масла.
- Опустите проведения пипетки и микроинъекции иглы в FHM капли. Разрешить 2-3 мин для игл, чтобы частично заполнить с FHM.
- Вымойте 20-30 тетраплоидных бластоцисты через капли FHM и передачи FHM капли на стекле микроскопа.
- Рот пипетки ИПСК смесь в каплю. Это может быть необходимо, чтобы разбавить смесь клеток в капле FHM заранее, если клетки слишком сконцентрированы или объединены.
- Возьмите 100-200 клеток с инъекционной иглой.
- Держите бластоцисты с внутренней клеточной массы в 9 часов постулироватьион. Inject клеток в бластоцель, проникая зона pellucida и трофобласта в позиции 3 часа. Вводят 16-18 клеток в бластоцисты.
- Вернуться ИПСК дополняется бластоцисты в KSOM-AA культуры.
7. Передача Дополняется Тетраплоидные бластоцисты в рога матки получателя мышей
Дополненный тетраплоидных бластоцисты хирургическим путем передаются в рога матки самок мышей получателя в соответствии с рекомендациями института исследователя, используя стандартную технику 20, которые мы кратко подведем итоги. Выберите женщины CD-1 мышей в про-течки стадии и настроить их для спаривания с vasectomized мужчин. Проверьте, вагинальные пробки на следующее утро. Женщины готовы к матке переноса эмбрионов два дня после того, как пробка была обнаружена (2,5 DPC).
За день до получателя женщин сопряжены с vasectomized мужчин, создать дополнительные CD-1 женщины с не-vasectomized мужчинбудет использоваться в качестве приемных матерей в течение всего ИПСК мышей извлекается кесарево сечение.
8. Кесарева сечения и укрепление ИПСК полученных щенков
Перенос эмбрионов TC обычно приводит к нескольким резорбции после имплантации, даже если ИПСК или ESC линия имеет высокий потенциал развития. В результате, можно ожидать не более 4 жизнеспособных щенков (обычно 1-2) на каждого получателя. Эти небольшие пометы, как правило, пренебрегают получателей. Для повышения уровня неонатальной помощи и выживаемость, мы выполняем кесарева сечения и содействие в соответствии со стандартными протоколами 20. Для выполнения кесарева сечения, усыпить получателя мышей через 16 дней после переноса эмбрионов на 7-8 вечера (получатель 18,5 ЦОД) и анализировать щенков из рога матки. Содействие жизнеспособным щенков CD-1 матерей, которые поставляются пометов в тот же день.
Результаты
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
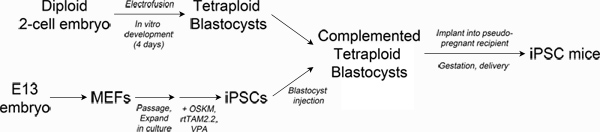
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
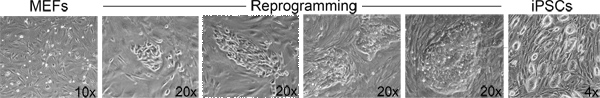
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
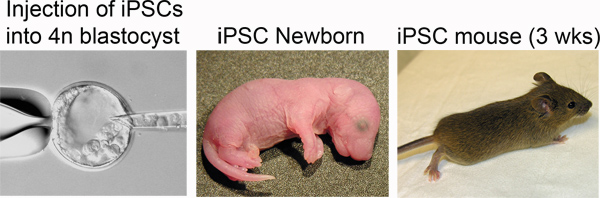
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
Обсуждение
Создание мышей от ИПСК линий с использованием анализов TEC обеспечивает строгий функциональный тест для плюрипотентности ИПСК линии. Этот тест может быть полезной для оценки относительной эффективности различных методов перепрограммирования или выявления ИПСК линий, которые могут быть наиболее полезны для получения определенных типов клеток в пробирке. Мыши, полученные от ИПСК могут быть использованы для строго проверить долгосрочную стабильность и туморогенности ИПСК полученных тканей. Этот протокол будет полезна исследователям желающих генерировать полностью плюрипотентных ИПСК линии или ИПСК мыши или сравнивать относительную полезность различных методов перепрограммирования.
Механизмов, которые управляют генерацией и идентификации полностью плюрипотентных ИПСК остаются плохо понятыми и не исключено, что некоторые линии ИПСК, полученные с использованием данного метода не пройдете тест TEC. Многие факторы могут варьироваться в зависимости от экспериментов в том числе генетические фоны, лентивирусные титр, модели лентивирусные яnsertion, клеточный цикл параметрах донора населения, межлабораторных различий в различные этапы процедуры TEC и переменной наклонности ИПСК питать генетических или эпигенетических отклонений. Чтобы лучше обеспечить успех, мы позаботимся, чтобы установить соответствующие уровни экспрессии генов лентивирусов в ИПСК экспериментов выводу, проверяя вирусных разведения по контролю MEFs, чтобы гарантировать, что каждый вирус достаточно сконцентрированы, чтобы произвести экспрессии этого гена не менее 80%, а в идеале 100% MEFs. Это позволяет нам определить линий с несколькими копиями различных лентивирусов, ограничивая при этом токсичность для MEFs и производстве колонии без переполненности скважин. Следует отметить, что несколько других протоколов было показано, что производят ИПСК с полной потенциал развития, с использованием различных методов и источников донорских клеток предполагая, что несколько путей к полной плюрипотентности может существовать 1,8-13,15. В настоящее время, однако, нет окончательного биомаркера полностью плюрипотентных ИПСКбыла определена и, следовательно, анализ TEC остается золотым стандартом испытаний ли ИПСК линия может генерировать все клеточные клоны в организме.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Поддержка ККБ, ГСК, JLH и KLN была предоставлена Калифорнийского института регенеративной медицины, Благотворительные фонды Пью биомедицинской программе ученых, Эстер Б. О'Киф семьи и Фонд Шапиро семьи. ККБ является Дональда и Делия В. Baxter фонда факультет Scholar.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
Ссылки
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены