Method Article
人工多能性幹細胞に由来するマウスの作製
要約
彼らは多能性のための標準的なテストを通過した時、誘導多能性幹細胞(IPSC)ラインを生成することはあっても発生能の異なる行が生成されます。ここでは、所有している完全な多能性としてIPSC行を定義性IPSC、から完全に由来するマウスを作製するためのプロトコルを記述する 1。
要約
体細胞から誘導多能性幹細胞(性IPSC)の生産は、基礎研究のための貴重なツールを作成する手段を提供し、また、再生治療のために患者をマッチさせた細胞の供給源を生成することがあります。性IPSCは、複数のプロトコルを使用して生成され、複数の細胞供給源に由来してもよい。一度生成された、性IPSCは、多能性マーカーの免疫染色、胚様体や奇形腫、胚性幹細胞(ESC)と生殖細胞系列への寄与2の有無にかかわらず、キメラマウスの作製と遺伝子発現の比較で三胚葉の生成を含む種々のアッセイを用いて試験する。重要なのは、これらのテストに合格IPSC線は依然として異なる分化細胞型2を製造する能力が異なります。これは難しいIPSC導出プロトコル、ドナー細胞ソースや選択方法が異なるアプリケーションのために最も有用である確立してきました。
最も厳しいテスト幹細胞株は、生物の生存に必要なすべての組織を生成するための十分な発生能を有するかどうかの(と呼ばれる完全な多能性)四倍体胚補完(TEC)3-5です。技術的には、TECは胚盤胞期6〜in vitroで培養することができる四倍体(4N)1細胞期胚を生成するには2つの細胞期胚の電気融合を伴います。二倍体(2n)の多能性幹細胞( 例えば ESCはまたは性IPSC)を四倍胚盤胞の胞胚腔に注入します( 図1を参照)妊娠のためのレシピエント雌に転送されます。二倍体細胞が注入された幹細胞株から完全に由来する胎児で、その結果、胚は適切な構成に対し、補完胚の四倍体成分は、胚体外組織(胎盤、卵黄嚢)にほぼ独占的に貢献しています。
最近、我々は再現性成体マウスを生成IPSC線の導出を報告テック1を介して。これらIPSC行はESCは3,4,7に匹敵すると、他のほとんどのIPSCライン8月12日のために報告されたものよりも高くなって、5から13パーセントの効率で実行可能な子犬を生じさせる。これらのレポートは、直接リプログラミングはTECテストで子犬を生成するの彼らの発達の可能性と効率性にESCを完全に一致させる多能性IPSCを作り出すことができることを示している。現時点では、それは完全に多能性IPSCの少ない強力なライン13から15の間で区別するものは明確ではありません。また、それは方法が最も効率的にこれらの行が生成されるリプログラミングは明らかである。ここでは、IPSC線の多能性を比較したり、別のプログラミング方法の同等性を確立しようとする研究者のために役立っているかもしれません完全に人工多能性IPSCと "all-IPSC"マウスを生成し、一つの方法を説明します。
プロトコル
このメソッドは、ボーランドら、Natureで報告された研究で使用されていた。461、91-96(2009)。1
1。レンチウイルスの作製
このプロトコルは、テト応答要素の制御下にあるOct4をコードするドキシサイクリン誘導性レンチウイルスシャトルベクター、レトロウイルスベクター、Klf4の、およびc-Mycを採用しています。導入遺伝子は、ドキシサイクリンの存在下で初期化因子の発現を誘導するリバーステトラサイクリントランス活性化タンパク質、rtTAM2.2 16によって活性化されます。このシステムは、初期化因子の厳密に制御され、高い発現を可能にする。ここで使用するレンチウイルスベクターは、自己不活性化であり、従って、以下のゲノム統合を複製することはできません。レンチでの作業とBSL2(米国)とS2(欧州)の規格に準拠研究所で行うべきただし、注意が必要です。
- TRA前に少なくとも一度HEK293T細胞と通路を解凍nsfection。細胞を37℃のHEK培地でコンフルエント密度℃、加湿された環境で、5%のCO 2に維持されるべきである。日常的に継代細胞1:6-1:10のスプリット比で2日ごと。
- シード〜8×10 6 25ミリリットルのHEK媒体とHEK293T cells/T150。各レンチの準備のための1 T150を使用しています。
- リン酸カルシウム沈殿によって翌日フェHEK293T細胞。 (注:私たちの手の中にリン酸カルシウム沈殿が日常的に80〜90%のトランスフェクション効率をもたらしますが、そのようなリポフェクタミン2000などのカチオン性脂質のトランスフェクション試薬を用いてもよい)。準備する各ウイルスの2つの15 mlコニカルチューブを準備します。 "A"と "B"のチューブにラベルする。チューブAの各10μgの:レンチウイルスシャトルベクターエンコーディング初期化因子(またはrtTAM2.2)、ウイルスパッケージングベクター、プラスミドエンコードウイルスエンベロープタンパク質、VSVg。チューブに186μlの2 M CaCl 2を追加し、滅菌H 2 Oで1.5ミリリットルにボリュームを持って来る。チューブB:1.5ミリリットル×2、HBS(室温にあらかじめ温めておいた)。
- それは均一な溶液になるまで、チューブ内の混合物をピペット。にB液を滴下して溶液を加え、2〜3分間室温で放置する。
- HEK293T細胞の増殖培地を吸引除去し、ペニシリンとストレプトマイシンずに22ミリリットルの予め温めたHEK培地と交換してください。
- ピペット合わせた溶液AB(リン酸カルシウム沈殿物)を直接細胞をHEK293Tし、緩やかに振盪して均一に分散させます。
- レンチウイルスとHEK-293T細胞のトランスフェクションの24時間後には、増殖培地を除去し、新鮮な、あらかじめ温めておいたHEK培地25mlに置き換える。インキュベーターにトランスフェクトされたHEKsを返します。
- レンチウイルスとHEK-293T細胞のトランスフェクションの48時間後には、トランスフェHEKsからレンチウイルス粒子を含有する増殖培地を収集します。 4℃で5分間、3,000×gで遠心分離により回収し、ウイルス液から微粒子を完全に除去
- 超遠心のthroによってウイルスを集中ぐふ4で112000×gで2時間、20%ショ糖クッション(2ミリリットルsucrose/25ミリリットルウイルス上清)℃優しく揺らしながら15〜30分間、4℃で0.4mlのMEF培地でウイルスペレットを一時停止します。 -80℃のシングルユースのアリコート( すなわち、50μl)でウイルス粒子を保存
2。リプログラミングマウス胚線維芽細胞(MEF)の調製
注:ここで概説プロトコルはTECアッセイにおける使用のためのE 13.5マウス胚線維芽細胞から性IPSCの導出に関する。他のグループは成人のドナー細胞源からのすべてIPSCマウスを作製しているが、我々は、他の細胞型でこのメソッドをテストしていないとドナー細胞の種類が要因ではないことを確信することはできません。
- マウス時限交配を設定します。胎生13.5日(E13.5)で、妊娠中の女性を安楽死させると子宮角から胚を解剖する。氷上1X PBSで場所や店舗の胚(4℃に予冷)。
- 胚体外組織(IEを削除絨毛膜、羊膜、胎盤)。胎児の首と尾を取り除く(オプション - ジェノタイピングのために必要な場合)と手足。ピンセットを用いて内臓、またはスコップ状のへらをかき出すとメスや鋭利なハサミの刃で残りの死体をミンチ。
- 5ミリリットル予冷1X PBSでミンチ死体を洗ってください。 5分間200×gで遠心分離します。
- 上清を吸引します。 37℃で5ミリリットル0.25%トリプシン-EDTAとインキュベート中にペレットをサスペンド℃の活発な20〜30分間振とうしながら。
- MEF培地(37℃に予め温め)、5分間、200×gで遠心分離し、ミックスの5ミリリットルを追加します。
- 予め温めておいたMEF培地で上清とペレットを再懸濁しを吸引します。
- 0.1%ゼラチンをプレコートした6ウェルプレートの2-3ウェル内プレート解離のMEF。これは通路1と見なされます。
- 1:4-1:5の希釈での通路のMEF毎に48時間。通路3でMEFはレンチウイルス形質導入のための準備が整いました。
3。 IPSCラインの導出
- レンチウイルストランスダクションの前日、0.1%ゼラチンでプレコーティングした6ウェルプレートの各ウェルに1種〜3×10 5プライマリMEFを。
- 1日目:プライマリMEFSは、レンチウイルス形質導入のための80〜90%コンフルエントになる必要があります。 37℃で一晩MEFを使用して直接、MEFメディアとインキュベートするレンチウイルス粒子を追加℃、加湿された環境で、5%CO 2。
- 翌日(2日目)は、培地を吸引し、ウイルス粒子を除去するための1X PBS 3ミリリットルで2回洗浄する。
- 37℃で細胞とインキュベートする0.5ミリリットルあらかじめ温めておいた0.25%トリプシン-EDTAを追加°時折揺らしながら3〜5分のC。
- 単細胞懸濁液を達成するためにひいて粉にする。単一細胞懸濁液を確実にするために光学顕微鏡で細胞を観察します。
- 5ミリリットルMEFメディアを含む15 mlコニカルチューブに移すのMEF。 5分間200×gで遠心分離します。 MEF培地で清と穏やかに再懸濁した細胞を吸引します。
- 均等に6 pウェルの2つのウェル間の細胞懸濁液を分割0.1%ゼラチンをプレコート後半。
- 左右に、プレートを前後に揺すると、かつてよく全体の細胞の均一な分布を達成するために円運動インチ37℃で一晩インキュベート℃、加湿された環境で、5%CO 2。
- 3日目:よく1から0.1%ゼラチンをプレコートした6ウェルプレートの3ウェルに均等にセルを分割除く手順を繰り返し4-9。これは、導入一次線維芽細胞の6ウェルをもたらすでしょう。
- 4日目:5月6日の井戸〜10μg/ mlの濃度で追加ドキシサイクリン(DOX)。一つは、よくコントロールとして機能するように治療しないまま放置しておく必要があります。
- DOXで処理された5つの井戸の1.9から3mmにVPAを追加します。 VPAは、MEFの増殖速度を低下させる。サブコン文化は2-5日以内に老化する傾向があるのに対し、MEFの密な文化がVPAに長時間さらされることを許容します。したがって、MEFは、VPAが追加された100%コンフルエントでなければなりません。注:これは既知のエピジェネティックな修飾子であり、SHであったので、私たちは私たちのリプログラミング実験にVPAを使用完全に多能性IPSC線を発生に対する効果とVPAの作用機序が知られていないものの、IPSCの発生17の効率を高めるために独自の。
- 5日目:、培地を吸引する前と細胞を洗浄し、トリプシン処理。通路細胞は新鮮なDOXおよびVPAを補ったES細胞用培地でプレコーティング10cm 2の皿にゼラチンやその他の条件のそれぞれ0.1パーセントをプレコート15センチメートル2の組織培養皿にDOX / VPAで処理した。
- 新鮮なDOXおよびVPAを補充ESC培地で毎日細胞を補充する。 ESCのようなコロニーがDOX / VPA治療における〜7日後とDOX単独治療で約10日後に現れるようになるはずです。全くコロニーはDOX治療の不在中に出現してはならない。
- かつての植民地は、明るい屈折を持って明確に定義された境界線と30から50のセルを含む、手動ゲルローディングピペットチップと0の20μlを含むU底96ウェルプレートへの転送でコロニーを分離0.25パーセントトリプシン-EDTA。単一細胞にトリプシン処理および単独のDOX / VPAまたはDOXを含む150μlのESC培地で平底96ウェルプレートでフィーダに転送されます。
- クローンのESC培地中のフィーダー上で孤立したIPSCのラインを拡大し続けています。そのほか(ポスト伝達23日目)の後19日目にDOXおよびVPAを削除します。 ESCのコントロールと同様に、自己再生または増殖率を維持していないIPSC行を破棄します。
それは、TECを実行する前にESCの関係であなたのIPSCのラインを特徴づけるために役立っているかもしれません。我々は、1)内因性の多能性細胞化学、2でマーカー(SSEA-1、あるOct4、Sox2は、NANOG))染色体計数により核型分析、3)胚様体形成の発現を私達のラインを特徴づけてきた。一つは、またプロウイルス導入遺伝子が性IPSCで表現されていないことを確認するために、レンチウイルス特異的RT-qPCRを行うことがあります。しかし、我々は唯一の形態学、免疫染色およびkaryotypを使用して、完全に多能性IPSCを同定したINGは。私たちの実験では、一般的に、潜在的に異常な核型を持つ複数の行を多能性マーカーを発現する株の過半数でのESCのような形態及び生育特性の結果に基づいてIPSC系の選択を特定している。
4。胚盤胞注入用性IPSCの調製
PSCのラインの継代数は、これが19依存の行であるかもしれませんが、その多能性を18に影響を及ぼすことが示されている。我々は、すべての成人-IPSCマウスを作製するために通路8 から 14の性IPSCを使用している。
- 融解性IPSCとESC培地中のフィーダー上にプレート。注射のため使用前にフィーダーに少なくとも一度通路が細胞。
- 70から80パーセントコンフルエント性IPSCを含む6ウェルプレートのウェル一つは、注射のための十分な細胞数以上のものを提供します。成長培地を吸引除去し、約3 mlの1X PBS(Ca 2 +の / Mg 2 +を含まない)で細胞を洗浄する。
- に0.5ミリリットルあらかじめ温めておいた0.05%トリプシン-EDTAを追加時折振盪しながら10分間37℃で細胞をインキュベートする。
- 単細胞懸濁液を達成するためにひいて粉にする。単一細胞懸濁液を確実にするために光学顕微鏡で細胞を観察します。インジェクションピペットを詰まらせます性IPSCはコロニー/細胞凝集塊のような単一細胞懸濁液に存在する必要があります。
- 単一細胞懸濁液は、ベンが達成した後、ウェルに1.0ミリリットルESCメディアを追加し、37℃のインキュベーターにプレートを返す。 〜15分間インキュベートするか、またはフィーダの過半数まで付着し始めている。
- 優しく弱く付着フィーダを取り除くしないように注意しながら性IPSCを含む培地を除去します。
- 5ミリリットルのESC培地を含む15 mlコニカルチューブに性IPSCを置きます。 5分間200×gで遠心分離します。上清を吸引除去し、マイクロピペットでES細胞用培地の残りの部分を削除します。 0.2〜0.5ミリリットル予冷FHMの培地でペレットと穏やかに再懸濁した細胞を取り除くために、チューブをタップします。四倍体Bへの注入までの間に氷の上で細胞を保存lastocysts。
5。四倍体胚盤胞の発生
このセクションで実行する手順は、他の場所で5,6,20詳細に記載されている。ここで我々はBTXエレクトロセルマニピュレータECM 2001用に最適化され私たちの技術を概説しています。
- PMSとhCGとプライミング23から28日齢の雌マウス(C57BL/6J-Tyr C-2J / BALB / cByJ F1)で胚ドナーマウスを設定します。 2PMでPMSの5 IUを投与し、HCGの47 hrの5 IU以降。 HCG注射後、C57BL/6J-Tyr C-2J / BALB / cByJのF1スタッドオスとメスのマウスを設定します。膣栓のために次の日を確認してください。
- 安楽死は、メスのマウスを接続していると卵管を収集します。ヒアルロニダーゼとFHMの卵を置いて、そっとampulaeを引き裂くことによって、1セルの胚を収集します。積雲大衆5-7分間FHM /ヒアルロニダーゼに座ることができます。
- 口ピペットを用いて1細胞期胚を収集し、KSOMにそれらを置く前にFHMのメディアの滴を通して洗う-AA文化。 37℃で培養°ミネラルオイル下℃、5%CO 2で一晩、2細胞期胚電気融合の曜日を選択し、他のすべての胚を廃棄します。
- 10cmペトリ皿にBTX Microslideを置きます。水没に溶液中でスライドを十分に室温電気融合メディアを注ぐが、それほど多くの電極の極が完全に水没していること。
- ECM 2001とBTXエンハンサー400のスイッチをオンにします。 microslideの電極にECMのケーブルを接続し、スライドの意図しない動きを防ぐために、ペトリ皿の側面にケーブルを固定します。
- BTXのエンハンサーの読み値を取得して適用されているAC / DC電流の電圧に注意することが1つの手動パルスを実行します。 AC電流は胚は、電極間に整列する速度を制御し、直流電流の割球を融合し、パルス時間は、DCパルスの長さを設定します。良い出発点は、AC 3V、直流100V、時間0.05ミリ秒です。最適なDCは、90から150ボルトの範囲で変化する。
- 口のピペットを用いて、KSOM-AAの文化30から40 2細胞胚程度かかると電気融合媒体の数滴を介してそれらを洗ってください。口ピペットにmicroslide皿から新鮮な電気融合メディアを描画し、洗浄から胚を取る。 microslide上の電極の間に1mmの隙間の中に置いてください。彼らはギャップの真ん中に、彼らがお互いに接触していないが、その位置が合っていることに注意してください。
- 手動パルスボタンを押してAC電流を適用します。割球の接触面が電極と平行になるまでの胚は、ACフィールドに回転します。胚は数秒で揃えられていない場合は、ACの設定を大きくします。
- 胚が整列した後、直流パルスを適用するには、もう一度手動パルスボタンを押してください。
- ピペットで電気融合培地で、microslideから胚を収集します。 KSOM-AAの数滴を介して胚を洗浄し、37℃KSOM-AAの文化の中に置いてください℃、5%CO 2で 。割球融合笙文化の中で30分未満で完了することがULD。
- 繰り返して、残りの2細胞期胚のための7から11を繰り返します。その後のフュージョン·グループの後、モニタおよび割球融合した胚を選択します。成功裏に融合した胚は、1細胞期のものとして認識されます。文化の中で30分後に溶解し、2セル胚を廃棄します。融合率が80%未満である場合は、5Vと0.01ミリ秒単位での電圧および/または時間を増やす。溶解率が20%を超えている場合は、それに応じて直流電圧および/または時間を短縮。我々の実験における最適な設定は、AC 4V、直流146V、そして0.07ミリ秒でした。これらの設定は、一貫してほとんど、あるいは全く溶解して90%以上の融合率が得られた。
- 37℃のミネラルオイル下KSOM-AAの微小液滴における文化融合胚℃、5%CO 2に進みます。あなたは、インキュベーションの48時間後に四倍体(4N)胚盤胞を形成するために融合胚の85から95パーセントを想定する必要があります。
6。四倍体胚盤胞への性IPSCのマイクロインジェクション
我々は、ニコンのTE-2000Uを使用する倒立顕微鏡は、胚盤胞注入用の、DIC光学とナリシゲマイクロマニピュレーターを装備。各テトラプロイド胚盤胞は、前のJove出版物5,20,21で実証されているマウスの胚盤胞にはESC注入するための標準プロトコルを使用して10月12日性IPSCを注入されて
- 凹面顕微鏡スライドの中央にFHMの20μlのドロップを置き、ミネラルオイル150μlのとそれをカバーしています。
- FHMのドロップにホールディングピペットやマイクロインジェクションニードルを下げます。両方の針が2-3分で部分的にFHMのでいっぱいにすることができます。
- FHMおよび顕微鏡スライド上にFHMのドロップへの転送の滴を通して20から30倍体胚盤胞を洗います。
- ドロップに口ピペットIPSCの混合物。それは細胞が濃すぎる、または集約された場合、事前にFHMのドロップ細胞混合物を希釈する必要があるかもしれません。
- 注射針で100から200のセルを拾う。
- 9時の仮定に内部細胞塊と胚盤胞を保持イオン。 3時の位置に透明帯と栄養膜を貫通して胞胚腔に細胞を注入します。胚盤胞あたり16から18の細胞を注入します。
- KSOM-AA文化にIPSC補完胚盤胞を返します。
7。レシピエントマウスの子宮角に補完さ四倍体胚盤胞の転送
四倍体胚盤胞補完は、外科的に私達が簡潔に要約しなければならない標準的な手法20を用いて 、研究者の研究所のガイドラインに従って女性レシピエントマウスの子宮角に転送されます。プロ発情期の段階で雌性CD-1マウスを選択し、精管切除した雄との交配のためにそれらを設定します。翌朝膣栓を確認してください。女性はプラグが検出された2日後に子宮胚移植(2.5 DPC)のための準備が整いました。
レシピエント雌は精管切除雄と交配される前に、ある日、非精管切除した雄と追加のCD-1雌を設定する帝王切開によって取得されたすべての-IPSCマウスについて仮親として使用することができます。
8。 IPSC由来子犬の帝王切開と育成
移植後に複数の吸収胚のTC胚の転送では、通常は、IPSCやESCラインが高い発生能を持っている場合でも。結果として、1つは、受信者ごとに4つの実行可能な仔(通常1-2)以上でないことを期待することができます。これらの小さな仔は通常、受信者によって無視されている。新生児医療のレベルと生存率を高めるために、我々は帝王切開を行い、標準的なプロトコル20によれば育成。帝王切開を実行するには、7-8PM(レシピエント18.5 DPC)で16日胚移植後にレシピエントマウスを安楽死させると子宮角から子犬を解剖する。同日リットルを納入したCD-1の母親に実行可能な子犬を育てる。
結果
In step 3, "Derivation of iPSCs from MEFs", one should observe morphological heterogeneity and immature iPSC colony formation starting 4-5 days after doxycycline/VPA addition and mature colonies between 7-10 days (Figure 2). The production of one-cell tetraploid embryos in step 5 is highly efficient (Figure 3). We routinely observe up to 95% of treated two-cell embryos successfully fuse to produce tetraploid one-cell embryos. The protocol followed to inject iPSCs into tetraploid blastocysts (Step 6, Figure 4) is similar to the protocol for injection of ESCs into diploid blastocysts to generate chimeric mice, and can be performed by an experienced microinjectionist. The number of live pups born depends on the cell line (Table 1).
| MEF preprogramming efficiency 0.01-0.03% | ||||
| Efficiency of iPSC mouse production by TEC | ||||
| Name | Description | Blastocysts injected | Live Newborn | Live Adult |
| iMZ-21 | iPSC | 867 | 53 (6.1%) | 19 (2.2%) |
| iMZ-9 | iPSC | 195 | 7 (3.6%) | 4 (2.1%) |
| iMZ-11 | iPSC | 338 | 1(0.3%) | 0 (0%) |
Table 1. Representative Results.
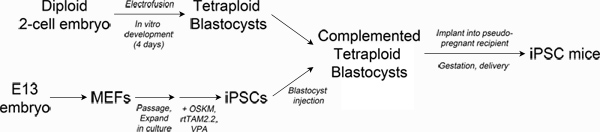
Figure 1. Schematic of experimental design. Top left: Production of tetraploid blastocysts. Fertilized two-cell embryos from albino mice are electrofused to generate tetraploid one-cell embryos, which are cultured in vitro to the blastocyst stage. Bottom left: Reprogramming. Mouse embryonic fibroblasts are transduced with lentiviral particles encoding Oct4, Sox2, Klf4 and c-Myc and the reverse tetracycline transactivating protein, rtTAM2.2. Addition of doxycycline results in transgene expression and the initiation of reprogramming to iPSCs. Right: Production of iPSC mice. iPSCs derived from pigmented mice are injected into the blastocoel of tetraploid blastocysts and then surgically implanted into pseudo-pregnant recipient mice. Newborn iPSC mice are delivered by Caesarian section and cross-fostered. Click here to view larger figure.
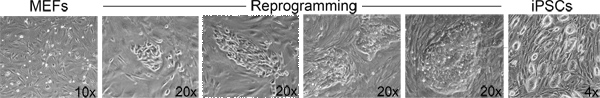
Figure 2. Morphological changes associated with reprogramming. From left to right: Examples of the morphological progression from fibroblasts to iPSC colonies during the course of a reprogramming experiment. Click here to view larger figure.

Figure 3. Production of tetraploid embryos. Diploid two-cell embryos are subjected to an electric pulse resulting in blastomere fusion and generation of one-cell tetraploid embryos.
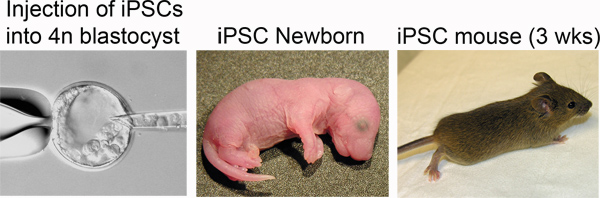
Figure 4. Production of iPSC mice. Left: iPSCs are injected into the blastocoel of a tetraploid blastocyst. Middle: Newborn iPSC mice are distinguished by pigmented eyes. Right: iPSC mouse at three weeks post-delivery.
ディスカッション
TECのアッセイを用いて、IPSCラインからマウスを生成すると、IPSCラインの多能性のための厳しい機能テストを提供しています。このテストでは、異なるプログラミング方法の相対的な有効性を評価したり、 試験管内で特定の種類の細胞を生成するための最も有用であろうIPSC行を識別するために、役に立つかもしれません。性IPSCから生成されたマウスは厳しくIPSC由来の組織の長期安定性と発癌性をテストするために使用されるかもしれません。このプロトコルは、完全に多能性IPSC IPSC線やマウスを作製したり、別のプログラミング方法の相対的な効用を比較するために希望する研究者に有用であろう。
完全に多能性IPSCの発生と同定は十分に理解のまま、それがこの方法を用いて製造ラインが一部IPSC TEC試験に合格しない可能性があります制御メカニズム。多くの要因が遺伝的背景、レンチウイルス力価は、レンチウイルスのパターンiを含む実験の間で異なるかもしれませんnsertion、ドナー集団の細胞周期パラメータは、TECの手順の様々なステップと性IPSCの変数性癖で研究室間の違いは遺伝的またはエピジェネティックな異常を抱いています。最高の成功を確実にするために、我々はそれぞれのウイルスが十分に検出可能な遺伝子発現を少なくとも80%との理想的には100%を生産するために集中していることを保証するためにコントロールのMEFのウイルス希釈液をテストすることにより、IPSC導出実験におけるレンチウイルス遺伝子発現の適切な水準を確立するために世話をするMEFに。これは過密井戸なしでのMEFと生産コロニーへの毒性を制限しながら、私たちは異なるレンチウイルスの複数のコピーを持つ行を識別することができます。これは、複数の他のプロトコルが完全多能性への複数のパスが1,8-13,15が存在するかもしれないことを示唆する複数の方法やドナー細胞の光源を使用し、完全発達可能性を秘めた性IPSCを生成することが示されている点に留意する必要がある。しかし現在は、完全に多能性IPSCのない決定的なバイオマーカー識別され、それゆえのTECアッセイはIPSCラインは生物のすべての細胞系譜を生成できるかどうかのゴールドスタンダードテスト残っています。
開示事項
特別な利害関係は宣言されません。
謝辞
KKB、MJB、ジーザスライフハウスとKLNへのサポートは、カリフォルニア再生医療研究所、ピュー慈善トラストメディカル奨学金プログラム、エスター·B·オキーフファミリー財団とシャピロファミリー財団によって提供されました。 KKBはドナルドE.とデリアB.バクスター財団学部学者である。
資料
| Name | Company | Catalog Number | Comments |
| DMEM (high glucose) | Invitrogen | 11965-092 | |
| ES cell qualified FBS | Invitrogen | 104392-024 | |
| FBS | Invitrogen | 16140-071 | |
| Glutamax | Invitrogen | 35050-061 | |
| β-Mercapt–thanol | Sigma | Sigma M7522 | |
| 0.1% Gelatin | Millipore | ES006-B | |
| MEM Non-Essential Amino Acids | Invitrogen | 11140 | |
| Medium 199 | Invitrogen | 11150-059 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| ESGRO (murine LIF) | Millipore | ESG1106 | |
| Valproic Acid | Sigma | P4543 | |
| DMSO | Fisher | BP231-100 | |
| 0.25% Trypsin-EDTA | Invitrogen | 25200 | |
| PBS Ca2+/Mg2+ | Invitrogen | 14040-133 | |
| PBS Ca2+/Mg2+ free | Invitrogen | 14190-144 | |
| Pregnant mare serum gonadotropin, for superovulation, freeze-dried, 2,000 IU | Harbor-UCLA Research Institute | n/a | |
| Chorionic gonadotropin, human | Sigma | C1063 | |
| FHM medium with Hyaluronidase | Millipore | MR-056-F | |
| KSOM-1/2 AA medium | Millipore | MR-106-D | |
| FHM | Millipore | MR-024-D | |
| Water, for embryo transfer, embryo tested | Sigma | W1503 | |
| Mineral oil, embryo tested | Sigma | M5310 | |
| CaCl2 | Sigma | C7902 | |
| MgSO4 | Sigma | M2773 | |
| D-Mannitol | Sigma | M4125 | |
| Bovine serum albumin (BSA), embryo tested | Sigma | A3311 | |
| Mouse embryonic fibroblasts, non-irradiated | Millipore | PMEF-CFL | |
| Media and buffers used in this protocol HEK293T growth medium. 90% DMEM, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Exclude penicillin and streptomycin from HEK media used on day of transfection. HEK medium can be stored at 4 °C for up to 1 month. 2x HBS. 42 mM Hepes, 274 mM NaCl, 10 mM KCl, 1.5 mM Na2HPO4·7H2O, 12 mM Dextrose. pH to 7.1 +/- 0.1. pH is critical! Sterile filter and store at 4 °C. Mouse embryonic fibroblast (MEF) growth medium (also for use with feeders). 70% DMEM, 20% Medium 199, 10% FBS, 100 U/ml penicillin and 10 mg/ml streptomycin. Store at 4 °C for up to 1 month. ESC growth medium. 85% DMEM,15% ES cell qualified FBS, 1x Glutamax, 0.1 mM non-essential amino acids, 0.1 mM β-mercapt–thanol, 1,000 U/ml ESGRO, 100 U/ml penicillin and 10 mg/ml streptomycin. ESC media can be stored at 4 °C for up to three weeks. Electrofusion medium. 0.3 M Mannitol, 0.1 mM MgSO4, 50 mM CaCl2, and 3% BSA in embryo tested water. Store at 4 °C for up to 3 months. | |||
参考文献
- Boland, M. J., et al. Adult mice generated from induced pluripotent stem cells. Nature. 461, 91-94 (2009).
- Robinton, D. A., Daley, G. Q. The promise of induced pluripotent stem cells in research and therapy. Nature. 481, 295-305 (2012).
- Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W., Roder, J. C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America. 90, 8424-8428 (1993).
- Eggan, K., et al. Hybrid vigor, fetal overgrowth, and viability of mice derived by nuclear cloning and tetraploid embryo complementation. Proc. Natl. Acad. Sci. U.S.A. 98, 6209-6214 (2001).
- Eggan, K., Jaenisch, R. Generation of embryonic stem (ES) cell-derived embryos and mice by tetraploid-embryo complementation. , Springer. (2006).
- McLaughlin, K. J. Production of tetraploid embryos by electrofusion. Methods Enzymol. 225, 919-930 (1993).
- Humpherys, D., et al. Epigenetic instability in ES cells and cloned mice. Science. 293, 95-97 (2001).
- Kang, L., Wang, J., Zhang, Y., Kou, Z., Gao, S. iPS cells can support full-term development of tetraploid blastocyst-complemented embryos. Cell Stem Cell. 5 (09), 135-138 (2009).
- Zhao, X. Y., et al. iPS cells produce viable mice through tetraploid complementation. Nature. 461, 86-90 (2009).
- Kang, L., et al. Viable mice produced from three-factor induced pluripotent stem (iPS) cells through tetraploid complementation. Cell Res. 21, 546-549 (2011).
- Zhao, X. -Y., et al. Viable Fertile Mice Generated from Fully Pluripotent iPS Cells Derived from Adult Somatic Cells. Stem Cell Reviews and Reports. 6, 390-397 (2010).
- Han, J., et al. Tbx3 improves the germ-line competency of induced pluripotent stem cells. Nature. 463, 1096-1100 (2010).
- Stadtfeld, M., et al. Ascorbic acid prevents loss of Dlk1-Dio3 imprinting and facilitates generation of all-iPS cell mice from terminally differentiated B cells. Nat. Genet. 44, 398-405 (2012).
- Stadtfeld, M., et al. Aberrant silencing of imprinted genes on chromosome 12qF1 in mouse induced pluripotent stem cells. Nature. 465, 175-181 (2010).
- Carey, B. W., et al. Reprogramming factor stoichiometry influences the epigenetic state and biological properties of induced pluripotent stem cells. Cell Stem Cell. 9, 588-598 (2011).
- Go, W. Y., Ho, S. N. Optimization and direct comparison of the dimerizer and reverse tet transcriptional control systems. The Journal of Gene Medicine. 4, 258-270 (2002).
- Huangfu, D., et al. Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds. Nature. 26, 795-797 (2008).
- Li, X. -y, et al. Passage number affects the pluripotency of mouse embryonic stem cells as judged by tetraploid embryo aggregation. Cell and Tissue Research. 327, 607-614 (2007).
- George, S. H. L., et al. Developmental and adult phenotyping directly from mutant embryonic stem cells. Proceedings of the National Academy of Sciences. 104, 4455-4460 (2007).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. Manipulating the mouse embryo: A laboratory manual. , Cold Spring Harbor Laboratory Press. (2003).
- Kirak, O., et al. Transnuclear Mice with Pre-defined T Cell Receptor Specificities Against Toxoplasma gondii Obtained Via SCNT. J. Vis. Exp. (43), e2168(2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved