A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل الخلايا الجذعية للسرطان من العينات البشرية سرطان البروستاتا
In This Article
Summary
عزل الخلايا الجذعية السرطانية (الخلايا الجذعية السرطانية) مباشرة من الأنسجة البشرية اللازمة لتوصيف البيولوجية. يصف هذا المخطوط منهجية لعزل الخلايا الجذعية السرطانية في البروستاتا من الأنسجة البشرية، مع توفير النصائح حول استكشاف الأخطاء وإصلاحها الخطوات الصعبة.
Abstract
وقد نموذج سرطان الخلايا الجذعية (CSC) النظر إلى حد كبير على مدى العقدين الماضيين. خلال هذا الوقت تم تحديد الخلايا الجذعية السرطانية ومعزولة مباشرة من الأنسجة البشرية ونشر متسلسل في الفئران العوز المناعي، وعادة من خلال وضع العلامات الضد من مجموعات سكانية فرعية من الخلايا وتجزئة من قبل التدفق الخلوي. ومع ذلك، فإن المظاهر السريرية فريدة من سرطان البروستاتا قد حدت كثيرا من دراسة الخلايا الجذعية السرطانية في البروستاتا من عينات الورم الإنسان الطازجة. نحن ذكرت مؤخرا عزل الخلايا الجذعية السرطانية في البروستاتا مباشرة من الأنسجة البشرية بحكم فئة HLA على النمط الظاهري الأول (HLAI) سلبية. ويتم حصاد خلايا سرطان البروستاتا من العينات الجراحية وفصلها ميكانيكيا. يتم إنشاء تعليق خلية وصفت مع HLAI وانسجة الأجسام المضادة مترافق fluorescently. يتم عزل مجموعات سكانية فرعية من الخلايا HLAI سلبية أخيرا باستخدام تدفق عداد الكريات. القيد الرئيسي لهذا البروتوكول هي طبيعة كثير من الأحيان المجهرية ومتعدد البؤر للالسرطان الأولية في عينات البروستاتا. مع ذلك، الخلايا الجذعية السرطانية معزولة البروستاتا الحية هي مناسبة للالتوصيف الجزيئي والتحقق من صحة وظيفية عن طريق زرع في الفئران العوز المناعي.
Introduction
ويعتبر عدم التجانس Intratumoral أن تكون السمة المميزة للسرطان 1. في الواقع، وقد وصفت عدة آليات من عدم التجانس intratumoral، بما في ذلك الطفرة الجينية والتفاعل مع المكروية. بالإضافة إلى ذلك، قد تحتوي بعض أنواع السرطان التسلسل الهرمي الخلوية مع جزء من السكان من الخلايا الجذعية السرطانية (الخلايا الجذعية السرطانية) التي يسلك خصائص القدرات بدء الورم والتجديد الذاتي في المسلسل المقايسات زرع 2-5. وصفت في البداية في الدم 6، 7 الثدي، والدماغ 8 الأورام الخبيثة، كما تم دراسة الخلايا الجذعية السرطانية في سرطان البروستاتا 9-12 وكذلك أنواع الأورام الأخرى 2-5.
وتعتبر الخلايا الجذعية السرطانية عموما جزء الخلوية ضمن مجموعة من السكان غير متجانسة 2-5. وبالتالي، فإن توصيف وظيفي والجزيئية الخلايا الجذعية السرطانية يتوقف على تخصيب بهم من السكان بكميات كبيرة. وفقا لذلك، وخلال العقدين الماضيين عدة التقىوقد وضعت hodologies تخصيب CSC التي تنطوي عادة على الفصل بين السكان وصفت من قبل التدفق الخلوي. بالإضافة إلى ذلك، النظر كبيرة في دراسة الخلايا الجذعية السرطانية هي أن التنظيم الهرمي للأنسجة البشرية قد تعطلت بسبب التلاعب التجريبية مثل الركض المسلسل في الثقافة أو العوز المناعي الفئران. ونتيجة لذلك، برزت العزلة المباشر من الخلايا الجذعية السرطانية من الأنسجة البشرية باعتبارها منهجية مهمة في مجال CSC.
سرطان البروستاتا هو السبب الرئيسي للمراضة والوفيات بالسرطان في الولايات المتحدة وحول العالم 13. وبالتالي، فإن العزلة وتوصيف الخلايا الجذعية السرطانية في البروستاتا البيولوجية هو من مصلحة كبيرة. سبق المخصب الخلايا الجذعية السرطانية في البروستاتا من خطوط الخلايا، والمريض المستمدة xenografts، ومرور منخفض المريض المستمدة الثقافات التعليق 9،10،12،14.
نحن ذكرت مؤخرا عزل الخلايا الجذعية السرطانية في البروستاتا مباشرة من ق الجراحية الإنسانamples بحكم بهم، HLAI السلبية سطح الخلية النمط الظاهري 10. نحن هنا بالتفصيل الإجراءات التي تم تنفيذها لعزل هذه الخلايا. ويتم حصاد أورام البروستاتا من العينات الجراحية وتقدم الى الايقاف الخلية. ثم هي ملطخة الخلايا باستخدام أجسام مضادة ضد HLAI فضلا عن اللحمية والجدوى علامات، ويتم عزل الخلايا الجذعية السرطانية عن طريق تنشيط الخلايا مضان الفرز (FACS). ويمكن بعد ذلك الخلايا الجذعية السرطانية المعزولة أن تستخدم لفحوصات تتطلب خلايا قابلة للحياة.
Protocol
1. حصاد وتجهيز الإنسان سرطان البروستاتا الأنسجة من العينات الجراحية
- إعداد اثنين من 50 مل البوليسترين أنابيب مخروطية تحتوي على 15 مل من معهد روزويل بارك التذكاري (RPMI) 1640 مستنبت تستكمل مع 10٪ مصل بقري جنيني (FBS) و 1٪ البنسلين / الستربتوميسين.
- موظفي الخدمة الباثولوجيا حصاد البروستاتا النقيلي العينات الأولية وسرطان البروستاتا وجراحة من الملطفة العينات، على التوالي، في إطار مجلس المراجعة المؤسساتي وافق البروتوكول. ويمكن الحصول على عينات من النقيلي الليمفاوية تشريح العقدة أثناء الجراحة الأولية، وفقرات خلال الإجراءات الجراحية الملطفة، مثل الضغط الحبل الشوكي، والرئتين أثناء إزالة تشخيص الآفات النقيلي واحدة، من بين آخرين.
- حصاد الأنسجة الزائدة الأكبر يست هناك حاجة للتشخيص السريري في أول 50 مل البوليسترين المخروطية أنبوب من الخطوة 1.1 وتخزينها على الفور في 4 درجات مئوية. والمقطوعد الأنسجة ينبغي قياس ما لا يقل عن 4-5 سم 2 في منطقة و1-2 سم في السمك.
- معالجة العاملين في المختبرات الأنسجة السائبة الحصول عليها من خدمة علم الأمراض استعدادا للفحص النسيجي وجيل من الايقاف الخلية.
- تجهيز الأنسجة الأكبر يجب أن لا تتجاوز 24 ساعة من استئصال الجراحي من أجل ضمان بقاء الخلية القصوى.
- العمل في مجلس الوزراء للسلامة الأحيائية مع مشرط معقم وملقط، واتخاذ 2-4 مم أقسام الأنسجة الأفقي من العقيدات الورم العيانية. تخزين فورا المقاطع في الثانية 50 مل البوليسترين المخروطية أنبوب من الخطوة 1.1.
- عندما لا يتم تصور العقيدات العيانية من عينات البروستاتا، وجمع عشوائي 2-4 مم أقسام الأنسجة الأفقي من الفص الخلفي ومنطقة انتقالية.
- فصل جزء من الأنسجة الجراحية باستخدام مشرط معقم وملقط وإصلاحه في 10٪ من الفورمالين قبل جنسانشوئها من الايقاف الخلية. أرشيف وتحليل هذه المواد تشريحيا لتأكيد وجود أنسجة سرطان البروستات.
2. جيل من تعليق خلية من أقسام الأنسجة
- العمل في مجلس الوزراء للسلامة الأحيائية العقيمة، ونقل قسم الأنسجة لمم طبق ثقافة 60 × 15 يحتوي على 1 مل من العقيمة 1X الفوسفات مخزنة المالحة (PBS).
- ميكانيكيا يسحن العينة باستخدام مشرط معقم وملقط.
- لا الهضم الأنزيمي في هذا البروتوكول.
- نقل تعليق 1 مل إلى 50 مل العقيمة أنبوب مخروطي.
- إضافة 1 مل إلى الطبق الثقافة وكرر الخطوة حتى يتم فصلها سحن قسم الأنسجة تماما، وعادة 3-4X.
- كرر هذا الإجراء بشكل متسلسل حتى يتم فصلها عن أقسام الأنسجة.
- resuspend ومحتويات 50 مل أنبوب البوليسترين المخروطية مع 5 مل بي المصليةpette ودوامة في أقصى سرعة (حوالي 3،200 دورة في الدقيقة) لمدة 1 دقيقة.
- تحديد التعليق الناتجة من خلال مصفاة الخلية 35 ميكرومتر وجمع في 50 مل العقيمة البوليسترين أنبوب مخروطي الشكل الثاني.
- توليد بيليه بواسطة الطرد المركزي في 450 x ج لمدة 10 دقيقة.
- تجاهل طاف، resuspend الكرية مع 5 مل من الدم الحمراء العازلة تحلل الخلية، واحتضان الحل لمدة 5 دقائق على RT. إزالة الدم الحمراء العازلة تحلل الخلايا بواسطة الطرد المركزي لمدة 5 دقائق في 450 XG في RT.
- تجاهل طاف، resuspend وبيليه في برنامج تلفزيوني 1X تستكمل مع 5٪ FBS، وتحديد عدد الخلايا (الأزرق التريبان السلبية) قابلة للحياة باستخدام عدادة الكريات أو خلية مكافحة الآلي. تولد الخلايا 1x10 6 / مل تعليق وتخزينها على الجليد لمدة لا تزيد عن 1 ساعة.
- الجدوى والعائد من الخلايا قد تختلف اختلافا كبيرا بين عينات الورم. في الإعداد للبروستاتا، قد تتراوح ما بين 45-70 الجدوى٪، وفايلقد 2-4 ملم قد يكون من المتوقع أن تسفر تقريبا 3X10 6 خلايا قابلة للحياة أقسام الأنسجة الأفقي سميكة من العقيدات الورم العيانية.
3. تلوين الأجسام المضادة للخلايا لنظام مراقبة الأصول الميدانية
- تسمية خمسة البوليسترين 15 مل أنابيب مخروطية كما هو مبين أدناه. استخدام CD45 CD31 ووضع العلامات مستضد لاستبعاد العناصر المكونة للدم والبطانية، على التوالي.
- طاهر
- مفتش 2A κ-PE + 1 مفتش κ-FITC
- HLAI-PE + 1 مفتش κ-FITC
- مفتش 2A κ-PE-CD31 + CD45 + FITC-FITC
- HLAI-PE-CD45 + CD31 + FITC-FITC
- توزيع تعليق خلية كميا من المقطع السابق (الخطوة 2.7) في أنابيب خمسة في الخطوة 3.1. إضافة الأجسام المضادة في التخفيف من 1:250، واحتضان الايقاف الخلية على الجليد لمدة 30 دقيقة.
- الطرد المركزي الخلايا في 450 x ج لمدة 3 دقائق في 4 درجات مئوية، وتجاهل supernatants.
- غسل الخلايا عن طريق إعادة التعليق بيليه مع كل العقيمة برنامج تلفزيوني 1X تستكمل مع FBS 10٪ تليها الطرد المركزي في 450 x ج لمدة 3 دقائق في 4 درجات مئوية.
- resuspend الخلايا في 1 مل من محلول يحتوي على برنامج تلفزيوني 1X 4 '،6-diamidino-2-phenylindole (دابي) في تركيز 10 ميكروغرام / مل.
- تحديد الحل النهائي من خلال 35 ميكرون قبعات مصفاة إلى 12 ملم × 75 ملم أنابيب البوليسترين.
4. عزل الخلايا الجذعية السرطانية البروستات بواسطة نظام مراقبة الأصول الميدانية
- الاستفادة من تدفق عداد الكريات للفرز الخلية.
- وضع ضوابط التعويض باستخدام خلايا من أنابيب # 1، # 2، # 3، ورقم 4.
- إنشاء البوابات التي تستبعد الحطام ومجموعات من الخلايا باستخدام المعلمات إلى الأمام والجانب مبعثر.
- إنشاء FITC وPE باستخدام بوابات تعليق من أنبوب # 3 و # 4 أنبوب، على التوالي.
- بوابة قابلة للحياة الخلايا (دابي السلبية) باستخدام المحيط الهادئ الأزرق قناة.
- باستخدام أنبوب # 5 تجاهل الخلايا CD31-CD45 إيجابي وإيجابية وجمع كل من السكان HLAI سلبية وإيجابية في HLAI العقيمة 15 مل أنابيب البوليسترين المخروطية التي تحتوي على 2 مل من RPMI تستكمل مع FBS 10٪.
- أجهزة الطرد المركزي لفرز الايقاف الخلية في 450 x ج لمدة 5 دقائق، ثم resuspend والكريات في 200-500 ميكرولتر من RPMI تستكمل مع FBS 10٪.
- تحديد الخلايا (الأزرق التريبان السلبية) قابلة للحياة باستخدام عدادة الكريات أو خلية مكافحة الآلي.
النتائج
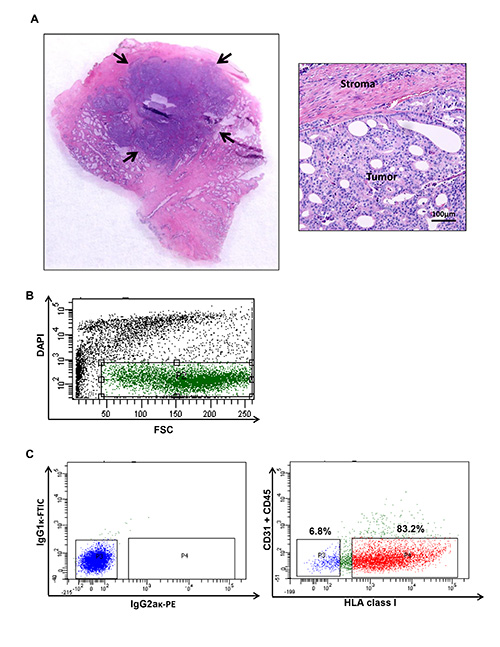
الشكل 1. البروستاتا البشرية الحصاد ورم السرطان والتدفق الخلوي مؤامرة توضح فئات معينة من السكان من سرطان البروستاتا الذي يصيب الانسان. (A) ويتم حصاد العقي?...
Discussion
يصف هذا البروتوكول عزلة الخلايا الجذعية السرطانية من أنسجة سرطان البروستاتا البشرية الطازجة. عدة اعتبارات هامة تؤثر على نتيجة ناجحة من هذا البروتوكول.
استعادة أعداد كبيرة من خلايا سرطان البروستاتا قابلة للحياة تعتمد على تقييم ?...
Disclosures
أعلن عن أي تضارب في المصالح.
Acknowledgements
وأيد هذا العمل من قبل مؤسسة الحريري ومؤسسة الأسرة TJ مارتل.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
References
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved