Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Isolierung von Krebs Stammzellen aus menschlichen Prostatakrebs-Proben
In diesem Artikel
Zusammenfassung
Die Isolierung von Krebsstammzellen (KSZ), die direkt aus menschlichen Geweben ist Voraussetzung für ihre biologische Charakterisierung. Dieses Manuskript beschreibt eine Methode zur Isolierung von Prostata-Krebsstammzellen aus menschlichen Geweben, aber auch mit Tipps zur Fehlerbehebung schwierige Schritte.
Zusammenfassung
Die Krebsstammzellen (CSC)-Modell wurde erheblich in den letzten zwei Jahrzehnten revisited. Während dieser Zeit KSZ wurden identifiziert und direkt isoliert aus menschlichen Geweben und seriell in immundefizienten Mäusen propagiert, typischerweise durch Antikörpermarkierung von Subpopulationen von Zellen und Fraktionierung mittels Durchflusszytometrie. Allerdings haben die einzigartigen klinischen Eigenschaften von Prostatakrebs erheblich begrenzt das Studium der Prostata KSZ von frischen menschlichen Tumorproben. Wir berichteten kürzlich über die Isolierung der Prostata-Krebsstammzellen direkt aus menschlichen Geweben durch ihre HLA-Klasse-I (hlai)-negative Phänotyp. Prostatakrebszellen aus chirurgischen Proben entnommen und mechanisch dissoziiert. Eine Zellsuspension erzeugt und mit Fluoreszenz-konjugierte hlai und Stromazellen Antikörpern markiert. Subpopulationen von hlai-negativen Zellen werden schließlich mit einem Durchflusszytometer isoliert. Die wichtigste Einschränkung dieses Protokoll ist das häufig mikroskopischen und multifokale Naturprimären Krebs in Prostatektomie Proben. Dennoch sind isolierter lebender Prostata-Krebsstammzellen für die molekulare Charakterisierung und funktionellen Validierung durch Transplantation bei immungeschwächten Mäusen.
Einleitung
Intratumorale Heterogenität wird als ein Kennzeichen von Krebs 1 sein. Tatsächlich mehrere Mechanismen der intratumoralen Heterogenität beschrieben wurden, einschließlich genetischer Mutation und Wechselwirkungen mit der Mikroumgebung. Darüber hinaus können einige Krebsarten eine zelluläre Hierarchie mit einer Subpopulation von Krebsstammzellen (KSZ), die die Eigenschaften tumorinitiierende Kapazität und Selbsterneuerung in serielle Transplantation Assays 2-5 zeigt enthalten. Zunächst in hämatologischen 6, Brust 7 und 8 Malignitäten des Gehirns beschrieben, wurden auch in KSZ Prostatakrebs 9-12 sowie andere Tumortypen 2-5 untersucht.
CSCs werden im Allgemeinen als ein Zellfraktion innerhalb einer heterogenen Bevölkerung 5.2. Daher ist die funktionelle und molekulare Charakterisierung von CSC ist abhängig von ihrer Anreicherung von Großgruppen. Dementsprechend wird während der letzten zwei Jahrzehnte mehreren erfüllthodologies von CSC Bereicherung entwickelt worden, welche typischerweise die Trennung von markierten Populationen mittels Durchflusszytometrie. Darüber hinaus ist eine wichtige Überlegung bei der Untersuchung von CSC dass die hierarchische Organisation von menschlichen Geweben können durch experimentelle Manipulationen wie serielle Passagen in Kultur oder immundefizienten Mäusen gestört werden. Als Ergebnis wurde die direkte Isolierung des CSC aus menschlichen Geweben als wichtige Methodik im Bereich CSC entstanden.
Prostatakrebs ist eine der häufigsten Ursachen von Krebs Morbidität und Mortalität in den Vereinigten Staaten und der ganzen Welt 13. Daher ist von erheblichem Interesse die Isolierung und biologische Charakterisierung von Prostata-Krebsstammzellen. Prostata-CSCs zuvor aus Zelllinien, Patienten abgeleitet Xenografts und niedrige Durchgang Patienten abgeleitet Suspensionskulturen 9,10,12,14 bereichert.
Wir berichteten kürzlich über die Isolierung der Prostata-Krebsstammzellen unmittelbar aus der Menschen chirurgischen sBeispiele aufgrund ihrer hlai-negative Zelloberflächen-Phänotyp 10. Hier werden wir ausführlich die für die Isolierung dieser Zellen implementierten Verfahren. Prostatatumoren aus chirurgischen Proben entnommen und in Zellsuspensionen hergestellt. Die Zellen werden dann unter Verwendung von Antikörpern gegen hlai sowie Stromazellen und Lebensfähigkeit Marker gefärbt und CSC werden durch Fluoreszenz-aktivierte Zellsortierung (FACS) isoliert. Isoliert CSCs können dann für Tests lebensfähigen Zellen erfordern verwendet werden.
Protokoll
1. Ernte und Verarbeitung von menschlichen Prostatakrebs-Gewebe von chirurgischen Proben
- Man stellt zwei 50-ml-Polystyrolröhrchen, konische 15 ml Roswell Park Memorial Institute (RPMI) 1640-Kulturmedium mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin.
- Pathologie Service-Personal ernten primären und metastatischen Prostatakrebs Proben von Prostatektomie und palliative Operationen Proben jeweils unter einem Institutional Review Board genehmigt Protokoll. Proben können von metastatischen Lymphknoten Dissektion während der ersten Operation erhalten werden, die Wirbel während palliative chirurgische Verfahren, wie Rückenmarks Dekompression und die Lungen während der diagnostischen Entnahme einzelner Metastasen, unter anderem.
- Ernten überschüssige Masse Gewebe in den ersten 50 ml konischen Röhrchen aus Polystyrol Schritt 1.1 nicht in der klinischen Diagnostik notwendig und sofort bei 4 ° C. Die Harvested Gewebe sollte mindestens 4-5 cm 2 groß und 1-2 cm Dicke zu messen.
- Das Laborpersonal verarbeiten, die von der Pathologie-Service in der Vorbereitung für die histologische Untersuchung und Erzeugung von Zellsuspensionen erhalten Groß Gewebe.
- Verarbeitung von Groß Gewebe sollte 24 Stunden von chirurgischen Resektion, um eine maximale Zelllebensfähigkeit garantieren nicht überschreiten.
- Die Arbeit in einem biologischen Sicherheitsschrank mit einem sterilen Skalpell und Pinzette, nehmen Sie 2-4 mm dicken horizontalen Gewebeschnitte von makroskopischen Tumorknoten. Die Abschnitte in der zweiten 50 ml konischen Röhrchen aus Polystyrol Schritt 1.1 sofort zu speichern.
- Wenn makroskopische Knötchen werden nicht von Prostatektomie-Proben sichtbar, sammeln Zufalls 2-4 mm dicken horizontalen Gewebeschnitte von der Hinterlappen und Übergangszone.
- Trennen Sie einen Teil der OP-Gewebe mit einem sterilen Skalpell und Pinzette und fixieren Sie sie in 10% Formalin vor Gattungention von Zellsuspensionen. Archiv und zu analysieren, dieses Material histologisch um das Vorhandensein von Prostatakrebsgewebe bestätigen.
2. Generierung von Zellsuspensionen aus Gewebeschnitten
- Arbeiten in einem sterilen biologischen Sicherheitswerkbank, zu übertragen, um einen Gewebeschnitt 60 x 15 mm-Kulturschale, die 1 ml steriles 1x phosphatgepufferter Kochsalzlösung (PBS).
- Mechanisch verreiben die Probe mit einem sterilen Skalpell und Pinzette.
- Keine Enzymaufschlüsse sind in diesem Protokoll.
- Übertragen Sie die 1 ml Suspension in ein steriles 50 ml konischen Röhrchen.
- 1 ml in die Kulturschale und wiederholen Sie den Vorgang, bis Verreiben der Gewebeschnitt vollständig dissoziiert, normalerweise 3-4x.
- Wiederholen Sie diesen Vorgang, bis alle seriell Gewebeschnitte wurden dissoziiert.
- Resuspendieren der Inhalt des 50-ml-Polystyrol konischen Rohrs mit einer 5 ml serologische piPette und Wirbel bei maximaler Geschwindigkeit (ca. 3200 UpM) für 1 min.
- Filtern Sie die erhaltene Suspension durch ein 35-um-Zelle Sieb und sammeln in einen zweiten sterilen 50 ml konischen Röhrchen Polystyrol.
- Generieren Sie eine Pellet durch Zentrifugation bei 450 g für 10 min.
- Überstand verwerfen, das Pellet mit 5 ml rote Blutkörperchen Lysepuffer und Inkubation der Lösung für 5 min bei RT. Entfernen der roten Blutkörperchen Lysepuffer durch Zentrifugation für 5 min bei 450 · g bei RT.
- Überstand verwerfen, das Pellet in 1x PBS, ergänzt mit 5% FBS und zu quantifizieren, die Anzahl der lebensfähigen (Trypanblau-negative) Zellen mit einer Zählkammer oder automatische Zellzähler. Generieren Sie eine 1x10 6 Zellen / ml Suspension und speichern Sie es auf Eis nicht mehr als 1 Stunde.
- Die Lebensfähigkeit und die Ausbeute der Zellen können sich zwischen Tumorproben variieren. In der Prostatektomie Einstellung können Lebensfähigkeit zwischen 45-70% und fi reichenve 2-4 mm dicken horizontalen Gewebeschnitte von einer makroskopischen Tumorknoten zu annähernd 3x10 6 lebensfähigen Zellen ergeben.
3. Antikörper-Färbung der Zellen für die FACS-
- Beschriften Sie fünf 15 ml konische Röhrchen Polystyrol wie unten gezeigt. Verwenden CD45 und CD31-Antigen Kennzeichnung hämatopoetische und endotheliale Elemente nicht auf.
- Unbefleckt
- IgG 2a-PE κ + IgG1 κ-FITC
- Hlai-PE + IgG κ 1-FITC
- IgG 2a κ-PE + CD31-FITC + CD45-FITC
- Hlai-PE + CD45-FITC + CD31-FITC
- Verteilen Sie die quantifizierten Zellsuspension aus dem vorherigen Abschnitt (Schritt 2.7) in die fünf Rohre in Schritt 3.1. Fügen Sie die Antikörper in einer Verdünnung von 1:250 und bebrüten die Zellsuspensionen auf Eis für 30 min.
- Zentrifugieren Sie die Zellen bei 450 g für 3 min bei 4 ° C, und entsorgen Sie die Überstände.
- Die Zellen werden durch Resuspendieren jedes Pellet mit sterilem 1x PBS, ergänzt mit 10% FBS, gefolgt von Zentrifugation bei 450 × g für 3 min bei 4 ° C.
- Resuspendieren der Zellen in einer Lösung von 1 ml 1x PBS, enthaltend 4 ',6-Diamidino-2-phenylindol (DAPI) in einer Konzentration von 10 ug / ml.
- Filtern Sie die endgültige Lösung durch 35 um Sieb Kappen in 12 mm x 75 mm Polystyrol-Röhrchen.
4. Isolierung von Prostata-Krebsstammzellen durch FACS
- Nutzen Sie ein Durchflusszytometer für die Zellsortierung.
- Stellen Kompensationssteuerungen unter Verwendung von Zellen aus Rohren # 1, # 2, # 3 und # 4.
- Neues Tore, die Trümmer und Cluster von Zellen auszuschließen Verwendung zukunfts und Nebenstreuparameter.
- Stellen Sie die FITC-und PE-Tore mit den Suspensionen von Rohr # 3 und # 4 Rohr auf.
- Tor lebensfähig (DAPI-negative) Zellen unter Verwendung des pacific blue-A-Kanal.
- Mit Schlauch Nr. 5 Ablage CD31-positiven und CD45-positiven Zellen undSammeln beide hlai-negativen und-positiven Populationen hlai in sterile 15 ml-Polystyrol konische Röhrchen mit 2 ml RPMI, ergänzt mit 10% FBS.
- Zentrifuge die sortiert Zellsuspensionen bei 450 × g für 5 min, und anschließend hat ein Resuspendieren der Pellets in 200-500 &mgr; l RPMI, ergänzt mit 10% FBS.
- Quantifizieren lebensfähig (Trypanblau-negative) Zellen mit einer Zählkammer oder automatisierten Zellzähler.
Ergebnisse
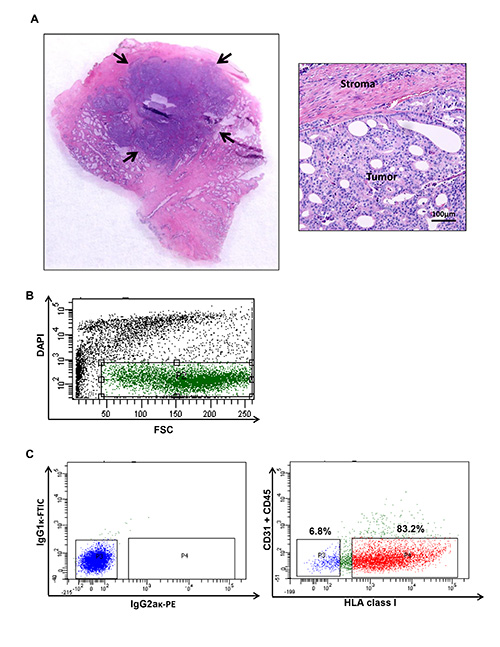
Fig. 1 ist. Menschliche Prostatakrebstumor Ernte und Durchflusszytometrie Diagramm, welches spezifische Populationen von einem menschlichen Prostatakrebs. (A) Tumorknoten werden geerntet, um eine Zellsuspension zu erzeugen. Tumorgehalt der verarbeiteten Probe wird unter Verwendung herkömmlicher Hämatoxylin und Eosin-F?...
Diskussion
Dieses Protokoll beschreibt die Isolierung von CSC aus frischen menschlichen Prostata-Krebsgewebe. Einige wichtige Überlegungen beeinflussen das erfolgreiche Ergebnis dieses Protokolls.
Die Erholung der hohen Zahl von lebensfähigen Prostatakrebs-Zellen ist abhängig von der sorgfältigen Beurteilung der Brutto chirurgischen Proben. Nach unserer Erfahrung ist die erfolgreiche Isolierung von tumorerzeugenden Zellen der Prostata am besten gewährleistet, wenn makroskopische Tumorknoten werden...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der Familie Hariri-Stiftung und der TJ Martell Foundation unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Referenzen
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten