Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выделение стволовых клеток рака из образцов предстательной железы человека
В этой статье
Резюме
Выделение стволовых клеток рака (ЦОК) непосредственно из тканей человека является необходимым условием для их биологической характеристике. Эта рукопись описывает методологию выделения CSCs простаты из тканей человека, а также обеспечивает советы по устранению неисправностей трудные шаги.
Аннотация
Рак стволовых клеток (ЦОК) модель была значительно пересмотрена в течение последних двух десятилетий. В течение этого времени ОКК были определены и непосредственно выделены из тканей человека и последовательно передаются в иммунодефицитных мышей, как правило, с помощью маркировки антител субпопуляций клеток и фракционирование с помощью проточной цитометрии. Тем не менее, уникальные клинические особенности рака простаты значительно ограничили изучение CSCs простаты из свежих образцов опухолей человека. Недавно мы сообщили о выделении CSCs простаты непосредственно из тканей человека в силу их класса HLA I (HLAI)-отрицательной фенотипа. Раковые клетки простаты собирают из хирургических образцов и механически диссоциируют. Суспензию клеток генерируется и помечены с флуоресцентно сопряженных HLAI и стромальных антител. Субпопуляциях из HLAI-негативных клеток, наконец, выделяли с использованием проточного цитометра. Основным ограничением этого протокола является часто микроскопические и мультифокальный характерпервичный рак в простатэктомий. Тем не менее, отдельные CSCs жить простаты подходят для молекулярных характеристик и функциональной проверки по трансплантации в иммунодефицитных мышей.
Введение
Внутриопухолевой неоднородность считается признаком рака 1. В самом деле, несколько механизмов внутриопухолевой неоднородности были описаны, в том числе генной мутации и взаимодействия с микросреды. Кроме того, некоторые виды рака могут содержать сотовый иерархию с субпопуляции стволовых клеток рака (ЦОК), который проявляет свойства опухоли-начала мощности и самообновления в серийных трансплантации анализов 2-5. Первоначально описано в гематологических 6, 7, молочной железы и мозга 8 злокачественных опухолей, CSCs также были изучены в рака простаты 9-12, а также других типов опухолей 2-5.
ОКК правило, считается сотовой доля в гетерогенной популяции 2-5. Поэтому функционал и молекулярная характеристика CSCs будет присвоен после их обогащения от массовых групп населения. Соответственно, в течение последних двух десятилетий несколько встретилисьhodologies из CSC обогащения были разработаны которые обычно включают разделение меченых популяциях с помощью проточной цитометрии. Кроме того, значительное внимание при изучении CSCs в том, что иерархическая организация тканях человека могут быть нарушены экспериментальных манипуляций, таких как Серийные пассажи в культуре или иммунодефицитных мышей. В результате прямого изоляция CSCs из тканей человека стала важной методикой в области CSC.
Рак предстательной железы является одной из ведущих причин заболеваемости раком и смертности в Соединенных Штатах и во всем мире 13. Таким образом, изоляция и биологическая характеристика CSCs простаты представляет значительный интерес. Простата CSCs ранее обогатилась из клеточных линий, пациентов получены ксенотрансплантаты и низкий прохода пациента происходит суспензионных культур 9,10,12,14.
Недавно мы сообщили о выделении CSCs простаты непосредственно от хирургических с человеканые примеры в силу их HLAI-отрицательных клеточной поверхности фенотипа 10. Здесь мы подробно процедуры, осуществляемые для выделения этих клеток. Опухоли простаты собирают из хирургических образцов и сделал в клеточных суспензий. Затем клетки окрашивали с использованием антител против HLAI а также стромальных и жизнеспособность маркеры, и ОКК выделяли с активацией флуоресценции сортировки клеток (FACS). Изолированные CSCs затем могут быть использованы для анализов, требующих жизнеспособных клеток.
протокол
1. Сбор и обработка ткани предстательной железы человека, из операционного материала
- Приготовьте два 50 мл конические пробирки из пенополистирола, содержащего 15 мл Roswell Park Memorial института (RPMI) 1640 культуральной среды с добавлением 10% эмбриональной телячьей сыворотки (FBS) и 1% пенициллина / стрептомицина.
- Патология обслуживающий персонал урожай образцы первичных и метастатических рака простаты от простатэктомии и паллиативной хирургии образцов соответственно под борту Institutional Review утвержден протокол. Метастатические образцы могут быть получены из лимфатических узлов вскрытия во время первичной операции, позвонки во время паллиативной хирургических процедур, таких как спинного мозга декомпрессии и легких во время диагностического удаления отдельных метастатических очагов, среди других.
- Урожай избыток объемную ткань не необходимое для клинической диагностики в первом 50-мл полистирола коническую трубку со стадии 1.1 и хранить сразу при 4 ° С. Harvesteг ткани должны измерять по крайней мере, 4-5 см 2 в области и 1-2 см в толщину.
- Персонал лаборатории обрабатывать объемную ткань, полученную от службы патологии в рамках подготовки к гистологического исследования и генерации клеточных суспензий.
- Обработка объемных тканей не должна превышать 24 часа из хирургической резекции, чтобы гарантировать максимальную жизнеспособность клеток.
- Работа в шкафу биобезопасности стерильным скальпелем и пинцетом, принять 2-4 мм толстые секции горизонтальные тканевые от макроскопических узелков опухоли. Сразу хранить разделы во втором 50 мл полистирола коническую трубку со стадии 1.1.
- Когда макроскопические узелки не визуализируются из образцов простатэктомии, собирать случайные 2-4 мм толстые секции горизонтальные тканевые из задних долей и переходной зоны.
- Отделите часть хирургического ткани с помощью стерильного скальпеля и пинцета и исправить ее в 10% формалине до родовных клеточных суспензий. Архив и проанализировать эту материальную гистологически чтобы подтвердить наличие рака простаты ткани.
2. Генерация клеточные суспензии из ткани разделах
- Работа в стерильной камере биологической, передача срез ткани в 60 х 15 мм чашки для культивирования, содержащей 1 мл стерильного 1x фосфатным буферным солевым раствором (PBS).
- Механически растирают образца с помощью стерильного скальпеля и пинцета.
- Нет ферментативные расщепление не в этом протоколе.
- Перенести подвеска 1 мл в стерильный 50 мл коническую трубку.
- Добавить 1 мл в чашку с культурой и повторить шаг Растирание, пока срез ткани не полностью диссоциирует, как правило, 3-4x.
- Повторите эту процедуру последовательно, пока все срезы ткани не были в отрыве.
- Ресуспендируют содержимое 50 мл полистирола коническую трубку с 5 мл серологического пиPette и вихрь на максимальной скорости (примерно 3200 оборотов в минуту) в течение 1 мин.
- Фильтр полученной суспензии через сито 35 мкм клетки и собирать во второй стерильной 50 мл полистирола коническую трубку.
- Генерирование осадок центрифугированием при 450 х г в течение 10 мин.
- Жидкость над осадком сливают, осадок ресуспендируют в 5 мл буфера для лизиса клеток красных кровяных, и инкубируют раствор в течение 5 мин при комнатной температуре. Удалите красную буфера для лизиса клеток крови центрифугированием в течение 5 мин при 450 х г при комнатной температуре.
- Жидкость над осадком сливают, ресуспендируют осадок в 1х PBS с добавлением 5% FBS, и количественно количество жизнеспособных (трипановым синим-отрицательных клеток) с помощью гемоцитометра или автоматизированного счетчика клеток. Создайте 1x10 6 клеток / мл суспензии и не храните его на льду в течение не более 1 часа.
- Жизнеспособность и урожайность клеток может значительно варьироваться в зависимости от образцов опухоли. В настройках простатэктомии, жизнеспособность может варьироваться между 45-70%, и фиве 2-4 мм срезы толщиной горизонтальные ткани от макроскопической опухолевого узла может быть ожидается выход примерно 3х10 6 жизнеспособных клеток.
3. Антитела Окрашивание клеток для FACS
- Этикетка пять 15 мл полистирола конические пробирки, как показано ниже. Используйте CD45 и CD31 антигена маркировки, чтобы исключить кроветворной и эндотелиальные элементы, соответственно.
- Незапятнанный
- IgG 2a κ-PE + IgG 1 κ-FITC
- HLAI-PE + IgG 1 κ-FITC
- IgG 2a κ-PE + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- Распространить количественных клеточной суспензии из предыдущего раздела (шаг 2.7) в пяти труб в шаге 3.1. Добавить антител в разведении 1:250, и инкубировать клеточные суспензии на льду в течение 30 мин.
- Центрифуга клетки при 450 мкг в течение 3 мин при 4 ° С, и отбросить супернатанты.
- Промывают клетки путем ресуспендирования каждый шарик стерильной 1x PBS с добавлением 10% FBS с последующим центрифугированием при 450 х г в течение 3 мин при 4 ° С.
- Ресуспендируют клеток в 1 мл раствора, содержащего 1 × PBS 4 ',6-диамидино-2-фенилиндола (DAPI) в концентрации 10 мкг / мл.
- Фильтр окончательное решение через 35 фильтрующих шапки мкм на 12 мм х 75 мм из полистирола труб.
4. Выделение простаты CSCs по СУИМ
- Использование цитометр потока для сортировки клеток.
- Установить контроль компенсации с использованием клеток из труб # 1, # 2, # 3 и # 4.
- Создать ворота, которые исключают мусора и скопления клеток с использованием параметров вперед и бокового разброса.
- Установите ФИТЦ и PE ворота, используя взвеси из трубы № 3 и трубки # 4, соответственно.
- Gate жизнеспособные (DAPI-отрицательных) клетки, использующие Pacific Blue-канал.
- Использование трубы № 5 Отбросить CD31-положительных и CD45-позитивные клетки исобрать как HLAI-отрицательные и HLAI-положительные населения в стерильные 15-мл полистирола конических пробирок, содержащих 2 мл RPMI с добавлением 10% FBS.
- Центрифуга сортируются клеточных суспензий при 450 х г в течение 5 мин, а затем ресуспендируют гранул в 200-500 мкл RPMI с добавлением 10% FBS.
- Количественная жизнеспособные (трипанового синего-отрицательных) клеток с помощью гемоцитометра или автоматизированного счетчика клеток.
Результаты
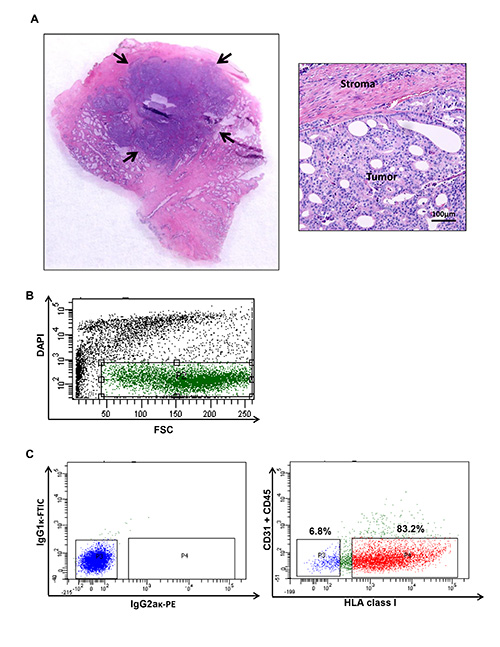
Рисунок 1. Человека простаты сбор раковая опухоль и проточной цитометрии график, иллюстрирующий конкретные населения от рака простаты человека. (А) опухолевые узлы собира...
Обсуждение
Этот протокол описывается изоляция CSCs из свежих раковых тканей простаты человека. Несколько важных соображения влияют на успешный исход этого протокола.
Восстановление большого числа жизнеспособных клеток рака простаты зависит от тщательного валового оценки хирурги...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Эта работа была поддержана Харири Family Foundation и TJ Martell Foundation.
Материалы
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Ссылки
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены