È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di cancro cellule staminali da campioni umani di cancro alla prostata
In questo articolo
Riepilogo
L'isolamento di cellule staminali tumorali (CSC) direttamente da tessuti umani è necessaria per la loro caratterizzazione biologica. Questo manoscritto descrive una metodologia per l'isolamento di CSC prostata da tessuti umani, fornendo anche suggerimenti sulla risoluzione dei problemi passi difficili.
Abstract
Il modello di cellule staminali cancerose (CSC) è stato notevolmente rivisitato nel corso degli ultimi due decenni. Durante questo periodo CSC sono stati identificati e direttamente isolato da tessuti umani e serialmente propagate in topi immunodeficienti, tipicamente attraverso l'etichettatura degli anticorpi di sottopopolazioni di cellule e frazionamento di citometria a flusso. Tuttavia, le caratteristiche cliniche uniche di cancro alla prostata hanno notevolmente limitato lo studio di CSC prostata da campioni freschi di tumori umani. Recentemente abbiamo riportato l'isolamento di CSC prostata direttamente da tessuti umani in virtù del loro fenotipo HLA di classe I (HLAI)-negativo. Le cellule tumorali della prostata vengono raccolte da campioni chirurgici e dissociate meccanicamente. Una sospensione cellulare viene generato ed etichettato con anticorpi HLAI e stromali coniugati modo fluorescente. Sottopopolazioni di cellule HLAI-negativi sono finalmente isolate utilizzando un citometro a flusso. Il limite principale di questo protocollo è la natura frequentemente microscopica e multifocaletumore primario nei campioni prostatectomia. Tuttavia, isolato CSC prostata dal vivo sono adatti per la caratterizzazione molecolare e validazione funzionale da trapianto in topi immunodeficienti.
Introduzione
Eterogeneità intratumorale è considerata una caratteristica del cancro 1. Infatti, sono stati descritti diversi meccanismi di eterogeneità intratumorale, inclusi la mutazione genetica e interazioni con il microambiente. Inoltre, alcuni tipi di cancro possono contenere una gerarchia cellulare con una sottopopolazione di cellule staminali tumorali (CSC), che presenta le caratteristiche di capacità del tumore di avvio e di auto-rinnovamento in saggi di trapianto di serie 2-5. Inizialmente descritto in ematologica 6, seno 7, 8 e cervello neoplasie, CSC sono stati studiati anche nel cancro della prostata 9-12 così come altri tipi di tumore 2-5.
CSC sono generalmente considerati una frazione cellulare all'interno di una popolazione eterogenea 2-5. Pertanto, la caratterizzazione funzionale e molecolare di CSC è subordinato al loro arricchimento da popolazioni di massa. Di conseguenza, nel corso degli ultimi due decenni vari soddisfattehodologies di CSC arricchimento sono stati inventati che in genere comportano la separazione delle popolazioni etichettati mediante citometria a flusso. Inoltre, una considerazione importante nello studio di CSC è che l'organizzazione gerarchica dei tessuti umani può essere interrotta da manipolazioni sperimentali come passaging seriale in coltura o immunodeficienti topi. Come risultato, l'isolamento diretto di CSC da tessuti umani è emerso come una metodologia importante nel campo CSC.
Il cancro della prostata è una delle principali cause di morbilità e mortalità negli Stati Uniti e in tutto il mondo 13 cancro. Pertanto, l'isolamento e la caratterizzazione biologica di CSC prostata è di notevole interesse. CSC prostata sono stati precedentemente arricchiti da linee cellulari, paziente derivati xenotrapianti e basso passaggio del paziente derivata sospensione culture 9,10,12,14.
Recentemente abbiamo riportato l'isolamento di CSC prostata direttamente da s chirurgici umaniamples in virtù della loro HLAI-negativi superficie delle cellule fenotipo 10. Qui abbiamo dettagliato le procedure adottate per l'isolamento di queste cellule. Tumori della prostata vengono raccolte da campioni chirurgici e trasformate in sospensioni cellulari. Le cellule vengono poi colorate con anticorpi contro HLAI nonché stromali e vitalità marcatori, e CSC sono isolati dalla fluorescenza attivato cell sorting (FACS). Isolato CSC possono quindi essere utilizzate per saggi richiedono cellule vitali.
Protocollo
1. Raccolta ed elaborazione di Human Prostate Cancer Tissue da campioni chirurgici
- Preparare due provette coniche da 50 ml in polistirolo contenente 15 ml di Roswell Park Memorial Institute (RPMI) 1.640 terreno di coltura supplementato con 10% di siero fetale bovino (FBS) e 1% di penicillina / streptomicina.
- Personale di servizio Patologia raccolto campioni primari e metastatici della prostata cancro da campioni prostatectomia e la chirurgia palliativa, rispettivamente, sotto un consiglio di Institutional Review approvato il protocollo. Campioni metastatici possono essere ottenuti da dissezioni linfonodali durante chirurgia primaria, le vertebre durante le procedure chirurgiche palliative, come decompressione del midollo spinale e polmoni durante la rimozione diagnostica delle lesioni metastatiche singoli, tra gli altri.
- Raccolta dei tessuti bulk eccesso non necessario per diagnostica clinica nel primo 50 ml tubo conico da polistirene passo 1.1 e memorizzare immediatamente a 4 ° C. Il Harvested tessuto deve misurare almeno 4-5 cm 2 di superficie e 1-2 cm di spessore.
- Elaborano personale di laboratorio tessuto sfuso ottenuto dal servizio patologia in preparazione per l'esame istologico e generazione di sospensioni cellulari.
- Lavorazione di tessuti rinfusa non deve superare 24 ore da resezione chirurgica per garantire la massima vitalità cellulare.
- Lavorare in un armadio biosicurezza con un bisturi sterile e pinze, prendere 2-4 mm di spessore sezioni di tessuto orizzontali di noduli tumorali macroscopici. Memorizzare immediatamente le sezioni nella seconda provetta da 50 ml conica in polistirolo dal punto 1.1.
- Quando noduli macroscopici non siano visualizzati da campioni prostatectomia, raccogliere casuali spesse sezioni di tessuto orizzontali 2-4 mm dai lobi posteriori e zona di transizione.
- Separare una porzione di tessuto chirurgico usando un bisturi sterile e pinza e fissarlo in 10% formalina prima generazionezione di sospensioni cellulari. Filmati e analizzare tale istologicamente materiale per confermare la presenza di tessuto del cancro della prostata.
2. Generazione di Cell Sospensioni da sezioni di tessuto
- Lavorando in un armadio biosicurezza sterile, trasferire una sezione di tessuto di un piatto 60 mm x 15 coltura contenente 1 ml di soluzione sterile 1x tampone fosfato salino (PBS).
- Meccanicamente triturare l'esempio utilizzando un bisturi sterile e pinze.
- Non digestioni enzimatiche sono in questo protocollo.
- Trasferire la sospensione 1 ml in un tubo da 50 ml sterile.
- Aggiungere 1 ml al piatto cultura e ripetere l'operazione di triturazione fino alla sezione di tessuto è completamente dissociato, solitamente 3-4x.
- Ripetere questa procedura in serie finché non sono stati dissociate tutte le sezioni di tessuto.
- Risospendere il contenuto della provetta conica da 50 ml polistirene con 5 ml pi sierologicapipetta e vortex alla velocità massima (circa 3.200 rpm) per 1 min.
- Filtrare la sospensione risultante attraverso un colino cella 35 micron e raccogliere in un secondo tubo da 50 ml polistirene sterile.
- Generare un pellet per centrifugazione a 450 xg per 10 min.
- Eliminare il surnatante, risospendere il pellet con 5 ml di tampone di lisi dei globuli rossi, ed incubare la soluzione per 5 minuti a temperatura ambiente. Rimuovere il tampone di sangue rosso lisi cellulare mediante centrifugazione per 5 minuti a 450 xg a temperatura ambiente.
- Eliminare il surnatante, risospendere il pellet in 1x PBS supplementato con 5% FBS, e quantificare il numero di (Tricloroetano-negativo) cellule vitali mediante un emocitometro o contatore di cellule automatizzato. Generare un 1x10 6 cellule / ml sospensione e conservarlo in ghiaccio per non più di 1 ora.
- La vitalità e la resa delle celle può variare notevolmente tra campioni tumorali. Nell'impostazione prostatectomia, la redditività può variare tra il 45-70%, e five 2-4 mm di spessore sezioni di tessuto orizzontali da un nodulo tumorale macroscopico possono essere tenuti a produrre circa 3x10 6 cellule vitali.
3. Antibody colorazione delle cellule per FACS
- Etichettare cinque provette da 15 ml coniche di polistirene come illustrato di seguito. Utilizzare CD45 e CD31 etichettatura antigene escludere ematopoietiche e elementi endoteliali, rispettivamente.
- Senza macchia
- IgG 2a κ-PE + IgG 1 κ-FITC
- HLAI-PE + IgG 1 κ-FITC
- IgG 2a κ-PE + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- Distribuire la sospensione cellulare quantificata dalla sezione precedente (passo 2.7) in cinque provette nel passo 3.1. Aggiungere gli anticorpi ad una diluizione di 1:250, e incubare le sospensioni di cellule in ghiaccio per 30 min.
- Centrifugare le cellule a 450 xg per 3 min a 4 ° C, e scartare il surnatante.
- Lavare le cellule da risospendere ogni pellet con 1x PBS sterile supplementato con 10% FBS seguita da centrifugazione a 450 xg per 3 min a 4 ° C.
- Risospendere le cellule in 1 ml di una soluzione di PBS 1x contenente 4 ',6-diamidino-2-fenilindolo (DAPI) ad una concentrazione di 10 ug / ml.
- Filtrare la soluzione finale attraverso 35 caps setaccio micron in 12 mm x 75 mm tubi di polistirolo.
4. Isolamento di prostata CSC da FACS
- Utilizzare un citometro di flusso per l'ordinamento delle cellule.
- Impostare i controlli di compensazione utilizzando cellule dai tubi # 1, # 2, # 3 e # 4.
- Creare cancelli che escludono detriti e ammassi di cellule utilizzando i parametri previsionali e side-scatter.
- Stabilire i FITC e PE cancelli con le sospensioni dal tubo # 3 e # 4 il tubo, rispettivamente.
- Vitali (DAPI-negativo) le cellule cancello utilizzando la pacific blue-Un canale.
- Utilizzando tubo # cellule CD31-positive e CD45-positive 5 scartare eraccogliere entrambe le popolazioni HLAI-negativi e HLAI-positivi in provette di polistirene coniche 15 ml sterili contenenti 2 ml di RPMI supplementato con 10% FBS.
- Centrifugare la sospensione cellulare filtrate a 450 xg per 5 min, e poi risospendere il pellet in 200-500 ml di RPMI supplementato con 10% FBS.
- Quantificare (trypan blu-negativo) cellule vitali mediante un emocitometro o contatore di cellule automatizzato.
Risultati
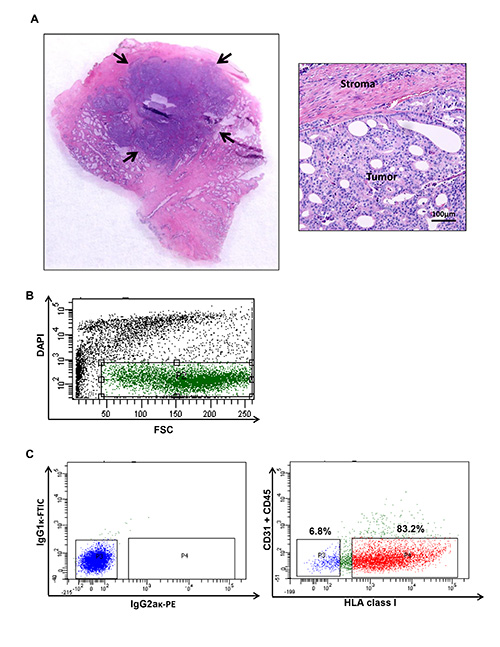
Figura 1. Prostata umana raccolta tumore del cancro e citometria a flusso grafico che illustra specifiche popolazioni provenienti da un cancro alla prostata umano. (A) noduli tumorali sono raccolte per generare una sospensione cellulare. Contenuto Tumore del campione processato viene confermata con ematossilina convenzi...
Discussione
Questo protocollo descrive l'isolamento di CSC da tessuti tumorali della prostata umana freschi. Diverse considerazioni importanti influenzano l'esito positivo di questo protocollo.
Il recupero di un numero elevato di cellule tumorali della prostata vitali dipende da un'attenta valutazione al lordo dei campioni chirurgici. Nella nostra esperienza, l'isolamento di successo delle cellule prostatiche tumorali è meglio garantita quando i noduli tumorali macroscopici sono osserva...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Questo lavoro è stato sostenuto dalla Fondazione Hariri Famiglia e la Fondazione TJ Martell.
Materiali
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Riferimenti
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon