Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Prostat Kanseri Örneklerinden Kanser Kök Hücreleri İzolasyon
Bu Makalede
Özet
Doğrudan insan dokularından kanser kök hücreler (rulmanları) izolasyonu biyolojik karakterizasyonu için bir koşuldur. Ayrıca zor sorun giderme adımları konusunda ipuçları sağlarken Bu makale, insan dokularından prostat CSCS izolasyonu için bir yöntem anlatılmaktadır.
Özet
Kanser kök hücre (CSC) modeli ölçüde son iki yılda yeniden gözden geçirilmiştir. Bu süre boyunca CSCS tanımlanır ve doğrudan insan dokularından izole edilmiş ve seri olarak, tipik olarak akış sitometrisi ile hücrelerin ve fraksiyonlama alt grupları antikor etiketleme yoluyla, bağışıklık yetersizliği olan farelerde yayılır edilmiştir. Bununla birlikte, prostat kanseri benzersiz klinik özellikleri önemli ölçüde taze insan tümör örneklerinden prostat CSCS olan çalışma sınırlıdır. Yakın zamanda, HLA sınıf I (HLAI)-negatif fenotipi nedeniyle, doğrudan insan dokularından prostat CSCS izolasyonunu bildirdi. Prostat kanser hücreleri cerrahi örneklerden hasat edilir ve mekanik olarak ayrıştırılırlar. Bir hücre süspansiyonu üretilir ve floresan konjuge HLAI ve stromal antikorlar ile etiketlenir. HLAI-negatif hücrelerin alt grubu son olarak bir akış sitometrisi kullanılarak izole edilmiştir. Bu protokolün başlıca sınırlaması sık mikroskobik ve multifokal doğaprostatektomi örneklerinde primer kanser. Bununla birlikte, izole edilmiş canlı prostat CSCS bağışıklık yetersizliği olan farelerde nakli ile moleküler karakterizasyonu ve fonksiyonel doğrulama için uygundur.
Giriş
Tümör içine heterojenlik kanser 1 ayırt edici bir özelliği olarak kabul edilir. Gerçekten de, tümör heterojenite çeşitli mekanizmalar genetik mutasyon ve mikro etkileşimler de dahil olmak üzere tarif edilmiştir. Buna ek olarak, bazı kanser türleri seri nakli deneylerinde 2-5 tümör başlatıcı kapasitesi ve kendini yenileme özelliklerini sergileyen kanser kök hücreleri (rulmanları) bir alt popülasyonunun bir hücresel hiyerarşisi içerebilir. Başlangıçta hematolojik 6, meme 7, 8 ve beyin habis de tarif CSCS aynı zamanda prostat kanseri 9-12 hem de diğer tümör tipleri 2-5 incelenmiştir.
CSCS genellikle oluşan heterojen bir topluluk içinde 2-5 hücresel fraksiyon olarak kabul edilir. Bu nedenle, CSCS fonksiyonel ve moleküler karakterizasyonu toplu nüfus onların zenginleşmesine şarta. Buna göre, son iki yılda çeşitli buluştuCSC zenginleştirme hodologies tipik olarak akış sitometrisi ile işaretlenmiş popülasyonlarının ayrılmasını içerir ki tasarlanmıştır. Buna ek olarak, CSCS çalışmada önemli bir husustur insan dokularının hiyerarşik organizasyonu, kültür veya bağışıklık yetersizliği olan farelerde seri pasaj olarak deneysel manipülasyonlar tarafından kesintiye edilebilir olmasıdır. Sonuç olarak, insan dokularından CSCS doğrudan izolasyon CSC alanda önemli bir yöntem olarak ortaya çıkmıştır.
Prostat kanseri kanser morbidite ve Amerika Birleşik Devletleri'nde ve dünya çapında 13 ölüm önde gelen bir nedenidir. Bu nedenle, prostat CSCS izolasyonu ve biyolojik karakterizasyonu önemli ilgi konusudur. Prostat CSCS önce hücre hatları, hasta türetilmiş ksenograftlarının ve düşük geçiş hasta süspansiyon kültürlerinden türetilmiş 9,10,12,14 ikinci zenginleştirilmiştir.
Biz son zamanlarda direkt olarak insan cerrahi s prostat CSCS izolasyonuna bildirdiOnların HLAI-negatif hücre yüzey fenotip 10 sayesinde depas'lar. Burada ayrıntılı bu hücrelerin izolasyonu için uygulanan prosedürler WE. Prostat tümörler cerrahi örneklerden hasat edildi ve hücre süspansiyonları içine yapılır. Hücreler daha sonra HLAI karşı antikorlar hem de stromal ve canlılığı belirteçleri kullanılarak lekelenmektedir, CSCS ve floresan aktive hücre sıralama (FACS) ile izole edilir. İzole CSCS sonra yaşayabilir hücreler gerektiren deneyleri için de kullanılabilir.
Protokol
1.. Hasat ve Cerrahi Örneklerinin İnsan Prostat Kanseri Doku İşleme
- Roswell Park Memorial Institute (RPMI),% 10 fetal sığır serumu (FBS) ve% 1 penisilin / streptomisin ile takviye edilmiş 1640 kültür ortam maddesi içinde 15 ml içeren iki 50 ml konik polistiren tüpler hazırlayın.
- Patoloji servis personeli protokolü onaylanan Kurumsal Değerlendirme Kurulu altında sırasıyla prostatektomi ve palyatif cerrahi örneklerinden primer ve metastatik prostat kanseri örnekleri, hasat. Metastatik örnekleri birincil, ameliyat sırasında lenf düğümü kesitlerden elde edilebilir, diğerleri arasında, bir metastatik lezyonların teşhis çıkarılması esnasında palyatif cerrahi gibi omurilik dekompresyon gibi işlemler, ve akciğer sırasında omur.
- Aşama 1.1 ilk 50 ml konik bir tüp içine polistiren Klinik teşhis için gerekli olmayan fazla toplu doku hasat ve 4 ° C 'de hemen depolamak Hasat edilird doku, en azından bir bölgede 4-5 cm 2 ve kalınlığı 1-2 cm boyutlarında olmalı.
- Laboratuvar personeli hücre süspansiyonları histolojik inceleme ve nesil için hazırlık patoloji servisinden alınan toplu doku işlemek.
- Kütle dokuların işlenmesi maksimum hücre canlılığı garanti etmek amacıyla cerrahi rezeksiyon 24 saat geçmemelidir.
- Steril bir neşter ve forseps ile bir biyogüvenlik kabini içinde çalışmak, makroskopik tümör nodüller 2-4 mm kalınlığında yatay doku bölümleri alır. Hemen aşama 1.1 saniye 50 ml konik bir tüp içinde polistiren bölümleri saklayın.
- Makroskopik nodüller prostatektomi örneklerinde görülmediği zaman, arka lob ve geçiş bölgesinden rastgele 2-4 mm kalınlığında yatay doku bölümleri toplamak.
- Steril bir bisturi bıçağını ve forsepsler kullanılarak cerrahi dokusunun bir kısmı ayrılır ve önce cinse% 10 formalin içinde tamirHücre süspansiyonları tion. Arşiv ve prostat kanseri dokusunun varlığını doğrulamak için bu malzeme histolojik analiz.
2. Doku bölümleri gelen hücre süspansiyonları Üretimi
- Steril bir biyo-güvenlik kabini içinde çalışan, steril 1 x fosfat tamponlu tuzlu su (PBS) içinde 1 ml ihtiva eden bir 60 x 15 mm kültür çanağı için bir doku bölümü aktarın.
- Mekanik bir steril neşter ve forseps kullanarak örnek çiğnemek.
- Hayır enzimatik sindirimler bu protokol vardır.
- Bir steril 50 ml konik bir tüp içine 1 ml süspansiyon aktarın.
- Kültür çanak 1 ml ekleyin ve doku bölümü tamamen genellikle 3-4x, ayrışmış kadar ezildikten adımı tekrarlayın.
- Tüm doku bölümleri ayrışmış kadar seri olarak bu işlemi tekrarlayın.
- 5 ml'lik bir serolojik pi ile 50 ml polistiren konik tüp içeriğini yeniden süspansepette ve 1 dakika boyunca maksimum hızda (yaklaşık 3,200 rpm) vorteks.
- 35 mikron hücre süzgecinden elde edilen süspansiyon filtre edilir ve ikinci bir steril 50 ml konik tüp içine polistiren toplar.
- 10 dakika boyunca 450 x g'de santrifüj ile pelet oluşturur.
- , Süpernatant atılır alyuvar lisiz tamponu, 5 ml pelet tekrar süspansiyon ve oda sıcaklığında 5 dakika için çözelti inkübe edin. Oda sıcaklığında 450 x g'de 5 dakika boyunca santrifüj ile kırmızı kan hücre parçalama tamponunu çıkarın.
- , Süpernatant atılır,% 5 FBS ile desteklenmiş 1 x PBS içinde tekrar süspansiyon pelet ve bir hemasitometre veya otomatik hücre sayacı kullanılarak uygulanabilir (tripan mavi-negatif) hücrelerin sayısını ölçmek. Bir 1x10 6 hücre / ml süspansiyon oluşturmak ve artık 1 saat daha buz üzerinde saklayın.
- Canlılık ve hücre verim tümör örnekleri arasında önemli ölçüde değişebilir. Prostatektomi ortamda, canlılığı 45-70 ve% fi arasında değişebilirBir makroskopik tümör nodül kalın yatay doku kesitleri yaklaşık 3x10 6 canlı hücreler elde bekleniyor olabilir 2-4 mm ettik.
3. FACS için Hücrelerinin antikor boyama
- Aşağıda gösterildiği gibi beş 15 ml polistiren konik tüpler etiketleyin. Sırasıyla, hematopoetik ve endotelial elemanları hariç CD45 ve CD31 antijeni etiketleme kullanın.
- Lekesiz
- IgG 2a κ-PE + IgG 1 κ-FITC
- HLAI-PE + IgG 1 κ-FITC
- IgG 2a κ-PE + CD31 + CD45-FITC-FITC
- HLAI-PE + CD45 + CD31-FITC-FITC
- Adım 3.1 'de beş tüplere önceki bölümde (adım 2.7) den sayısallaştırılmış hücre süspansiyonu dağıtın. 1:250 seyreltide antikor ekleyin ve 30 dakika boyunca buz üzerinde inkübe hücre süspansiyonları.
- 4 ° C'de 3 dakika boyunca 450 x g'de santrifüj hücreleri ve süpernatantlar atın.
- Steril 1x PBS ile her bir topağın tekrar askıda bırakılmasıyla hücreleri yıkanır, 4 ° C'de 3 dakika boyunca 450 x g'de santrifüj ile ve ardından,% 10 FBS ile takviye edilmiş
- 10 ug / ml 'lik bir konsantrasyonda 4 1x PBS ihtiva eden bir çözelti, 1 ml' ,6-diamidino-2-fenilindol (DAPI) 'de tekrar süspansiyon hücreleri.
- 12 mm x 75 mm polistiren tüpler içine 35 um süzgeç kapaklar aracılığıyla nihai çözüm Filtre.
4. FACS ile Prostat CSCS izolasyonu
- Hücre sıralama için bir flowsitometri yararlanın.
- Tüplerden # 1, # 2, # 3 hücreleri kullanılarak tazminat kontrolleri ayarlayın, ve 4..
- Ileri ve yan dağılım parametreleri kullanarak enkaz ve hücre kümeleri hariç kapıları oluşturun.
- Sırasıyla, tüp # 3 ve # boru 4 süspansiyonlar kullanılarak FITC ve PE kapıları oluşturulması.
- Pasifik mavi-A kanalı kullanılarak kapı canlı (DAPI-negatif) hücreler.
- Tüp # 5 ıskarta CD31-pozitif ve CD45-pozitif hücreler kullanılarak veRPMI içinde 2 ml% 10 FBS ile takviye içeren steril 15 ml konik polistiren tüpler içine de HLAI-negatif ve pozitif HLAI popülasyonları toplar.
- Santrifüj 5 dakika boyunca 450 x g'de hücre süspansiyonları sıralanmış ve daha sonra% 10 FBS ile takviye edilmiş RPMI içinde 200-500 ul pelet tekrar süspansiyon.
- Hemasitometre ya da otomatik hücre sayıcı kullanarak canlı (trypan mavi-negatif) hücrelerini ölçmek.
Sonuçlar
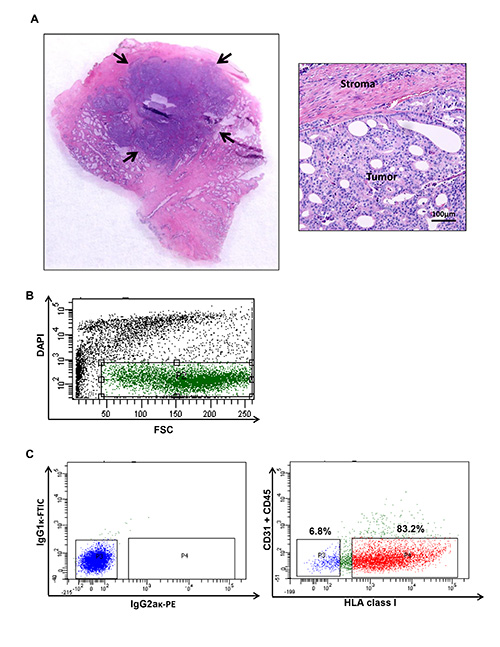
Şekil 1. İnsan prostat kanseri tümörü hasat ve bir insan prostat kanseri belirli popülasyonlarının arsa görüntüleyen akış sitometrisi. (A) Tümör nodülleri bir hücre süspansiyonu üretmek için hasat edilir. Işlenmiş örnek Tümör içeriği, geleneksel hematoksilen ve eozin boyama ile teyit edilir. D...
Tartışmalar
Bu protokol, taze insan prostat kanseri dokulardan CSCS izolasyonunu tarif eder. Birçok önemli hususlar bu protokolün başarılı sonucunu etkiler.
Uygun bir prostat kanseri hücrelerinin yüksek sayıda geri kazanım Cerrahi numunelerin dikkat brüt değerlendirmesine bağlıdır. Makroskopik tümör nodüller gözlendi ve 10 işlendiğinde bizim deneyim, tümörijenik prostat hücrelerinin başarılı izolasyonu iyi sağlanır.
Bununla birlikte, p...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Hariri Ailesi Vakfı ve TJ Martell Vakfı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Referanslar
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır