このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト前立腺癌サンプルからがん幹細胞の単離
要約
直接ヒト組織からがん幹細胞(CSCが)の単離は、それらの生物学的特性評価のために必要である。また、難しい手順のトラブルシューティングのヒントを提供しながら、この原稿は、ヒト組織からの前立腺のCSCを単離するための方法論を説明します。
要約
癌幹細胞(CSC)のモデルはかなり過去20年間に再訪されています。この時間の間のCSCを同定し、直接単離されたヒト組織から直列典型的にフローサイトメトリーによる細胞分画の亜集団の抗体標識を介して、免疫不全マウス中で増殖されている。しかし、前立腺癌の独特の臨床的特徴は、かなり新鮮なヒト腫瘍試料から前立腺のCSCの研究が限られている。我々は最近、HLAクラスI(HLAI)のおかげで、直接ヒト組織由来の前立腺のCSCの分離陰性の表現型を報告した。前立腺癌細胞は、手術標本から採取し、機械的に解離される。細胞懸濁液が生成され、蛍光共役HLAIおよび間質抗体で標識される。 HLAI陰性細胞の亜集団は、最終的にフローサイトメーターを用いて単離される。このプロトコルの主な制限は、頻繁に微視的および多発性性質である前立腺切除標本における原発性癌。それにもかかわらず、孤立したライブ前立腺CSCは免疫不全マウスでの移植による分子特性および機能検証に適しています。
概要
腫瘍内不均一性癌1の特徴であると考えられている。実際、腫瘍内の不均一性のいくつかのメカニズムは、遺伝子変異と微小環境との相互作用を含む、記載されている。さらに、いくつかの癌は、連続移植アッセイ2-5における腫瘍開始能力および自己再生の性質を示す癌幹細胞(CSCが)の亜集団を有する細胞の階層を含むことができる。最初に血液学6、7乳房、および脳8に記載の悪性腫瘍、CSCはまた、前立腺癌の9-12、ならびに他の腫瘍タイプ2-5に研究されている。
CSCは、一般的に不均一な集団2-5内細胞画分と見なされます。したがって、CSCが機能的分子特性は、バルク集団からの濃縮条件とする。したがって、最後の二十年の間に数が満たさCSCの濃縮のhodologiesは、典型的には、フローサイトメトリーによって標識された集団の分離を伴うが考案されてきた。また、CSCが研究で重要な考慮事項は、ヒト組織の階層的な組織がそのような文化や免疫不全マウスでの連続継代として実験操作によって破壊され得ることである。その結果、ヒト組織からのCSCの直接単離は、CSCの分野で重要な方法論として浮上している。
前立腺癌は、癌の罹患率および米国および世界中13の周り死亡の主要な原因である。従って、前立腺のCSCの単離および生物学的特徴付けは重要な関心である。前立腺CSCは、以前の細胞株、患者に由来する異種移植片、および低継代患者派生懸濁培養9,10,12,14から濃縮されています。
我々は最近、直接人間の外科sから前立腺のCSCの単離を報告そのHLAI陰性細胞表面表現型10のおかげでamples。ここでは詳細は、これらの細胞の単離のための手順を実装WE。前立腺腫瘍は、手術標本から採取し、細胞懸濁液中に形成されている。次いで、細胞をHLAIに対する抗体ならびに間質および生存度マーカーを用いて染色し、CSCは、蛍光活性化セルソーティング(FACS)により単離される。単離されたCSCはその後、生細胞を必要とするアッセイに用いることができる。
プロトコル
1。手術標本からのヒト前立腺癌組織の収穫と処理
- ロズウェルパーク記念研究所(RPMI)1640を15mlの10%ウシ胎児血清(FBS)を補充した培養培地および1%ペニシリン/ストレプトマイシンを含む二つの50ミリリットルポリスチレンコニカルチューブを準備する。
- 治験審査委員会は、プロトコルを承認の下で病理サービス担当者は、それぞれ、前立腺切除および緩和手術標本から原発性および転移性前立腺癌試料を収穫。転移性の試料は、一次外科手術中リンパ節郭清から得ることができる、とりわけ単転移病変の診断除去、緩和的外科手術の間、脊髄減圧などの手順、および肺中の椎骨。
- ステップ1.1からの第50ミリリットルのポリスチレンコニカルチューブに臨床診断のために必要とされない余分なバルク組織を採取し、4℃ですぐに保存harvesteD組織は、少なくとも面積4〜5 cm 2であり、厚さ1〜2センチ測定する必要があります。
- 研究室の担当者は、細胞懸濁液の組織学的検査および生成の準備のために病理サービスから得られたバルク組織を処理します。
- バルク組織の処理は、最大の細胞生存率を保証するために外科的切除から24時間を超えてはならない。
- 滅菌メスや鉗子でバイオセーフティキャビネット内で作業し、巨視的腫瘍結節から2〜4ミリメートルの厚さの水平組織切片を取る。すぐにステップ1.1からの第50ミリリットルポリスチレンコニカルチューブ内のセクションを格納します。
- 巨視的な結節が前立腺切除サンプルから可視化されていない場合、後方ローブと遷移ゾーンからランダムに2〜4ミリメートルの厚さの水平組織切片を収集する。
- 滅菌メスとピンセットを用いて外科的組織の一部を分離し、前の属に10%ホルマリンで固定細胞懸濁液のTiON。アーカイブおよび前立腺癌組織の存在を確認するために、この材料組織学的に分析する。
2。組織切片からの細胞懸濁液の生成
- 無菌のバイオセーフティキャビネット内で作業し、滅菌1×リン酸緩衝生理食塩水(PBS)1 mlを含む60×15mmの培養皿に組織切片を転送する。
- 機械的に滅菌メスや鉗子を使用してサンプルを粉砕する。
- いいえ、酵素消化は、このプロトコルではありません。
- 無菌50mlコニカルチューブに1ミリリットルサスペンションを転送します。
- 組織切片が完全に解離されるまで3〜4倍、通常、培養皿に1ミリリットルを加え、チュレーションの手順を繰り返します。
- すべての組織切片が解離されるまで連続的に、この手順を繰り返します。
- 5ミリリットル血清学的にπの50mlポリスチレンコニカルチューブの内容物を再懸濁1分間最高速度(約3,200 rpm)でpetteと渦。
- 35μmの細胞濾過器、得られた懸濁液を濾過し、第二の滅菌50ミリリットルポリスチレンコニカルチューブに集める。
- 10分間450×gでの遠心分離によってペレットを生成します。
- 上清を捨て、赤血球溶解緩衝液5mlでペレットを再懸濁し、そしてRTで5分間溶液をインキュベートする。 RTにおける450×gで5分間遠心分離し、赤血球細胞溶解緩衝液を除去する。
- 上清を捨て、5%FBSを補充した1×PBS中でペレットを再懸濁し、血球計又は自動化細胞カウンターを用いて生存(トリパンブルー陰性)細胞の数を定量化する。 1×10 6個/ mlの懸濁物を生成し、それはもはや、1時間よりも、氷上で保管していません。
- 細胞の生存率および収率は腫瘍検体との間でかなり変化し得る。前立腺切除の設定では、生存率は45から70パーセント、かつfの間の範囲であり得る肉眼で見える腫瘍小結節から2〜4ミリメートルの厚さの水平組織切片が約3×10 6個の生細胞を得ることが期待できる見る。
3。 FACSのための細胞の抗体染色
- 以下に示すように5 15ミリリットルポリスチレンコニカルチューブにラベルを付けます。それぞれ、造血および内皮の要素を除外するために、CD45およびCD31抗原のラベルを使用してください。
- 汚れのない
- のIgG 2aは κ-PE +のIgG 1κ-FITC
- HLAI-PE +のIgG 1κ-FITC
- のIgG 2aは κ-PE + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- ステップ3.1において5管に前のセクション(ステップ2.7)から定量細胞懸濁液を配布します。 1:250の希釈で抗体を追加し、30分間氷上で細胞懸濁液をインキュベートする。
- 4℃で3分間450×gで細胞を遠心分離し、上清を捨てる。
- 滅菌1×PBSで各ペレットを再懸濁することにより細胞を洗浄し、4℃で3分間、450×gで遠心分離し、続いて10%FBSを補充した
- 10μgの/ mlの濃度で、4 '、6 - ジアミジノ-2 - フェニルインドール(DAPI)を含有する1×PBS 1mlの溶液で細胞を再懸濁する。
- 12ミリメートル×75ミリメートルのポリスチレンチューブに35μmのストレーナーキャップを通じて最終的な解決策をフィルタリング。
4。 FACSによる前立腺のCSCの分離
- 細胞選別のためのフローサイトメーターを利用している。
- 管#1、#2、#3、#4からの細胞を用いて補償制御を設定する。
- 前方および側方散乱パラメータを用いて破片および細胞のクラスターを除外ゲートを作成する。
- それぞれ、チューブ#3とチューブ#4からの懸濁物を使用して、FITCおよびPEゲートを確立する。
- パシフィックブルー·チャネルを使用して実行可能なゲート(DAPI陰性)細胞。
- チューブ#5廃棄CD31陽性およびCD45陽性細胞を使用し、のRPMI 2ミリリットルを含む滅菌15 mlのポリスチレンコニカルチューブにHLAI陰性とHLAI陽性集団の両方を収集し、10%FBSを添加した。
- 遠心機で5分間450×gで細胞懸濁液をソートした後、10%のFBSを補充したRPMI 200〜500μlにペレットを再懸濁する。
- 血球計数器または自動化細胞カウンターを使用して実行可能な(パンブルー陰性)細胞を定量。
結果
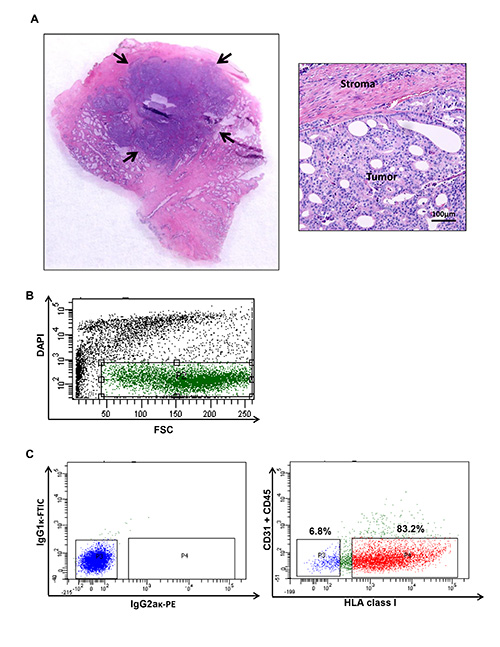
図1。ヒト前立腺癌腫瘍を収穫し、ヒト前立腺癌の特定の集団を示すフローサイトメトリープロット。(A)腫瘍結節細胞懸濁液を生成するために収穫される。処理された試料の腫瘍含有量は、従来のヘマトキシリン及びエオシン染色を用?...
ディスカッション
このプロトコルは、新鮮なヒト前立腺癌組織からのCSCの単離を記載している。いくつかの重要な考慮事項は、このプロトコルの成功結果に影響を与える。
生存可能な前立腺癌細胞の高い数の回復は、外科的試料を慎重に肉眼的評価に依存する。巨視的腫瘍結節が観察され、10を処理する際に我々の経験では、腫瘍形成性前立腺細胞の正常なアイソレーションが最?...
開示事項
利害の対立が宣言されていません。
謝辞
この作品は、ハリリファミリー財団とTJマーテル財団によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
参考文献
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved