É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de células-tronco cancerosas em amostras de câncer de próstata humano
Neste Artigo
Resumo
O isolamento de células-tronco cancerosas (CSCs) diretamente a partir de tecidos humanos é requisito para a sua caracterização biológica. Este manuscrito descreve uma metodologia para o isolamento de CSCs próstata de tecidos humanos, além de fornecer dicas sobre solução de problemas etapas difíceis.
Resumo
O modelo de células-tronco do câncer (CSC) tem sido revisitado consideravelmente ao longo das últimas duas décadas. Durante este tempo os CSCs foram identificados e isolado directamente a partir de tecidos humanos e em série propagados em ratinhos imunodeficientes, normalmente por meio de marcação de anticorpos de subpopulações de células e de fraccionamento, por citometria de fluxo. No entanto, as características únicas clínicos de cancro da próstata tem limitado consideravelmente o estudo das CSCs da próstata a partir de amostras de tumores humanos frescos. Recentemente, referiram o isolamento de CSCs próstata directamente a partir de tecidos humanos, em virtude da sua classe I HLA fenótipo (HLAI)-negativo. Células de câncer de próstata são colhidas a partir de espécimes cirúrgicos e dissociados mecanicamente. A suspensão de células é gerada e marcada com anticorpos HLAI e estromais conjugados fluorescentes. As subpopulações de células HLAI-negativos são finalmente isolados utilizando um citómetro de fluxo. A principal limitação deste protocolo é a natureza muitas vezes microscópica e multifocal decâncer primário em espécimes de prostatectomia. No entanto, isolados CSCs próstata ao vivo são adequados para a caracterização molecular e validação funcional por transplante em ratos imunodeficientes.
Introdução
Heterogeneidade intratumoral é considerado uma indicação do cancro 1. De facto, vários mecanismos de heterogeneidade intratumoral foram descritas, incluindo a mutação genética e interacções com o microambiente. Além disso, alguns tipos de cancro podem conter uma hierarquia celular com uma sub-população de células estaminais de cancro (CSCs) que exibe as propriedades de capacidade de iniciação do tumor e de auto-renovação em ensaios de transplante em série 2-5. Inicialmente descrito em hematológica 6, 7 de mama, cérebro e 8 malignidades, CSCs também têm sido estudadas em cancro da próstata 9-12, bem como outros tipos de tumor de 2-5.
CSCs são geralmente considerados uma fracção celular dentro de uma população heterogénea de 2-5. Portanto, a caracterização funcional e molecular de CSCs depende seu enriquecimento de populações em massa. Assim, durante as últimas duas décadas vários conheceuhodologies de CSC enriquecimento foram concebidas que normalmente envolvem a separação de populações marcados por citometria de fluxo. Além disso, uma consideração importante no estudo da CSCs é que a organização hierárquica de tecidos humanos pode ser interrompido por meio de manipulações experimentais, tais como passagens em série em cultura ou imunodeficientes ratinhos. Como resultado, o isolamento directo de CSCs de tecidos humanos tem emergido como uma importante metodologia no campo CSC.
O câncer de próstata é uma das principais causas de morbidade e mortalidade nos Estados Unidos e ao redor do mundo 13 de câncer. Assim, o isolamento e caracterização biológica da CSCs próstata é de interesse significativo. CSCs próstata tenham sido previamente enriquecido a partir de linhagens de células derivadas de pacientes, xenotransplantes e baixa passagem pacientes provenientes de culturas em suspensão 9,10,12,14.
Recentemente, relatou o isolamento de CSCs próstata diretamente de s cirúrgicos humanosplos em virtude de sua HLAI negativo da superfície celular fenótipo 10. Aqui detalhamos os procedimentos implementados para o isolamento dessas células. Tumores da próstata são colhidas a partir de amostras cirúrgicas e feito em suspensões de células. As células são depois coradas utilizando anticorpos contra HLAI assim como marcadores estromais e de viabilidade, e CSCs são isoladas por separação de células activadas por fluorescência (FACS). Isolado CSCs podem então ser utilizadas para ensaios que exigem células viáveis.
Protocolo
1. Colheita e Processamento de tecido de câncer de próstata humano de espécimes cirúrgicos
- Preparar dois tubos cónicos de 50 ml de poliestireno que contêm 15 ml de Roswell Park Memorial Institute (RPMI) 1640, suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina / estreptomicina.
- Pessoal de serviço de Patologia colher amostras primários e metastáticos de câncer de próstata de prostatectomia e cirurgia paliativa espécimes, respectivamente, no âmbito de um Conselho de Revisão Institucional protocolo aprovado. Amostras metastáticos podem ser obtidos a partir de dissecações nódulos linfáticos durante a cirurgia primária, as vértebras durante procedimentos cirúrgicos paliativas, tais como descompressão medular, e os pulmões durante a remoção de diagnóstico de lesões metastáticas individuais, entre outros.
- Colher grandes quantidades de tecido em excesso não é necessário para diagnósticos clínicos para o primeiro tubo de 50 ml de poliestireno cónica a partir do passo 1.1 e imediatamente armazenar a 4 ° C. O colhidatecido d deve medir pelo menos um 4-5 cm 2 de área e 1-2 cm de espessura.
- O pessoal do laboratório processar grandes quantidades de tecido obtido a partir do serviço de patologia em preparação para exame histológico e a geração de células em suspensão.
- Processamento de tecidos em massa não deve exceder 24 horas de ressecção cirúrgica, a fim de garantir a viabilidade celular máxima.
- Trabalhando em uma cabine de segurança biológica com um bisturi e pinças estéreis, tome 2-4 mm cortes de tecido horizontais grossas de nódulos tumorais macroscópicos. Imediatamente armazenar as seções no segundo 50 ml tubo cônico de poliestireno do passo 1.1.
- Quando nódulos macroscópicos não são visualizados a partir de amostras de prostatectomia, recolher aleatórios 2-4 mm cortes de tecido horizontais grossas dos lobos posteriores e zona de transição.
- Separe uma parte do tecido cirúrgico utilizando um bisturi e pinças estéreis e fixá-lo em formol a 10% antes de gênerosção de suspensões de células. Arquivo e analisar esta histologicamente o material para confirmar a presença de tecido de câncer de próstata.
2. Geração de suspensões de células a partir de tecido secções
- Trabalhando numa câmara de biossegurança estéril, transferir uma parte do tecido para um prato de 60 mm x 15 cultura contendo 1 mL de 1x tampão fosfato salino estéril (PBS).
- Mecanicamente triturar a amostra usando um bisturi e pinças estéreis.
- Não digestões enzimáticas são neste protocolo.
- Transferir a suspensão de 1 ml em uma estéril tubo de 50 ml.
- Adicionar 1 ml para o prato de cultura e repetir a etapa de trituração, até a secção de tecido é completamente dissociada, geralmente de 3 a 4 vezes.
- Repita este procedimento até que todos os serialmente cortes de tecidos foram dissociados.
- Ressuspender o conteúdo do tubo de 50 ml de poliestireno cónica com 5 ml de pi serológicoPette e vortex a velocidade máxima (aproximadamente 3200 rpm) durante 1 min.
- Filtrar a suspensão resultante através de um filtro de células de 35 mícrons e recolher num segundo tubo de 50 ml estéril cónico poliestireno.
- Gerar uma pelete por centrifugação a 450 xg durante 10 min.
- Rejeitar o sobrenadante, ressuspender o sedimento com 5 ml de tampão de lise de glóbulos vermelhos, e incubar a solução durante 5 min à TA. Remover o tampão de lise de glóbulos vermelhos por centrifugação durante 5 min a 450 xg à temperatura ambiente.
- Rejeitar o sobrenadante, ressuspender o sedimento em 1x PBS suplementado com 5% de FBS, e quantificar o número de células viáveis (azul de tripano-negativo), utilizando um hemocitómetro ou contador de células automatizado. Gerar um 1x10 6 células / ml suspensão e armazená-lo no gelo para não mais do que 1 hora.
- A viabilidade ea produção de células pode variar consideravelmente entre as amostras tumorais. No cenário prostatectomia, a viabilidade pode variar entre 45-70%, e five 2-4 mm de secções de tecido horizontais grossas de um nódulo de tumor macroscópico pode ser esperado para produzir cerca de 3x10 6 células viáveis.
3. Anticorpo de coloração de células de FACS
- Identifique cinco 15 ml de poliestireno tubos cônicos como mostrado abaixo. Use CD45 e CD31 de marcação pelo antígeno para excluir hematopoiéticas e elementos endoteliais, respectivamente.
- Imaculado
- IgG 2a κ-PE + IgG 1 κ-FITC
- HLAI-PE + IgG 1 κ-FITC
- IgG 2a κ-PE + CD31 + CD45-FITC-FITC
- HLAI-PE + CD45 + CD31-FITC-FITC
- Distribuir a suspensão celular quantificada a partir da secção anterior (passo 2.7) em cinco tubos na etapa 3.1. Adicionar os anticorpos, a uma diluição de 1:250, e incuba-se as suspensões de células sobre gelo durante 30 min.
- Centrifugar as células a 450 xg durante 3 minutos a 4 ° C, e descartar os sobrenadantes.
- Lave as células por ressuspensão cada pellet com 1x PBS estéril suplementado com 10% de FBS, seguido por centrifugação a 450 xg durante 3 minutos a 4 ° C.
- Ressuspender as células em uma solução de 1 ml de 1x PBS contendo 4 ',6-diamidino-2-fenilindole (DAPI), a uma concentração de 10 ug / ml.
- Filtrar a solução final através de 35 tampas de coador ^ M em 12 milímetros x 75 mm tubos de poliestireno.
4. Isolamento da próstata CSCs por FACS
- Utilize um citômetro de fluxo para separação de células.
- Definir os controles de compensação usando células de tubos # 1, # 2, # 3 e # 4.
- Criar portões que excluem detritos e aglomerados de células usando parâmetros para a frente e de lado de dispersão.
- Estabelecer os FITC e PE portas usando as suspensões de tubo n º 3 e n º 4 do tubo, respectivamente.
- Células (DAPI-negativo) Portão viáveis utilizando o Pacific Blue-A do canal.
- Usando tubo n º 5 de descarte de células CD31-positivas e CD45-positivas erecolher ambas as populações HLAI-negativas e HLAI-positivos em tubos de poliestireno de 15 ml cónicos estéreis contendo 2 ml de meio RPMI suplementado com 10% de FBS.
- Centrifugar a suspensões de células classificadas em 450 xg durante 5 min, e depois voltar a suspender as pelotas em 200-500 mL de meio RPMI suplementado com 10% de FBS.
- Quantificar as células viáveis (Trypan Blue-negativo) utilizando um hemocitômetro ou contador de células automatizado.
Resultados
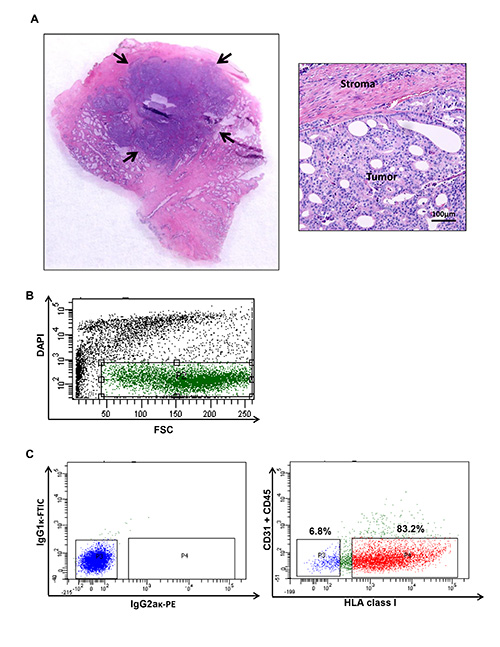
Figura 1. Próstata humana colheita tumor de câncer e citometria de fluxo enredo ilustrando populações específicas de um câncer de próstata humano. (A) nódulos tumorais são colhidas para gerar uma suspensão celular. Teor de tumor da amostra processada é confirmada usando hematoxilina e eosina convencional.
Discussão
Este protocolo descreve o isolamento das CSCs de fresco tecidos de cancro da próstata humano. Várias considerações importantes influenciam o sucesso deste protocolo.
A recuperação de um elevado número de células cancerosas da próstata viáveis depende de avaliação cuidadosa bruta de amostras cirúrgicas. Em nossa experiência, o isolamento de células prostáticas tumorais é melhor assegurada quando nódulos tumorais macroscópicas são observados e tratados 10. ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pela Fundação Hariri Família e da Fundação TJ Martell.
Materiais
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Referências
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados