Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement de cellules souches du cancer à partir d'échantillons cancer de la prostate humaine
Dans cet article
Résumé
L'isolement des cellules souches cancéreuses (CCM) directement à partir de tissus humains est nécessaire pour leur caractérisation biologique. Ce manuscrit décrit une méthodologie pour l'isolement des CSC de la prostate à partir de tissus humains, tout en offrant des conseils sur le dépannage des mesures difficiles.
Résumé
Le modèle de cellules souches du cancer (SCC) a été considérablement revu au cours des deux dernières décennies. Pendant ce temps, les CSC ont été identifiés et directement isolé à partir de tissus humains et en série propagé dans des souris immunodéficientes, généralement grâce à l'étiquetage des anticorps de sous-populations de cellules et de fractionnement par cytométrie de flux. Cependant, les caractéristiques cliniques uniques de cancer de la prostate ont considérablement limité l'étude de la CSC de la prostate à partir d'échantillons frais de tumeurs humaines. Nous avons récemment rapporté l'isolement des CSC de la prostate directement à partir de tissus humains en raison de leur classe de phénotype HLA I (HLAI)-négatif. des cellules de cancer de la prostate sont récoltées à partir de pièces chirurgicales et dissociées mécaniquement. Une suspension de cellules est généré et marqué avec des anticorps conjugués HLAI stromales et par fluorescence. Les sous-populations de cellules HLAI négatifs sont finalement isolés en utilisant un cytomètre de flux. La principale limitation de ce protocole est la nature souvent microscopique et multifocalecancer primaire en pièces de prostatectomie. Néanmoins, isolés CSC de la prostate en direct sont appropriés à la caractérisation moléculaire et la validation fonctionnelle par transplantation dans des souris immunodéficientes.
Introduction
Hétérogénéité intratumorale est considérée comme une caractéristique du cancer 1. En effet, plusieurs mécanismes d'hétérogénéité intratumorale ont été décrites, y compris la mutation génétique et les interactions avec le micro-environnement. En outre, certains cancers peuvent contenir une hiérarchie cellulaire avec une sous-population de cellules souches cancéreuses (CCM) qui présente des propriétés de capacité de la tumeur et initier l'auto-renouvellement dans des essais de transplantation de série 2-5. Initialement décrit dans hématologique 6, du sein 7, 8 et les tumeurs malignes du cerveau, CCF ont également été étudiés dans le cancer de la prostate 9-12 ainsi que d'autres types de tumeurs 2-5.
CSC sont généralement considérés comme une fraction cellulaire dans une population hétérogène 2-5. Par conséquent, la caractérisation fonctionnelle et moléculaire du CSC est subordonnée à leur enrichissement des populations en vrac. En conséquence, au cours des deux dernières décennies, plusieurs se sont réunishodologies d'enrichissement SCC ont été élaborées qui impliquent généralement la séparation des populations marquées par cytométrie de flux. En outre, une considération importante dans l'étude de la CSC est que l'organisation hiérarchique des tissus humains peut être perturbée par des manipulations expérimentales telles que passages en série en culture ou immunodéficientes souris. En conséquence, l'isolement direct des CSC de tissus humains a émergé comme une méthode importante dans le domaine du SCC.
cancer de la prostate est une cause majeure de morbidité et de mortalité aux États-Unis et partout dans le monde 13 cancer. Par conséquent, l'isolement et la caractérisation biologique des CSC de la prostate est d'un grand intérêt. CCF de la prostate ont été préalablement enrichi à partir de lignées cellulaires dérivées de patients, des xénogreffes, et une faible passage de patients provenant de cultures en suspension 9,10,12,14.
Nous avons récemment rapporté l'isolement des CSC de la prostate directement à partir de chirurgicales humainesexemples en vertu de leur HLAI négatif surface cellulaire phénotype 10. Ici, nous détaillons les procédures mises en place pour l'isolement de ces cellules. tumeurs de la prostate sont récoltées à partir de prélèvements chirurgicaux et transformées en suspensions cellulaires. Les cellules sont ensuite colorées à l'aide d'anticorps contre HLAI ainsi que des marqueurs de stroma et de viabilité, et les CCM sont isolés par tri cellulaire activé par fluorescence (FACS). CSC isolées peuvent ensuite être utilisés pour les essais nécessitant cellules viables.
Protocole
Une. La récolte et le traitement des tissus de cancer de la prostate humain spécimens chirurgicaux
- Préparer deux 50 ml polystyrène contenant des tubes coniques de 15 ml de Roswell Park Memorial Institute (RPMI) 1640 du milieu de culture supplémenté avec 10% de sérum fœtal bovin (FBS) et 1% de pénicilline / streptomycine.
- personnel des services de pathologie récolter des échantillons primaires et métastatiques de la prostate cancer de la prostatectomie et la chirurgie palliative échantillons, respectivement, en vertu d'un Institutional Review Board protocole approuvé. Métastatiques échantillons peuvent être obtenus à partir de ganglions lymphatiques dissections pendant la chirurgie primaire, les vertèbres pendant les procédures chirurgicales, les soins palliatifs comme la décompression de la moelle épinière, et les poumons lors de l'enlèvement de diagnostic de lésions métastatiques simples, parmi d'autres.
- Récolter excès de tissu en vrac ne sont pas nécessaires pour le diagnostic clinique dans le premier tube de 50 ml polystyrène conique de l'étape 1.1 et stocker immédiatement à 4 ° C. Le Foind tissu doit mesurer au moins un 4-5 cm 2 de surface et 1-2 cm d'épaisseur.
- Le personnel de laboratoire traiter un tissu en vrac obtenu à partir du service de pathologie en cours de préparation pour un examen histologique et la production de suspensions cellulaires.
- Le traitement des tissus en vrac ne doit pas dépasser 24 heures à partir de la résection chirurgicale afin de garantir la viabilité cellulaire maximale.
- Travailler dans une enceinte de sécurité biologique avec un scalpel et pince stérile, prendre 2-4 coupes de tissus mm d'épaisseur horizontale de nodules tumoraux macroscopiques. Stocker immédiatement les sections dans la deuxième Tube 50 ml polystyrène conique de l'étape 1.1.
- Lorsque nodules macroscopiques sont pas visualisées à partir d'échantillons de prostatectomie, collecter des sections aléatoires 2-4 mm d'épaisseur horizontales de tissus provenant des lobes postérieurs et de la zone de transition.
- Séparer une partie du tissu chirurgical à l'aide d'un scalpel et pince stérile et fixer formol à 10% avant genrestion de suspensions cellulaires. Archive histologiquement et analyser ce matériau afin de confirmer la présence de tissu de cancer de la prostate.
2. Génération des suspensions cellulaires à partir de sections de tissu
- Travailler dans une enceinte de sécurité biologique stérile, transférer une partie de tissu à une boîte de 60 mm x 15 de culture contenant 1 ml de stérile 1x tampon phosphate salin (PBS).
- Mécaniquement triturer l'échantillon en utilisant un scalpel et pince stérile.
- Pas de digestions enzymatiques sont dans ce protocole.
- Transférer la suspension de 1 ml dans un tube conique de 50 ml stérile.
- Ajouter 1 ml de la boîte de culture et répéter l'étape de trituration jusqu'à ce que la coupe de tissu est complètement dissocié, habituellement 3-4x.
- Répétez cette procédure jusqu'à ce que toutes les sections en série de tissus ont été dissociées.
- Remettre en suspension le contenu du tube de polystyrène conique de 50 ml avec 5 ml d'une pi sérologiquepette et vortex à vitesse maximale (environ 3200 tours par minute) pendant 1 min.
- Filtrer la suspension au travers d'un tamis cellulaire de 35 um et de recueillir dans un deuxième 50 ml tube conique en polystyrène stérile.
- Générer un culot par centrifugation à 450 xg pendant 10 min.
- Jeter le surnageant, remettre en suspension le culot avec 5 ml de tampon de lyse des globules rouges, et incuber la solution pendant 5 min à température ambiante. Retirer le tampon de lyse des globules rouges du sang par centrifugation pendant 5 min à 450 x g à température ambiante.
- Jeter le surnageant, remettre en suspension le culot dans 1 x PBS supplémenté avec 5% de FBS, et de quantifier le nombre de cellules viables (trypan bleu-négative) en utilisant un hémocytomètre ou compteur de cellules automatisé. Générer un 1x10 6 cellules / ml de suspension et de le stocker sur la glace pendant plus de 1 heure.
- La viabilité et le rendement des cellules peuvent varier considérablement entre les échantillons de tumeur. Dans le cadre de la prostatectomie, la viabilité peut varier entre 45-70%, et five 4.2 mm coupes de tissus horizontales épaisses d'un nodule de la tumeur macroscopique peut s'attendre à un rendement d'environ 3x10 6 cellules viables.
3. Anticorps coloration des cellules pour FACS
- Étiqueter cinq tubes de 15 ml coniques en polystyrène comme indiqué ci-dessous. Utilisez CD45 et CD31 étiquetage de l'antigène à exclure hématopoïétiques et endothéliales éléments, respectivement.
- Unstained
- IgG 2a-PE κ + κ une IgG-FITC
- HLAI-PE + IgG-FITC 1 κ
- IgG 2a κ-PE + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- Répartir la suspension de cellules quantifié à partir de la section précédente (étape 2.7) dans les cinq tubes à l'étape 3.1. Ajouter les anticorps à une dilution de 1:250, et incuber les suspensions de cellules sur de la glace pendant 30 min.
- Centrifuger les cellules à 450 g pendant 3 min à 4 ° C, et jeter le surnageant.
- Laver les cellules par remise en suspension chaque culot avec 1x stérile PBS supplémenté avec 10% de FBS, suivie d'une centrifugation à 450 g pendant 3 min à 4 ° C.
- Remettre en suspension les cellules dans une solution de 1 ml de 1 x PBS contenant 4 ',6-diamidino-2-phénylindole (DAPI) à une concentration de 10 pg / ml.
- Filtrer la solution finale par 35 um bouchons de tamis en 12 mm x 75 mm tubes de polystyrène.
4. Isolation de la prostate CSC par FACS
- Utiliser un cytomètre de flux pour le tri de cellules.
- Réglez les contrôles de compensation en utilisant des cellules de tubes # 1, # 2, # 3, et # 4.
- Créer portes qui excluent les débris et les amas de cellules en utilisant des paramètres avant et latérale dispersion.
- Établir les FITC et PE portes en utilisant les suspensions de tubes n ° 3 et le tube n ° 4, respectivement.
- Cellules viables grille (DAPI négatif) en utilisant le bleu pacifique-Un canal.
- Utilisant un tube # des cellules CD31-positives et CD45-positifs 5 rejets etrecueillir les deux populations HLAI-négatives et positives HLAI dans 15 ml tubes coniques stériles de polystyrène contenant 2 ml de milieu RPMI supplémenté avec 10% de FBS.
- Centrifuger la suspension de cellules triées à 450 xg pendant 5 min, puis remettre en suspension les culots dans 200 à 500 pi de milieu RPMI supplémenté avec 10% de FBS.
- Quantifier les cellules viables (trypan bleu-négatif) en utilisant un hématimètre ou compteur de cellules automatisé.
Résultats
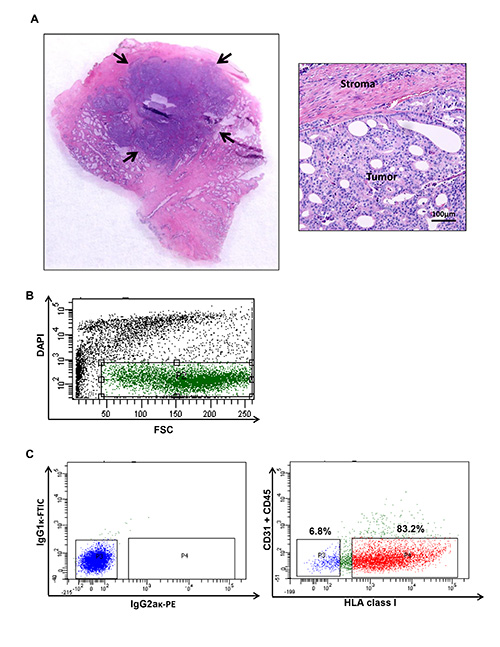
Figure 1. La récolte de la tumeur du cancer de la prostate de l'humain et de la cytométrie en flux tracé illustrant des populations spécifiques d'un cancer de la prostate humain (A). Nodules tumoraux sont récoltées pour produire une suspension de cellules. contenu de la tumeur de l'échantillon traité...
Discussion
Ce protocole décrit l'isolement de CCF à partir de tissus de cancer de la prostate humain frais. Plusieurs facteurs importants influent sur le succès de ce protocole.
La récupération des nombres élevés de cellules cancéreuses de la prostate viables dépend de l'évaluation brute minutieuse des échantillons chirurgicaux. Dans notre expérience, l'isolement réussi de cellules de la prostate tumorigènes est mieux assurée lorsque nodules tumoraux macroscopiques sont obser...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été soutenu par la Fondation Hariri famille et la TJ Martell Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
Références
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon