A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד של תאי גזע סרטני מדגימות אדם סרטן הערמונית
In This Article
Summary
הבידוד של תאי גזע סרטני (CSCs) ישירות מרקמות אנושיות הוא הנדרש לאפיון הביולוגי שלהם. כתב יד זה מתאר מתודולוגיה לבידודה של CSCs ערמונית מרקמות אנושיות, תוך מתן טיפים על פתרון בעיות בצעדים קשים גם.
Abstract
מודל תאי גזע סרטני (CSC) כבר בקר במידה ניכרת במהלך שני העשורים האחרונים. במהלך תקופה זו CSCs זוהה ובודד ישירות מרקמות אנושיות ומופץ באופן סדרתי בעכברים עם מערכת חיסון חלש, בדרך כלל באמצעות תיוג נוגדן של אוכלוסיות של תאים וחלוקה על ידי cytometry זרימה. עם זאת, המאפיינים הקליניים הייחודיים של סרטן הערמונית באופן משמעותי מוגבלים על המחקר של CSCs ערמונית מדגימות גידול אנושיים טריות. לאחרונה דיווחו על הבידוד של CSCs ערמונית ישירות מרקמות אנושיות מכוח פנוטיפ (HLAI) שלילי כיתת HLA שלהם. תאי סרטן ערמונית נקצרים מן הדגימות כירורגית וניתקו באופן מכאני. השעיה תא שנוצרה ושכותרתו עם נוגדני HLAI וסטרומה מצומדות fluorescently. תת אוכלוסיות של תאי HLAI השליליים סוף סוף מבודדות באמצעות cytometer זרימה. המגבלה העיקרית של פרוטוקול זה היא הטבע בתדירות גבוהה המיקרוסקופי והמולטי שלסרטן ראשוני בדגימות ערמונית. יחד עם זאת, CSCs ערמונית חי המבודד מתאים לאפיון מולקולרי ואימות פונקציונלית על ידי השתלה בעכברים עם מערכת חיסון חלש.
Introduction
ההטרוגניות intratumoral נחשבת לסימן היכר של סרטן 1. ואכן, מספר מנגנונים של הטרוגניות intratumoral תוארו, כולל מוטציה ואינטראקציות עם microenvironment גנטיים. בנוסף, סוגים מסוימים של סרטן עשויים להכיל היררכיה סלולרית עם subpopulation של תאי גזע סרטני (CSCs) המציג את המאפיינים של יכולת ייזום גידול והתחדשות עצמית במבחני השתלה סידוריים 2-5. תאר בתחילה בהמטולוגיות 6, 7 שד, ומוח 8 ממאירות, CSCs נחקר גם בסרטן ערמונית 9-12, כמו גם סוגי גידולים אחרים 2-5.
CSCs נחשב בדרך כלל חלק קטן הסלולר בתוך אוכלוסייה הטרוגנית 2-5. לכן, האפיון הפונקציונלי ומולקולרי של CSCs מותנה ההעשרה שלהם מאוכלוסיות בתפזורת. בהתאם לכך, בשני העשורים האחרונים כמה נפגשוhodologies העשרת CSC כבר המציא אשר בדרך כלל כרוך בהפרדה בין אוכלוסיות שכותרתו על ידי cytometry זרימה. בנוסף, שיקול משמעותי במחקר של CSCs הוא שהארגון ההיררכי של רקמות אנושיות עשוי להיות מופר על ידי מניפולציות ניסוייות כגון passaging הסידורי בעכברים עם מערכת חיסון חלש או תרבות. כתוצאה מכך, הבידוד הישיר של CSCs מרקמות אנושיות התפתחה המתודולוגיה חשובה בתחום CSC.
סרטן הערמונית הוא סיבה מובילה לתחלואה בסרטן והתמותה בארצות הברית וברחבי העולם 13. לכן, הבידוד והאפיון ביולוגי של CSCs הערמונית הוא עניין משמעותי. CSCs ערמונית בעבר כבר מועשר משורות תאים, xenografts מטופל נגזר, ותרבויות השעיה מטופל נובע מעבר נמוך 9,10,12,14.
לאחרונה דיווחו על הבידוד של CSCs ערמונית ישירות מים כירורגית אדםamples מכוח פנוטיפ תא שטח HLAI השלילי 10. כאן אנו מפרטים את הנהלים המיושמים לבידוד של תאים אלה. גידולי ערמונית נקצרים מן הדגימות כירורגית וגרמו להשעיות תא. לאחר מכן תאים הם מוכתמים באמצעות נוגדנים נגד HLAI כמו גם סמני סטרומה וכדאיויות, וCSCs מבודדים על ידי מיון תא הקרינה מופעלת (FACS). CSCs הבודד לאחר מכן ניתן להשתמש עבור מבחני הדורשים תאי קיימא.
Protocol
1. איסוף ועיבוד של רקמה האנושית של סרטן הערמונית מדגימות כירורגית
- הכן שני 50 מיליליטר צינורות חרוטי קלקר המכילים 15 מיליליטר של Roswell Park Memorial Institute (RPMI) מדיום 1640 תרבות בתוספת 10% בסרום שור העובר (FBS) ו -1% פניצילין / סטרפטומיצין.
- אנשי שירות פתולוגיה למסוק דגימות ראשוניות וגרורתי סרטן ערמונית מדגימות כריתת ערמונית וניתוח פליאטיבי, בהתאמה, תחת דירקטוריון סקירה מוסדית אישרו פרוטוקול. ניתן לקבל דגימות גרורתי מניתוחי בלוטות לימפה במהלך ניתוח ראשוני, החוליות במהלך הליכים פליאטיבי כירורגית, כגון לחץ בעמוד השדרה, והריאות במהלך הסרת אבחון של גרורות בודדות, בין יתר.
- קציר רקמות עודפות בתפזורת אין צורך לאבחון קליני לתוך צינור חרוטי הקלקר הראשון 50 מ"ל משלב 1.1 ולאחסן מייד ב 4 ° C. Harvesteרקמת ד צריכה למדוד לפחות 4-5 סנטימטר 2 באזור ו1-2 סנטימטר עובי.
- אנשי מעבדה לעבד רקמה בכמות גדולה שהתקבלה מהשירות לפתולוגיה בהכנה לבחינה ודור היסטולוגית של השעיות תא.
- עיבוד של רקמות בתפזורת לא יעלה 24 שעות מכריתה כירורגית על מנת להבטיח את כדאיות תא מקסימליים.
- עבודה בארון בטיחות ביולוגית עם אזמל ומלקחיים סטריליות, לקחת 2-4 חלקי מ"מ עובי אופקי רקמה מגושים סרטניים מקרוסקופיים. מייד לאחסן את החלקים בצינור חרוטי קלקר השני 50 מיליליטר משלב 1.1.
- כאשר גושים מאקרוסקופיים לא דמיינו מדגימות ערמונית, לאסוף קטעים אקראיים 2-4 מ"מ עובי אופקיים רקמה מהאונות האחורית ואזור מעבר.
- להפריד בין חלק של הרקמה כירורגית באמצעות אזמל ומלקחיים סטריליות ולתקן אותה בפורמלין 10% לפני generation של השעיות תא. ארכיון ולנתח בהיסטולוגיה החומר הזה כדי לאשר את קיומו של רקמת סרטן ערמונית.
2. דור של השעיות תא מסעיפי רקמות
- עבודה בארון בטיחות ביולוגית סטרילי, להעביר קטע רקמה למנת תרבות מ"מ 60 x 15 מכילה 1 מיליליטר של בופר פוספט 1x סטרילי (PBS).
- מכאני triturate המדגם באמצעות אזמל ומלקחיים סטריליות.
- לא digestions האנזימטית הם בפרוטוקול זה.
- מעביר את ההשעיה 1 מיליליטר לתוך צינור חרוטי 50 מיליליטר סטרילי.
- הוסף 1 מיליליטר למנת התרבות ולחזור על שלב טחינה דקה עד לקטע הרקמה מנותק לחלוטין, בדרך כלל 3-4x.
- חזור על תהליך זה באופן סדרתי עד שכל חלקי הרקמות כבר ניתקו.
- Resuspend את התוכן של צינור חרוטי קלקר 50 מיליליטר עם pi סרולוגיות 5 מיליליטרpette ומערבולת במהירות המרבית (כ 3,200 סל"ד) דקות 1.
- סנן את ההשעיה וכתוצאה מכך דרך מסננת תא 35-מיקרומטר ולאסוף לתוך צינור שני סטרילי 50 מיליליטר קלקר חרוטי.
- לייצר גלולה ידי צנטריפוגה ב450 XG 10 דקות.
- בטל supernatant, resuspend את הכדור עם 5 מיליליטר של חיץ תמוגה תא דם אדום, ודגירת הפתרון עבור 5 דקות ב RT. הסר את חוצץ תמוגה תא דם האדום על ידי צנטריפוגה במשך 5 דקות ב 450 XG ב RT.
- בטל supernatant, resuspend את הכדור ב 1x PBS בתוספת 5% FBS, ולכמת את מספר תאי קיימא (trypan הכחולים שליליים) באמצעות hemocytometer או נגד תא אוטומטי. צור 1x10 6 תאים / מיליליטר השעיה ולאחסן אותו על קרח למשך לא יותר משעה 1.
- הכדאיות והתשואה של תאים עשויות להשתנות במידה ניכרת בין דגימות גידול. בהגדרת כריתת הערמונית, כדאיות עשויה לנוע בין 45-70%, ובדיונייש 2-4 מ"מ סעיפי רקמות אופקיים עבים מגולה גידול מאקרוסקופי עשויים להיות צפויים להניב כ 3x10 6 תאי קיימא.
3. מכתים נוגדן של תאים עבור FACS
- לייבל חמישה 15 מיליליטר צינורות חרוטי קלקר כמוצג להלן. השתמש בתיוג אנטיגן CD45 CD31 ולהוציא hematopoietic ואלמנטי אנדותל, בהתאמה.
- ללא רבב
- 2a IgG κ-PE + IgG 1 κ-FITC
- HLAI-PE + IgG 1 κ-FITC
- κ-PE 2a IgG + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- הפץ את ההשעיה תא לכימות מהסעיף הקודם (שלב 2.7) לחמישה צינורות בשלב 3.1. מוסיף את הנוגדנים בדילול של 1:250, ודגירת השעיות תא על קרח למשך 30 דקות.
- צנטריפוגה התאים ב XG 450 3 דקות ב 4 ° C, וזורקים supernatants.
- לשטוף את התאים על ידי resuspending כל גלולה עם סטרילי 1x PBS בתוספת 10% FBS ואחריו צנטריפוגה ב450 XG במשך 3 דקות ב 4 ° C.
- Resuspend התאים בתמיסת 1 מיליליטר של 1x PBS המכילה 4 ',6-diamidino-2-phenylindole (DAPI) בריכוז של 10 מיקרוגרם / מיליליטר.
- סנן את הפתרון הסופי באמצעות 35 כובעי מסננת מיקרומטר ל12 מ"מ x 75 צינורות קלקר מ"מ.
4. בידוד של הערמונית CSCs ידי FACS
- לנצל cytometer זרימה למיון תא.
- קבע בקרות פיצוי באמצעות תאים מצינורות # 1, # 2, # 3, ומס '4.
- צור שערים שלא לכלול פסולת ואשכולות של תאים באמצעות פרמטרים צופה ותופעות פיזור.
- להקים את שערי FITC ו-PE באמצעות ההשעיות מצינור # 3 וצינור # 4, בהתאמה.
- תאי שער קיימא (DAPI שלילי) באמצעות כחול ערוץ האוקיינוס השקט.
- באמצעות צינור # תאים חיוביים ל-CD45 CD31 חיובי ו5 קלפים שנזרקו ולאסוף שני אוכלוסיות HLAI שליליות וHLAI חיוביות לתוך צינורות חרוטי קלקר 15 מיליליטר סטרילי המכילים 2 מיליליטר של RPMI בתוספת 10% FBS.
- צנטריפוגה מסודרים השעיות תא ב450 XG במשך 5 דקות, ולאחר מכן resuspend את כדורים ב200-500 μl של RPMI בתוספת 10% FBS.
- לכמת תאי קיימא (trypan הכחולים שליליים) באמצעות hemocytometer או נגד תא אוטומטי.
תוצאות
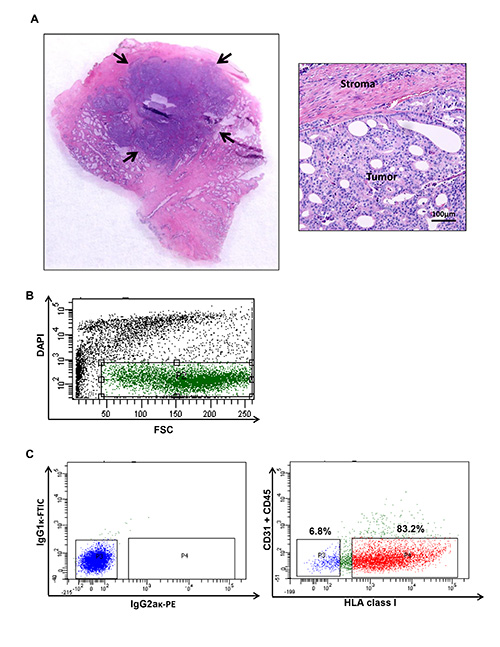
איור 1. קצירת גידול של סרטן ערמונית אדם וcytometry זרימת עלילה הממחישה אוכלוסיות ספציפיות מסרטן הערמונית אנושית. () גושי גידול נקצרים ליצור השעיה תא. תוכן גידו?...
Discussion
פרוטוקול זה מתאר את בידודו של CSCs מרקמות סרטן ערמונית אנושית טריות. כמה שיקולים חשובים להשפיע על התוצאות המוצלחות של פרוטוקול זה.
ההתאוששות של מספרים גבוהים של תאי סרטן ערמונית קיימא תלויה בהערכה זהירה ברוטו של דגימות כירורגית. מ?...
Disclosures
אין ניגודי האינטרסים הכריזו.
Acknowledgements
עבודה זו נתמכה על ידי קרן משפחת חרירי וקרן TJ מארטל.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
References
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved