需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
癌症干细胞从人类前列腺癌样本隔离
摘要
肿瘤干细胞(肿瘤干细胞)直接从人体组织中的隔离是必要的其生物学特性。这个手稿描述了从人体组织前列腺肿瘤干细胞的分离的方法,同时还提供疑难排解困难的步骤提示。
摘要
癌症干细胞(CSC)型号已大大超过重新审视过去二十年。在这段时间的CSCs已经确定并直接分离自人组织和串联传播在免疫缺陷小鼠中,通常是通过细胞和分馏通过流式细胞术的亚群的抗体标记。然而,前列腺癌的独特临床特征有很大限制从人类的肿瘤标本前列腺肿瘤干细胞的研究。我们最近报道的前列腺肿瘤干细胞直接从人体组织凭借自己的HLA I类(HLAI)阴性表型的隔离。前列腺癌的细胞是从手术标本收集和机械解离。细胞悬液生成和标有荧光标记的HLAI和间质抗体。 HLAI阴性细胞亚群用流式细胞仪最终分离。该协议的主要限制是经常微观和多灶性性质原发癌在前列腺切除标本。尽管如此,独立的活前列腺肿瘤干细胞是适合的分子特征和功能验证通过移植免疫缺陷小鼠。
引言
瘤内的异质性被认为是癌症1的标志。事实上,肿瘤内的异质性的几种机制已经描述了,包括基因突变,并与微环境相互作用。此外,一些癌症可能含有与癌症干细胞(肿瘤干细胞)亚群表现出的肿瘤起始能力和自我更新的串行移植实验2-5的属性蜂窝层次。在血液学6,乳腺癌7,和脑8恶性肿瘤最初描述,肿瘤干细胞也已经研究了前列腺癌9-12以及其他类型的肿瘤2-5。
肿瘤干细胞通常被认为是一个异质群体2-5中的细胞部分。因此,肿瘤干细胞的功能和分子特征是在从大量人群的充实队伍。因此,在过去的二十年里遇到几个CSC富集hodologies已经设计出通常涉及标记人群通过流式细胞仪分离。另外,在肿瘤干细胞的研究的显著考虑的是,人体组织的层次组织可以通过实验操作,例如在培养物或免疫缺陷小鼠中连续传代被打乱。其结果是,从人体组织的CSCs的直接分离已经成为在CSC领域的一个重要方法。
前列腺癌是癌症的发病率和死亡率在美国和世界各地13的主要原因。因此,前列腺肿瘤干细胞的分离和生物学特性是显著的兴趣。前列腺肿瘤干细胞先前已经从富集的细胞系,来自患者的移植,以及低传来自患者的悬浮培养9,10,12,14。
我们最近报道的前列腺肿瘤干细胞直接从人的手术S中的隔离amples凭借自己HLAI阴性细胞表面表型10。在这里,我们详细地实施了这些细胞的分离的过程。前列腺肿瘤是从手术标本采集后制成细胞悬液。然后将细胞用抗HLAI抗体以及基质和生存能力标记染色,肿瘤干细胞是通过荧光激活细胞分选术(FACS)分离。孤立的CSCs可以被用于需要活细胞测定法。
研究方案
1。采收和从手术标本人前列腺癌组织处理
- 制备含有15毫升Roswell公园纪念研究所(RPMI)含10%胎牛血清(FBS)和1%青霉素/链霉素1640培养基250毫升聚苯乙烯锥形管中。
- 病理学服务人员从收获前列腺切除和姑息手术标本原发性和转移性前列腺癌样本,分别根据机构审查委员会批准的协议。转移性样本可以从淋巴结清扫术中主要手术来获得,在此期间在诊断除去单个转移灶,其中包括姑息性外科手术,例如脊髓减压,和肺中的椎骨。
- 收获过量块状组织不需要用于临床诊断为第一的50ml聚苯乙烯锥形管从步骤1.1,并立即储存于4℃。该harveste三维组织至少应为4-5厘米2的面积和1-2厘米的厚度。
- 实验室人员处理从筹备组织学检查细胞悬浮液的产生病理的服务获得大量的组织。
- 散装组织处理不应超过从手术切除24小时,以保证最大的细胞活力。
- 工作在生物安全柜消毒的手术刀和镊子,采取从肉眼可见的肿瘤结节2-4毫米厚的水平组织切片。立即存储部分在第二50毫升聚苯乙烯锥形管从步骤1.1。
- 当宏观结节不从前列腺可视化的样本,收集来自后叶和过渡区随机2-4毫米厚的横向组织切片。
- 用无菌手术刀和镊子分离外科组织的一部分,并且固定在10%福尔马林之前属化细胞悬液。存档和分析该材料在组织学证实的前列腺癌组织中的存在。
2。从组织切片悬浮细胞的生成
- 工作在一个无菌的生物安全柜,组织切片转移到含1ml无菌1X磷酸盐缓冲盐水(PBS)中的60×15毫米培养皿中。
- 用无菌手术刀和镊子机械磨碎的样品。
- 没有消化酶在这个协议。
- 转移1毫升悬浮到无菌的50ml锥形管中。
- 加入1 ml至培养皿,并重复研磨步骤,直到所述组织部分被完全离解的,一般为3至4倍。
- 重复此过程连续,直到所有的组织切片已经分离。
- 重悬50毫升聚苯乙烯锥形管中的内容物用5ml的血清学圆周率pette和涡以最大速度(约3,200 rpm)离心1分钟。
- 通过一个35微米的细胞滤网过滤所得悬浮液,并收集到一个第二无菌50毫升聚苯乙烯锥形管。
- 通过离心分离,在450×g离心10分钟,生成的颗粒。
- 弃上清,重悬沉淀,用5ml的红细胞裂解缓冲液,并温育5分钟,在室温的溶液中。通过离心除去红血细胞裂解液5分钟,在450×g离心于RT。
- 弃去上清液,沉淀重悬在1×PBS中补充有5%FBS,并使用血细胞计数器或自动细胞计数器量化可行的(台盼蓝阴性)细胞的数量。产生一个1×10 6细胞/ ml的悬浮液,并将其存储在冰中不超过1小时。
- 的可行性和细胞的产量可能肿瘤标本之间有很大的不同。在前列腺切除术的设定,生存能力可能之间45-70%,和fi范围已经2-4毫米从宏观的肿瘤结节厚的水平组织切片可以预计产量约3×10 6活细胞。
3。细胞的流式细胞仪抗体染色
- 标签515毫升聚苯乙烯锥形管,如下图所示。使用CD45和CD31抗原的标记,以分别排除造血细胞和内皮元素。
- 未染色
- 2A的IgGκ-PE + IgG的1κ-FITC
- HLAI-PE +的IgG 1κ-FITC
- 2A的IgGκ-PE + CD31-FITC + CD45-FITC
- HLAI-PE + CD45-FITC + CD31-FITC
- 从上一节(步骤2.7)分发量化细胞悬液进五管在步骤3.1。加入抗体稀释度为1:250,并在冰上孵育的细胞悬液30分钟。
- 离心细胞,在450×g离心3分钟,在4℃,并丢弃上清液。
- 通过再悬浮每个粒料用无菌的1×PBS洗涤细胞在补充有10%FBS,然后离心以450×g离心3分钟,在4℃下
- 重悬在1×PBS中的1毫升溶液含4',6 - 二脒基-2 - 苯基吲哚(DAPI)在10微克/毫升的浓度将细胞。
- 通过35微米过滤器过滤帽的最终解决方案为12厘米x 75厘米聚苯乙烯管。
4。前列腺肿瘤干细胞的流式细胞仪分离
- 利用流式细胞仪进行细胞分选。
- 设置使用细胞管#1,#2,#3补偿控制,和#4。
- 创建,使用前向和侧向散射参数排除碎片和细胞群的大门。
- 从管#3和#管4确定用悬浮液FITC和PE门,分别为。
- 门可行的(DAPI阴性)使用太平洋蓝色的通道细胞。
- 采用管#5丢弃的CD31阳性且CD45阳性细胞和收集两个HLAI阴性和HLAI阳性人群成含2ml RPMI的补充有10%FBS的无菌的15毫升的聚苯乙烯锥形管中。
- 离心机的排序,在450×g离心5分钟,细胞悬浮液,然后重新悬浮小球在200-500微升的RPMI补加有10%胎牛血清。
- 使用血球或自动细胞计数器量化可行的(台盼蓝染色阴性)细胞。
结果
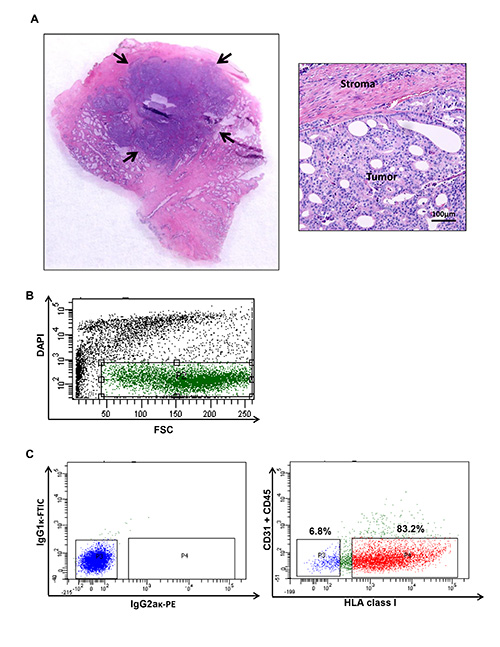
图1。人类前列腺癌肿瘤的收获和流式细胞仪曲线图,展示从人类前列腺癌的特定人群(A)肿瘤结节收获生成细胞悬液。经处理的样品的肿瘤含量用常规苏木精和曙红染色证实。 (B)细胞为DAPI染色阳性被排除隔离只存活细胞。 (
讨论
本协议描述的CSCs的从新鲜人前列腺癌组织中的隔离。几个重要的考虑因素影响本协议的成功结果。
高数可行前列腺癌细胞的恢复依赖于外科手术样品小心总的评估。在我们的经验,致瘤性的前列腺细胞的成功分离,最好保证当肉眼可见的肿瘤结节观察和处理10。
然而,从前列腺切除标本派生时下原发病常常是多灶性和微观。在这些情况下,当可?...
披露声明
没有利益冲突的声明。
致谢
这项工作是由哈里里家族基金会和TJ马爹利基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| RPMI | Gibco Life Technologies | 11875-093 | |
| Fetal bovine serum | Gibco Life Technologies | 10437-028 | |
| Penicillin Streptomycin | Gibco Life Technologies | 15140-122 | |
| PBS | Corning Cell Gro | 21-031-CM | |
| 60 mm, 15 mm Cell culture dish | Corning | 3295 | |
| 35 µm Cell Strainer | BD Falcon | 352340 | |
| 50 ml conical tube | Crystalgen | 23-2263 | |
| 15 ml conical tube | Crystalgen | 23-2265 | |
| Red blood cell lysing buffer | Sigma | R7757 | |
| HLA class I (W6/32) PE antibody | Abcam | ab43545 | |
| CD31 FITC antibody | eBioscience | 11-0319-42 | |
| CD45 FITC antibody | Abcam | ab27287 | |
| IgG2aκ PE antibody | BD Pharminogen | 555574 | |
| IgG1κ FITC antibody | BD Pharminogen | 551954 | |
| DAPI | Invitrogen | d3571 | |
| 12 mm x 75 mm Polystyrene tubes with cell strainer cap | BD Falcon | 352235 | |
| Vortex Mixer | Crystalgen | CG-BV1000 | |
| 10% Neutral Buffer Formalin | Fisher | RBBP-0480 |
参考文献
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144, 646-674 (2011).
- Magee, J. A., Piskounova, E., Morrison, S. J. Cancer stem cells: impact, heterogeneity, and uncertainty. Cancer Cell. 21, 283-296 (2012).
- Nguyen, L. V., Vanner, R., Dirks, P., Eaves, C. J. Cancer stem cells: an evolving concept. Nat. Rev. Cancer. 12, 133-143 (2012).
- Valent, P., et al. Cancer stem cell definitions and terminology: the devil is in the details. Nat. Rev. Cancer. 12, 767-775 (2012).
- Visvader, J. E., Lindeman, G. J. Cancer stem cells: current status and evolving complexities. Cell Stem Cell. 10, 717-728 (2012).
- Lapidot, T., et al. A cell initiating human acute myeloid leukaemia after transplantation into SCID mice. Nature. 367, 645-648 (1994).
- Al-Hajj, M., Wicha, M. S., Benito-Hernandez, A., Morrison, S. J., Clarke, M. F. Prospective identification of tumorigenic breast cancer cells. Proc. Natl. Acad. Sci. U.S.A. 100, 3983-3988 (2003).
- Singh, S. K., et al. Identification of human brain tumour initiating cells. Nature. 432, 396-401 (2004).
- Collins, A. T., Berry, P. A., Hyde, C., Stower, M. J., Maitland, N. J. Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res. 65, 10946-10951 (2005).
- Domingo-Domenech, J., et al. Suppression of acquired docetaxel resistance in prostate cancer through depletion of notch- and hedgehog-dependent tumor-initiating cells. Cancer Cell. 22, 373-388 (2012).
- Patrawala, L., Calhoun-Davis, T., Schneider-Broussard, R., Tang, D. G. Hierarchical organization of prostate cancer cells in xenograft tumors: the CD44+alpha2beta1+ cell population is enriched in tumor-initiating cells. Cancer Res. 67, 6796-6805 (2007).
- Qin, J., et al. The PSA(-/lo) prostate cancer cell population harbors self-renewing long-term tumor-propagating cells that resist castration. Cell Stem Cell. 10, 556-569 (2012).
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics, 2013. CA Cancer J. Clin. 63, 11-30 (2013).
- Patrawala, L., et al. Highly purified CD44+ prostate cancer cells from xenograft human tumors are enriched in tumorigenic and metastatic progenitor cells. Oncogene. 25, 1696-1708 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。