A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
A منصة رواية تمتد للتطبيقات في الخلايا والأنسجة Mechanobiology
In This Article
Summary
نقدم في هذه المقالة منصة تمتد الرواية التي يمكن استخدامها لتحقيق استجابات خلية واحدة إلى مجمع متباين الخواص الميكانيكية تشوه ذو محورين وتحديد الخواص الميكانيكية للالأنسجة البيولوجية.
Abstract
يمكن أن الأدوات التي تسمح تطبيق القوى الميكانيكية للخلايا والأنسجة أو أن قياس ساهمت الخواص الميكانيكية للالأنسجة البيولوجية بشكل كبير في فهم mechanobiology الأساسية. تم هذه التقنيات المستخدمة على نطاق واسع لشرح كيفية تتأثر ظهور وتطور الأمراض المختلفة بشكل كبير من قبل العظة الميكانيكية. يقدم هذا المقال ذو محورين تمتد (BAXS) منصة متعددة الوظائف التي يمكن إما ميكانيكيا تحفيز خلايا واحد أو قياس صلابة الميكانيكية للأنسجة. تتكون منصة BAXS من أربعة محركات لفائف الصوت التي يمكن التحكم بشكل مستقل. الخلايا وحيدة يمكن تربيتها على ركيزة المرنة التي يمكن تركيبها على المحركات يسمح احد لفضح الخلايا إلى حقول سلالة معقدة، ودينامية، ومكانيا متفاوتة. على العكس، من خلال دمج خلية الحمل القوة، يمكن للمرء أيضا قياس الخواص الميكانيكية للأنسجة ابتدائية وهم يتعرضون لدورات تشوه.في كلتا الحالتين، ومجموعة مناسبة من المشابك يجب أن تصمم وشنت على منصة BAXS المحركات من أجل اعتقادا راسخا الركيزة مرنة أو الأنسجة من الاهتمام. منصة BAXS يمكن تركيبه على مجهر مقلوب لأداء الضوء المرسل في وقت واحد و / أو التصوير مضان لدراسة الاستجابة الهيكلية أو البيوكيميائية من العينة خلال التجارب التمدد. توفر هذه المقالة تفاصيل التجريبية من تصميم واستخدام منصة BAXS ويعرض النتائج لخلية واحدة ودراسات النسيج كله. تم استخدام منصة BAXS لقياس تشوه في نوى خلايا فأر myoblast واحد ردا على الركيزة سلالة وقياس صلابة من aortas الماوس معزولة. منصة BAXS هو أداة متعددة الاستعمالات التي يمكن دمجها مع مختلف microscopies الضوئية من أجل تقديم رؤى mechanobiological الرواية على الصعيدين الأنسجة شبه الخلوية، الخلوية وكامل.
Introduction
المكروية الميكانيكية تلعب دورا هاما في العديد من وظائف الخلية مثل انتشار، والهجرة، والتمايز، والتي يكون لها أثر عميق في التنمية والتوازن من الأنسجة، وكذلك في الأمراض 1-6. على مر السنين، وقد استخدمت العديد من الأدوات التجريبية لتحفيز ميكانيكيا الخلايا أو الأنسجة وقياس الخواص الميكانيكية للالأنسجة البيولوجية بهدف زيادة فهمنا للmechanobiology الأساسية ودراسة ظهور وتطور الأمراض 6-17. ومع ذلك، يجب على المرء غالبا ما تعتمد على العديد من الأجهزة التجريبية المختلفة من أجل تحقيق أهداف دراسة خاصة. تقدم هذه المقالة واحدة، متعددة الوظائف، ذو محورين تمتد (BAXS) منصة تسمح للدراسات أن التحقيق في الدور الذي تلعبه الخواص الميكانيكية والقوات الميكانيكية في علم الأحياء في شبه الخلوية لمقاييس الطول النسيج كله. منصة BAXS لا يسمح للquantificatioن من الخواص الميكانيكية للأنسجة معزولة، ولكن أيضا يسهل القدرة على تطبيق حقول السلالة بسيطة ومعقدة، ودينامية إلى الخلايا الحية من أجل فهم ردودها تمتد التي تحدث في الجسم الحي. منصة BAXS تحتفظ أيضا القدرة على أداء المجهري الخلية الحية أثناء اختبار الميكانيكية والاضطرابات على الخلايا والأنسجة.
منصة BAXS هو جهاز مبنية خصيصا والتي يمكن استخدامها لدراسة تأثير الركيزة تشوه على المستوى الخلوي وإجراء اختبارات الشد على الأنسجة البيولوجية (الشكل 1A). كانت ملفقة سخان الألومنيوم لاستيعاب القياسية صحن 10 سم بيتري والحفاظ على أي حلول الفسيولوجية عند 37 درجة مئوية باستخدام وحدة تحكم في درجة الحرارة وسخانات KAPTON (الشكل 1B). هذه المنصة BAXS يمكن أن تكون متكاملة على تباين المرحلة مقلوب و / أو المجهر مضان ويسمح للتصوير في وقت واحد (الشكل 1C).وباختصار، تتكون منصة BAXS أربعة الخطية المحركات لفائف صوت الأجزاء المتحركة التي هي التي شنت على مصغرة الكرة الحركة الخطية الموجهة الشرائح تحمل على طول محورين عمودي (الشكل 1D). هي التي شنت مرحلة تحديد المواقع خطية إلى كل من المحركات الأربعة للسماح الحركة العمودية للنظام لقط التي سيتم استخدامها (الشكل 1E). ويتم رصد موقف كل السيارات من قبل ترميز البصرية مع قرار من 500 نانومتر (الشكل 1F). يتم التحكم في كل أربعة المحركات بشكل مستقل مع وحدة تحكم حركة توظيف ردود الفعل ترميز البصرية لتنفيذ أوامر الحركة (الشكل 1G). يوفر واجهة ابفيف السيطرة الكاملة على حجم الإزاحة، والسرعة، والتسارع من كل محرك من أجل توليد تشوه تخصيص بالكامل، والدينامية، من الخلايا أو عينات الأنسجة.
ويتم تحقيق هذه التقنية تستخدم للحث على تشوه في الخلايا ببساطة عن طريق allowinالخلايا ز الالتزام التام ركيزة مرنة وشفافة ومن ثم تمتد هذه الركيزة باستخدام المحركات الأربعة للمنصة BAXS. منصة BAXS يسمح تركيب أي مجموعة مصمم خصيصا من المشابك إرفاق الركيزة على المحركات لفائف صوت. لهذا الغرض، قمنا بتصميم مجموعة من المشابك التي ركيزة مرنة وشفافة، مصنوعة من (PDMS) polydimethylsiloxane، يمكن أن تعلق (أرقام 2A-C والشكل 3). كما سوف يتعرض المشابك لحلول الفسيولوجية، تم تشكيله جميع أجزاء من الفولاذ المقاوم للصدأ للسماح للتعقيم. وقد تم تصميم هذه المشابك بعناية لتحقيق الركيزة أقرب وقت ممكن إلى الهدف المجهر لتعزيز جودة الصورة وتقليل الإجهاد على الركيزة خلال تمتد (الشكل 2D).
ويمكن أيضا منصة BAXS نفس أن تستخدم لقياس صلابة من عينات الأنسجة الصغيرة، وذلك باستخدام مجموعة مناسبة من المشابك مع ادابتيد لتدعم عينات الأنسجة والخلايا الحمل لمراقبة القوات. ويمكن اتخاذ عدة نهج لتركيب الأنسجة إلى منصة BAXS المحركات؛ في هذه الحالة الفولاذ المقاوم للصدأ المسامير minutiens الحشرات يمكن ربط من خلال افتتاح الأنسجة الوعائية من أجل إجراء اختبارات الشد (أرقام 4A-B). بدلا من ذلك، لأنسجة سميكة بدون فتحة طبيعية، يمكن أن تكون إما عقد حواف الأنسجة في موقف مع المشابك التي تعلق على المحركات لفائف الصوت أو لصقها على الشرائح الزجاجية الصغيرة مع الغراء البيولوجية وتعلق على المحركات مع المشابك. من أجل أداء اختبارات الشد مطلوب خلية الحمل مصغرة ويمكن إدراجها بسهولة على منصة BAXS المحركات وتستخدم لقياس القوة المؤثرة على النسيج خلال دورة تمتد (الشكل 4C). كما يتكون النظام الأساسي BAXS من أربعة محركات، وإدخال خلية الحمل الثاني يسمح احد لأداء اختبار الشد على طول اتجاهين متعامدين. هذه القدرة يسمح احد لquantifذ صلابة الميكانيكية للنسيج واحد على طول اتجاهين متعامدين خلال نفس التجربة.
الأهم من ذلك، في كافة تكوينات، والخلايا أو عينات الأنسجة من الاهتمام ويحتفظ دائما في حمام تسيطر عليها درجة الحرارة التي هي في متناول المستخدم. هذه القدرة تسمح لإدخال وكلاء الدوائية خلال عينة تمتد من أجل دراسة استجابة الزمني للعينة. بالإضافة إلى ذلك، والمحور البصري للمجهر مقلوب لا تزال دون عائق، وجميع أشكال المجهري لا تزال متاحة للمستخدم. أخيرا، وكما جميع المحركات الأربعة للمنصة BAXS مستقلة فمن الممكن تطبيق حقول سلالة شكلي للغاية لعينة من الفائدة. يتعرضون في الجسم الحي الخلايا والأنسجة لمعقدة ومتباين الخواص تمتد التي يمكن أن تكون تحاكي الأنسب في هذا المنبر في مقابل لالتقليدي ذو محورين تمتد منصة 7،13،15،18،19. وعلاوة على ذلك، فإن الخصائص الفيزيائيةالحقل سلالة يمكن تغيير على الطاير خلال التجربة. هذه القدرات تسمح للمستخدم لدراسة الاستجابة الخلوية ومستوى الأنسجة لعدد كبير من معقدة للغاية، متباين الخواص، زمانيا، ومكانيا متفاوتة المجالات السلالة. توضح هذه المقالة مزايا والقيود المفروضة على منصة BAXS فضلا عن تصميمها، مبادئ التشغيل، والتفاصيل التجريبية لخلية واحدة والتجارب النسيج كله.

الشكل 1. نظرة عامة على منصة BAXS. أ) أعلى نظرا منصة BAXS تظهر أربعة محركات لفائف صوت. B) صور مفصلة للسخان طبق بتري تستخدم للحفاظ على الخلايا والأنسجة عند 37 درجة مئوية C) ومنصة يمكن تركيبه على مجهر مقلوب لأداء الحية التصوير الخلية خلال التجارب التمدد.D) صورة تفصيلية للمحرك لفائف صوت؛ الجزء المتحرك من المنصة. E) صورة تفصيلية للمرحلة تحديد المواقع خطي يسمح النزوح العمودي للأنظمة لقط. F) صورة تفصيلية للترميز البصرية التي توفر موقف في الوقت الحقيقي من المحرك إلى وحدة تحكم الحركة. G) صورة تفصيلية من وحدة تحكم الحركة تظهر المدخلات البصرية التشفير أربعة ومخرجات الطاقة إلى أربعة محركات لفائف صوت.
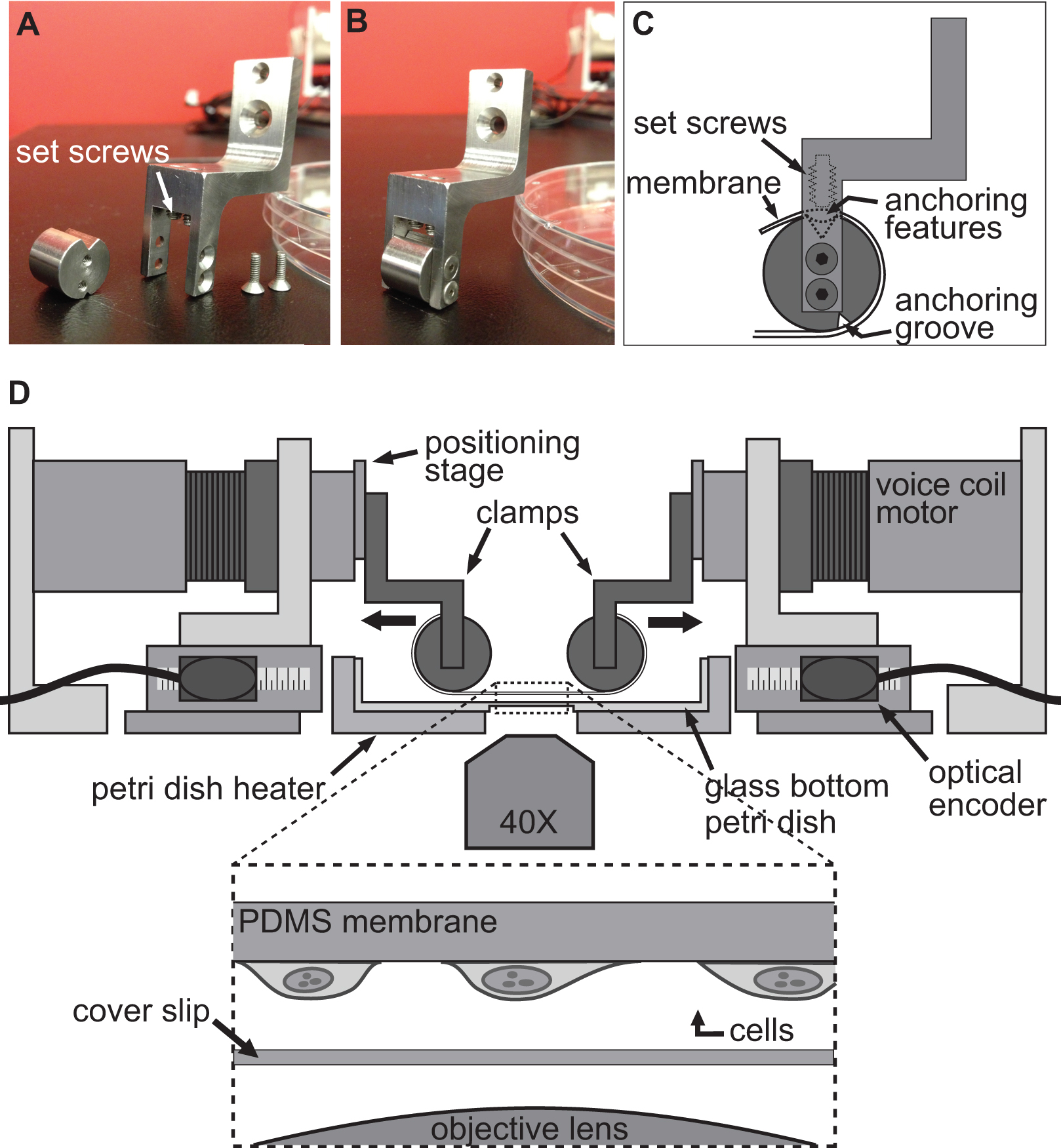
الشكل 2. نظام تحامل الخلية تمتد التجارب. AB) صور تظهر تفاصيل المشابك تستخدم لإرفاق الركيزة PDMS إلى المحركات لفائف صوت ليمتد. C) يتم تغليف الركيزة حول الجزء الأسطواني من المشبك مع الملامح ترسيخ لوفاق يجلس في أخدود في الأعلى. ثم يتم تأمين الركيزة باستخدام الصواميل التي تدفع الركيزة / ترسيخ الميزات في أخدود العلوي. D) توضيحات من منصة BAXS مع المشابك عقد الركيزة في المكان. يبين أقحم على عرض تفصيلي لالركيزة مع الخلايا المرتبطة به يجلس فوق زلة الغطاء والهدف المجهر.

الرقم 3. بيل من المواد الغشاء ونظام لقط لها. رسومات تبين أبعاد الأجزاء الرئيسية المتكاملة إلى منصة ذو محورين لأداء الخلية تمتد التجارب.

الشكل 4. السابقينوافرة من نظام لقط لتقييم تصلب الأوعية العيار الصغير. AB) صور مفصلة للنظام لقط تستخدم للحث على تشوه في 1 مم الماوس الشريان الأورطي. وقد شكل دبابيس الفولاذ المقاوم للصدأ بعناية إلى مثلثات مفتوحة للسماح للسفينة أن تنزلق على كل الدبابيس. C) توضيحات من منصة BAXS مع المشابك عقد السفينة وخلية الحمل تعلق بين المحركات الثابتة والمشبك اليسرى. يظهر أقحم أعلى عرض مفصل للسفينة التي شنت على المسامير.
Protocol
1. التشوه الميكانيكية للخلايا واحدة
- اختلاق الركيزة PDMS مع الخرز نيون جزءا لا يتجزأ من
قبل تلفيق الركيزة، ومعلق المجهرية الفلورية في المحلول المائي في الأيزوبروبانول لتعزيز حبة خلط في PDMS نظرا لطبيعتها مسعور.- ماصة 500 ميكرولتر من الفلورسنت المجهرية إلى 1.5 مل أنبوب microcentrifuge وأجهزة الطرد المركزي في 16،200 x ج لمدة 10 دقيقة.
- تجاهل طاف وإضافة 500 ميكرولتر من اتباعها مع الأيزوبروبانول 5 دقائق من vortexing ل. وضعت القارورة جانبا بين عشية وضحاها في الظلام من أجل السماح للأي الجزيئات الكبيرة المجاميع إلى الرواسب.
- في صباح اليوم التالي، وإزالة بعناية طاف لميكروسنتريفوج قارورة نظيفة. هذا الحل حبة يمكن استخدامها لصنع أكثر من 5 ركائز. ملاحظة: سوف تستمر الحل حبة لالرواسب لمدة 3 أيام القادمة. كن حذرا لتجنب إعادة التعليق على بيليه.
- صب 0.5 غرام من وكيل علاج المقدمةمع عدة PDMS في microcentrifuge قارورة 1.5 مل باستخدام ميزان علمي. خطوات متتالية، إضافة ما مجموعه 90 ميكرولتر من الخرز (15 في ستة الإضافات ميكرولتر)، vortexing لمدة 1 دقيقة بين كل إضافة. توضع جانبا.
- تزن 10 غرام من PDMS وتخلط لمدة 12 دقيقة على الأقل مع 0.5 غرام من وكيل علاج تستكمل مع الخرز الفلورسنت.
- افتعال SU-8 2050 قالب على شكل عبر استخدام تقنيات ضوئيه القياسية التالية تعليمات الشركة الصانعة. القالب تستخدم يبلغ ارتفاعه 320 ميكرومتر ومساحتها 13.4 سم 2 (الشكل 3). يمكن أن يحتوي القالب 428 ميكرولتر أو 440 ملغ من PDMS.
- صب 400 ملغ من PDMS مع حبات في قالب على شكل عبر باستخدام ماصة نقل وعلاج لمدة 2 ساعة على 80 درجة مئوية. بعد المعالجة، تقشر الركيزة من القالب (الشكل 5A). يمكن أن تظل الركيزة في طبق بيتري في درجة حرارة الغرفة لمدة 2 أسابيع دون أن تظهر تغييرات كبيرة في خصائصه الميكانيكية.
- صب قطرات من PDMS (وكيل علاج: PDMS مع نسبة 1:20) في طبق بتري مع الحجم النهائي من حوالي 4 مم وقطرها علاجها رأسا على عقب لمدة 2 ساعة على 80 درجة مئوية (الشكل 5B). هذه الميزات ترسيخ يمكن أن يوضع في طبق بتري لعدة أسابيع. ملاحظة: الحفاظ على الطبق رأسا على عقب لمنع قطرات من تسطيح أثناء عملية المعالجة.
- علاج الهواء البلازما (30 ثانية في 30 W) الركيزة و8 الميزات رسو. ربط الميزات على كل نهاية من الركيزة على مسافة 4 مم من شكل مربع المسافة البادئة موجودة على الركيزة (الشكل 5C).
- تصاعد غشاء على المشابك
- التفاف كل نهاية الركيزة حول الجزء أسطواني مخدد من المشابك وضمان الحصول عليها في مكان مع 2 الصواميل من أعلى (الشكل 2B وأرقام 5D-E).
- المسمار 4 المشابك على حامل المشبك وتصب PDMS (نسبة 1:20) باستخدام ر القابل للتصرفاملحول ماصة في واجهة بين الركيزة والجزء المجوف أسطواني من المشابك. نشر PDMS غير مخمر حول الجزء أسطواني مخدد باستخدام مفتاح عرافة 1.5 مم.
- صب PDMS (1:20) في الأخاديد حتى تملأ تماما من عمل شعري وعلاج التجمع في 80 درجة مئوية لمدة 2 ساعة (الشكل 5F).
- بذر خلايا في غشاء
- علاج الهواء البلازما (30 ثانية في 30 W) على الجمعية العامة بكامل هيئتها لتعقيم وfunctionalize الركيزة للسماح للالكولاجين الطلاء.
- Functionalize مجال الركيزة حيث سيتم المصنفة الخلايا مع 1 مل من 0.02 M حمض الخليك تستكمل مع 16 ميكروغرام / مل من الفئران الذيل الكولاجين في درجة حرارة الغرفة لمدة 1 ساعة. كثافة الكولاجين النهائي المطلوب هو 5 ميكروغرام / سم 2.
- شطف 3X الركيزة مع العازلة الفوسفات واتركها لتجف في درجة حرارة الغرفة لمدة لا تقل عن 10 دقيقة.
- إضافة 40 ميكرولتر من مستنبت تستكمل مع 10٪ سيرو بقري جنينيم و 1٪ البنسلين الستربتوميسين تحتوي على 2،000 الخلايا في جزء من مركز الركيزة لتغطية مساحة 1 سم 2 (كثافة الخلايا: 20 خلية / ملم 2). ويمكن تغيير كثافة الخلية وفقا لمتطلبات التجريبية.
- وضع التجميع كله في مستوى حاضنة الثقافة الخلية مع الركيزة مواجهة مع قطرة من مستنبت الخلايا التي تحتوي على ذلك. ملاحظة: يجب أن تبقى الجمعية مع الركيزة مواجهة لا يقل عن 3 ساعة للسماح للخلايا لنعلق بحزم ذلك. لمنع التبخر، يضاف 30 ميكرولتر من مستنبت دافئ في انخفاض على الركيزة كل 45 دقيقة لمدة 3 ساعة.
- بعد 3 ساعة، والوجه الجمعية العامة بكامل هيئتها في طبق بتري مليئة مستنبت جديدة ليغرق الركيزة واحتضان بين عشية وضحاها للسماح الخلايا على التكاثر.
- في اليوم التالي، وإعداد محلول ملحي HEPES مخزنة (HBSS؛ 20 ملم من HEPES، 120 ملي كلوريد الصوديوم، 5.3 ملي من بوكل، 0.8 ملي من MgSO 4، 1.8 ملم من و CaCl 2، و 11.1 ملي ديxtrose). ضبط الرقم الهيدروجيني إلى 7.4. ملاحظة: الحل HBSS أن تكون مستعدة يوميا وأبقت على 37 درجة مئوية خلال التجارب. يستخدم هذا الحل الفسيولوجية للحفاظ على الخلايا على المسرح المجهر عن طريق محاكاة البيئة الأنسجة / الدم الطبيعي.
- تركيب مجموعة المتابعة على النقيض من المرحلة مقلوب أو المجهر الفلورسنت جبل المشبك الجمعية الركيزة على منصة BAXS والمحركات. ملء طبق بتري داخل سخان طبق بتري مع HEPES العازلة (الشكل 2D).
2. تصلب قياس السفن الصغيرة العيار
- إعداد
- كريبس حل الفسيولوجية: يعد حل من 118.1 ملي مول كلوريد الصوديوم، 11.1 ملي مد الجلوكوز، 25 مم 3 NaHCO، 4.7 ملي بوكل، 1.2 ملي MgSO 4، 1.2 ملي KH 2 PO 4، و 2.5 مم CaCl 2. ضبط درجة الحموضة إلى 7.4 والأوكسجين الحل مع كربوجين الغاز الطبي (95٪ O 2/5٪ CO 2) لمدة 30 دقيقة. ملاحظة: soluti كريبسعلى أن تكون مستعدة يوميا وأبقت على 37 درجة مئوية خلال التجارب. يستخدم هذا الحل الفسيولوجية للحفاظ على الأنسجة على قيد الحياة عن طريق محاكاة البيئة الأنسجة / الدم الطبيعي.
- جمع الأدوات اللازمة للتشريح وتقييم الميكانيكية للسفن الأبهر: مقص جراحي، ملاقط محني، المقص الصغير، مجهر تشريح الجراحي، و 50 مل أنابيب البولي بروبلين الطرد المركزي، و 10 مل الماصات المصلية. إجراء العمليات الجراحية والتجربة لا تتطلب أي ظروف معقمة. جبل المشابك من منصة BAXS جنبا إلى جنب مع تحميل خلية مسبقا.
- عزل الأنسجة وتشريح
جميع الإجراءات التجريبية التي تنطوي على الحيوانات المختبرية أن تتم الموافقة عليها من قبل لجنة رعاية الحيوان واستخدام المستخدمين مؤسسة، والذي يتوافق مع دليل الصحة لرعاية واستخدام الحيوانات المختبرية من المستخدمين البلاد.- أداء الماوس الموت الرحيم مع استنشاق 99٪ CO 2 (7 رطل)في (الشكل 6A) غرفة زجاجي.
- البطن مفتوحة الماوس وقطع الشريان الأورطي الصدري ينزف الماوس.
- إزالة الحجاب الحاجز، والقفص الصدري وفصوص الرئة (الشكل 6B). ملاحظة: لتقليل خطر إتلاف الأنسجة، والحفاظ على قلب تعلق على الشريان الأورطي وتجنب لمس السفينة مباشرة ولكن التلاعب به باستخدام القلب.
- إزالة القلب وجذر الشريان الأبهر والشريان الأورطي الصدري عن طريق خفض بلطف بين السفينة والعمود الفقري. ملاحظة: لا تحمل أي استطالة في السفينة أثناء الختان للحفاظ على البنية الداخلية للأنسجة سليمة (الشكل 6C).
- تزج فورا والحفاظ على القلب والشريان الأورطي في حل كريبس.
- قص وغسل بعناية الشريان الأورطي في حل كريبس لإزالة أي جلطات الدم. إزالة النسيج الضام باستخدام مقص الصغرى، ملاقط والجراحية تشريح المجهر (الشكل 6D-E). ملاحظة: حافظ على كل طول السفينة واستخدام منطقة المسؤولية الجذر عرة لتحديد اتجاه السفينة.
- سفينة تحديد البعد وتصاعد
لتحديد صلابة من السفينة، ويطلب من أبعاد السفينة تفريغ ويمكن تحديد مع المجهر معايرة.- قطع حلقة الأبهر من حوالي 2 ملم في الطول وبدقة قياس طوله باستخدام مجهر معايرة وضع (أرقام 6F-G). وضع هذا الجزء جانبا في حل كريبس.
- خفض آخر حلقة الأبهر صغيرة قدر الإمكان بين كل من قطاعات مم 2 (الشكل 6F). وضع هذه الشريحة صغيرة على شريحة زجاجية المجهر مع لمعة مواجهة وقياس سمك الجدار باستخدام إعداد المجهر معايرة (الشكل 6H).
- ملء طبق بيتري على منصة BAXS مع الحل كريبس وإدراج شريحة حلقة الأبهر 2 ملم على دبابيس سحب (أقحم في الشكل 4C).
جنرال الكتريك = "دائما"> 
الرقم 5. الركيزة PDMS تصنيع وتركيب. A) وبعد المعالجة، ومقشر الركيزة بعناية قبالة SU-8 2050 العفن وضعت جانبا في طبق بتري. B) رسو ميزات مصنوعة من PDMS وتساعد على تأمين الركيزة على المشابك. C) الركيزة مع ترسيخ ملامح جاهزة للتركيب. D) هي التي شنت على الركيزة المشابك 4، والتي يتم تركيبها على حامل المشبك (انظر الشكل). E) صور مفصلة للالركيزة التي شنت على 4 المشابك. F ) الإجراء من صب PDMS في الأخدود تحت الركيزة. السهم يظهر PDMS ملء ببطء الأخدود التي كتبها الشعرية.
454fig6highres.jpg "العرض =" 500 "/>
الرقم 6. إعداد وعزل الشريان الأورطي الصدري. أ) إعداد الأدوات الجراحية والماوس الموت الرحيم. B) من خلال شق في البطن الطولية، وتتم إزالة القفص الصدري والرئة lobs. C) يتم إزالة الشريان الأورطي بعناية باستخدام قلب للتلاعب الأنسجة. D) والقلب والشريان الأورطي وضعت في كريبس حل الفسيولوجية. يتم تنظيف الشريان الأورطي عن طريق إزالة جميع الأنسجة الضامة. E) صورة مفصلة تبين. F) الجزء الأبهر القلب والشريان الأورطي المستخدمة لتقييم صلابة جنبا إلى جنب مع شرائح صغيرة تستخدم لقياس سمك. GH) طول دقيقة (G) وسمك (H) يتم تقييم كل من قطاعات السفينة باستخدام مجهر العكسية وبرنامج التحليل.
النتائج
الخلية تمتد
تم استخدام منصة BAXS للتحقيق في استجابة الميكانيكية للنواة في خلايا فأر myoblast واحد (C2C12) تعرضت لتشوه الركيزة من 25٪. تم العثور على خلايا Myoblast في الأنسجة العضلية ويتعرضون باستمرار لتمتد الميكانيكية والضغط في ال?...
Discussion
منصة BAXS المقدمة هنا يسهل تجارب عديدة في دراسة mechanobiology، من تحقيقات واحد من الخلايا إلى الأنسجة كله. بالإضافة إلى ذلك، منصة مرنة للغاية وشكلي، مما يسمح للعديد من التجارب التحفيز الميكانيكي ومتعددة المحوري اختبار الشد. منصة تمكن أيضا الحفاظ على الخلايا والأنسجة في الظ?...
Disclosures
يعلن الكتاب أنه ليس لديهم مصالح مالية المتنافسة.
Acknowledgements
وأيد DT قبل studentship ما بعد الدكتوراه من Le فون للبحوث كيبيك الطبيعة وآخرون تكنولوجيز (FQRNT) وارفع زمالة الاستراتيجية MITACS. وأيد CMC من قبل studentship ما بعد الدكتوراه من Le فون للبحوث في مجال سانتي كيبيك (FRSQ) وإرنست ومارغريت فورد أمراض القلب هبت زمالة بحثية من جامعة أوتاوا معهد القلب. وأيد EOB من خلال تشغيل المنح MOP80204 من المعهد الكندي للبحوث الصحية (CIHR) وT6335 من القلب والسكتة الدماغية مؤسسة أونتاريو. وCIHR ومدترونيك تقديم جماعي EOB مع كرسي أبحاث لاستعراض الأقران (URC # 57093). ويتم تمويل AEP من العلوم الطبيعية والهندسة مجلس البحوث (NSERC) اكتشاف غرانت، وهو الملحق NSERC اكتشاف مسرع وبامتنان دعم كراسي البحث كندا برنامج (CRC)، وجائزة الباحث في وقت مبكر من مقاطعة أونتاريو.
Materials
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
References
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved