É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uma plataforma Novel Alongamento para Aplicações em Celular e Tecidual mechanobiology
Neste Artigo
Resumo
Apresentamos neste artigo uma novela que se estende plataforma que pode ser usada para investigar as respostas das células individuais a complexa deformação mecânica biaxial anisotrópica e quantificar as propriedades mecânicas dos tecidos biológicos.
Resumo
As ferramentas que permitem a aplicação de forças mecânicas de células e tecidos, ou que podem quantificar as propriedades mecânicas dos tecidos biológicos têm contribuído significativamente para o entendimento de mechanobiology básico. Estas técnicas têm sido amplamente utilizados para demonstrar como o aparecimento e progressão de várias doenças são fortemente influenciados por estímulos mecânicos. Este artigo apresenta uma plataforma multi-funcional biaxial alongamento (BAXS) que pode estimular mecanicamente células individuais ou quantificar a rigidez mecânica dos tecidos. A plataforma BAXS consiste de quatro motores de bobina de voz, que pode ser controlada de forma independente. As células individuais podem ser cultivadas num substrato flexível que pode ser ligada aos motores que permitem uma para expor as células a campos de deformação complexos, dinâmicos, e variando espacialmente. Por outro lado, através da incorporação de uma célula de carga de força, pode-se também quantificar as propriedades mecânicas dos tecidos primários, eles são expostos a ciclos de deformação.Em ambos os casos, um conjunto apropriado de braçadeiras devem ser concebidas e montadas para os motores de plataforma BAXS de modo a segurar firmemente o substrato flexível ou o tecido de interesse. A plataforma BAXS pode ser montado em um microscópio invertido para realizar luz transmitida em simultâneo e / ou imagem de fluorescência para verificar a resposta estrutural ou bioquímica da amostra durante as experiências de alongamento. Este artigo fornece detalhes experimentais do projeto e utilização da plataforma BAXS e apresenta os resultados de estudos de tecidos inteiros única célula e. A plataforma BAXS foi usado para medir a deformação de núcleos nas células do rato mioblastos individuais em resposta ao substrato tensão e para medir a rigidez de isolados de rato aortas. A plataforma BAXS é uma ferramenta versátil, que pode ser combinado com vários microscopia óptica, a fim de proporcionar novos conhecimentos mechanobiological nos níveis de tecidos sub-celular, celular e inteiro.
Introdução
O microambiente mecânica desempenha um importante papel em muitas funções celulares tais como a proliferação, migração e diferenciação, que têm um impacto profundo no desenvolvimento e homeostasia dos tecidos e também em doenças 1-6. Ao longo dos anos, uma série de ferramentas experimentais têm sido utilizados para estimular mecanicamente as células ou tecidos e medir as propriedades mecânicas dos tecidos biológicos com o objetivo de aumentar a compreensão das mechanobiology básico e estudando o início e progressão de doenças 6-17. No entanto, deve-se muitas vezes dependem de vários dispositivos experimentais diferentes, a fim de alcançar os objetivos de um estudo particular. Este artigo apresenta uma plataforma única, multi-funcional, biaxial alongamento (BAXS) que permite para os estudos que investigam o papel que as propriedades mecânicas e forças mecânicas jogar em biologia na sub-celular para escalas de comprimento tecido inteiras. A plataforma BAXS não só permite a quantification das propriedades mecânicas dos tecidos isolados, mas também facilita a capacidade de aplicar campos de tensão simples, complexos, e dinâmicas de células vivas, de modo a compreender as suas respostas ao alongamento que ocorre in vivo. A plataforma BAXS também mantém a capacidade de realizar microscopia de células ao vivo durante os testes mecânicos e perturbações em células e tecidos.
A plataforma BAXS é um aparelho integrado personalizado que pode ser utilizado para investigar o efeito de deformação do substrato, ao nível celular e realizar ensaios de tracção em tecidos biológicos (Figura 1A). Um aquecedor de alumínio foi fabricado para acomodar um padrão prato de Petri de 10 cm e manter as soluções fisiológicas, a 37 ° C, utilizando um controlador de temperatura e aquecedores de Kapton (Figura 1B). Esta plataforma BAXS podem ser integrados em um contraste de fase invertida e / ou microscópio de fluorescência e permite a gravação simultânea (Figura 1C).Em breve, a plataforma BAXS consiste de quatro motores lineares de bobina de voz, dos quais as partes móveis são montadas em lâminas de rolamento de esferas de movimento linear em miniatura orientados ao longo de dois eixos perpendiculares (Figura 1D). Uma fase de posicionamento linear é montado em cada um dos quatro motores para permitir o movimento vertical do sistema de aperto que vai ser usado (Figura 1E). A posição de cada um dos motores é controlada por um codificador óptico com uma resolução de 500 nm (Figura 1F). Todos os quatro motores são controlados de forma independente com um controlador de movimento empregando retorno do codificador óptico para executar comandos de movimento (Figura 1G). Uma interface LabVIEW fornece controle total sobre a magnitude do deslocamento, velocidade e aceleração de cada motor, a fim de gerar deformação completamente customizável, estática e dinâmica, das células ou amostras de tecido.
A técnica utilizada para induzir uma deformação em células é conseguido por simplesmente allowing de células para aderir firmemente a um substrato flexível e transparente e, em seguida, este alongamento do substrato utilizando quatro motores da plataforma BAXS. A plataforma BAXS permite a montagem de qualquer conjunto de design personalizado de grampos para prender o substrato sobre os motores de bobina de voz. Para esta finalidade, desenvolvemos uma série de grampos para que um substrato transparente e flexível, feita de polidimetilsiloxano (PDMS), podem ser ligados (Figuras 2A-C e Figura 3). Como os grampos vai ser exposto a soluções fisiológicas, todas as partes foram maquinados a partir de aço inoxidável para permitir a esterilização. Estes grampos foram cuidadosamente concebidos para levar o substrato tão perto quanto possível em relação ao objectivo do microscópio para melhorar a qualidade de imagem ao mesmo tempo minimizando a tensão sobre o substrato durante o alongamento (Figura 2D).
A mesma plataforma BAXS também pode ser utilizado para quantificar a rigidez de pequenas amostras de tecido, utilizando um conjunto apropriado de braçadeiras com adaptaçãoted suporte para as amostras de tecido e de uma célula de carga para monitorar forças. Várias abordagens podem ser tomadas para a montagem de um tecido para os motores de plataforma BAXS; neste caso, os aços inoxidáveis micro alfinetes minucias insectos pinos pode ligar através da abertura de tecidos vasculares, a fim de realizar ensaios de tracção (Figuras 4A-B). Em alternativa, no caso dos tecidos de espessura sem uma abertura natural, as bordas do tecido pode ser mantido em posição com grampos ligados aos motores de bobina de voz, ou colados às pequenas lâminas de vidro com cola biológica e ligados aos motores com os grampos. A fim de realizar os testes de tracção é necessária uma célula de carga e em miniatura podem ser facilmente incorporados em motores de plataforma BAXS e usadas para medir a força que actua sobre o tecido durante um ciclo de alongamento (Figura 4C). À medida que a plataforma BAXS é composta de quatro motores, a introdução de uma segunda célula de carga permite a realização de testes de tracção ao longo de duas direcções ortogonais. Esta capacidade permite quantify a rigidez mecânica de um único tecido ao longo de duas direcções perpendiculares, durante o mesmo experimento.
Importante, em todas as configurações, as células ou amostras de tecido de interesse são sempre mantidas em um banho de temperatura controlada, que é acessível ao utilizador. Esta capacidade permite a introdução de agentes farmacológicos, durante o alongamento da amostra, a fim de analisar a resposta temporal da amostra. Além disso, como o eixo óptico do microscópio invertido permanece sem obstruções, todas as formas de microscopia ainda estão disponíveis para o utilizador. Finalmente, como todos os quatro motores da plataforma BAXS são independentes, é possível aplicar campos estirpe altamente configuráveis para a amostra de interesse. Em células in vivo e os tecidos são expostos a complexo e anisotrópica de alongamento que pode ser mais apropriadamente imitou nesta plataforma, em oposição a tradicional uniaxial 7,13,15,18,19 plataforma alongamento. Além disso, as características físicasdo campo de tensão pode ser alterado em tempo real durante um experimento. Essas habilidades permitem que o usuário examinar a resposta ao nível do tecido celular e um grande número de alta complexidade, anisotrópica, temporalmente, e os campos de deformação variando espacialmente. Este artigo descreve as vantagens e limitações da plataforma BAXS, bem como a sua concepção, princípios de funcionamento e os detalhes experimentais para uma única célula e tecido experiências integrais.

Figura 1. Visão geral da plataforma BAXS. A) Vista de cima da plataforma BAXS mostrando os quatro motores de bobina de voz. B) imagem detalhada do aquecedor de placa de Petri usada para manter as células e os tecidos a 37 ° C. C) A plataforma pode ser montada sobre um microscópio invertido para apresentar ao vivo- imagens de células durante as experiências de alongamento.D) imagem detalhada do motor de bobina de voz; E) foto da parte móvel da plataforma. detalhada da fase de posicionamento linear permitindo o deslocamento vertical dos sistemas de fixação. F) imagem detalhada do codificador óptico que fornece posição em tempo real do motor para o controlador de movimento G) Retrato detalhado. do controlador de movimento que mostra as quatro entradas e saídas do codificador óptico de energia para os quatro motores de bobina de voz.
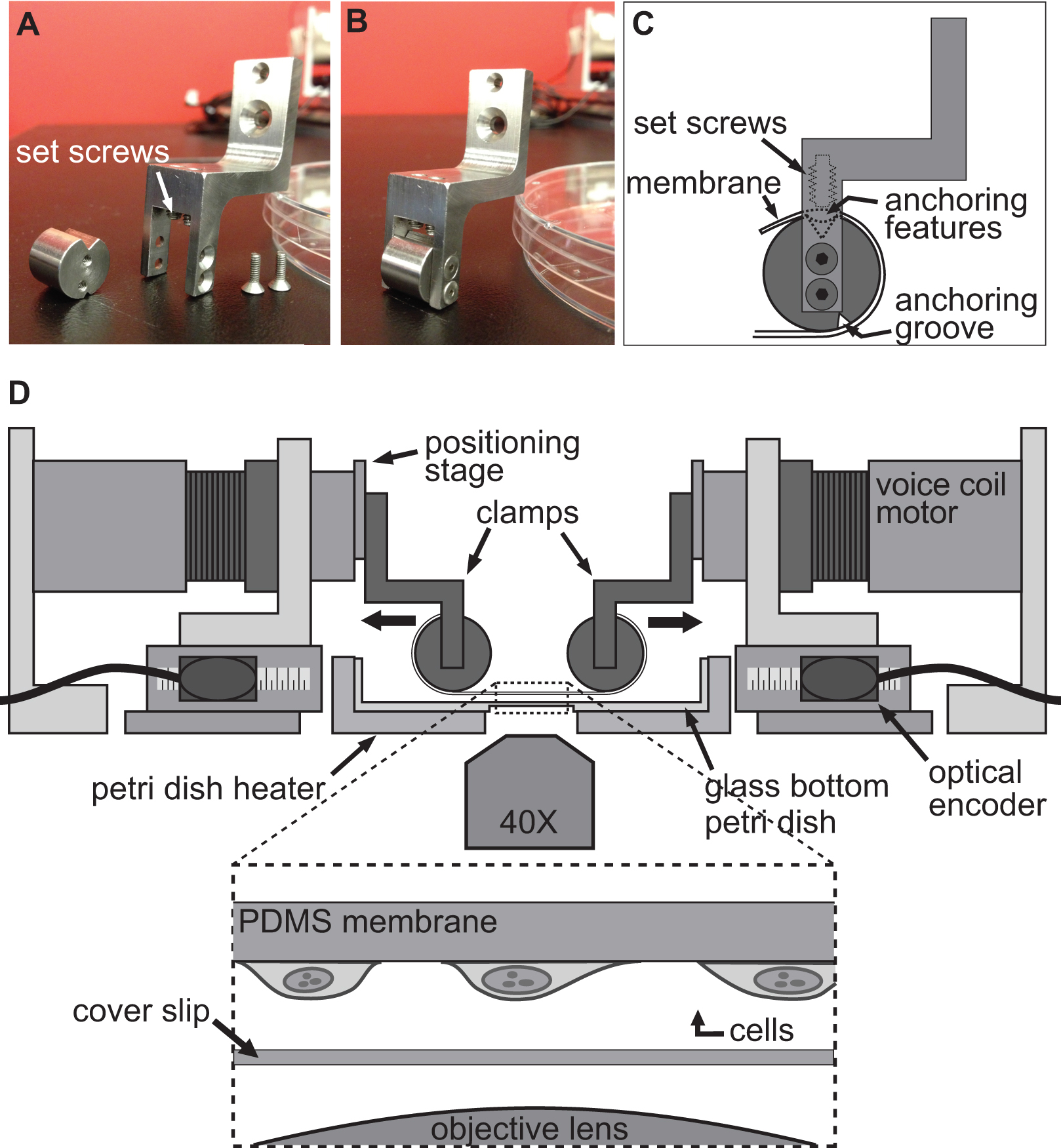
Figura 2. Sistema de fixação para experimentos com células de alongamento. AB) de imagens que mostram os detalhes dos grampos utilizados para fixar o substrato de PDMS para os motores de bobina de voz para o alongamento. C) O substrato é enrolado em volta da parte cilíndrica do grampo com a sua ancoragem features sentado na ranhura na parte superior. Em seguida, o substrato é D) Ilustração da plataforma BAXS com os grampos segurando o substrato em lugar protegido usando os parafusos que empurram o substrato / ancoragem recursos para o topo groove.. A inserção mostra uma visão detalhada do substrato com células ligadas a ele sentado logo acima uma lamínula ea objetiva do microscópio.

Figura 3. Lista de materiais da membrana e o seu sistema de aperto. Desenhos mostram as dimensões das partes principais integrado para a plataforma biaxial para efectuar experiências com células de alongamento.

Figura 4. Examplo de um sistema de fixação para a avaliação da rigidez dos vasos de pequeno calibre. AB) Imagens detalhadas do sistema de fixação usado para induzir deformação de 1 mm de diâmetro rato aorta. Pinos de aço inoxidável, foram cuidadosamente moldadas em triângulos abertos para permitir que o navio para deslizar em ambos os pinos C) Ilustração da plataforma BAXS com os grampos de segurar o recipiente e uma célula de carga ligado entre o motor e fixo o grampo esquerdo.. A inserção mostra uma vista de cima e pormenorizada do recipiente montado sobre os pinos.
Protocolo
1. Deformação mecânica de células individuais
- Fabricação de um substrato de PDMS com partículas fluorescentes incorporadas
Antes do fabrico do substrato, as microesferas fluorescentes em solução aquosa, são suspensas de novo em isopropanol para melhorar a mistura do grânulo em PDMS, devido à sua natureza hidrofóbica.- Pipetar 500 l de microesferas fluorescentes para um tubo de microcentrífuga de 1,5 mL e centrifuga-se a 16.200 xg durante 10 min.
- Descartar o sobrenadante e adicionar 500 mL de isopropanol seguido de 5 min de agitação em vórtice. Coloque o frasco de lado durante a noite, no escuro, a fim de permitir que as partículas grandes agregados para sedimentar.
- Na manhã seguinte, retire cuidadosamente o sobrenadante para um tubo de microcentrífuga limpo. Esta solução de esferas pode ser utilizado para fabricar mais do que 5 substratos. Nota: A solução talão continuará a sedimentar para os próximos 3 dias. Tenha cuidado para evitar ressuspensão do pellet.
- Despeje 0,5 g do agente de cura desdecom o kit de PDMS em um frasco de 1,5 ml de microcentrífuga com uma balança científica. Por etapas sucessivas, adicionar um total de 90 ul de contas (em seis adições de 15 ul), vortex durante 1 minuto entre cada adição. Ponha de lado.
- Pesar 10 g de PDMS e mistura-se durante pelo menos 12 minutos, com a 0,5 g do agente de cura suplementado com esferas fluorescentes.
- Fabricar um SU-8 2050 molde em forma de cruz, utilizando técnicas de fotolitografia padrão seguindo as instruções do fabricante. O molde utilizado tem uma altura de 320 microns e uma área de 13,4 cm 2 (Figura 3). O molde pode conter 428 mL ou 440 mg de PDMS.
- Despeje a 400 mg de PDMS com grânulos no molde em forma de cruz com uma pipeta de transferência e de cura durante 2 horas a 80 ° C. Após a cura, descolar o substrato a partir do molde (Figura 5A). O substrato pode ser mantido numa caixa de Petri à temperatura ambiente durante 2 semanas sem exibir alterações significativas nas suas propriedades mecânicas.
- Despeje gotículas de PDMS (agente de cura: PDMS com uma proporção de 1:20) em uma placa de Petri com um tamanho final de aproximadamente 4 mm de diâmetro e curá-las de cabeça para baixo durante 2 horas a 80 ° C (Figura 5B). Estas características de ancoragem podem ser mantidos numa placa de Petri por semana. NOTA: Mantenha o prato de cabeça para baixo para evitar que as gotas de achatamento durante o processo de cura.
- Deleite Ar plasma (30 segundos a 30 W) o substrato e oito recursos de ancoragem. Ligar os recursos em cada extremidade do substrato a uma distância de 4 mm a partir do travessão em forma quadrada presentes sobre o substrato (Figura 5C).
- Montagem da membrana sobre os grampos
- Enrole cada extremidade do substrato ao redor da parte cilíndrica com ranhuras dos grampos e fixá-lo no lugar com os dois parafusos da parte superior (Figura 2B e Figuras 5D-E).
- Aperte os quatro grampos no suporte do grampo e despeje PDMS (razão de 1:20) usando um descartável transferência pipeta na interface entre o substrato e a parte cilíndrica com ranhuras das braçadeiras. Espalhe as PDMS não curado ao redor da parte cilíndrica com ranhuras utilizando uma chave sextavada de 1,5 mm.
- Despeje PDMS (01:20) nas ranhuras até estar completamente preenchido por acção capilar e curar o conjunto a 80 ° C durante 2 horas (Figura 5F).
- Semeando células na membrana
- Deleite Ar plasma (30 segundos a 30 W) toda a assembléia para esterilizar e funcionalizar o substrato para permitir revestimento de colágeno.
- Funcionalizar a superfície do substrato em que as células irão ser semeado com 1 ml de 0,02 M de ácido acético suplementado com 16 ug / ml de colagénio de rato-cauda, à temperatura ambiente durante 1 hora. A densidade de colagénio final desejado é de 5 mg / cm 2.
- Lavar 3x com tampão de fosfato de substrato e deixar secar à temperatura ambiente durante, pelo menos, durante 10 min.
- Adicionar 40 ul de meio de cultura suplementado com 10% seru fetal bovinom e 1% de penicilina-estreptomicina, contendo 2000 células na porção central do substrato para cobrir uma área de 1 cm 2 (densidade celular: 20 células / mm 2). A densidade celular pode ser alterado de acordo com requisitos experimentais.
- Colocar todo o conjunto numa incubadora de cultura de células padrão com o substrato virado para cima com a gota de meio de cultura contendo as células nele. NOTA: O conjunto deve ser mantido com o substrato virado para cima por pelo menos 3 horas para permitir que as células para anexá-lo com firmeza. Para evitar a evaporação, a 30 mL de meio de cultura quente é adicionada à gota sobre o substrato a cada 45 min durante 3 horas.
- Depois de 3 horas, virar todo o conjunto em uma placa de Petri cheia de meio de cultura fresco para submergir o substrato e incubar durante a noite para permitir que as células a proliferar.
- No dia seguinte, preparar uma solução salina tamponada com HEPES (HBSS, 20 mM de Hepes, 120 mM de NaCl, 5,3 mM de KCl, 0,8 mM de MgSO4, 1,8 mM de CaCl2, e 11,1 mM de dextrose). Ajustar o pH para 7,4. NOTA: A solução de HBSS tem que ser preparada diariamente e mantida a 37 ° C durante as experiências. Esta solução fisiológica é usada para manter as células na fase de microscópio imitando o ambiente de tecido / sangue normal.
- Monte o set-up em invertido de contraste de fase ou microscópio fluorescente Monte o conjunto da braçadeira-substrato na plataforma BAXS e motores. Encher o prato de Petri no interior do aquecedor de placa de Petri com um tampão de HEPES (Figura 2D).
2. Rigidez Arqueação das Embarcações de pequeno calibre
- Preparação
- Solução fisiológica de Krebs: Prepara-se uma solução de 118,1 mM de NaCl, 11,1 mM de D-glucose, 25 mM NaHCO3, 4,7 mM de KCl, 1,2 mM de MgSO4, 1,2 mM de KH 2 PO 4, e 2,5 mM de CaCl 2. Ajustar o pH para 7,4 e oxigenar a solução com carbogénio gás médico (95% de O2 / 5% CO 2) durante 30 min. NOTA: A solução que Krebsno tem que ser preparada diariamente e mantida a 37 ° C durante as experiências. Esta solução fisiológica é usada para manter os tecidos vivos ao imitar o ambiente de tecido / sangue normal.
- Reúna a instrumentação para a dissecção e avaliação mecânica dos vasos de aorta: tesouras cirúrgicas, pinças dobrados, micro-tesouras, cirúrgica microscópio de dissecação, 50 ml tubos de centrífuga de polipropileno e 10 ml pipetas sorológicas. O procedimento cirúrgico e experiência não necessita de quaisquer condições estéreis. Montar as pinças da plataforma BAXS juntamente com a célula de carga de antemão.
- Isolamento de Tecidos e Dissection
Todos os procedimentos experimentais envolvendo animais de laboratório tem que ser aprovado pelo Comitê Animal Care e Use dos usuários "instituição, que está em conformidade com o Guia de Saúde para o Cuidado e Uso de Animais de Laboratório dos usuários 'país.- Realizar rato eutanásia com a inalação de 99% de CO 2 (7 psi)numa câmara de plexiglass (Figura 6A).
- Abdômen aberto rato e cortar a aorta torácica para sangrar o mouse.
- Remover o diafragma, a caixa torácica e os lobos pulmonares (Figura 6B). NOTA: Para minimizar o risco de danificar o tecido, manter o coração ligado à aorta e evite tocar o navio diretamente, mas manipulá-lo usando o coração.
- Remover o coração, a raiz da aorta e da aorta torácica, cortando suavemente entre o navio e da coluna vertebral. NOTA: Não induzir qualquer alongamento no navio durante a excisão para manter a estrutura interna do tecido intacto (Figura 6C).
- Mergulhar imediatamente e manter o coração ea aorta em solução de Krebs.
- Cortar e lavar cuidadosamente a aorta em solução de Krebs para remover quaisquer coágulos sanguíneos. Remover o tecido conjuntivo usando micro-tesouras, pinças e cirúrgico microscópio de dissecação (Figura 6D-E). NOTA: Mantenha todo o comprimento do vaso e usar o aorraiz tique para determinar a orientação da embarcação.
- Vessel Dimension Determinação e montagem
Para determinar a rigidez do recipiente, as dimensões do reservatório descarregadas são necessários e podem ser determinadas com um microscópio calibrado.- Cortar um anel aórtico de cerca de 2 mm de comprimento e medir com precisão o seu comprimento, utilizando um microscópio calibrado configuração (Figuras 6F-L). Coloque este segmento de lado em solução de Krebs.
- Corte outro anel aórtico tão pequeno quanto possível entre cada um dos segmentos de 2 milímetros (Figura 6F). Coloque este pequeno segmento sobre uma lâmina de vidro de microscópio com a luz para cima e medir a espessura da parede usando uma configuração de microscópio calibrado (Figura 6H).
- Encher a placa de Petri sobre a plataforma BAXS com solução de Krebs e inserir o segmento de aorta anel 2 mm nas pinos de tracção (inset na Figura 4C).
ge = "always"> 
Fabricação de substrato Figura 5. PDMS e montagem. A) Após a cura, o substrato é cuidadosamente tirou o SU-8 2050 molde e posta de lado em uma placa de Petri. B) Ancoragem recursos feitos de PDMS e ajudar a proteger o substrato sobre o E) imagem grampos C Substrato.) com características de fixação prontos para a montagem. D) O substrato é montado nos quatro grampos, que são depois montadas sobre o suporte do grampo (ver inserção). detalhada do substrato montadas nos quatro grampos. F ) Processo de verter PDMS na ranhura por baixo do substrato. A seta indica o PDMS enchendo lentamente o sulco por capilaridade.
"Width =" 500 454fig6highres.jpg "/>
Figura 6. Preparação e isolamento da aorta torácica. A) Preparação de instrumentos cirúrgicos e o ratinho sacrificado. B) Através de uma incisão abdominal longitudinal, a caixa torácica e lobs pulmonares são removidos. C) A aorta é cuidadosamente removido utilizando o coração para manipular o tecido. D) O coração e aorta são colocados em solução fisiológica de Krebs. A aorta é limpa por remoção de todos os tecidos conjuntivos. E) imagem detalhada, mostrando o coração e aorta. F) do segmento da aorta utilizado para a avaliação da rigidez juntamente com pequenos segmentos utilizados para a medição da espessura. GH) O comprimento exacto (L) e a espessura (H) de cada um dos segmentos de navios são avaliados utilizando um microscópio invertido e um programa de análise.
Resultados
Alongamento celular
A plataforma BAXS foi utilizado para investigar a resposta mecânica do núcleo do rato em células individuais de mioblastos (C2C12) exposto a uma deformação do substrato de 25%. Células de mioblastos são encontrados no tecido muscular e estão constantemente expostos a estiramento mecânico e compressão in vivo. As propriedades de forma e mecânicas do núcleo celular têm demonstrado desempenhar um papel importante na regulação da expre...
Discussão
A plataforma BAXS aqui apresentado facilita numerosas experiências no estudo de mechanobiology, a partir de investigações de células individuais de tecidos completos. Além disso, a plataforma é altamente flexível e configurável, permitindo a numerosas experiências de estimulação mecânica e os ensaios de tracção de multi-axial. A plataforma também permite a manutenção de células e tecidos em condições fisiológicas e permite a microscopia simultânea durante as experiências de alongamento. Os dois ex...
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
DT foi apoiado por uma bolsa de estudo de pós-doutorado de Le Fonds de Recherche du Québec-Nature et Technologies (FQRNT) e um MITACS Elevate Estratégico Fellowship. CMC foi apoiado por uma bolsa de estudo de pós-doutorado de le Fonds de Recherche en Santé du Québec (FRSQ) e Ernest e Margaret Ford cardiologia dotado bolsa de pesquisa da Universidade de Ottawa Heart Institute. EOB foi apoiado por subvenções de funcionamento MOP80204 do Instituto Canadense de Pesquisa em Saúde (CIHR) e T6335 da Heart and Stroke Foundation of Ontario. O CIHR e Medtronic fornecer coletivamente EOB com uma cadeira da pesquisa peer-reviewed (URC # 57093). AEP é financiado pelas Ciências Naturais e do Conselho de Pesquisa de Engenharia (NSERC) Descoberta Grant, um suplemento NSERC Discovery Accelerator e agradece o apoio dos presidentes de Pesquisa do Canadá programa (CRC) e um pesquisador Prêmio início da Província de Ontário.
Materiais
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Referências
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados