È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Una piattaforma Novel Stretching per applicazioni in cellule e tessuti mechanobiology
In questo articolo
Riepilogo
Presentiamo in questo articolo un romanzo stiramento piattaforma che può essere usato per studiare le risposte delle cellule singole a complessi anisotropo deformazione meccanica biassiale e quantificare le proprietà meccaniche dei tessuti biologici.
Abstract
Strumenti che consentono l'applicazione di forze meccaniche alle cellule e tessuti o che possono quantificare le proprietà meccaniche dei tessuti biologici hanno contribuito notevolmente alla comprensione della mechanobiology base. Queste tecniche sono stati ampiamente utilizzati per dimostrare come l'insorgenza e la progressione di diverse malattie sono fortemente influenzati da stimoli meccanici. Questo articolo presenta un allungamento biassiale (BAXS) piattaforma multi-funzionale che può sia stimolare meccanicamente le cellule singole o quantificare la rigidità meccanica dei tessuti. La piattaforma BAXS consiste di quattro motori voice coil che possono essere controllati in modo indipendente. Singole cellule possono essere coltivate su un substrato flessibile che può essere collegato ai motori permettendo di esporre le cellule a campi di deformazione complessi, dinamici e spazialmente variabili. Viceversa, incorporando una cella di carico forza, si può anche quantificare le proprietà meccaniche dei tessuti primari come sono esposti a cicli di deformazione.In entrambi i casi, un adeguato sistema di aggancio deve essere progettato e montato ai motori piattaforma BAXS per trattenere saldamente il substrato flessibile o tessuto di interesse. La piattaforma BAXS può essere montato su un microscopio invertito effettuare simultanea luce trasmessa e / o fluorescenza per esaminare la risposta strutturale o biochimica del campione durante gli esperimenti di stretching. Questo articolo fornisce dettagli sperimentali di progettazione e l'utilizzo della piattaforma BAXS e presenta risultati per singola cella e gli studi di tutto il tessuto. La piattaforma BAXS stato usato per misurare la deformazione di nuclei in cellule singole topo mioblasti in risposta al substrato ceppo e per misurare la rigidità di isolato aorte topo. La piattaforma BAXS è uno strumento versatile che può essere combinato con vari microscopia ottica al fine di fornire nuovi approfondimenti mechanobiological ai livelli tissutali sub-cellulari, cellulari e complesso.
Introduzione
Il microambiente meccanica svolge un ruolo importante in molte funzioni cellulari come la proliferazione, migrazione e differenziazione, che hanno un profondo impatto nello sviluppo e omeostasi dei tessuti e anche in malattie 1-6. Nel corso degli anni, una moltitudine di strumenti sperimentali sono stati utilizzati per stimolare meccanicamente cellule o tessuti e misurare le proprietà meccaniche dei tessuti biologici con l'obiettivo di aumentare la nostra comprensione di mechanobiology base e studiando l'insorgenza e la progressione delle malattie 6-17. Tuttavia, si deve spesso basarsi su varie differenti dispositivi sperimentali per conseguire gli obiettivi di un particolare studio. Questo articolo presenta un unico multi-funzionale, allungamento biassiale (BAXS) piattaforma, che consente per gli studi che indagano il ruolo che le proprietà meccaniche e le forze meccaniche giocano in biologia a livello sub-cellulare per intere scale di lunghezza del tessuto. La piattaforma BAXS permette non solo per la quantification delle proprietà meccaniche dei tessuti isolati, ma agevola anche la capacità di applicare campi di deformazione semplici, complessi e dinamici di cellule viventi per capire le loro risposte a deformazione che si verifica in vivo. La piattaforma BAXS mantiene anche la capacità di eseguire la microscopia live-cell durante le prove meccaniche e perturbazioni sulle cellule e tessuti.
La piattaforma BAXS è un apparecchio su misura che può essere usato per studiare l'effetto di substrato deformazione a livello cellulare ed eseguire prove di trazione sui tessuti biologici (Figura 1A). Un riscaldatore di alluminio è stato fabbricato per accogliere un piatto 10 cm Petri standard mantenere le soluzioni fisiologiche a 37 ° C utilizzando un regolatore di temperatura e riscaldatori kapton (Figura 1B). Questa piattaforma BAXS può essere integrato su un contrasto di fase invertita e / o microscopio a fluorescenza e permette l'imaging simultaneo (Figura 1C).In breve, la piattaforma BAXS consiste di quattro motori voice coil lineari i cui movimenti sono montati su sfere in miniatura movimento lineare guide a orientate lungo due assi ortogonali (Figura 1D). Una tavola di posizionamento lineare è montato a ciascuno dei quattro motori per consentire il movimento verticale del sistema di bloccaggio che verrà utilizzato (Figura 1E). La posizione di ciascun motore è controllato da un encoder ottico con una risoluzione di 500 nm (Figura 1F). Tutti e quattro i motori sono controllati in modo indipendente con un controller di movimento impiegando encoder ottici per eseguire comandi di movimento (Figura 1G). Un'interfaccia LabVIEW fornisce il pieno controllo della grandezza spostamento, velocità e accelerazione di ciascun motore per generare deformazioni completamente personalizzabile, statica e dinamica, delle cellule o campioni di tessuto.
La tecnica utilizzata per indurre una deformazione in cellule avviene semplicemente allowincellule g di aderire saldamente ad un substrato flessibile e trasparente e poi si estende questo supporto con i quattro motori della piattaforma BAXS. La piattaforma BAXS permette il montaggio di un set custom-designed di morsetti per il fissaggio del supporto sui motori voice coil. A questo scopo, abbiamo progettato una serie di morsetti per cui un substrato flessibile e trasparente, fatta di polidimetilsilossano (PDMS), può essere fissata (figure 2A-C e Figura 3). Come i morsetti saranno esposti a soluzioni fisiologiche, tutte le parti sono state lavorate da acciaio inossidabile per consentire la sterilizzazione. Questi morsetti sono stati accuratamente progettati per portare il substrato più vicino possibile al microscopio obiettivo di migliorare la qualità dell'immagine riducendo al minimo lo stress sul substrato durante stiramento (Figura 2D).
La stessa piattaforma BAXS può anche essere usato per quantificare la rigidità di piccoli campioni di tessuto, utilizzando un insieme appropriato di pinze con adattatoreTED supporti per i campioni di tessuto e una cella di carico per controllare le forze. Diversi approcci possono essere adottate per montare un tessuto ai motori piattaforma BAXS; in questo caso l'acciaio inossidabile minutiens insetti spilli possono agganciare attraverso l'apertura di tessuti vascolari per eseguire prove di trazione (Figure 4A-B). In alternativa, per i tessuti spessi senza apertura naturale, bordi di tessuto può essere tenuto in posizione con i morsetti collegati ai motori voice coil o incollati ai piccoli vetrini con colla biologica e collegati ai motori con le pinze. Al fine di effettuare test di trazione è richiesta una cella di carico miniatura e facilmente integrabile sui motori piattaforma BAXS e usato per misurare la forza che agisce sul tessuto durante un ciclo stiramento (Figura 4C). Mentre la piattaforma BAXS è composta di quattro motori, l'introduzione di una seconda cella di carico permette di eseguire prove di trazione lungo due direzioni ortogonali. Questa capacità consente di quantify la rigidità meccanica di un singolo tessuto lungo due direzioni perpendicolari durante lo stesso esperimento.
È importante sottolineare che, in tutte le configurazioni, le cellule o campioni di tessuto di interesse sono sempre mantenuti in un bagno a temperatura controllata che è accessibile all'utente. Questa capacità consente l'introduzione di agenti farmacologici durante campione estende per esaminare la risposta temporale del campione. Inoltre, come l'asse ottico del microscopio invertito rimane libera, tutte le forme di microscopia sono ancora disponibili per l'utente. Infine, come tutti i quattro motori della piattaforma BAXS sono indipendenti è possibile applicare campi di deformazione altamente configurabili al campione di interesse. In vivo cellule e tessuti sono esposti a complessi e anisotropo stiramento che può essere più appropriatamente imitato in questa piattaforma rispetto tradizionali monoassiale allungamento piattaforma 7,13,15,18,19. Inoltre, le caratteristiche fisichedel campo di deformazione può essere modificato al volo durante un esperimento. Queste capacità consentono all'utente di esaminare la risposta cellulare e tissutale livello ad un ampio numero di elevata complessità, anisotropo, temporalmente, e campi di deformazione spazialmente variabili. Questo articolo descrive i vantaggi e le limitazioni della piattaforma BAXS così come il suo design, principi di funzionamento, ed i dettagli sperimentali per singola cella e gli esperimenti dei tessuti interi.

Figura 1. Panoramica della piattaforma BAXS. A) Vista dall'alto della piattaforma BAXS che mostra i quattro motori voice coil. B) quadro dettagliato del riscaldatore piastra di Petri usato per mantenere le cellule e tessuti a 37 ° C. C) La piattaforma può essere montato su un microscopio invertito per eseguire live- imaging cellulare durante gli esperimenti di stretching.D) Immagine dettagliata del motore bobina; la parte mobile della piattaforma. E) quadro dettagliato della fase di posizionamento lineare che permette lo spostamento verticale dei sistemi di bloccaggio. F) quadro dettagliato del encoder ottico che fornisce la posizione in tempo reale del motore per il controller di movimento. G) Immagine dettagliata del controller di movimento che mostra i quattro ingressi encoder ottici e le uscite di potenza per i quattro motori voice coil.
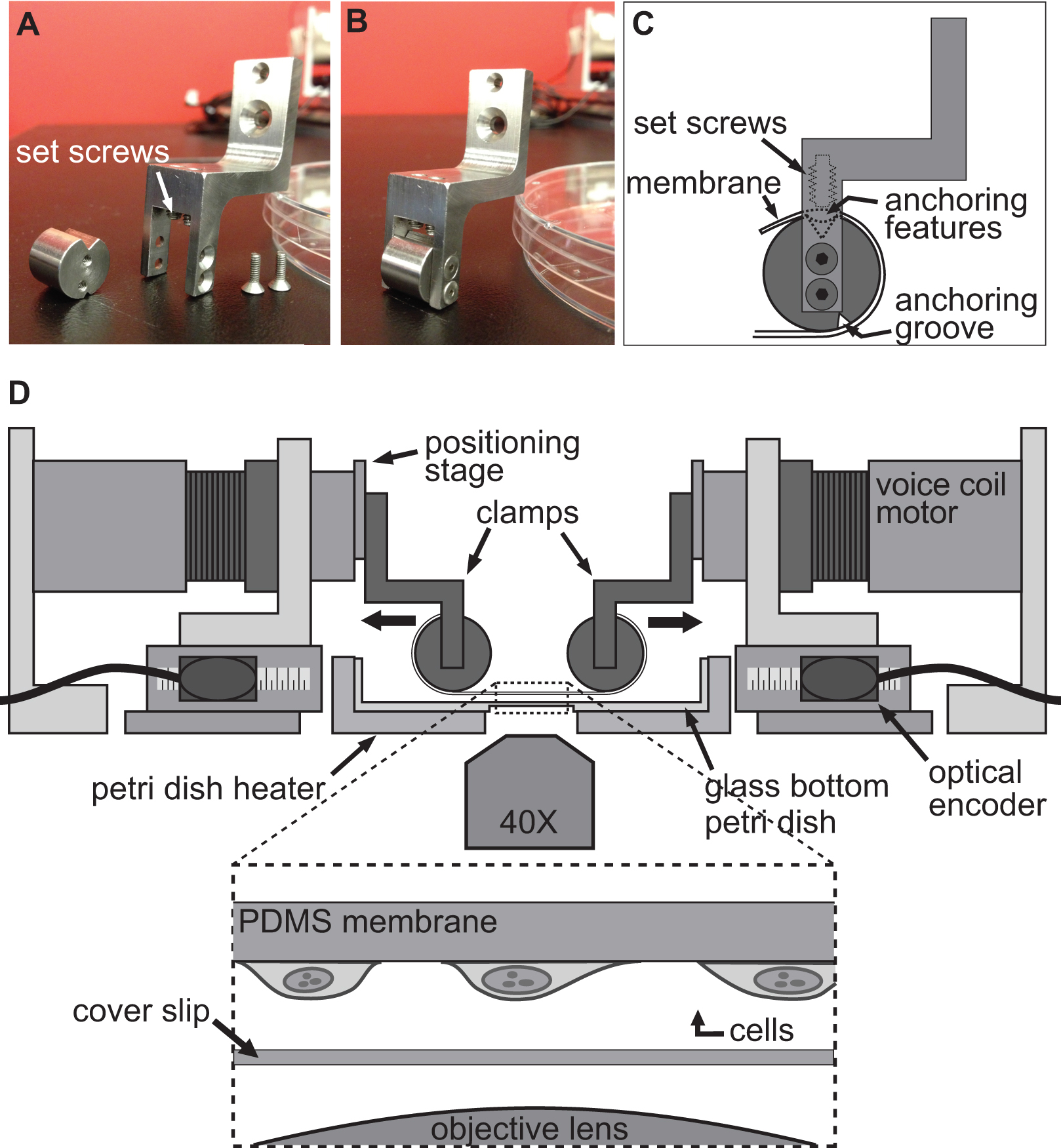
Figura 2. Sistema di bloccaggio per esperimenti sulle cellule stretching. AB) immagini che mostrano i dettagli dei morsetti utilizzati per fissare il substrato PDMS ai motori voice coil per stiramento. C) Il substrato è avvolto attorno alla parte cilindrica del morsetto con la sua featur ancoraggioes seduto nella scanalatura in alto. Poi il substrato è fissato con le viti che spingono il substrato / ancoraggio caratteristiche nella scanalatura superiore. D) Illustrazione della piattaforma BAXS con i morsetti tenendo il substrato in posto. L'inserto mostra una vista dettagliata del substrato con cellule attaccate ad esso seduto sopra un vetrino e l'obiettivo microscopio.

Figura 3. Distinte dei materiali della membrana e del suo sistema di bloccaggio. Disegni con le dimensioni delle parti principali integrati alla piattaforma biassiale effettuare esperimenti sulle cellule stretching.

Figura 4. Exampio di un sistema di bloccaggio per valutare la rigidità di vasi di piccolo calibro. AB) Quadri dettagliati del dispositivo di fissaggio utilizzato per indurre la deformazione in una aorta topo diametro di 1 mm. Spilli di acciaio inossidabile sono stati accuratamente modellate in triangoli aperti per permettere alla nave di scivolare su entrambi i pin. C) Illustrazione della piattaforma BAXS con i morsetti mantenere la nave e una cella di carico divisoria tra motore fisso e il morsetto sinistro. L'inserto mostra una vista dall'alto dettagliata della nave montato sui perni.
Protocollo
1. Deformazione meccanica di singole cellule
- Realizzazione di un substrato PDMS con perline fluorescenti incorporati
Prima di montaggio del substrato, microsfere fluorescenti in soluzione acquosa vengono risospese in isopropanolo per migliorare perla di miscelazione nelle PDMS dovute alla natura idrofoba.- Pipettare 500 ml di microsfere fluorescenti in una provetta da microcentrifuga da 1,5 ml e centrifugare a 16.200 xg per 10 min.
- Eliminare il surnatante e aggiungere 500 ml di isopropanolo seguito con 5 min di vortex. Mettere il flaconcino da parte una notte al buio, al fine di consentire eventuali particelle più grandi aggregati a sedimentare.
- La mattina successiva, rimuovere con attenzione il surnatante per una microcentrifuga fiala pulita. Questa soluzione tallone può essere utilizzato per fabbricare più di 5 substrati. NOTA: La soluzione tallone continuerà a sedimentare per i prossimi 3 giorni. Fare attenzione a non risospendere il pellet.
- Versare 0,5 g dell'agente indurente fornitocon il kit PDMS in una microcentrifuga fiala 1,5 ml con una bilancia scientifica. Per fasi successive, aggiungere un totale di 90 ml di perle (in sei 15 microlitri integrazioni), vortex per 1 minuto tra ogni aggiunta. Mettere da parte.
- Pesare 10 g di PDMS e mescolare per almeno 12 minuti con 0,5 g di agente reticolante integrato con perline fluorescenti.
- Realizzare un SU-8 2050 stampo a forma di croce con tecniche di fotolitografia standard, seguendo le istruzioni del produttore. Lo stampo utilizzato ha un'altezza di 320 micron e una superficie del 13,4 cm 2 (Figura 3). Lo stampo può contenere 428 ml o 440 mg di PDMS.
- Versare 400 mg di PDMS con perline nello stampo a forma di croce con una pipetta di trasferimento e curare per 2 ore a 80 ° C. Dopo l'indurimento, staccare il substrato dallo stampo (Figura 5A). Il substrato può essere conservato in una piastra di Petri a temperatura ambiente per 2 settimane senza mostrare variazioni significative relative proprietà meccaniche.
- Versare goccioline di PDMS (induritore: PDMS con un rapporto di 1,20) in una piastra di Petri con una dimensione finale di circa 4 mm di diametro e curare capovolti per 2 ore a 80 ° C (Figura 5B). Queste caratteristiche di ancoraggio possono essere conservati in una capsula di Petri per settimane. NOTA: Mantenere il piatto capovolto per evitare che le gocce di appiattimento durante il processo di polimerizzazione.
- Trattamento aria-plasma (30 sec a 30 W), il substrato e 8 funzioni di ancoraggio. Associare le caratteristiche su ciascuna estremità del substrato ad una distanza di 4 mm dal trattino forma quadrata presenti sul substrato (Figura 5C).
- Montaggio membrana sui morsetti
- Avvolgere ogni estremità del substrato intorno alla parte cilindrica scanalato dei morsetti e fissarlo in posizione con le 2 viti di fissaggio dalla parte superiore (Figura 2B e figure 5D-E).
- Avvitare le 4 fascette sul supporto pinza e versare PDMS (rapporto 01:20) utilizzando un t usa e gettaransfer pipetta all'interfaccia tra il substrato e la parte cilindrica scanalata dei morsetti. Stendere le PDMS non induriti intorno alla parte cilindrica scanalata utilizzando una chiave esagonale da 1,5 millimetri.
- Versare PDMS (1,20) nelle scanalature completamente riempito per azione capillare e curare il montaggio a 80 ° C per 2 ore (Figura 5F).
- Semina celle dal Membrane
- Trattamento aria plasma (30 sec a 30 W) l'intero gruppo di sterilizzare e funzionalizzare il substrato per consentire rivestimento collagene.
- Funzionalizzare la superficie del substrato dove saranno seminate cellule con 1 ml di 0,02 M di acido acetico, completata con 16 ug / ml di coda di topo collagene a temperatura ambiente per 1 ora. La densità collagene finale desiderato è 5 mg / cm 2.
- Sciacquare il 3x supporto con tampone fosfato e lasciare asciugare a temperatura ambiente per almeno 10 min.
- Aggiungere 40 ml di mezzo di coltura supplementato con 10% fetale Seru bovinam e 1% di penicillina-streptomicina contiene 2.000 celle nella parte centrale del substrato per coprire una superficie di 1 cm 2 (densità delle cellule: 20 cellule / mm 2). Densità cellulare può essere modificata a seconda delle esigenze sperimentali.
- Mettere tutto assieme in un incubatore di coltura cellulare standard con il substrato rivolta verso l'alto con la goccia di terreno di coltura contenente cellule su di esso. NOTA: Il gruppo deve essere conservato con il substrato rivolto verso l'alto per almeno 3 ore per permettere alle cellule di allegare saldamente. Per evitare l'evaporazione, 30 ml di terreno di coltura caldo viene aggiunto nella goccia sul substrato ogni 45 min per 3 ore.
- Dopo 3 ore, capovolgere l'intera assemblea in una capsula di Petri riempita con terreno di coltura fresco per immergere il substrato e incubare una notte per consentire alle cellule di proliferare.
- Il giorno successivo, preparare la soluzione salina tamponata con HEPES (HBSS, 20 mM di Hepes, 120 mM di NaCl, 5,3 mM di KCl, 0,8 mM di MgSO4, 1.8 mM di CaCl 2, e 11,1 mM di dextrose). Regolare il pH a 7,4. NOTA: La soluzione HBSS deve essere preparata giornalmente e mantenute a 37 ° C durante gli esperimenti. Questa soluzione fisiologica viene utilizzato per mantenere le cellule sul palco microscopio imitando il normale ambiente di tessuto / sangue.
- Montare il set-up sul contrasto di fase invertito o microscopio a fluorescenza Montare il gruppo pinza-substrato sulla piattaforma e motori BAXS. Riempire il piatto di Petri all'interno del riscaldatore piatto di Petri con tampone HEPES (Figura 2D).
2. Rigidità stazzatura delle navi di piccolo calibro
- Preparazione
- Soluzione fisiologica Krebs: Preparare una soluzione di 118,1 mM NaCl, 11.1 mM D-glucosio, 25 NaHCO mm 3, 4.7 mM KCl, 1,2 MgSO mm 4, 1.2 mM KH 2 PO 4, e 2,5 mM CaCl 2. Aggiustare il pH a 7,4 e ossigenare la soluzione con gas medicali CarboGen (95% O 2/5% CO 2) per 30 min. NOTA: Il soluti Krebson deve essere preparato giornalmente e mantenute a 37 ° C durante gli esperimenti. Questa soluzione fisiologica viene utilizzato per mantenere i tessuti vivi simulando l'ambiente normale tessuto / sangue.
- Raccogliere strumentazione per la dissezione e la valutazione meccanica dei vasi aortici: forbici chirurgiche, pinzette piegate, micro-forbici, microscopio da dissezione chirurgica, 50 ml provette per centrifuga in polipropilene, e 10 ml pipette sierologiche. La procedura chirurgica e esperimento non richiede condizioni sterili. Montare i morsetti della piattaforma BAXS con la cella di carico anticipo.
- Isolamento tessuti e dissezione
Tutte le procedure sperimentali su animali da laboratorio devono essere approvati dal comitato degli utenti cura degli animali ed uso 'istituzione, conforme alla Guida alla salute per la cura e l'uso di animali da laboratorio degli utenti' paese.- Eseguire il mouse eutanasia con l'inalazione del 99% di CO 2 (7 psi)in una (Figura 6A) camera di plexiglas.
- Aprire il mouse addome e tagliare l'aorta toracica a sanguinare il mouse.
- Rimuovere il diaframma, la gabbia toracica e lobi polmonari (Figura 6B). NOTA: Per ridurre al minimo il rischio di danneggiare il tessuto, mantenere il cuore attaccato alla aorta ed evitare di toccare direttamente il vaso ma manipolarlo usando cuore.
- Rimuovere cuore, la radice aortica e dell'aorta toracica tagliando delicatamente tra la nave e la colonna vertebrale. NOTA: Non provocare alcun allungamento in nave durante l'escissione di mantenere la struttura interna del tessuto intatto (Figura 6C).
- Immergere immediatamente e mantenere il cuore e l'aorta in soluzione Krebs.
- Tagliare e lavare accuratamente l'aorta in soluzione Krebs per rimuovere eventuali coaguli di sangue. Rimuovere il tessuto connettivo utilizzando micro-forbici, pinzette e chirurgico microscopio da dissezione (Figura 6D-E). NOTA: Conservare tutta la lunghezza della nave e utilizzare il aorradice tic per determinare l'orientamento nave.
- Mezzo Dimension Determinazione e montaggio
Per determinare la rigidità della nave, dalle dimensioni del serbatoio scaricate sono necessari e possono essere determinate con un microscopio calibrato.- Tagliare un anello aortico di circa 2 mm di lunghezza e misurare con precisione la sua lunghezza con una impostazione (figure 6F-G) microscopio calibrato. Mettete questo segmento da parte in soluzione di Krebs.
- Tagliare un altro anello aortico più piccolo possibile tra ciascuno dei segmenti mm2 (Figura 6F). Mettere questo piccolo segmento su un vetrino da microscopio con il lume rivolto verso l'alto e misurare lo spessore della parete utilizzando un'impostazione microscopio calibrato (Figura 6H).
- Riempire il piatto Petri sulla piattaforma BAXS con soluzione di Krebs e inserire il segmento anello aorta 2 mm perni di trazione (riquadro in Figura 4C).
ge = "always"> 
Figura 5. PDMS substrato di fabbricazione e di montaggio. A) Dopo l'indurimento, il substrato viene accuratamente staccata il SU-8 2050 stampo e mettere da parte in una capsula di Petri. B) Ancoraggio caratteristiche fatte di PDMS e aiutano a fissare il supporto sul morsetti. C) Substrato di ancoraggio caratteristiche pronta per il montaggio. D) Il substrato è montato sui morsetti 4, che vengono poi montati sul supporto del morsetto (vedi riquadro). E) Un'immagine dettagliata del substrato montati sulle 4 morsetti. F ) Procedimento di colata PDMS alla scanalatura sottostante substrato. La freccia indica il PDMS lentamente riempiendo la scanalatura per capillarità.
454fig6highres.jpg "width =" 500 "/>
Figura 6. Preparazione ed isolamento dell'aorta toracica. A) Preparazione di strumenti chirurgici e il mouse eutanasia. B) attraverso un'incisione longitudinale addominale, la gabbia toracica e pallonetti polmonari vengono rimossi. C) L'aorta è attentamente rimosso usando il cuore per manipolare il tessuto. D) Il cuore e aorta sono messi in soluzione fisiologica Krebs. L'aorta viene pulita rimuovendo tutti i tessuti connettivi. E) Immagine dettagliata che mostra l'. F) segmento aorta cuore e aorta utilizzata per la valutazione rigidità con piccoli segmenti utilizzati per la misura di spessore. GH) La lunghezza precisa (G) e spessore (H) ripartiti per segmenti di flotta vengono valutate utilizzando un microscopio inverso e un programma di analisi.
Risultati
Cella Stretching
La piattaforma BAXS stato usato per studiare la risposta meccanica del nucleo in cellule singole topo mioblasti (C2C12) esposta a una deformazione substrato del 25%. Mioblasti si trovano nel tessuto muscolare e sono costantemente esposti a stiramento meccanico e compressione in vivo. Le proprietà di forma e meccaniche del nucleo cellulare hanno dimostrato di giocare un ruolo importante nella regolazione dell'espressione genica e l'attività...
Discussione
La piattaforma BAXS qui presentato facilita numerosi esperimenti nello studio di mechanobiology, dalle indagini di singole cellule ai tessuti interi. Inoltre, la piattaforma è altamente flessibile e configurabile, consentendo numerosi esperimenti di stimolazione meccanici e prove di trazione multiassiale. La piattaforma consente anche la manutenzione di cellule e tessuti in condizioni fisiologiche e permette di microscopia simultanea durante gli esperimenti di stretching. I due esperimenti descritti nelle sezioni prece...
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
DT è stato sostenuto da una borsa di studio post-dottorato da Le Fonds de Recherche du Québec-Natura et Technologies (FQRNT) e ha una MITACS Elevate strategico Fellowship. CMC è stato sostenuto da una borsa di studio post-dottorato da Le Fonds de Recherche en Santé du Québec (FRSQ) e Ernest e Margaret Ford cardiologia dotato ricerca borsa di studio presso l'Università di Ottawa Heart Institute. EOB è stato sostenuto da sovvenzioni di funzionamento MOP80204 dal Canadian Institute for Health Research (CIHR) e T6335 dalla Heart and Stroke Foundation of Ontario. Il CIHR e Medtronic collettivamente forniscono EOB con una sedia di ricerca peer-reviewed (URC # 57093). AEP è finanziato dalle scienze naturali e ingegneria Research Council (NSERC) Discovery Grant, un supplemento NSERC Discovery Accelerator e riconosce con gratitudine il sostegno dei presidenti di ricerca Canada (CRC) del programma e di un ricercatore Award anticipata dalla Provincia dell'Ontario.
Materiali
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Riferimenti
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon