Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre ve Doku mechanobiology Applications A Novel Germe Platformu
Bu Makalede
Özet
Bu makalede kompleks anizotropik çift eksenli mekanik deformasyona karşı tek bir hücre yanıtları araştırmak ve biyolojik dokuların mekanik özelliklerini ölçmek için kullanılabilen yeni bir germe platformu sunmak.
Özet
Hücre ve dokulara mekanik kuvvetlerin uygulama veya buna izin Araçları biyolojik dokuların mekanik özellikleri temel mekanobiyolojisinin anlaşılmasına önemli ölçüde katkıda bulunmuştur ölçmek olabilir. Bu teknikler yaygın olarak çeşitli hastalıkların başlangıcı ve ilerlemesi ağır mekanik ipuçları tarafından nasıl etkilendiğini göstermek için kullanılır olmuştur. Bu makalede, bir mekanik olarak hücreleri uyarmak ya da dokuların mekanik sertliğini ölçmek ya çok fonksiyonlu bir çift eksenli germe (BAXS) platformu sunmaktadır. BAXS platformu bağımsız olarak kontrol edilebilir, dört ses bobini motorundan oluşur. Tek hücre, bir karmaşık, dinamik ve mekansal olarak değişen gerilme alanları hücreleri ortaya çıkarmak için izin motorlara bağlı esnek bir alt-tabaka üzerinde kültürlenebilir. Tersine, bir güç yük hücresi dahil edilmesi ile, aynı zamanda, bir deformasyon döngüsüne maruz olduğu gibi primer dokularının mekanik özelliklerini ölçmek olabilir.Her iki durumda da, flanş uygun bir dizi tasarlanmış olması gerekir ve sıkı bir şekilde esnek substrat veya ilgilenilen doku tutmak için BAXS platformu motorlara monte edilmiştir. BAXS Platform germe deney sırasında numunenin yapısal veya biyokimyasal tepki incelemek için aynı anda iletilen ışık ve / veya flüoresan görüntüleme gerçekleştirmek için bir ters mikroskop üzerine monte edilebilir. Bu makalede, BAXS platformun tasarım ve kullanım deneysel ayrıntıları temin etmekte ve tek hücre ve bütün doku çalışmaları için sonuçlar sunulmaktadır. BAXS platformu gerginlik alt tabakaya ve izole edilmiş fare aorta sertliğini ölçmek için yanıt olarak tek bir fare miyoblast hücrelerinin çekirdeklerin içinde deformasyonunu ölçmek için kullanılmıştır. BAXS platformu alt-hücre, hücre ve doku bütün seviyelerde yeni mechanobiological anlayış sağlamak için çeşitli optik mikroskop ile kombine edilebilir çok yönlü bir araçtır.
Giriş
Mekanik mikro çevre dokuların gelişimi ve homeostazında ve ayrıca hastalık 1-6 derin bir etkiye sahip çoğalma, göç ve farklılaşma gibi birçok hücre fonksiyonları, önemli bir rol oynar. Yıllar geçtikçe, deneysel araçları çok sayıda mekanik hücreleri veya dokuları uyarmak ve temel mechanobiology anlayışımızı artırarak ve hastalıkların 6-17 başlamasını ve ilerlemesini okuyan amacı ile biyolojik dokuların mekanik özelliklerini ölçmek için kullanılır olmuştur. Ancak, sık sık belirli bir çalışmanın hedeflerine ulaşmak için birçok farklı deneysel cihazlarda güvenmek gerekir. Bu makale, mekanik özellikleri ve mekanik kuvvetler bütün doku uzunluk ölçekleri ile alt hücresel biyoloji oynadığı rolü araştırmak çalışmalar için izin veren bir tek, çok fonksiyonlu, iki eksenli germe (BAXS) platformu sunuyor. BAXS platformu quantificatio sağlar sadeceAyrıca, izole edilmiş dokular, mekanik özellikleri, ancak bu n in vivo meydana gelen germe yanıtlarını anlamak için canlı hücreler için, basit, karmaşık ve dinamik gerilme alanları uygulama yeteneğini kolaylaştırmaktadır. BAXS platform aynı zamanda hücre ve dokulara mekanik test ve tedirginlikler sırasında canlı hücre mikroskobu gerçekleştirmek için kapasitesini korur.
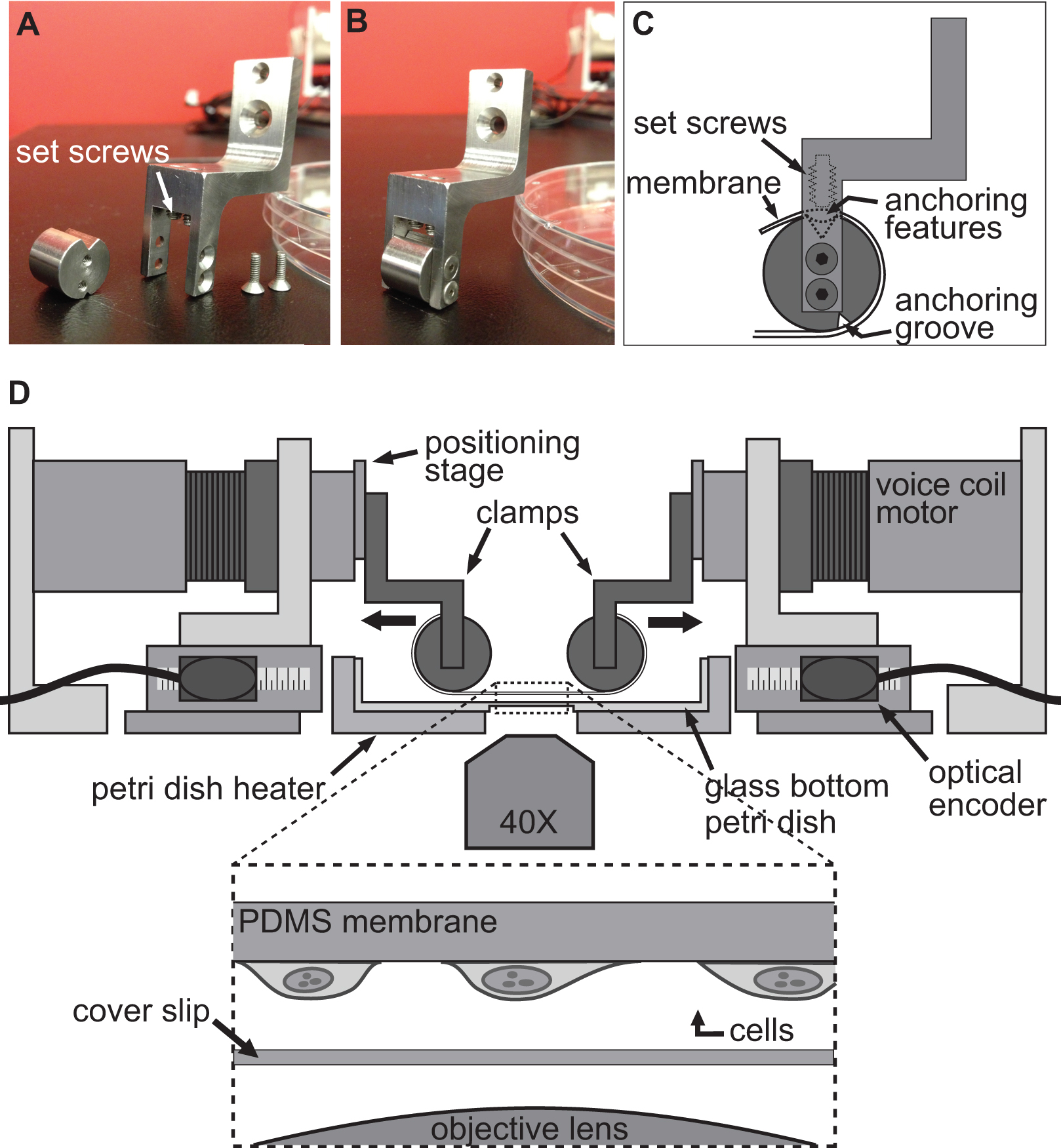
BAXS platformu hücresel seviyede deformasyon alt-tabaka etkisini araştırmak ve biyolojik dokularda (Şekil 1A) üzerinde gerilme testleri yapmak için kullanılabilir, özel olarak yapılmış bir cihaz. Alüminyum bir ısıtıcı, bir standart 10-cm Petri için uygun ve bir sıcaklık kontrol ve kapton ısıtıcılar (Şekil 1 B) kullanarak, 37 ° C'de herhangi bir fizyolojik çözüm sağlamak için imal edilmiştir. Bu BAXS platformu, bir ters faz kontrast ve / veya floresan mikroskop üzerine entegre ve eş zamanlı olarak görüntüleme (Şekil 1C) sağlar edilebilir.Kısaca, BAXS platformu hareketli parçalar birbirine dik iki eksen (Şekil 1D) boyunca yönlendirilmiş olan minyatür doğrusal hareket rulman slaytlar üzerine monte edilir ki, dört ses bobini lineer motorlar oluşur. Doğrusal bir konumlandırma aşamasında (Şekil 1E) kullanılacak olan bir sıkma sistemi, dikey hareketine izin vermek üzere dört motorlar her birine monte edilir. Her bir motorun konumu 500 nm 'lik bir çözünürlüğe (Şekil 1F) sahip bir optik kodlayıcı tarafından izlenir. Dört motorları bağımsız hareket komutlarını (Şekil 1G) yürütmek için optik enkoder geri bildirim kullanan bir hareket kontrolörü ile kontrol edilir. A LabVIEW arabirimi hücre veya doku numunelerinin, tamamen özelleştirilebilir statik ve dinamik deformasyon üretmek için yer değiştirme büyüklüğü, hız ve her motorun hızlandırılması üzerinde tam kontrol sağlar.
Hücrelerde bir deformasyona neden için kullanılan teknik sadece allowin ile elde edilmektedirg kadar hücre sıkı bir şekilde, esnek ve şeffaf bir alt-tabakaya bağlı ve daha sonra BAXS platformun dört motorlar kullanılarak bu alt-tabakanın germe. BAXS platformu ses bobini motorlarda tabakayı takmak için kelepçeleri herhangi bir özel tasarlanmış set montaj sağlar. Bu amaçla, polidimetilsiloksan (PDMS) yapılmış bir esnek ve saydam alt-tabaka, (Şekil 2A-C ve Şekil 3) bağlı olabilir için kelepçeler bir dizi tasarlanmıştır. Kelepçeler fizyolojik çözeltiler maruz gibi, tüm parçaları sterilizasyon sağlamak için paslanmaz çelikten işlendi. Bu kelepçeler, dikkatli bir şekilde (Şekil 2B) germe esnasında alt-tabaka üzerindeki stresi en aza indirirken, resim kalitesini arttırmak için mikroskop amacı mümkün olduğu kadar yakın bir alt-tabakanın getirmek için tasarlanmıştır.
Aynı BAXS platform da ADAp ile kelepçeler arasında uygun bir dizi ile, küçük doku örneklerinin sertliğini ölçmek için kullanılabilirted doku örnekleri ve kuvvetleri izlemek için bir yük hücresi için destekler. Çeşitli yaklaşımlar BAXS platformu motorlar için bir doku monte alınabilir; bu durumda, paslanmaz çelik böcek minutiens pim çekme testleri (Şekil 4A-B) gerçekleştirmek için vasküler dokuların açıklıktan kanca. Seçenek olarak ise, bir doğal açılmaksızın kalın dokuların doku kenarları ya da ses bobini motorlara bağlı ya da biyolojik yapıştırıcı ile küçük cam slaytlar yapıştırılmış ve kelepçeli motorlara bağlı kelepçeli konumda tutulabilir. Gerilme gerçekleştirmek için minyatür yük hücresi gereklidir test ve kolayca BAXS platformu motorların üzerine kurulmuştur ve bir germe döngüsü (Şekil 4C) sırasında doku üzerine etki eden kuvveti ölçmek için kullanılabilir. BAXS platformu dört motor oluşur gibi, ikinci bir yük hücresinin giriş bir iki dik doğrultuları boyunca çekme testi gerçekleştirmek için olanak sağlar. Bu özellik, bir quantif sağlar:y, aynı deney sırasında iki dikey yönde boyunca tek bir doku mekanik sertliği.
Önemli olarak, tüm yapılandırmalarında, hücreler ya da ilgi doku numuneleri her zaman kullanıcı tarafından erişilebilen bir sıcaklık kontrollü banyosu içinde muhafaza edilmiştir. Bu yetenek, numunenin zamansal tepkisini incelemek amacıyla germe sırasında örnek farmakolojik maddelerin katılmasına olanak sağlamaktadır. Ters mikroskop optik eksen engelsiz kalır Ayrıca, mikroskopi bütün biçimlerinin hala kullanıcı için kullanılabilir. BAXS platformun dört motorlar bağımsız Son olarak, ilgi alanındaki örnek için çok yapılandırılabilir gerilme alanları uygulamak mümkündür. In vivo hücre ve dokuları maruz kompleks ve farklı olarak bu platformda daha uygun bir şekilde taklit olabilir germe anizotropik Geleneksel tek eksenli germe platformu 7,13,15,18,19 için. Ayrıca, fiziksel özelliklerigerilme alanının bir deney sırasında anında değiştirilebilir. Bu yetenekleri kullanıcı bir zamansal son derece karmaşık, anizotropik çok sayıda, ve mekansal olarak değişen gerilme alanları hücresel ve doku düzeyinde yanıt incelemek için izin verir. Bu makalede, avantajları ve sınırlamaları BAXS platformun yanı sıra tasarımı, çalışma prensiplerini ve tek bir hücre ve doku bütün deneyler için, deney detaylarını açıklar.

BAXS platformun Şekil 1.. Bakış. Dört ses bobini motorlar platformu gerçekleştirmek için canlı ters bir mikroskop üzerine monte edilebilir) 37 ° C C'de hücre ve dokuları korumak için kullanılan Petri ısıtıcının. B) Ayrıntılı resim gösteren BAXS platformu A) Üst görünüm germe deneyler sırasında hücre görüntüleme.D) ses bobini motorun detaylı resmini; bağlama sistemlerinin hareket kontrol. G) Detaylı resim için motorun gerçek zamanlı konumunu sağlayan optik encoder. F) Ayrıntılı resim dikey değiştirmesine izin lineer konumlandırma aşamasında platformunun hareketli parçası. e) Ayrıntılı resim Dört ses bobini motorlar dört optik enkoder girişleri ve güç çıkışları gösteren hareket denetleyicisi.
Şekil 2,. Hücre germe deneyler için bağlama sistemi. Substrat olarak tutma İKLER ile kelepçenin silindirik kısmı etrafında sarılır. ° C) germe için ses bobini motorlara PDMS tabakayı bağlamak için kullanılan kelepçelerin ayrıntılarını gösteren, AB) Resimlerdees üstündeki oluğa oturan. Sonra tabaka üst oluğa özelliklerini demirleme / tabakayı itin vidalarını kullanılarak sabitlenir. Kelepçeler yerinde tabakayı tutan BAXS platformu D) İllüstrasyon. Ilave ona bağlı hücreler sadece bir kapak ve kayma mikroskop objektif üzerinde oturan substratın ayrıntılı bir görünüşünü gösterir.

Şekil 3. Membran ve bağlama sisteminin malzemelerin Bill. Asıl parçaların boyutlarını gösteren resimler hücre germe deneyler gerçekleştirmek için çift eksenli platforma entegre.

Şekil 4,. ExKüçük kalibreli damarların sertliği değerlendirilmesi, 1 mm çaplı fare aort deformasyona neden için kullanılan bir sıkma sistemi. AB) Detaylı resim için bir sıkıştırma sistemi geniş. Paslanmaz çelik pimler dikkatle damar hem de iğneler üzerinde kelepçeler gemi ve sabit motor ve sol kelepçe arasında bağlı bir yük hücresi tutan BAXS platformun. C) gösteren örnek kaymasına izin vermek için açık bir üçgen halinde şekillendirilir edilmiştir. Ilave pimler üzerine monte teknenin ayrıntılı bir üst görünüşünü gösterir.
Protokol
Tek Hücrelerinin 1.. Mekanik Deformasyon
- Gömülü Floresan Boncuk ile bir PDMS Yüzey Fabrikasyon
Önce, alt-tabakanın imalatı için, su çözeltisi içerisinde flüoresan mikro hidrofobik doğası nedeniyle PDMS boncuk karıştırmayı artırmak için izopropanol içinde yeniden süspanse edilir.- 10 dakika boyunca 16.200 x g'de bir 1.5 ml mikrosantrifüj tüpü ve santrifüj flüoresan mikro pipetle 500 ul.
- Süpernatantı atın ve eklemek izopropanolün 500 ul vortekslen 5 dakika ile izledi. Herhangi bir büyük partiküllerin çökelmesi için agrega sağlamak için karanlıkta gece boyunca bir kenara şişeyi koyun.
- Ertesi sabah, dikkatli bir şekilde temiz bir mikrosantrfuj şişeye süpernatantı. Bu çözelti, daha fazla boncuk 5 tabakaları imal etmek için kullanılabilir. NOT: boncuk çözeltisi bir sonraki 3 gün boyunca tortu devam edecektir. Pelet resuspending önlemek için dikkatli olun.
- Resim sertleştirme ajanının 0.5 g dökünbilimsel bir tartıyı kullanarak, bir 1.5 ml mikrosantrifüj şişede PDMS kiti ile. Birbirini takip eden adımlar ile, her bir ilave arasında 1 dakika boyunca karıştırın, (altı 15 ul ilave olarak) boncuk 90 ul bir toplam ekleyin. Kenara koyun.
- PDMS, 10 g tartılır ve flüoresan boncuklar ile desteklenmiş sertleştirme maddesinin 0.5 g, en azından 12 dakika boyunca karıştırın.
- Üreticinin talimatlarına göre standart teknikler kullanılarak bir fotolitografi SU-8 2.050 çapraz şeklinde kalıp imal. Kullanılan kalıp 320 um'lik bir yüksekliğe ve 13.4 cm2 bir alan (Şekil 3) sahiptir. Kalıp 428 ul veya PDMS 440 mg içerebilir.
- Bir transfer pipeti kullanarak, çapraz-şekilli kalıpta boncuklar ile PDMS 400 mg dökün ve 80 ° C'de 2 saat boyunca kür Sertleştirme sonrası, kalıbın (Şekil 5A) arasındaki alt-tabakanın soyulabilir. Alt-tabaka, mekanik özelliklerinde önemli değişiklikler göstermeden 2 hafta boyunca oda sıcaklığında bir Petri kabındaki tutulabilir.
- Çap olarak yaklaşık 4 mm lik bir son boyutuna sahip bir Petri kabındaki (01:20 oranı ile bir PDMS sertleştirme maddesi) ve 80 ° C'de (Şekil 5B), 2 saat boyunca baş aşağı tedavi PDMS damlacıkları dökün. Bu ankraj özellikler hafta içinde bir Petri kabındaki tutulabilir. NOT: sertleştirme işlemi sırasında düzleşme gelen düşüşlerini önlemek için ters çanak koruyun.
- Hava plazma tedavi (30 W 30 sn) yüzey ve 8 ankraj özellikleri. Alt-tabakanın (Şekil 5C) üzerinde bulunan kare şeklindeki girintisi 4 mm bir mesafede alt-tabakanın her iki ucundaki özellikleri bağlayın.
- Üzerinde Kelepçe Membran Montaj
- Kelepçelerin oluklu silindirik kısmı çevresinde alt-tabakanın her iki ucunda sarın ve üstten 2 ayar vidaları (Şekil 2B ve Şekil 5D-E) ile yerine sabitleyin.
- Kelepçe tutucuya 4 kelepçeler vida ve bir tek t kullanarak PDMS (oran 1:20) dökmekalt-tabaka ve kelepçeler yivli silindir kısmı arasındaki ara yüzde ransfer pipet. 1.5 mm altıgen anahtarı kullanarak yivli silindirik parçası etrafında sertleşmemiş PDMS yayıldı.
- Tamamen kılcal hareket ile doldurulmuş ve 2 saat (Şekil 5F), 80 ° C de montaj tedavi kadar oluklarından PDMS (1:20) dökün.
- Membran Hücreler tohumlama
- Hava plazma muamele (30 W 30 saniye) kolajen kaplamaya izin vermek için alt-tabaka ve sterilize işlevselleştirilmesi bütün düzeneği.
- Hücreler, 1 saat boyunca oda sıcaklığında fare kuyruk kolajeni ve 16 ug / ml ile takviye edilmiş, 0.02 M asetik asit içinde, 1 ml ile tohumlanmış edilecek alt-tabakanın alanı işlevselleştirilmesi. Istenen son kollajenizasyon 5 ug / cm 2 'dir.
- Fosfat tampon maddesi ile alt-tabaka 3 kez yıkayın ve bu, oda sıcaklığında kuru, en az 10 dakika boyunca için sağlar.
- % 10 fetal sığır tenan ile takviyeli kültür ortamında 40 ul eklem ve 1 cm2'lik bir alanı kapsayacak şekilde, substratın orta kısmında 2000 hücreleri ihtiva eden,% 1 penisilin-streptomisin (hücre yoğunluğu: 20 hücre / mm 2). Hücre yoğunluğu deneysel ihtiyaçlarına göre değiştirilebilir.
- Alt-tabaka üzerinde hücreleri ihtiva eden kültür ortamı içinde damla ile yukarı bakacak şekilde, standart hücre kültür inkübatörü içinde bütün montaj koyun. NOT: montaj tabaka hücreleri sıkıca takmak için izin en az 3 saat boyunca yukarı bakacak şekilde tutulmalıdır. Buharlaşmayı önlemek için, sıcak bir kültür ortamının 30 ul alt tabaka üzerindeki damla 3 saat için her 45 dakika içinde ilave edilir.
- 3 saat sonra, alt-tabakanın daldırın ve hücreler çoğalmaya izin vermek için bir gece boyunca inkübasyona taze kültür ortamı ile doldurulmuş bir Petri çanağı içine bütün montaj çevirin.
- Ertesi gün, HEPES-tamponlu tuz çözeltisi (HBSS hazırlanması, Hepes, NaCl 120 mM, KCl 5.3 mM, MgSO 4, 0.8 mM, CaCI2 1.8 mM, ve DE 11.1 mM ile 20 mMxtrose). PH'ı 7.4 'e ayarlayın. NOT: HBSS çözeltisi günlük olarak hazırlandı ve deney esnasında 37 ° C 'de muhafaza edilmesi gerekir. Bu fizyolojik çözelti, normal doku / kan ortamı taklit ile mikroskop sahnede hücreleri korumak için kullanılır.
- Ters faz kontrast veya floresan mikroskop Dağı BAXS platformu ve motor üzerinde kelepçe-tabaka montaj on set-up monte edin. HEPES tamponu (Şekil 2B) olan Petri çanağı içine ısıtıcı Petri kabı doldurun.
Küçük Kalibre Gemiler 2. Sertlik Ölçüm
- Hazırlık
- Krebs fizyolojik çözelti: 118.1 mM NaCI, 11.1 mM D-glikoz, 25 mM NaHCO 3, 4.7 mM KCI, 1.2 mM MgSO 4, 1.2 mM KH 2 PO 4 ve 2.5 mM CaCl2 ihtiva eden bir çözelti hazırlayın. PH'ı 7.4 'e ayarlayın ve 30 dakika karbojen tıbbi gaz (% 95 O 2/5% CO2) ile çözüm oksijen. NOT: Krebs solutigünlük hazırlanır ve deney esnasında 37 ° C 'de muhafaza edilmesi gerekir. Bu fizyolojik çözelti, normal doku / kan ortamı taklit ederek canlı dokuları korumak için kullanılır.
- Cerrahi makas, bükülmüş cımbız, mikro-makas, cerrahi diseksiyon mikroskop, 50 ml polipropilen santrifüj tüpleri, ve 10 ml serolojik pipet: diseksiyonu ve aort damarlarının mekanik değerlendirilmesi için enstrümantasyon toplayın. Cerrahi ve deney prosedürü herhangi bir steril koşullar gerekmez. Önceden yük hücresi ile birlikte BAXS platformun kelepçeler monte edin.
- Doku İzolasyon ve Diseksiyon
Laboratuvar hayvanları içeren tüm deneysel prosedürleri ülke 'kullanıcıların Laboratuvar Hayvanları Bakım ve Kullanım Sağlık Rehberi ile uyumludur kurum,' kullanıcı Hayvan Bakım ve Kullanım Kurulu tarafından onaylanmış olması gerekir.- % 99 CO 2 inhalasyon ile fare ötenazi gerçekleştirin (7 psi)Bir pleksiglas odası (Şekil 6A) içinde.
- Açık fare karın ve fareyi kanamaya aorta kesti.
- Diyafram, göğüs kafesi ve akciğer lobları (Şekil 6B) sökün. NOT: dokuya zarar riskini en aza indirmek aorta bağlı kalp tutmak ve doğrudan damar dokunmaktan kaçının ama kalbi kullanarak işlemek için.
- Nazikçe gemi ve omurga arasındaki kesim tarafından kalp, aort kökü ve aorta çıkarın. NOT: doku bozulmamış (Şekil 6C) iç yapısını korumak için eksizyonu sırasında geminin herhangi bir uzama kusturmayın.
- Hemen batırmak ve Krebs çözeltisi içinde kalp ve aort tutun.
- Kes ve dikkatle herhangi bir kan pıhtıları uzaklaştırmak için Krebs çözeltisi içinde aorta yıkayın. Mikro-makas, cımbız ve cerrahi mikroskop (Şekil 6D-E) kullanılarak bağ dokusu kaldırmak. NOT: Tüm damar uzunluğu tutun ve AOR kullanındamar yönünü belirlemek için tik kök.
- Gemi Boyut Belirlenmesi ve Montaj
Kabın sertliğini belirlemek için, boş kap boyutları gerekmektedir ve kalibre edilmiş bir mikroskopla saptanabilir.- Uzunluğu yaklaşık 2 mm arasında bir aort halkası kesin ve hassas bir şekilde (Şekil 6F-G) ayar kalibre edilmiş bir mikroskop kullanarak uzunluğunu ölçer. Krebs çözeltisi içinde kenara bu segmenti koydu.
- 2 mm kesimleri (Şekil 6F) her biri arasında, mümkün olduğu kadar küçük bir aortik halka kesin. Lümen yukarı bakacak şekilde bir mikroskop cam slayt üzerinde bu küçük kesimi koyun ve bir kalibre mikroskop ayarı (Şekil 6H) kullanarak duvar kalınlığı ölçmek.
- Krebs çözeltisi ile BAXS platformu üzerinde Petri kabı doldurup (Şekil 4C'de ek), çekme iğneler üzerinde 2 mm aort halka segmenti yerleştirin.
ge = "always"> 
Kür sonra Şekil 5. PDMS substrat imalat ve montaj. A), alt tabaka dikkatlice SU-8 2050 kalıp soyulmuş ve. B) PDMS'nin yapılmış özelliklerini Sabitleştirilmesi Petri kabındaki bir kenara koymak ve üzerindeki tabakayı korumak için yardımcı olduğunu 4 kelepçeler üzerine monte alt tabakanın alt tabaka daha sonra kelepçe tutucu üzerine monte edilmiş 4 kelepçeler, (inset bakınız) üzerine monte edilir. D) montaj için hazır özellikleri ankraj ile kelepçeleri. C) Yüzey. E) Ayrıntılı resim. F alt-tabaka altında oluk PDMS dökme) Prosedür. Ok, yavaş yavaş kılcallık ile oluğu dolduran PDMS gösterir.
454fig6highres.jpg "width =" 500 "/>
Şekil 6. Hazırlanması ve torakal aort izolasyon. A) uzunlamasına bir insizyon sayesinde cerrahi aletler ve ötenazi fare. B) hazırlanması, toraks ve akciğer lobs kaldırılır. C) aort dikkatle işlemek için kalp kullanılarak kaldırılır doku. D) kalp ve aort Krebs fizyolojik çözelti konur. Aort, tüm bağ dokuları kaldırarak temizlenir. Kalınlığı ölçümü için kullanılan küçük kesimleri ile birlikte sertlik değerlendirmesi için kullanılan kalp ve aort. F) Aort segmenti. GH) kesin uzunluğu (G) ve kalınlığını gösteren E) Detay resim (H) Her damar kesimleri ters bir mikroskop ve analiz programı kullanılarak değerlendirilmiştir.
Sonuçlar
Esneme Hücre
BAXS platformu tek bir fare miyoblast hücrelerinde çekirdeğin mekanik yanıtını (C2C12)% 25 bir alt-tabaka deformasyona maruz araştırmak için kullanıldı. Miyoblast hücreleri, kas dokusunda bulunan ve sürekli olarak, in vivo olarak, mekanik gerilme ve sıkıştırma maruz kalmaktadır. , Hücre çekirdeğinin şekli ve mekanik özellikleri gen ifadesi ve transkripsiyon aktivitesi 20,21 düzenlenmesinde ve gelişimsel bozukluklar v...
Tartışmalar
Burada sunulan BAXS platformu tek hücre incelemelerden bütün dokulara, mechanobiology çalışmada çeşitli deneyler kolaylaştırır. Buna ek olarak, çok sayıda platformu, mekanik uyarma deneyleri ve çok eksenli gerilme testi için izin veren, son derece esnek ve yapılandırılabilir. Platform ayrıca, fizyolojik koşullar hücre ve dokuların bakımı sağlayan ve germe deneyler sırasında aynı anda mikroskopi için izin verir. Montaj kelepçeleri uygun bir dizi kullanırken, önceki bölümlerde açıklanan...
Açıklamalar
Yazarlar, hiçbir rakip mali çıkarlarını olmadığını beyan ederim.
Teşekkürler
DT le Fonds de Recherche du Québec-Doğa ve Teknolojileri (FQRNT) ve bir MITACS Yükseltmek Stratejik Bursu bir doktora sonrası öğrencilikle tarafından desteklenmiştir. CMC le Fonds de Recherche en Sante du Québec (FRSQ) ve Ernest ve Ottawa Kalp Enstitüsü Üniversitesi'nden Margaret Ford kardiyoloji sahip araştırma bursu bir doktora sonrası öğrencilikle tarafından desteklenmiştir. EOB işletim hibeleri Sağlık Araştırmaları Kanada Enstitüsü (CIHR) dan MOP80204 ve Kalpten T6335 ve Ontario İnme Vakfı tarafından desteklenmiştir. CIHR ve Medtronic topluca bir hakemli Araştırma Başkanı (ÜAK # 57093) ile EOB sağlar. AEP Doğal Bilimler ve Mühendislik Araştırma Konseyi (NSERC) Discovery Grant, bir NSERC Discovery Hızlandırıcı Supplement tarafından finanse edilen ve minnetle Kanada Araştırma Sandalyeler (CRC) programı ve Ontario Eyaleti Erken Araştırmacı Ödülü desteğini kabul edilir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Referanslar
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır