需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在细胞和组织力学生物学应用一种新型的拉伸平台
摘要
我们在本文中展示了一种新的拉伸平台,可用于研究单个细胞的反应,复杂的各向异性的双轴机械变形和量化生物组织的机械性能。
摘要
工具,使机械力的应用,细胞和组织,或可量化的生物组织的机械性能有了显着的贡献基本力学生物学的理解。这些技术已被广泛使用,以说明如何各种疾病的发病和进展被很大程度上受到机械线索的影响。本文介绍了一个多功能双轴拉伸(BAXS)平台,可以通过机械刺激单细胞或组织量化的机械刚度。该BAXS平台包括可独立控制的4音圈电机。单细胞可以培养的柔性基板,可以连接到电机允许一个细胞暴露于复杂的,动态的和空间上变化的应变场上。相反,通过将力负载单元,可以同时量化初级组织的机械性能,因为它们暴露于形变周期。在这两种情况下,一组适当的夹具必须设计和安装在BAXS平台马达,以牢牢占据柔性基板或感兴趣的组织。该BAXS平台可以安装在倒置显微镜来执行同时的透射光及/或荧光成像研究中的拉伸实验样品的结构或生物化学反应。本文提供的BAXS平台的设计和使用的实验细节,并提出结果适用于单节和整个组织的研究。该BAXS平台被用来测量细胞核中单个小鼠成肌细胞在响应的变形到基板的应变与测量的离体小鼠主动脉的刚度。该BAXS平台是可以与各种光学显微术以提供在亚细胞,细胞和整体组织水平新颖mechanobiological见解进行组合的多功能工具。
引言
机械微环境中许多细胞功能如细胞增殖,迁移和分化,它们在组织的发育和内环境稳定,以及在疾病1-6产生深远的影响中起着重要的作用。多年来,大量的实验工具已被用于机械刺激的细胞或组织,并测量随着我们的基本力学生物学的理解和学习的疾病6-17的发病和进展的目标生物体组织的机械性能。然而,一个人必须经常依赖于几个不同的实验装置,以实现特定的研究的目标。本文介绍了一个单一的,多功能,双轴拉伸(BAXS)平台,使该调查中的作用是机械性能和机械力的亚细胞到整个组织的尺度在发挥生物学研究。该BAXS平台不仅允许quantification个孤立的组织的机械性能,而且也有利于以简单的,复杂的和动态应变场适用于活细胞,以了解他们的反应,拉伸发生在体内的能力。该BAXS平台还维护期间机械测试和扰动对细胞和组织进行活细胞显微镜的能力。
该BAXS平台是可用于研究衬底变形的效果在细胞水平和对生物体组织( 图1A)进 行拉伸试验定制的设备。铝加热器制造,以适应标准的10厘米的培养皿,在37℃下用温度控制器和聚酰亚胺薄膜加热器( 图1B)维护任何生理溶液。这BAXS平台可以集成到一个倒置相差和/或荧光显微镜,并允许同时成像( 图1C)。简言之,BAXS平台包括四个线性音圈马达,其中该可移动部件被安装在沿两个垂直的轴( 图1D)面向微型直线运动球轴承的滑动。线性定位平台被安装到四个马达,以允许将用于( 图1E)的夹紧系统的垂直运动。各电动机的位置是由具有500纳米的分辨率( 图1F)的光学编码器监视。所有的四台电机独立控制,采用光电编码器反馈来执行运动命令( 图1G)运动控制器。 LabVIEW的接口提供了完全控制的位移幅度,速度,以产生细胞或组织样品的完全可定制的,静态的和动态的,变形每个电机的加速。
用于诱导细胞中的形变的方法是通过简单地allowin实现G细胞坚定奉行一个灵活和透明的衬底,然后用四台电机的BAXS平台的拉伸该基板。该BAXS平台允许安装夹附着在基材上的音圈电机的任何自定义设计的一套。为此,我们设计了一套夹具,其灵活和透明基板,制成聚二甲基硅氧烷(PDMS)的,可贴( 图2A-C和图3)。作为夹具将暴露于生理溶液中,所有的份数均用不锈钢机加工,以便灭菌。这些夹具都经过精心设计,以使基底尽可能接近到显微镜物镜以提高图像质量,同时尽量减少应力在基材上伸展( 图2D)时。
同一BAXS平台还可以用于量化的小组织样本的刚度,使用一组合适的夹具与ADAP的特德支持的组织样本和称重传感器监测力量。几种方法可采取安装一个组织到BAXS平台的电机;在这种情况下,不锈钢的昆虫minutiens标签可以为了进行拉伸试验( 图4A-B)通过血管组织中的开口钩。另外,对于粗的组织未经自然开口,组织边缘可以被保持在适当位置与连接到音圈马达或胶合到小玻片用生物胶和附加到与夹具马达夹具。为了进行拉伸测试的微型测力传感器是必需的,并且可以很容易地合并在BAXS平台的电机和用于测量过程中的拉伸循环( 图4C)作用在组织上的力。作为BAXS平台由四个电动机,引入第二负载单元允许一个沿两个正交的方向进行拉伸试验。这种能力允许一个的量化Ý沿两个垂直方向上的相同的实验过程中的单个组织的机械刚度。
重要的是,在所有配置中,将细胞或感兴趣的组织样品始终保持在一个与温度控制槽,都可以访问的用户。这种能力允许样品中引入的药理学试剂的拉伸,以考察样品的时间响应。另外,如在倒置显微镜的光轴保持通畅,各种形式的显微仍可供用户使用。最后,所有的四个马达的BAXS平台为独立是可能的高度可配置的应变场应用到感兴趣的样品。 体内细胞和组织暴露于复杂的和各向异性的拉伸,可以更适当地模仿在这个平台上,而不是传统的单轴拉伸平台7,13,15,18,19。此外,该物理特性的应变场可以动态实验期间改变。这些能力允许用户在检查到一个宽一些的高度复杂的,各向异性的,在时间上和空间上变化的应变场的细胞和组织水平上的反应。本文介绍了BAXS平台的优势和局限性,以及其设计,工作原理和实验细节的单细胞和整个组织的实验。

图1概述了BAXS平台。该BAXS平台的 )顶视图显示四个音圈马达用以维持细胞和组织在37°C C)的培养皿加热器该平台可以安装在倒置显微镜进行活的B)详细图片在拉伸实验细胞成像。D)的音圈电机的详细图像;线性定位平台允许夹紧系统的光学编码器提供电机的实时位置,运动控制器。G)的详细图片。F)的详细画面的垂直位移平台的运动部件E)详细图片示出的四个音圈马达的四个光学编码器的输入和功率输出的运动控制器。
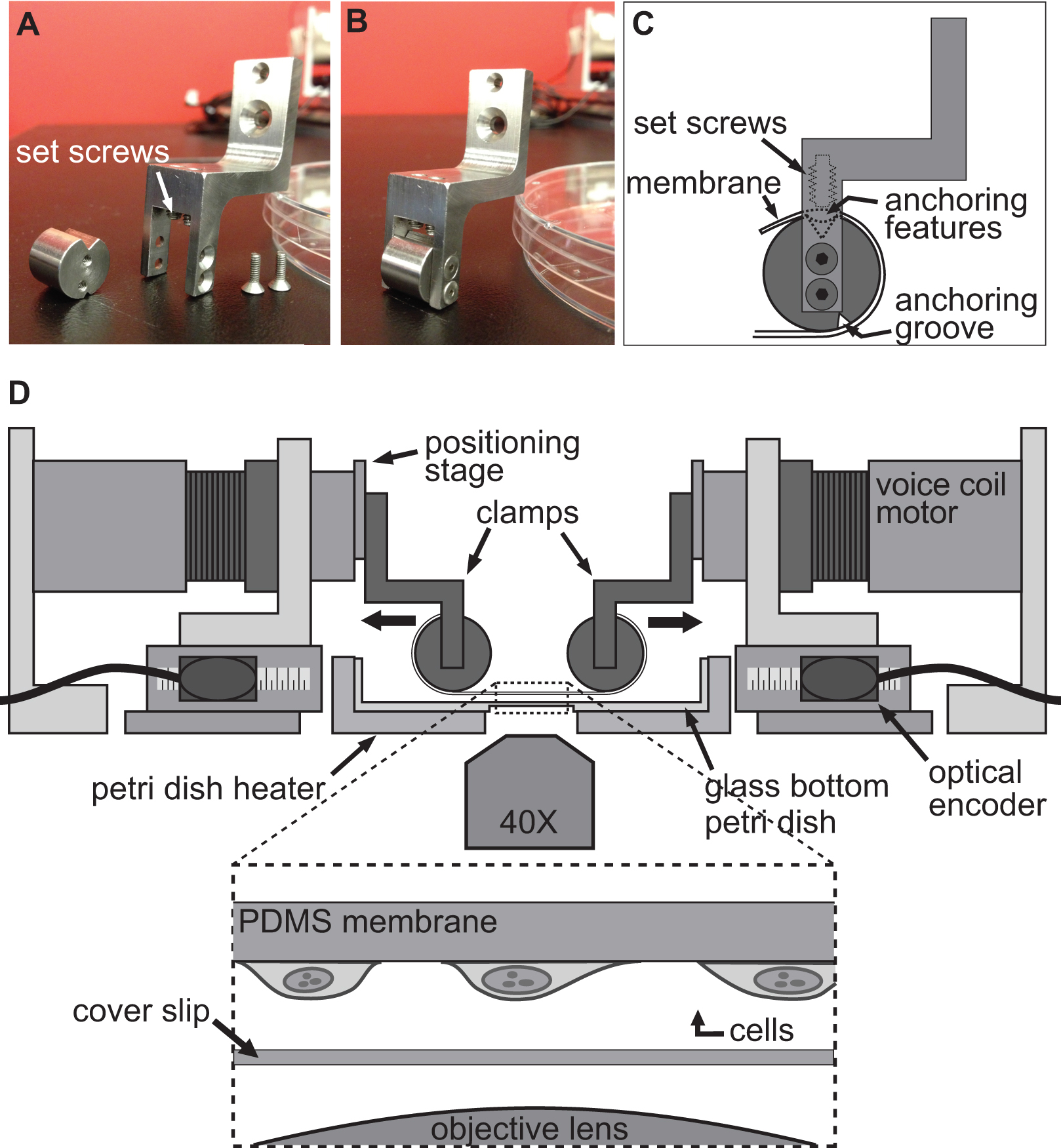
图2。夹紧系统细胞拉伸实验。 A,B)的照片示出用于将PDMS衬底 连接到音圈电机用于拉伸。C)该基片缠绕其锚定的featur夹具的圆筒部的夹具的细节ES坐入槽的顶部。然后将基板使用推基板/锚定功能进入前槽的固定螺丝固定。 四)插图BAXS平台与夹具夹持衬底代替。插图示出了具有连接到它的细胞坐在正上方盖玻片与显微镜物镜的基底的详细视图。

图3的膜和它的夹紧系统的材料清单。图纸表示该主要部分的尺寸集成到双轴平台进行小区拉伸实验。

图4实施例充足的夹紧系统,小口径血管僵硬评估用于诱导变形1毫米直径的小鼠主动脉夹紧系统。AB)的详细图片。不锈钢脚都被精心塑造成开放式的三角形,让船只在两个针脚上滑动。C)插图BAXS平台与夹具保持血管和连接固定电机和左钳之间的负载细胞。插图示出了一个详细的顶视图,安装在标签的容器。
研究方案
单细胞1。机械变形
- 一个PDMS基板与嵌入式荧光珠的制作
前基片的制造中,在水溶液中的荧光微球体悬浮于异丙醇中,以加强珠混合中,由于其疏水性的PDMS。- 移液管将500μl荧光微球至1.5 ml微量离心管中并离心16,200×g离心10分钟。
- 弃上清,加入500μl异丙醇,随后用5分钟涡旋的。把小瓶静置过夜在黑暗中,以允许任何大颗粒聚集体,去滓。
- 第二天早上,小心取出上清液到一个干净的离心管中。此珠溶液可用于制造超过5基材。注:珠子的解决方案将会继续沉淀在接下来的3天。要小心避免重悬沉淀。
- 倾将0.5g固化剂提供与PDMS的试剂盒中使用的科学平衡1.5 ml离心管中。通过连续的步骤,共90微升的有孔玻璃珠添加(在6 15微升),加涡旋每次添加之间进行1分钟。备用。
- 权衡10克的PDMS并混合至少12分钟,使用的0.5克补充有荧光珠的固化剂。
- 制造使用标准光刻技术下制造商的说明进行SU-8 2050十字型模具。所使用的模具具有320微米的高度和13.4平方厘米的面积( 图3)。模具可包含428微升或440毫克的PDMS。
- 倒入400毫克,在十字形模具珠的PDMS的使用移液管和固化2小时,在80℃下固化后,从模具中( 图5A)剥离衬底。衬底可以保持在一个培养皿在室温下放置2周,没有示出在其机械性能显著变化。
- 倾PDMS的微滴(固化剂:PDMS与1:20的比例)在培养皿中约4毫米直径的最终尺寸,并在80℃( 图5B)治愈他们颠倒2小时。这些锚定功能可以保持在一个培养皿数周。注:保持盘倒置,以防止液滴从在固化过程中压扁。
- 空气等离子体处理(30秒,30瓦)的基板和8个固定功能。在基板为4毫米的正方形状缩进存在于衬底( 图5C)上的距离的每个端部结合的功能。
- 在夹具固定膜
- 环绕夹具的槽的圆筒部的基片的每一端,并从顶部的2固定螺钉( 图2B和图5D-E)将其固定到位。
- 用螺丝将4个夹子上的夹持器,并使用一次性吨倒PDMS(1:20)转拨移液管在所述基板和所述夹具的槽的圆柱形部分之间的接口。使用1.5毫米六角扳手传遍开槽圆柱部分未固化的PDMS。
- 在凹槽中倒入PDMS(1:20),直到通过毛细管作用完全填充并固化该组件在80℃下搅拌2小时( 图5F)。
- 在膜播种细胞
- 空气等离子体处理(30秒,30瓦)整机装配到灭菌和功能化基片,让胶原蛋白涂层。
- 官能化,其中细胞将被接种1毫升的0.02M的醋酸补充有鼠尾胶原在室温下搅拌1小时,16微克/毫升的底物的区域。所需的最终胶原密度是5微克/厘米2。
- 冲洗衬底3次,用磷酸盐缓冲液,并让它干燥在室温下放置至少10分钟。
- 加40微升培养基中补充了10%胎牛塞鲁米和1%含2000细胞在衬底的中心部分以覆盖1厘米2的面积青霉素-链霉素(细胞密度:20 个 / mm 2)。细胞密度可以根据实验的要求来改变。
- 把整个组件在标准细胞培养孵化器与基板朝上与含有在其上的细胞培养基中的压降。注:该组件必须保持与基底朝上至少3小时,以使细胞牢固地安装。为了防止蒸发,加入30μl温暖的培养基加入到所述衬底上的压降,每45分钟3小时。
- 3小时后,翻转整个组件装入培养皿中充满了新鲜的培养基中以浸没所述基板和孵育过夜,允许细胞增殖。
- 第二天,制备HEPES缓冲盐溶液(HBSS;的Hepes,120 mM氯化钠的,5.3 mM的氯化钾,0.8mM的MgSO 4干燥,180毫米的CaCl 2,和11.1毫之日的20毫xtrose)。将pH调节至7.4。注:HBSS溶液每天制备,并保持在37℃,在该实验。这种生理溶液是用来通过模拟正常组织/血液环境,以保持在显微镜载物台上的细胞。
- 安装在倒置相差或荧光显微镜装载了BAXS平台和电机上的夹紧衬底组件的设置。填培养皿培养皿加热器与HEPES缓冲液( 图2D)的内部。
2,刚度小口径血管测量
- 准备
- 克雷布斯生理溶液:制备118.1 mM氯化钠,11.1 mM的D-葡萄糖,25mM的碳酸氢钠 ,4.7 mM的氯化钾,1.2mM的MgSO 4干燥,1.2 mM的KH 2 PO 4,和2.5mM的CaCl 2溶液。将pH调节至7.4和充氧的溶液用30分钟卡波金医疗气体(95%O 2/5%CO 2)。注:克雷布斯SOLUTI上有每日进行制备,并保持在37℃时的实验。这种生理溶液是用来通过模拟正常组织/血液环境,以保持活的组织中。
- 收集仪器的夹层和主动脉血管的力学评估:手术剪刀,镊子弯曲,微型剪刀,外科解剖显微镜,加入50ml聚丙烯离心管中,和10毫升血清移液管。外科手术和实验过程不需要任何无菌条件。安装BAXS平台的夹具以及预先称重传感器。
- 组织分离和解剖
所有涉及实验动物的实验步骤必须由用户的动物护理和使用委员会“的机构,这符合健康指南为用户的实验动物的护理和使用”的国家批准。- 用99%的CO 2的吸入执行鼠标安乐死(7磅)在一个树脂玻璃腔室( 图6A)。
- 打开鼠标的腹部切胸主动脉流血鼠标。
- 取出膜片,胸廓和肺叶( 图6B)。注意:为尽量减少损坏的组织的风险,保持附着于主动脉的心脏,并避免直接接触容器,但使用的心脏操纵它。
- 由容器和脊柱之间轻轻地切割取出心脏,主动脉根部及胸主动脉。注意:不要诱导血管伸长任何切除时保持组织完整( 图6C)的内部结构。
- 立即浸入冷水并保持在Krebs溶液的心脏和主动脉。
- 剪下并仔细清洗主动脉Krebs溶液以去除任何血块。使用微型剪刀,镊子和手术解剖显微镜( 图6D-E)删除结缔组织。注意:请将所有的血管长度,并使用AOR抽动根,以确定血管方向。
- 容器尺寸的确定和安装
以确定容器的刚度,卸载容器的尺寸是必需的,并且可以用一个校准显微镜来确定。- 切成约2毫米长度的主动脉环和使用校准的显微镜设置( 图6F-G)的精确测量其长度。将这个片段在一旁Krebs溶液。
- 再降主动脉环尽可能小各2毫米段( 图6F)之间。把此小片段上与内腔朝上的显微镜载玻片上并用校准显微镜的设置( 图6H)测量壁厚。
- 填补了培养皿中BAXS平台Krebs溶液并插入上拉引脚( 图4C插入图示)与2毫米主动脉环段。
GE =“总是”> 
图5。PDMS基板制造和安装A)固化后,将衬底仔细剥离的SU-8 2050模具抛开在培养皿B)锚定造出来的PDMS功能,并有助于确保基板上的装在4个夹子衬底夹具C)的底物与锚定功能准备好用于安装D)的基片安装在4个夹子,然后将其安装在所述夹持器(见插图)。E)的详细图像。F )程序在基板下方的槽浇注PDMS的。箭头示出了慢慢通过毛细管填充槽的PDMS。
454fig6highres.jpg“宽度=”500“/>
图6的制备和胸主动脉的隔离。一 )准备手术器械和安乐死鼠标B)通过纵向腹部切口,胸廓和肺的高吊球被删除。 三)主动脉小心使用心脏操纵移除组织D)的心脏和主动脉被放在克雷布斯生理溶液。主动脉是通过删除所有结缔组织清洗E)详细图片放映的心脏和主动脉F)主动脉用于刚度评估以及用于厚度测量小段段。GH)的精确长度(G)和厚度(H)使用逆显微镜和分析程序的每个血管段进行评估。
结果
细胞伸展
该BAXS平台被用来研究细胞核中单小鼠成肌细胞的力学响应(C2C12)暴露于25%的基底变形。成肌细胞存在于肌肉组织内,并不断受到机械拉伸和压缩在体内 。细胞核的形状和机械性能都显示出在基因表达和转录活性20,21的调节,并在多种发育缺陷和疾病,如哈钦森- Gilford早衰综合症(HGPS),刚玉粉中发挥了重要作用-Dreifuss肌营养不良(EDM...
讨论
该BAXS平台这里提出有利于在力学生物学的研究中无数次的实验,从单细胞的调查,以整个组织。此外,该平台具有高度的灵活性和可配置性,从而允许多个机械刺激实验和多轴向拉伸试验。该平台还可以使细胞和组织的维持在生理条件下,并在拉伸试验允许同时显微镜。上一节中介绍的两个实验证明BAXS平台的通用性使用一组适当的安装夹时。一种模块化和可定制的样品安装系统,光学连接和添?...
披露声明
作者宣称,他们有没有竞争的财务权益。
致谢
DT是由乐全宗去RECHERCHE魁北克 - 自然等技术(FQRNT)和MITACS升降式战略奖学金博士后奖学金支持。 CMC是由乐全宗去RECHERCHE恩桑特魁北克(FRSQ)和欧内斯特并从渥太华心脏研究所大学玛格丽特福特心脏病学赋研究奖学金博士后奖学金支持。 EOB被授予经营从加拿大卫生研究院(CIHR)MOP80204,并从心T6335和中风安大略基金会的支持。该CIHR及美敦力公司共同提供平等机会条例草案与同行评审的研究主席(URC#57093)。 AEP是由自然科学和工程研究理事会(NSERC)发现格兰特,一个NSERC Discovery Accelerator的补充资金,并衷心感谢加拿大研究主席(CRC)计划和安大略省的早期研究者奖的支持。
材料
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
参考文献
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。