Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Роман Растяжка Платформа для приложений в клеточной и тканевой Mechanobiology
В этой статье
Резюме
Мы представляем в этой статье новый растяжения платформу, которую можно использовать для исследования одиночных клеточные реакции в сложной анизотропной двухосной механической деформации и количественной оценки механических свойств биологических тканей.
Аннотация
Инструменты, которые позволяют применение механических сил в клетках и тканях или которые могут количественно механические свойства биологических тканей резко вклад в понимание фундаментальных mechanobiology. Эти методы широко используются для демонстрации того, как начало и прогрессирование различных заболеваний находятся под сильным влиянием механических сигналов. В данной статье представлен многофункциональный двухосного растяжения (BAXS) платформу на которые могут либо механически стимулировать отдельные клетки или количественно механическую жесткость тканей. Платформа BAXS состоит из четырех звуковой катушки двигателей, которыми можно управлять независимо. Отдельные клетки можно культивировать на гибкой подложке, которую можно присоединить к двигателям, позволяющих одним подвергать клетки к сложным, динамических и пространственно меняющихся полей деформации. С другой стороны, за счет включения нагрузки силой ячейку, можно также количественно механических свойств первичных тканей, которые подвергаются воздействию циклов деформации.В обоих случаях, надлежащий комплект зажимов должны быть спроектированы и установлены на платформе двигателей BAXS для того, чтобы твердо удерживать гибкую подложку или ткани интересов. Платформа BAXS может быть установлен на инвертированный микроскоп одновременно осуществлять проходящем свете и / или визуализации флуоресценции для изучения структурной или биохимической реакции образца при растяжении экспериментов. Эта статья предусматривает экспериментальные детали дизайна и использования платформы BAXS и представляет результаты для одной клетки и целые исследований тканей. Платформа BAXS был использован для измерения деформации ядер в отдельных клеток мыши миобластов в ответ на подложку напряжения и измерить жесткость изолированных аорты мыши. Платформа BAXS является универсальным инструментом, который может быть объединен с различными оптическими микроскопии того, чтобы обеспечить новые mechanobiological идеи на ткани уровней субклеточном, клеточном и вся.
Введение
Механический микросреда играет важную роль во многих клеточных функций, таких как пролиферация, миграции и дифференциации, которые имеют огромное влияние в разработке и гомеостаза тканей, а также при заболеваниях 1-6. На протяжении многих лет, множество экспериментальных средств были использованы для механически стимулируют клетки или ткани и измерения механических свойств биологических тканей с целью повышения нашего понимания основного mechanobiology и изучения возникновения и прогрессирования заболеваний 6-17. Однако, надо часто основаны на различных экспериментальных устройств для достижения целей конкретного исследования. Данная статья представляет собой единый, многофункциональный, двухосного растяжения (BAXS) платформу, которая позволяет для исследований, которые исследуют роль, которую механические свойства и механические силы играют в биологии в субклеточном до целых масштабах длины ткани. Платформа BAXS позволяет не только для quantificatioн механических свойств изолированных тканей, но также облегчает способность применять простые, сложные, и динамические поля деформации в живых клетках, чтобы понять свои ответы на растяжение, что происходит в естественных условиях. Платформа BAXS также поддерживает способность выполнять живых клеток микроскопии во механических испытаний и возмущений на клетки и ткани.
Платформа BAXS является на заказ аппарат, который может быть использован для изучения влияния деформации подложки на клеточном уровне и выполнять испытания на растяжение на биологические ткани (рис. 1А). Алюминий нагреватель был изготовлен для размещения стандартную антенну 10 см Петри и поддерживать любые физиологические растворы при 37 ° С с помощью контроллера температуры и Kapton нагреватели (рис. 1b). Это BAXS платформа может быть интегрирована на перевернутой фазового контраста и / или флуоресцентного микроскопа и позволяет одновременно томографии (рис. 1в).Вкратце, платформа BAXS состоит из четырех линейных звуковой катушки двигателей из которых движущиеся части, установленные на миниатюрные шаровые линейное движение несущих горками, ориентированных вдоль двух перпендикулярных осей (рис. 1D). Этап линейного позиционирования установлен на каждой из четырех двигателей, чтобы обеспечить вертикальное перемещение зажимного системы, которая будет использоваться (рис. 1E). Положение каждого двигателя контролируется с помощью оптического датчика с разрешением 500 нм (рис. 1F). Все четыре двигателя регулируются независимо с контроллером движения, использующего оптический обратной связи с датчиком для выполнения команды движения (рис. 1 г). Интерфейс LabVIEW предоставляет полный контроль над величиной смещения, скорости и ускорения каждого двигателя в целях получения полностью настраиваемый, статическую и динамическую, деформацию клеток или образцов ткани.
Техника используется, чтобы вызвать деформацию в клетках достигается простым allowinг клеток твердо придерживаться гибкой и прозрачной подложке, а затем растяжение этот субстрат с помощью четырех двигателей платформы BAXS. Платформа BAXS позволяет устанавливать любой специально разработанный набор хомутов прикрепить основу на звуковой катушки двигателей. С этой целью мы разработали множество зажимов, к которой гибкая и прозрачная подложка, изготовленная из полидиметилсилоксана (ПДМС), могут быть прикреплены (2а-с и рис. 3). Поскольку зажимы будут подвергаться воздействию физиологических растворах, все части были изготовлены из нержавеющей стали, чтобы обеспечить стерилизации. Эти зажимы были тщательно разработаны, чтобы принести подложку как можно ближе к объектива микроскопа для повышения качества изображения при минимизации стресса на подложке при растяжении (рис. 2, г).
То же самое BAXS платформа может также использоваться для количественного определения жесткости маленькие образцы ткани, используя соответствующий набор зажимов с ADAPТед опоры для образцов ткани и клетки нагрузки для мониторинга силы. Несколько подходов могут быть приняты, чтобы смонтировать ткани платформы двигателей BAXS; в этом случае нержавеющей стали minutiens насекомых штифты можно подключить через отверстие сосудистых тканей для выполнения испытания на растяжение (фиг. 4A-B). Кроме того, для толстых тканей без естественное отверстие, ткани края могут быть на руках в положении с помощью зажимов, прикрепленных к звуковой катушки двигателей или приклеенных к маленькие стеклянные слайды с биологической клея и приложенных к двигателям с зажимами. Для выполнения испытания на растяжение требуется миниатюрный датчик нагрузки и могут быть легко включены на платформу двигателей BAXS и используется для измерения силы, действующей на ткани при растяжении цикла (фиг.4С). Поскольку платформа BAXS состоит из четырех двигателей, введение второго тензодатчика позволяет выполнять испытания на растяжение вдоль двух ортогональных направлениях. Эта способность позволяет quantifу механическое жесткость одной ткани вдоль двух перпендикулярных направлениях в течение того же эксперимента.
Важно отметить, что во всех конфигураций, клетки или образцы ткани, представляющие интерес, всегда поддерживается в контролируемой температурой бане, доступной для пользователя. Эта способность позволяет для введения фармакологических средств во время выборки растяжения с целью изучения временного отклика образца. Кроме того, как оптическая ось инвертированного микроскопа остается беспрепятственно, все формы микроскопии по-прежнему доступны для пользователя. Наконец, так как все четыре двигатели платформы BAXS независимы можно применить настраиваемый полей деформации в образце, представляющего интерес. В естественных клеток и тканей подвергаются сложным и анизотропной растяжения, которые могут быть более соответствующим образом имитируется в этой платформе, в отличие к традиционному одноосного растяжения платформы 7,13,15,18,19. Кроме того, физические характеристикиполя деформаций может быть изменен на лету во время эксперимента. Эти способности позволяют пользователю исследовать клеточный и тканевом уровне ответ на широком ряде весьма сложной, анизотропной, временно, и пространственно меняющихся полей деформации. В этой статье описаны преимущества и ограничения платформы BAXS а также его дизайн, принцип работы, и экспериментальные данные для одной клетки и экспериментов целых тканей.

Рисунок 1. Обзор платформы BAXS. А) Вид сверху на платформе BAXS показывая четыре звуковой катушки двигателей. Б) детальную картину блюдо нагревателя Петри, используемой для поддержания клеток и тканей при температуре 37 ° C. C) Платформа может быть установлен на инвертированный микроскоп выступать с концертами- изображений клеток при растяжения экспериментов.D) Подробная картину двигателя звуковой катушки; подвижная часть платформы. Е) детальную картину сцены линейная позиционирования, позволяющей вертикальное перемещение зажимных систем. F) детальную картину оптического датчика, который обеспечивает в режиме реального времени положение двигателя в контроллер управления движением. G) детальную картину контроллера движения показывая четыре входа оптических датчиков и выходные мощности к четырем звуковой катушки двигателей.
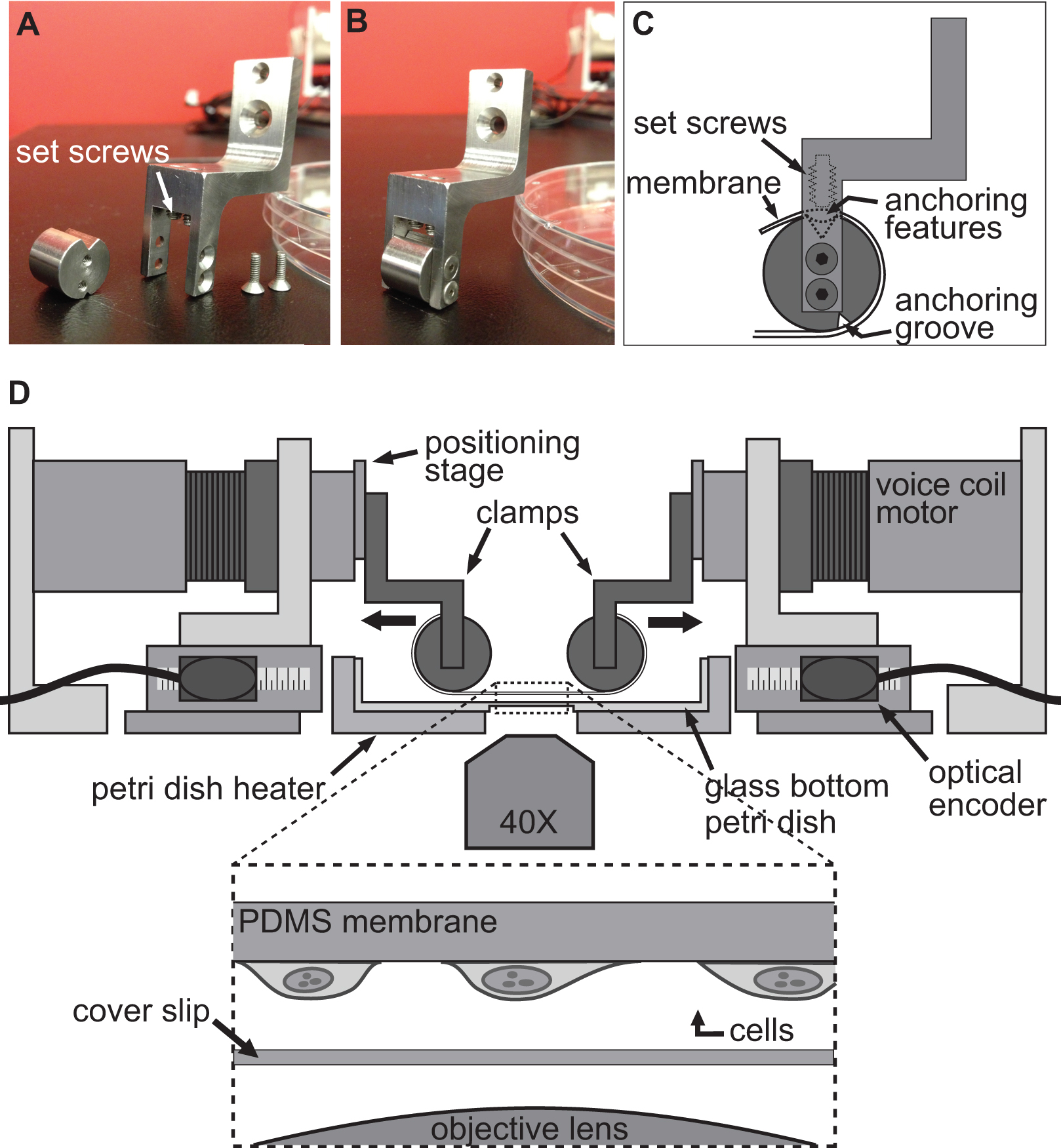
Рисунок 2. Зажима для экспериментов клетки растяжения. AB) Фотографии, показывающие детали зажимов, используемых для крепления PDMS подложки звуковой катушки двигателей для растяжки. C) Субстрат оборачивают вокруг цилиндрической части зажима с его крепежной FeaturES сидит в канавке в верхней части. Затем подложка прикреплена с помощью винтов, которые толкают субстрат / якорь особенности в верхний паз. D) Иллюстрация платформы BAXS с зажимами проведение субстрат на месте. На вставке подробный вид подложки с клетки, прикрепленные к ней сидит чуть выше покровным стеклом и объектива микроскопа.

Рисунок 3. Ведомость материалов мембраны и ее системы зажима. Рисунки, показывающие размеры главных частей интегрированы в двухосной платформы для проведения экспериментов клетки растяжения.

Рисунок 4. Эксдостаточно зажимного системы оценки жесткости мелких сосудов калибра. AB) детальные снимки зажимного системы, используемой, чтобы вызвать деформацию в 1 мм аорты диаметр мыши. Штифты из нержавеющей стали были тщательно формируется в открытых треугольников разрешить судну скользить по обе булавки. C) Иллюстрация платформе BAXS с зажимы держала сосуд и датчик нагрузки, прикрепленный между неподвижным двигателем и левой зажима. На вставке показан детальный вид сверху судна, установленного на штифтов.
протокол
1. Механической деформации отдельных клеток
- Изготовление из PDMS субстрата с внедренными флуоресцентные шарики
До изготовления подложки, флуоресцентные микросферы в водном растворе ресуспендируют в изопропаноле для повышения шарик перемешивание в PDMS из-за его гидрофобной природы.- Пипетка 500 мкл флуоресцентных микросфер в 1,5 мл микроцентрифужных трубки и центрифуге при 16200 х г в течение 10 мин.
- Удалите супернатант и добавить 500 мкл изопропанола следуют с 5 мин встряхивания. Поместите флакон в сторону ночи в темноте, с тем чтобы позволить любые крупные частицы агрегатов для осаждения.
- На следующее утро, осторожно удалите супернатант в чистую микроцентрифужную флаконе. Это решение шарик может быть использован для изготовления более 5 субстраты. ПРИМЕЧАНИЕ: Решение шарик будет продолжать оседать в течение следующих 3 дней. Будьте осторожны, чтобы избежать ресуспендированием осадок.
- Налейте 0,5 г отвердителя при условии,с комплектом PDMS в 1,5 мл микроцентрифужных пробирку с помощью научных баланс. По последовательных шагов, добавить в общей сложности 90 мкл шариков (в шести 15 дополнений мкл), встряхиванием в течение 1 мин между каждым добавлением. Отложите.
- Взвешивают 10 г PDMS и перемешивают в течение по крайней мере 12 мин с 0,5 г отвердителя с добавлением флуоресцентных шариков.
- Изготовление в СУ-8 2050 крестообразные формы, используя стандартные методы фотолитографии в соответствии с инструкциями изготовителя. Используемая форма имеет высоту 320 мкм и площадью 13,4 см2 (рис. 3). Пресс-форма может содержать 428 мкл или 440 мг PDMS.
- Налейте 400 мг в PDMS с бисером в крестообразным плесени с помощью пипетки передачи и вылечить в течение 2 часов при 80 ° С После отверждения, снимите подложку из формы (рис. 5А). Подложка может быть в чашке Петри при комнатной температуре в течение 2 недель без предъявления значительных изменений в его механических свойств.
- Налейте капельки PDMS (отвердитель: PDMS в соотношении 1:20) в чашке Петри с конечным размером примерно 4 мм в диаметре и вылечить их вверх дном в течение 2 часов при 80 ° C (фиг.5В). Эти анкерные особенности могут быть сохранены в чашке Петри в течение многих недель. Примечание: Поддержание блюдо вверх дном, чтобы предотвратить сплющивание капель от во время процесса отверждения.
- Воздушно-плазменная удовольствие (30 с при 30 Вт) субстрат и 8 анкерных особенности. Привязка функции на каждом конце подложки на расстоянии 4 мм от квадратной формы абзаце, присутствующих на подложке (рис. 5С).
- Монтаж мембраны на хомут
- Оберните каждый конец подложки вокруг рифленой цилиндрической части зажимы и закрепите его на месте с 2 винтами сверху (рис. 2б и показатели 5D-E).
- Винт 4 зажимы на держателе зажима и залить PDMS (соотношение 1:20), используя одноразовые тransfer пипетки на границе раздела между подложкой и рифленой цилиндрической части зажимов. Разведите неотвержденных PDMS вокруг рифленой цилиндрической части с помощью шестигранного ключа 1,5 мм.
- Налейте PDMS (1:20) в канавках до полного заполнено под действием капиллярных сил и вылечить сборку при 80 ° С в течение 2 часов (рис. 5F).
- Сеялки клетки на мембране
- Воздушно-плазменная удовольствие (30 с при 30 Вт) все собрание для стерилизации и функционализировать субстрат для обеспечения коллагена покрытием.
- Функционализации поверхности подложки, где клетки будут посеяны 1 мл 0,02 М уксусной кислоты с добавлением 16 мкг / мл крысиного хвоста коллагена при комнатной температуре в течение 1 часа. Желаемый конечный плотность коллаген 5 мкг / см 2.
- Промыть подложки 3 раза фосфатным буфером и дать высохнуть при комнатной температуре в течение по крайней мере в течение 10 мин.
- Добавить 40 мкл культуральной среде с добавлением 10% эмбриональной телячьей Серум и 1% пенициллина-стрептомицина, содержащий 2000 клеток в центральной части подложки, чтобы покрыть площадь 1 см 2 (плотность клеток: 20 клеток / мм 2). Плотность клеток могут быть изменены в соответствии с экспериментальными требований.
- Положите весь узел в стандартном инкубаторе для клеточных культур с субстратом вверх с падением культуральной среде, содержащей клетки на ней. ПРИМЕЧАНИЕ: Сборка должна храниться вместе с субстратом вверх, по крайней мере 3 часа, чтобы позволить клеткам прочно прикрепить его. Чтобы предотвратить испарение, 30 мкл теплой культуральной среде добавляют в капли на подложке каждые 45 мин в течение 3 часов.
- Через 3 ч, флип весь узел в чашку Петри, наполненную свежей культуральной средой, чтобы погрузить подложку и инкубировать в течение ночи, чтобы позволить клеткам пролиферировать.
- На следующий день, подготовить HEPES-буферный солевой раствор (HBSS; 20 мМ Hepes, 120 мМ NaCl, 5,3 мМ KCl, 0,8 мМ MgSO 4, 1,8 мМ CaCl 2, и 11,1 мМ деxtrose). Отрегулируйте рН до 7,4. Примечание: раствор HBSS должен быть подготовлен в день и выдерживают при 37 ° С в течение экспериментов. Это физиологический раствор используется для поддержания клеток на столике микроскопа, имитируя нормальную среду ткани / крови.
- Установите настройку на перевернутой фазового контраста или флуоресцентного микроскопа горе зажим-субстрат сборки на платформе и двигателей BAXS. Заполните чашку Петри внутри посудомоечной нагревателя Петри с Гепеса (рис. 2D).
2. Жесткость Измерение малого калибра судов
- Подготовка
- Кребс физиологический раствор: Приготовьте раствор 118,1 мМ NaCl, 11,1 мМ D-глюкозы, 25 мМ NaHCO 3, 4,7 мм KCl, 1,2 мМ MgSO 4, 1,2 мм KH 2 PO 4 и 2,5 мМ CaCl 2. Отрегулируйте рН до 7,4 и кислородом решение с карбогена медицинского газа (95% O 2/5% СО 2) в течение 30 мин. ПРИМЕЧАНИЕ: Кребс решением,на должен быть подготовлен в день и выдерживают при 37 ° С в течение экспериментов. Это физиологический раствор используется для поддержания тканей живых, имитируя нормальную среду ткани / крови.
- Соберите приборы для вскрытия и механического оценки аорты сосудов: хирургические ножницы, согнутые пинцетом, микро-ножницы, хирургическое вскрытие микроскопа, 50 мл полипропиленовые центрифужные пробирки и 10 мл серологические пипетки. Хирургическая и эксперимент процедура не требует никаких стерильных условий. Установите зажимы платформы BAXS вместе с датчиком нагрузки заранее.
- Ткань Выделение и Рассечение
Все экспериментальные процедуры, связанные лабораторных животных должны быть одобрены уходу и использованию животных комитета пользователей учреждения, что соответствует путеводителя по здравоохранению по уходу и использованию лабораторных животных пользователей стране.- Выполните мыши эвтаназию с вдыханием 99% CO 2 (7 фунтов на квадратный дюйм)в Оргстекло камера (рис. 6А).
- Живота Открыть мыши и сократить грудной аорты кровотечение мышь.
- Снимите мембрану, грудной клетки и долей легких (рис. 6, б). ПРИМЕЧАНИЕ: Для минимизации риска повреждения ткани, сохранить сердце, прикрепленный к аорте, не касаясь судно непосредственно, но работать с ним, используя сердце.
- Снимите сердце, корня аорты и грудной аорты, осторожно резки между судном и позвоночника. ПРИМЕЧАНИЕ: Не вызывать любую удлинение в сосуде во время иссечения сохранить внутреннюю структуру ткани нетронутыми (фиг.6С).
- Сразу погрузиться и держать сердце и аорту в растворе Кребса.
- Вырезать и тщательно мыть аорту в растворе Кребса, чтобы удалить любые сгустки крови. Удалить соединительную ткань с помощью микро-ножницы, пинцеты и хирургические рассекает микроскопом (рис. 6D-E). ПРИМЕЧАНИЕ: Держите все длины судна и использовать ЗОкрестики корень для определения ориентации судна.
- Определение Размеры судов и монтажа
Для определения жесткости сосуда, ненагруженном размеры сосуда необходимы и могут быть определены с помощью калиброванного микроскопа.- Вырежьте аорты кольцо около 2 мм в длину и точно измерить его длину с помощью калиброванного микроскопа настройки (рисунки 6F-G). Положите этот сегмент сторону в растворе Кребса.
- Вырезать другой аорты кольцо как можно меньше между каждым из сегментов 2 мм (рис. 6F). Поместите этот небольшой сегмент на микроскоп стекло с просветом вверх и измерить толщину стенки с помощью калиброванного настройку микроскопа (рис. 6H).
- Заполните чашку Петри на платформе BAXS раствором Кребса, и вставьте 2 мм аорты кольцевой сегмент на мелкий штифтов (вставка на фиг.4С).
GE = "всегда"> 
Рисунок 5. Изготовление PDMS субстрат и монтаж.) После отверждения субстрат тщательно снимают СУ-8 2050 плесень и отложить в сторону в чашке Петри. Б) якорь особенности, сделанные из PDMS и помочь обеспечить подложку, на Зажимы. С) Субстрат с крепления особенности готов к установке. D) Подложка установлена на 4 зажимов, которые затем смонтированных на держателе зажима (см. вставку). E) Подробное изображение подложки, установленный на 4 зажимами. F ) Процедура заливки PDMS в канавке под подложкой. Стрелка показывает PDMS медленно заполняя паз под действием капиллярных сил.
454fig6highres.jpg "ширина =" 500 "/>
Рисунок 6. Получение и выделение грудной аорты.) Подготовка хирургических инструментов и эвтаназии мыши. B) через продольную разрез брюшной стенки, грудной клетки и легких больших объектов, удаляются. С) аорта осторожно удаляют с помощью сердца, чтобы манипулировать ткань. D) Сердце и аорта ставятся в Кребса физиологического раствора. Аорта очищают путем удаления всех соединительных тканей. E) подробное изображение показывает сердце и аорта. F) сегмент аорты используется для оценки жесткости вместе с маленьких сегментов, используемых для измерения толщины. GH) точное длину (G) и толщину (H) каждого сегмента сосуда анализируются с помощью программы анализа обратную микроскоп и.
Результаты
Сотовый Растяжка
Платформа BAXS использовалась для исследования механической реакции ядра в отдельные клетки мыши миобластов (С2С12), подверженную подложки деформации 25%. Миобластов клетки находятся в мышечной ткани и постоянно подвергаются механическим растяж?...
Обсуждение
Платформа BAXS представленные здесь облегчает многочисленные эксперименты в изучении mechanobiology, из исследований отдельных клеток до целых тканей. Кроме того, платформа является очень гибким и настраиваемым, что позволяет многочисленным механических экспериментов стимуляции и многоосн?...
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
DT поддержали докторской студенчества от Ле Fonds по исследованиям Квебека-природе ET технологий (FQRNT) и MITACS Elevate стратегического стипендий. CMC поддержали докторской студенчества от ле Fonds по исследованиям ан Санте Квебека (FRSQ) и Эрнеста и Маргарет Форд кардиологии наделен исследований общения из Университета Оттавы института сердца. EOB поддержали операционной грантов MOP80204 от Канадского института исследований в области здравоохранения (CIHR) и T6335 от сердца и инсульта Фонда Онтарио. CIHR и Medtronic коллективно обеспечить EOB с рецензируемом заведующая кафедрой (УРК # 57093). AEP финансируется естественных и технических наук исследовательский совет (NSERC) Discovery Грант, в Приложении NSERC Discovery Accelerator и благодарит за поддержку научно-исследовательской кафедр Канада программы (КПР) и раннего премии исследователь из провинции Онтарио.
Материалы
| Name | Company | Catalog Number | Comments |
| PDMS | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | The ratio base to cross-linker used in this protocol is 20:1. Mix in a laminar hood to keep dust from contamining your |
| FluoSpheres fluorescent microspheres | Invitrogen | F8810 | Keep away from light. |
| Linear voice coil | Moticont | LVCM-051-051-01 | The motro comes in two pieces (magnet and coil). It has to be mounted on a ball bearing sytem to be functional. |
| Ball bearing slide | Edmund Optics | NT37-360 | Miniature and Small Linear Motion Ball Bearing Slides |
| Linear positioning stage | Edmund Optics | 38-960 | Center Drive 1.25" Square Linear Translation Stages |
| Optical encoder | GSI microE systems | Mercury II 1600S - 0.5um resolution | reflective incremental encoder. |
| Motion controller | Galil | DMC-2143(DIN)-DC48 with AMP-20440 | 4 axis controller with a 4 axis amplifier |
| Load cell | Honeywell | 31 low | miniature load cell with a range of 0-150 g |
| Insect minutiens pins (0.20 mm) | Pin Service Austerlitz Insect pins | Stainless steel pins that are bended in an opened triangle shape | |
| SU-8 2050 | Micro Chem | SU-8 2050 | Permanent epoxy negative photoresist. Keep away from heat and light |
| Air-plasma treatment system | Glowresearch | Autoglow Oxygen Plasma System | |
| Rat-tail collagen | Invitrogen | A10483-01 | Collagen I, Rat Tail 5 mg/ml |
| Hoechst 33342 | Invitrogen | R37605 | DNA-specific fluorescent dye. Keep in the fridge. |
| Kapton (Polyimide Film) Insulated Flexible Heaters | omega.ca | KHLV-0504/(10)-P | 28 V flexible heaters; can be supplied with a 24 V |
| 1/16 DIN Autotune Temperature and Process Controllers | omega.ca | CN63200-R1-LV | Temperature controller; supply 24 V. |
| DMEM culture medium | Hyclone | SH3024301 | Dulbecco’s Modified 30 Eagle Medium. Keep at 4 °C |
| Penicillin-Streptomycin | Hyclone | SV30010 | Keep stock frozen. Keep working solution at 4 °C. |
| Fetal bovine serum (FBS) | Hyclone | SH3039603C | Keep frozen. |
| Trypsin 0.05% | Hyclone | SH30236.02 | Keep frozen. Digestion of cell attachement proteins for subcultivation |
| Hepes | Wisent Inc | 330-050-EL | HEPES-buffered salt solution |
| NaCl | Fisher Scientific | BP358-1 | HEPES-buffered salt solution / Krebs physiological solution |
| KCl | Fisher Scientific | BP366-500 | HEPES-buffered salt solution / Krebs physiological solution |
| MgSO4 | Fisher Scientific | M65-500 | HEPES-buffered salt solution / Krebs physiological solution |
| CaCl2 | Fisher Scientific | C614-500 | HEPES-buffered salt solution / Krebs physiological solution |
| Dextrose | Fisher Scientific | BP220-1 | HEPES-buffered salt solution / Krebs physiological solution |
| NaHCO3 | Fisher Scientific | BP328-1 | Krebs physiological solution |
| KH2PO4 | Fisher Scientific | BP362-500 | Krebs physiological solution |
| Carbogen 95% O2/5% CO2 | Lindle | DIN:02154749 | Krebs physiological solution oxygenation |
| Nocodazole | Sigma | M1404 | Microtubules depolymerization agent |
| Cytochalasin-D | Sigma | C8273 | Actin filaments depolymerization agent |
| Anti-α-SMA-FITC | Sigma | F3777 | Used to stain and quantify smooth muscle cells content |
| Picrosirius red stain | Fluka | 43665 | Used to stain and quantify collagen content |
Ссылки
- Yim, E. K., Sheetz, M. P. Force-dependent cell signaling in stem cell differentiation. Stem Cell Res Ther. 3, (2012).
- Vogel, V., Sheetz, M. Local force and geometry sensing regulate cell functions. Nat Rev Mol Cell Biol. 7, 265-275 (2006).
- Wang, N., Tytell, J. D., Ingber, D. E. Mechanotransduction at a distance: mechanically coupling the extracellular matrix with the nucleus. Nat Rev Mol Cell Biol. 10, 75-82 (2009).
- Ingber, D. E. Mechanobiology and diseases of mechanotransduction. Ann Med. 35, 564-577 (2003).
- Janmey, P. A., Miller, R. T. Mechanisms of mechanical signaling in development and disease. J Cell Sci. 124, 9-18 (2011).
- Bukoreshtliev, N. V., Haase, K., Pelling, A. E. Mechanical cues in cellular signalling and communication. Cell Tissue Res. 352, 77-94 (2013).
- Chen, Y., Pasapera, A. M., Koretsky, A. P., Waterman, C. M. Orientation-specific responses to sustained uniaxial stretching in focal adhesion growth and turnover. Proc Natl Acad Sci USA. 110, (2013).
- Rosenzweig, D. H., Matmati, M., Khayat, G., Chaudhry, S., Hinz, B., Quinn, T. M. Culture of Primary Bovine Chondrocytes on a Continuously Expanding Surface Inhibits Dedifferentiation. Tissue Eng Part A. 18, 2466-2476 (2012).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc Natl Acad Sci USA. 108, 19943-19948 (1994).
- Steward, R., Cheng, C. M., Ye, J., Bellin, R., LeDuc, P. Mechanical stretch and shear flow induced reorganization and recruitment of fibronectin in fibroblasts. Sci Rep. 1, (2011).
- Wang, D., Xie, Y., Yuan, B., Xu, J., Gong, P., Jiang, X. A stretching device for imaging real-time molecular dynamics of live cells adhering to elastic membranes on inverted microscopes during the entire process of the stretch. Integr Biol (Camb). 2, 288-293 (2010).
- Haskett, D., Johnson, G., Zhou, A., Utzinger, U., Van de Geest, J. Microstructural and biomechanical alterations of the human aorta as a function of age and location. Biomech Model Mechanobiol. 9, 725-736 (2010).
- Duprey, A., Khanafer, K., Schlicht, M., Avril, S., Williams, D., Berguer, R. In vitro characterisation of physiological and maximum elastic modulus of ascending thoracic aortic aneurysms using uniaxial tensile testing. Eur J Vasc Endovasc Surg. 39, 700-707 (2010).
- Tremblay, D., et al. A comparison of mechanical properties of materials used in aortic arch reconstruction. Ann Thorac Surg. 88, 1484-1491 (2009).
- Khanafer, K., Duprey, A., Zainal, M., Schlicht, M., Williams, D., Berguer, R. Determination of the elastic modulus of ascending thoracic aortic aneurysm at different ranges of pressure using uniaxial tensile testing. The Journal of thoracic and cardiovascular surgery. 142, 682-686 (2011).
- Van de Geest, J. P., Sacks, M. S., Vorp, D. A. The effects of aneurysm on the biaxial mechanical behavior of human abdominal aorta. J Biomech. 39, 1324-1334 (2006).
- Guolla, L., Bertrand, M., Haase, K., Pelling, A. E. Force transduction and strain dynamics in actin stress fibres in response to nanonewton forces. J Cell Sci. 125, 603-613 (2012).
- Wang, J. H., Goldschmidt-Clermont, P., Wille, J., Yin, F. C. Specificity of endothelial cell reorientation in response to cyclic mechanical stretching. J Biomech. 34, 1563-1572 (2001).
- Jungbauer, S., Gao, H., Spatz, J. P., Kemkemer, R. Two characteristic regimes in frequency-dependent dynamic reorientation of fibroblasts on cyclically stretched substrates. Biophys J. 95, 3470-3478 (2008).
- Dahl, K. N., Ribeiro, A. J. S., Lammerding, J. Nuclear shape, mechanics, and mechanotransduction. Circ Res. 102, 1307-1318 (2008).
- Shivashankar, G. V. Mechanosignaling to the cell nucleus and gene regulation. Annu Rev Biophys. 40, 361-378 (2011).
- Chiquet, M., Gelman, L., Lutz, R., Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochim Biophys Acta. 1793, 911-920 (2009).
- Sullivan, T., et al. Loss of A-type lamin expression compromises nuclear envelope integrity leading to muscular dystrophy. J Cell Biol. 147, 913-920 (1999).
- Lammerding, J., et al. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Tremblay, D., Andrzejewski, L., Leclerc, A., Pelling, A. E. Actin and microtubules play distinct roles in governing the anisotropic deformation of cell nuclei in response to substrate strain. Cytoskeleton. , (2013).
- Cuerrier, C. M., et al. Chronic over-expression of heat shock protein 27 attenuates atherogenesis and enhances plaque remodeling: a combined histological and mechanical assessment of aortic lesions. PLoS ONE. 8, (2013).
- Tremblay, D., Cartier, R., Mongrain, R., Leask, R. L. Regional dependency of the vascular smooth muscle cell contribution to the mechanical properties of the pig ascending aortic tissue. J Biomech. 43, 2448-2451 (2010).
- Barker, A. J., Lanning, C., Shandas, R. Quantification of hemodynamic wall shear stress in patients with bicuspid aortic valve using phase-contrast MRI. Ann Biomed Eng. 38, 788-800 (2010).
- Haga, J. H., Li, Y. S. J., Chien, S. Molecular basis of the effects of mechanical stretch on vascular smooth muscle cells. J Biomech. 40, 947-960 (2007).
- Frydrychowicz, A., et al. Time-resolved magnetic resonance angiography and flow-sensitive 4-dimensional magnetic resonance imaging at 3 Tesla for blood flow and wall shear stress analysis. The Journal of thoracic and cardiovascular surgery. 136, 400-407 (2008).
- Boccafoschi, F., Mosca, C., Bosetti, M., Cannas, M. The role of mechanical stretching in the activation and localization of adhesion proteins and related intracellular molecules. J Cell Biochem. 112, 1403-1409 (2011).
- Yang, G., Crawford, R. C., Wang, J. H. C. Proliferation and collagen production of human patellar tendon fibroblasts in response to cyclic uniaxial stretching in serum-free conditions. J Biomech. 37, 1543-1550 (2004).
- Goldyn, A. M., Rioja, B. A., Spatz, J. P., Ballestrem, C., Kemkemer, R. Force-induced cell polarisation is linked to RhoA-driven microtubule-independent focal-adhesion sliding. J Cell Sci. 122, 3644-3651 (2009).
- Heo, S. J., et al. Fiber stretch and reorientation modulates mesenchymal stem cell morphology and fibrous gene expression on oriented nanofibrous microenvironments. Ann Biomed Eng. 39, 2780-2790 (2011).
- Zdero, R., et al. Linear and torsional mechanical characteristics of intact and reconstructed scapholunate ligaments. J Biomech Eng. 131, (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены