A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس الاستجابة التغذية الناجم عن الجلوتاثيون في حيدرة
In This Article
Summary
Here we describe a simple assay for the quantification of the feeding response in hydra induced by the reduced form of glutathione. This assay relies on measuring the distance between the apical end of the tentacle and mouth of hydra.
Abstract
Hydra is among the most primitive organisms possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey. The movement of prey organisms causes mechanosensory discharge of the stinging cells called nematocysts from hydra, which are inserted into the prey. The feeding response in hydra, which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth and consequent engulfing of the prey, is triggered by GSH present in the fluid released from the injured prey. To be able to identify the molecular mechanism of the feeding response in hydra which is unknown to date, it is necessary to establish an assay to measure the feeding response. Here, we describe a simple method for the quantitation of the feeding response in which the distance between the apical end of the tentacle and mouth of hydra is measured and the ratio of such distance before and after the addition of GSH is determined. The ratio, called the relative tentacle spread, was found to give a measure of the feeding response. This assay was validated using a starvation model in which starved hydra show an enhanced feeding response in comparison with daily fed hydra.
Introduction
Hydra is the most primitive organism possessing a nervous system and chemosensation for detecting reduced glutathione (GSH) for capturing the prey1. It feeds on a variety of animals such as nematode, crustacea, insect larvae, tadpoles and newly hatched fish1. The movement of these prey organisms causes mechanosensory discharge of the stinging capsules called nematocysts from hydra, which are inserted into the prey2. GSH present in the fluid released from the injured prey subsequently activates the feeding response in hydra which includes curling of the tentacles to bring the prey towards the mouth, opening of the mouth, and consequent engulfing of the prey. Multiple molecules, such as dopamine3, glutamate4, GABA, glycine5, NMDA receptors6, and allatotropin7, have been shown to be involved in the feeding response in hydra. It has also been shown that the chemosensory response induced by GSH is modulated by the feeding status of the animal such that starved hydra exhibited enhanced feeding response1. Such an increase in the GSH sensitivity is biologically relevant since under starvation hydra need to find its prey at higher sensitivity.
Although the feeding response induced by GSH can be clearly observed under microscope, the methods typically used for measuring the feeding response observations are non-quantitative. In most of the cases, the time during which the mouth of the hydra remains open was taken as a measure of the feeding response8,9; whereas in another case, quantitation was based on the number of hydra out of a population showing the feeding response10. However, observing the mouth opening time of the hydra polyps is cumbersome and subject to variation induced by uncontrollable parameters such as the direction of the mouth orientation during observations. Similarly, since the feeding response is a quantitative parameter, population-based approaches are subject to variations/errors caused by the opinion or observational bias of the individual observer. To circumvent these issues we have developed a method for the relative quantification of the feeding response in hydra (Hydra vulgaris Ind-Pune11) based on the distance of the apical end of the tentacle from the mouth of the hydra polyp.
Protocol
1. هيدرا الثقافة وقياس الاستجابة التغذية
- الحفاظ على الاورام الحميدة هيدرا في الثقافة عن طريق تغذية لهم يوميا مع الأرتيميا وابقائها في المتوسط (1 ملي تريس، حمض الهيدروكلوريك العازلة، ودرجة الحموضة 7.6، 1 ملي مول كلوريد الصوديوم، 1 ملم CaCl 2، 0.1 ملم بوكل، و 0.1 ملي MgSO 4) الواردة في زجاج وعاء عند 18 درجة مئوية تحت 12 ساعة ضوء لمدة 12 ساعة دورات مظلمة كما هو موضح سابقا (12).
- لقياس استجابة للتغذية، ونقل احد تنضج سليلة هيدرا وجود بين 5 و 6 مخالب لبئر واحد من 24 لوحة جيدا. إزالة المتوسطة المتبقية من البئر عن طريق إمالة، ثم تضاف على الفور 500 ميكرولتر من متوسطة جديدة.
- تحضير 9 ميكرومتر حل الجلوتاثيون في المتوسط حيدرة. منذ حل الجلوتاثيون هو عرضة للأكسدة، استخدم دائما حل الجلوتاثيون الطازجة لكل تجربة.
- نقل لوحة لمنصة التصوير من المجهر وجود أحكام لتسجيل الصورة. استخدام خلفية داكنة تلك التي س السلوكو سليلة هيدرا يمكن تصويرها بشكل واضح على خلفية المتناقضة.
- غرفة تستخدم للمراقبة والتصوير سلوك هيدرا خالية من الأضواء من تذبذب شدة، وتيارات الهواء والضوضاء. يمكن لهذه الاضطرابات أيضا أن يسبب ورم هيدرا لتظهر انكماش مخالب - حتى في حالة عدم وجود الجلوتاثيون.
- السماح للورم للاسترخاء لمدة 5 دقائق.
- تأكد من أن ورم يقع على طول المنطقة الوسطى من مثل جيدا أن السلوك يمكن تصويرها بشكل واضح. إذا كانت سليلة هو على حافة البئر، وإحضاره إلى المركز من قبل بيغ المتوسطة باستخدام ماصة والسماح لها مرة أخرى للاسترخاء.
- التقاط صورة من هيدرا في حالة استرخاء. وستكون هذه الملاحظة نقطة الصفر مرة.
- بسرعة إضافة 9 ميكرومتر حل الجلوتاثيون للوصول إلى تركيز النهائي من 3 ميكرومتر في البئر. اعتمادا على الغرض من التجربة والرد الذي أبداه هيدرا، واختبار مجموعة من تركيزات مختلفة من الجلوتاثيون وتشوحد ذاته تركيز مناسب المطلوبة.
- بدء الموقت فورا بعد إضافة حل الجلوتاثيون والتقاط الصور بعد كل 15-30 ثانية لمدة 4-5 دقيقة. لا تغيير إعدادات التكبير خلال الوقت الفاصل بين التصوير.
- إضافة محلول الجلوتاثيون بلطف ومع تدفق موحد من هذا القبيل أن موقف الحيوان في البئر سوف تضطرب طفيفة في مجال الرؤية من المجهر. ومع ذلك، إذا يتحرك سليلة على نطاق واسع بعد إضافة حل الجلوتاثيون، حرك لوحة بلطف جدا لجلب ورم في مجال الرؤية لالتقاط الصور.
- في تجربة السيطرة، واستخدام تفتقر المتوسطة الجلوتاثيون مع الحفاظ على جميع المعلمات أخرى مماثلة.
- تأكد من تنفيذ كافة الخطوات التجريبية السابقة خلال النصف الأول من اليوم - قبل 13:00 لتجنب التأثير المحتمل لإيقاع الساعة البيولوجية على مدى استجابة التغذية.
- فتح كل واحدة من الصور التي تم التقاطها باستخدام برنامج التلاعب جنو صورة (الأعرج).
- استخدام "القياس" وسيلة متاحة من القائمة> الأدوات> قياس لتحديد المسافة بين نهاية قمية كل من مخالب والكارح. إذا لاحظت فتحة الفم في أي من الصور، وتحديد المسافة بين وسط الفم وافتتح نهاية قمية من اللامسة. الرجوع إلى هذه المسافة مع انتشار اللامسة.
- حساب معدل انتشار اللامسة لكل ورم قبل وبعد التعرض الجلوتاثيون. حساب متوسط نسبة انتشار اللامسة عند نقطة الصفر مرة لأنه في كل لاحقة نقاط الوقت. وسوف يطلق هذا نسبة انتشار اللامسة النسبي.
- تكرار القياسات لا يقل عن 20 البوليبات.
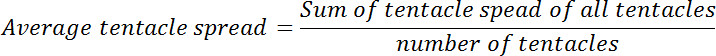

2. طريقة التحقق من صحة استخدامالمجاعة نموذج
- لالمجاعة، ونقل بعض الاورام الحميدة هيدرا إلى وعاء زجاجي منفصل ولا إطعامهم لمدة 5 أيام. إطعام مجموعة مراقبة من بضعة الاورام الحميدة يوميا مع الأرتيميا في وعاء مماثل الحجم. تغيير المتوسطة من كلا التجريبية الأوعية يوميا لتجنب نمو الفطريات في المتوسط.
- في يوم من التجربة، وإطعام مجموعة مراقبة من هيدرا مع الأرتيميا لمدة 1 ساعة واستخدام هذه هيدرا لتجارب لاحقة بعد إزالة جميع الأرتيميا غير مأكول وميت من المتوسط.
- قياس استجابة للتغذية هيدرا تجويع بالمقارنة مع هيدرا من المجموعة الضابطة التي كتبها الطريقة الموضحة في الخطوة 1. في وقت سابق لتفادي أي تحيز بسبب وقت الرصد، بالتناوب قياسات كل من تجويع الاورام الحميدة والسيطرة هيدرا.
النتائج
يسبب الجلوتاثيون هيدرا لتظهر الشباك من مخالب نحو الفم لغرض تجتاح فريسة. مثل هذا الشباك من مخالب يجلب نهايات قمية من مخالب أقرب إلى الكارح. هذا يؤدي إلى انخفاض في انتشار اللامسة، أو المسافة الخطية بين نهاية قمية من اللامسة والكارح (الشكل 1). انتشار اللامسة الن?...
Discussion
سلوك التغذية في حيدرة يمثل واحدا من أكثر أنظمة حسي كيميائي الأجداد في metazoans. على الرغم من أن تم الكشف عن وجود الجلوتاثيون في السائل القشريات صدر بعد بمساعدة كيسة خيطية التقاط الفريسة منذ فترة طويلة 1، وقد تميزت أيا من البروتين GSHR ولا المفترض الجين الترميز / ث من ه...
Disclosures
The authors declare no competing financial interests.
Acknowledgements
Authors are thankful to K. P. Madhu, Nita Beliappa and staff of the Media Centre of Indian Institute of Science Education and Research, Pune for their help in the video production. The work was supported by funding under the Centre of Excellence program of Department of Biotechnology, Government of India to SG and postdoctoral fellowship by Department of Science and Technology, Government of India to RK.
Materials
| Name | Company | Catalog Number | Comments |
| Cooled Incubator | Panasonic | MIR-254-PE | |
| Microscope | Leica | S8AP0 | |
| Camera for the microscope | Leica | EC3 | |
| Reduced glutathione | Sigma | G4251 | Stored at 4 °C. Bring the bottle to room temperature before opening to avoid oxidation |
| Image editing program | GIMP | Version 2.8 |
References
- Loomis, W. F. Glutathione control of the specific feeding reactions of hydra. Ann. Ny. Acad. Sci. 62, 209-228 (1955).
- Beckmann, A., Ozbek, S. The Nematocyst: a molecular map of the Cnidarian stinging organelle. Int. J. Dev. Biol. 56, 577-582 (2012).
- Venturini, G., Carolei, A. Dopaminergic receptors in Hydra. Pharmacological and biochemical observations. Comp. Biochem. Phys. C. 102, 39-43 (1992).
- Kass-Simon, G., Scappaticci, A. A. Glutamatergic and GABAnergic control in the tentacle effector systems of Hydra vulgaris. Hydrobiologia. 530-531, 67-71 (2004).
- Pierobon, P., Tino, A., Minei, R., Marino, G. Different roles of GABA and glycine in the modulation of chemosensory responses in Hydra vulgaris (Cnidaria, Hydrozoa). Hydrobiology. 178, 59-66 (2004).
- Pierobon, P., Sogliano, C., Minei, R., Tino, A., Porcu, P., Marino, G., Tortiglione, C., Concas, A. Putative NMDA receptors in Hydra: a biochemical and functional study. Eur. J. Neurosci. 20, 2598-2604 (2004).
- Alzugaray, M. E., Adami, M. L., Diambra, L. A., Hernandez-Martinez, S., Damborenea, C., Noriega, F. G., Ronderos, J. R. Allatotropin: An ancestral myotropic neuropeptide involved in feeding. PLoS ONE. 8, (2013).
- Bellis, S. L., Laux, D. C., Rhoads, D. E. Affinity purification of Hydra glutathione binding proteins. FEBS Lett. 354, 320-324 (1994).
- Lenhoff, H. M., Shaw, C. A. The discovery of the GSH receptor in Hydra and its evolutionary significance. Glutathione in the Nervous System. , 25-43 (1998).
- Venturini, G. The hydra GSH receptor. Pharmacological and radioligand binding studies. Comp. Biochem. Phys. C. 87, 321-324 (1987).
- Reddy, P. C., Barve, A., Ghaskadbi, S. Description and phylogenetic characterization of common hydra from India. Curr. Sci. 101, 736-738 (2011).
- Horibata, Y., et al. Unique catabolic pathway of glycosphingolipids in a hydrozoan, Hydra magnipapillata. Involving endoglycoceramidase. J. Biol. Chem. 279, 33379-33389 (2004).
- Koizumi, O., Maeda, N. Rise of feeding threshold in satiated Hydra. J. Comp. Physiol. 142, 75-80 (1981).
- Bellis, S. L., Kass-Simon, G., Rhoads, D. E. Partial characterization and detergent solubilization of the putative glutathione chemoreceptor from hydra. Biochemistry. 31, 9838-9843 (1992).
- Morita, H., Hanai, K. Taste receptor proteins in invertebrates - with special reference to glutathione receptor of hydra. Chem. Senses. 12, 245-250 (1987).
- Colasanti, M., Venturini, G., Merante, A., Musci, G., Lauro, G. M. Nitric oxide involvement in Hydra vulgaris very primitive olfactory- like system. Journal of Neurosci. 17, 493-499 (1997).
- Kuhn, A., Tsiairis, C. D., Williamson, M., Kalbacher, H., Grimmelikhuijzen, C. J., Holstein, T. W., Gründer, S. Three homologous subunits form a high affinity peptide-gated ion channel in Hydra. J. Biol. Chem. 285, 11958-11965 (2010).
- Wang, M., Yao, Y., Kuang, D., Hampson, D. R. Activation of family C G-protein-coupled receptors by the tripeptide glutathione. J. Biol. Chem. 281, 8864-8870 (2006).
- Ruggieri, R. D., Pierobon, P., Kass-Simon, G. Pacemaker activity in hydra is modulated by glycine receptor ligands. Comp. Biochem. Phys. C. 138, 193-202 (2004).
- Ramazani, R. B., Krishnan, H. R., Bergeson, S. E., Atkinson, N. S. Computer automated movement detection for the analysis of behavior. J. Neurosci. Meth. 162, 171-179 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved